2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237
大气气溶胶沉降带来的铁(Fe)和磷(P)是海洋表层营养物质的重要来源[1-2],但其中只有溶解态的Fe和P可以被浮游植物直接吸收利用,从而影响海洋初级生产力[3-4]。气溶胶中Fe和P的溶解度(即溶解态浓度占总浓度的百分比)决定着其沉降入海后的生物可利用性。影响气溶胶中Fe和P溶解度的因素主要包括气溶胶的来源及其在大气传输过程中所经历的物理化学过程[5-6]。已有研究表明,人为源气溶胶往往比沙尘源气溶胶具有更高的Fe和P溶解度,新鲜沙尘气溶胶中Fe溶解度一般低于0.5%,而燃烧源气溶胶中Fe溶解度全球平均为4.7%~7.3%[7-8];沙尘气溶胶中P溶解度约为8%,而受人为排放影响的气溶胶中P溶解度达87%[9-10]。不同来源的气溶胶粒子在传输过程中可能与污染气团中的SO2和NOx发生非均相反应,转化为SO42-和NO3-等酸组分[11],气溶胶酸性增强可促进气溶胶中Fe和P由不溶态向可溶态转化,从而提高其溶解度[6, 12-13]。Ingall等[14]报道了北大西洋气溶胶中Fe溶解度与气溶胶pH的关系,当pH为4~7时,Fe溶解度通常低于5%,当pH < 4时,Fe溶解度达35%。Herbert等[15]发现大气酸化过程可使气溶胶P溶解度从全球平均约10%的初始溶解度,增加到大西洋的18%,太平洋的42%,印度洋的20%。在传输过程中,气溶胶细粒子因较大的比表面积和较长的停留时间,使其中Fe和P更有机会与酸组分发生反应,因此相比于粗粒子往往具有更高的Fe和P溶解度[9]。Baker等[10]报道,在大西洋采集的气溶胶细粒子中Fe和P的溶解度分别为4%~20%和12%~25%,均明显高于粗粒子中的0%~4%和2%~12%。
近年来,我国雾霾天气频繁发生,重污染天气下气溶胶中Fe和P可能具有较高的初始溶解度,加之与污染气团中较高浓度的酸组分反应,可能进一步促进Fe和P溶解度的提升,因此,这些气溶胶粒子沉降入海后可能提供更多的生物可利用的Fe和P。Zhang等[16]和李佳慧等[17]通过船基围隔实验发现,添加灰霾粒子可以促进西北太平洋、南海和黄海海域浮游植物的生长。迄今为止,关于气溶胶中Fe和P溶解度的研究已经广泛开展[2, 18],但雾、霾天气下气溶胶中Fe和P溶解度的研究却鲜见报道。本文选择雾霾天频发的供暖季节在黄海近岸城市——青岛采集PM2.5样品,分析其中总态、溶解态Fe (Total Fe, TFe; Soluble Fe, SFe)和总态、溶解态P (Total P, TP; Soluble P, SP)浓度,讨论雾、霾天对Fe和P的浓度及溶解度影响的差异及其原因。在大气污染日趋加剧的背景下,本研究对理解人为活动影响下Fe和P溶解度的变化及其控制过程,并对准确评估大气Fe和P沉降对海洋初级生产力的贡献具有重要科学意义。
1 材料与方法 1.1 样品采集采样地点位于青岛中国海洋大学崂山校区(36°9′N, 120°29′E),距离海岸线约7 km。采用KC-1000大流量气溶胶采样器(配置PM2.5切割头,青岛崂山电子公司),采样头高度距地面约2 m。于2017年11月15日~2018年1月21日采集PM2.5样品25个,同时采集现场空白样品,采样流量为1.05 m3·min-1,每个样品累积采集16 h左右。采样膜为预先经过酸洗的Whatman41纤维滤膜。样品采集后,小心取下滤膜,对折后放入洁净聚乙烯自封袋中,于-20 ℃冰箱中保存。采样前后采样膜的处理均在超净台中完成。
1.2 样品预处理与分析样品中Fe的分析:裁取6 cm2样品膜于高压消解罐聚四氟乙烯内胆中,加入强酸溶液(2 mL 69% HNO3+0.5 mL 40% HF,均为优级纯),于180 ℃消解48 h。消解完全后,消解液于160 ℃蒸发至近干,残渣溶解在2% HNO3中,定容至50 mL,用于TFe分析;裁取12 cm2样品膜在0 ℃下于15 mL超纯水(≥18.2 MΩ·cm)中超声萃取1 h,萃取液经0.45 μm过滤器过滤,定量加入HNO3酸化至2%,用于SFe分析。样品溶液于-20 ℃冷冻保存,并于7 d完成测定。
样品中P的分析:裁取8 cm2样品膜于高压消解罐聚四氟乙烯内胆中,加入强酸溶液(4 mL HNO3+1 mL HF),于180 ℃下消解48 h。消解液于160 ℃下蒸发至近干,残渣用超纯水溶解,定容至25 mL,用于TP分析;裁取48 cm2样品膜在0 ℃下于15 mL超纯水中超声萃取20 min,萃取液经0.45 μm过滤器过滤,滤液定容至50 mL。取10 mL滤液加2.5 mL碱性过硫酸钾于120 ℃下消解30 min,用于SP分析。处理后的样品溶液在24 h内测定。
样品中Fe浓度采用电感耦合等离子体质谱法(ICP-MS)分析,P浓度采用钼蓝分光光度法分析。标准物质GSS-8(中国国家标准物质中心)和GBW07408(中国地球物理和地球化学调查研究所)分别用于检验样品中TFe和TP分析的准确性。TFe和TP的测定精密度分别为3.9%和3.0%,回收率分别为88%~105%和95%~105%。本研究还同时分析了样品中其他金属的总态和溶解态浓度(ICP-MS)及水溶性离子浓度(离子色谱法,ICS-3000),样品处理、分析和质量控制方法详见文献[19-21]。
1.3 气象数据来源与天气条件分类采样期间,相对湿度、能见度(Visibility, Vis)和天气现象等3小时气象参数来自https://rp5.ru/青岛市天气。空气质量指数(Air quality index, AQI)和PM2.5等1小时空气质量数据来自www.pm25.in。根据样品采集期间的天气现象对样品进行分类[22],当样品采集期间持续出现雾,记为雾天样品(1个),其平均能见度小于10 km,RH>85%;当样品采集期间雾和霾交替持续出现,记为雾霾天样品(4个),其能见度小于10 km,70% < RH < 85%,AQI>100;当样品采集期间出现霾,记为霾天样品(6个),其能见度小于10 km,RH < 70%,AQI>100;当样品采集期间基本为晴天、无雾和霾出现,记为晴天样品(14个),其能见度大于10 km,AQI < 100。
2 结果与讨论 2.1 青岛不同天气下PM2.5中Fe的浓度与溶解度2017—2018年冬季青岛PM2.5浓度为15.2~207.4 μg·m-3,雾天和雾霾天最高,分别为188.2和(164.8±53.2)μg·m-3,霾天次之,为(94.7±19.1)μg·m-3,晴天最低,为(34.6±11.4)μg·m-3。TFe浓度为368.2~2 585.2 ng·m-3,高值多出现在晴天和霾天,平均分别为(1 204.0±624.8)和(1 166.6±331.3) ng·m-3,低值多出现在雾天和雾霾天,分别为448.6 ng·m-3和(726.7±254.1) ng·m-3(见图 1)。TFe与Al、Ba、Mn、Sr等地壳源元素均具有显著相关关系,但仅与人为源组分Cr和K有一定相关关系,与Pb、nss-SO42-和NO3-等无相关关系(见表 1),表明PM2.5中的TFe主要来自于矿物沙尘源,人为源的贡献较小。TFe的富集因子(以Al作为地壳源参比元素)为1.0±0.3,也表明了这一点。Mahowald等[18]报道气溶胶中超过80%的TFe来自矿物沙尘的贡献,人为源的贡献仅为1.2%。霾天和晴天时单位体积大气中TFe浓度基本相当,但霾天时单位质量PM2.5中TFe含量为(13.0±5.2) ng·μg-1,仅为晴天时(36.1±20.1) ng·μg-1的1/3左右,表明霾颗粒本身不会贡献更多的TFe。这一结果也证实了PM2.5中TFe主要来自矿物沙尘而非人为源的贡献。有研究显示霾发生时,PM2.5中土壤源的贡献仅为2%~7%[23],而人为源组分SO42-、NO3-和NH4+的贡献由非霾天时的43.9%升高至62.3%[24]。雾天和雾霾天相比于晴天较低的TFe浓度可能与雾具有一定的湿清除作用,或者雾天较高RH减少了地表扬尘的贡献有关。分析TFe和RH的关系,二者具有显著负相关关系(r=-0.63, P < 0.01)支持了这一点。

|
图 1 不同天气条件下PM2.5中TFe和SFe浓度及Fe溶解度(Fe%) Fig. 1 TFe and SFe concentrations and Fe solubility (Fe%) in PM2.5 under different weather conditions |
|
|
表 1 PM2.5中Fe、P浓度及溶解度与微量元素及水溶性离子的相关关系 Table 1 Correlation of concentrations and solubility of Fe and P versus trace element and water-soluble ion levels in PM2.5 |
青岛PM2.5中SFe浓度为12.9~118.2 ng·m-3,与TFe不同,SFe的高值出现在雾天,为75.5 ng·m-3,其次是雾霾天和霾天,平均分别为(55.6±11.2) 和(42.2±20.2) ng·m-3,低值出现在晴天,为(34.6±28.5) ng·m-3(见图 1)。Ingall等[14]研究显示,在印度污染严重的大气中SFe浓度为(90±26) ng·m-3,明显高于北非清洁大气中的(32±52) ng·m-3。分析SFe和AQI的关系,发现二者之间具有显著相关关系(r=0.55, P < 0.01),表明随着大气污染加剧,气溶胶中SFe浓度随之升高。雾霾天时较高浓度的SFe可能是人为源直接贡献了较多的SFe,也可能是大气传输过程中不溶态Fe与酸组分反应转化为SFe。SFe与总态的Ni、Cr、Pb等人为源元素无相关关系,但与溶解态的地壳源和人为源元素均呈显著相关关系(见表 1),表明Fe与这些元素可能经历了相似的大气过程。因此,雾霾样品中较高浓度的SFe可能来自不溶态Fe在大气中的二次转化而不是人为源一次排放的贡献。
青岛PM2.5中Fe溶解度为1.0%~16.8%,与北冰洋大气细粒子(< 1 μm)中的4.1%~17%基本一致[25],明显高于日本大气细粒子(< 2 μm)中的1.2%~2.2%[26]。雾天和雾霾天时,Fe溶解度为16.8%和8.9%±3.4%,显著高于晴天的3.0%±1.5%和霾天的3.9%±1.8%(见图 1)。Fe溶解度与AQI呈现显著相关关系(r=0.81, P < 0.01),表明随着大气污染加重,气溶胶中Fe溶解度显著提高。Ingall等[14]的研究也表明,在污染严重的大气中Fe溶解度普遍高于5%,在清洁大气中Fe溶解度基本低于2%。比较不同天气下Fe溶解度发现,尽管霾天的污染程度显著高于晴天、AQI约为晴天的2倍,但霾天的Fe溶解度仅略高于晴天,表明污染大气中Fe溶解度与污染程度相关的同时,还受到其他因素的制约。
2.2 青岛不同天气下PM2.5中P的浓度与溶解度观测期间PM2.5中TP浓度为21.7~217.3 ng·m-3,与TFe相似,TP的高值也多出现在晴天和霾天,平均分别为(84.0±54.3)和(87.0±23.8) ng·m-3,低值多出现在雾天和雾霾天,平均分别为51.4和(61.0±10.2) ng·m-3(见图 2),但TP浓度在不同天气下的差异明显小于TFe。相关性分析表明,TP与TFe之间具有显著相关关系(r=0.88, P < 0.01),表明二者可能具有相同的来源。TP与地壳源元素呈显著相关,与人为源元素(Ni、K、Cr)也有一定相关性,但相关系数小于地壳元素(见表 1),表明TP主要来自于矿物沙尘源,人为源也有一定贡献。矿物沙尘被认为是气溶胶中P的主要来源,全球尺度上,大气中约80%的TP来自矿物气溶胶,人为源P的贡献约为5%[2, 27],但也有研究认为燃烧源贡献了大气中50%的P[28]。TP与RH也具有显著负相关关系(r=-0.47, P < 0.05),表明雾天和雾霾天较低的TP浓度可能与雾的湿清除或者高湿度下地表扬尘减弱有关。

|
图 2 青岛不同天气条件下PM2.5中TP和SP浓度及P溶解度(P%) Fig. 2 TP and SP concentrations and P solubility (P%) in PM2.5 under different weather conditions in Qingdao |
SP浓度为7.2~59.1 ng·m-3,高值出现在雾霾天和雾天,分别为(49.2±10.0)和41.8 ng·m-3,其次是霾天,为(36.9±12.9) ng·m-3,晴天显著低于其他天气(P < 0.05),为(20.6±13.8) ng·m-3(见图 2)。SP与燃烧源元素Pb和K的总态浓度有显著相关关系,且与溶解态的微量元素和二次无机离子均呈显著相关关系(见表 1),表明SP可能一部分来自燃烧源一次排放的直接贡献,一部分来自不溶态P在大气中的二次转化溶解。与SFe相似,SP与AQI也存在显著相关关系(r=0.73, P < 0.01),表明SP浓度随着空气污染加重而升高。Zamora等[29]在北大西洋沿岸迈阿密的研究也显示受人为污染影响的气溶胶中SP浓度比未受污染影响的高70%。
P溶解度为12.9%~92.9%,与大西洋大气细粒子(< 1 μm)中的10%~90%基本一致[10],高于青岛2013年冬季总悬浮颗粒物(TSP)样品中的32.9%±16.7%[21]。与Fe相似,P溶解度的高值也多出现在雾天和雾霾天,分别为81.3%和80.3%±8.3%,低值多出现在晴天,为26.6%±8.6%,但与Fe不同的是,霾天时P溶解度明显高于晴天,为44.8%±18.0%。研究表明受人为污染影响的气溶胶中P溶解度明显高于未受影响的气溶胶[4, 30],例如,在地中海受人为污染影响和未受污染影响的气溶胶中P溶解度分别约为50%和10%[31]。P溶解度与AQI也呈显著相关关系(r=0.75, P < 0.01),表明空气污染加重导致了P溶解度的提升。
2.3 影响青岛PM2.5中Fe和P溶解度的因素 2.3.1 TFe和TP负载PM2.5中Fe溶解度与TFe之间存在显著的负指数幂函数关系(见图 3),这种关系在全球很多区域的TSP样品中普遍存在,被看作为具有低TFe负载和高Fe溶解度的人为源颗粒与具有高TFe负载和低Fe溶解度的矿物沙尘源颗粒两个端元的混合[5, 32]。比较不同天气下二者之间的关系,发现雾天和雾霾天数据点基本分布在人为源端,且多数位于拟合曲线之上,晴天的数据点较为分散,基本位于拟合曲线之下,表明雾霾天时较高的Fe溶解度除两个端元混合颗粒初始溶解度的贡献外,还受到其他因素影响。由Fe溶解度和TFe的拟合曲线可以看到,沙尘源端Fe溶解度约为1.5%,表明青岛细颗粒矿物沙尘中Fe溶解度约为1.5%,这与我国西部沙尘源区气溶胶中0.28%~4.1%的Fe溶解度较一致[33]。

|
图 3 青岛不同天气条件下PM2.5中Fe溶解度(Fe%)和TFe浓度的关系 Fig. 3 Relationship of Fe solubility (Fe%) with TFe in PM2.5under different weather conditions in Qingdao |
P溶解度与TP负载之间也呈现出类似的负指数幂函数关系(y=80.7x-0.27, R2=0.25, P=0.07),但这种关系不显著,这可能是因为P来自人为源的贡献相比于Fe更大。进一步分析P溶解度与地壳源代表元素Al(total Al, TAl)的关系,发现二者呈显著反比例关系(见图 4),这种关系在青岛TSP样品中也存在[21]。比较不同天气下P溶解度与TAl的关系发现,与Fe相似,P溶解度在雾天和雾霾天的数据点靠近人为源端,且位于TAl浓度相近时的晴天数据点之上,表明雾霾天时较高的P溶解度除两个端元混合颗粒初始溶解度的贡献外,还受到其他因素影响。由P溶解度和TAl的拟合曲线可以看到,沙尘源端P溶解度约为16%,表明青岛细颗粒矿物沙尘中P溶解度约为16%。这一数值高于青岛TSP矿物沙尘气溶胶中约12%的溶解度[21],与在地中海观测的撒哈拉沙尘气溶胶中2%~20%的P溶解度处于相同范围[31]。

|
图 4 青岛不同天气条件下PM2.5中P溶解度(P%)和TAl的关系 Fig. 4 Relationship of P solubility (P%) with TAl in PM2.5under different weather conditions in Qingdao |
大气酸化过程是气溶胶传输过程中提升气溶胶中Fe溶解度的主要机制[14-15]。分析Fe溶解度与气溶胶中含量最多的酸组分nss-SO42-和NO3-的关系,结果显示,Fe溶解度与两种酸组分均具有显著相关关系(见表 1),因此合并两种酸组分进行后续讨论。酸组分与TFe的摩尔浓度比被定义为气溶胶Fe的酸化程度,是反映大气酸化过程对Fe溶解度影响的有效指标[34]。分析Fe溶解度与(2nss-SO42-+NO3-)/TFe的关系,发现除雾天外,二者呈显著线性相关关系(见图 5),拟合方程的截距为2.04,表明未受到大气酸化过程影响的PM2.5中Fe初始溶解度约为2.0%,这与前文估计的青岛细颗粒矿物沙尘中1.5%的Fe溶解度基本一致。

|
图 5 PM2.5中Fe溶解度(Fe%)与(2nss-SO42-+NO3-)/TFe的关系 Fig. 5 Relationship of Fe solubility (Fe%) with(2nss-SO42-+NO3-)/TFe in PM2.5 |
对比分析不同天气下Fe溶解度与酸化程度的关系,发现雾霾天的(2nss-SO42-+NO3-)/TFe最高,晴天时最低,平均分别为(143.3±56.6)和(17.5±12.5)nmol·nmol-1,这是雾霾天最高的酸组分浓度和较低的TFe浓度、晴天时最低的酸组分浓度和最高的TFe浓度带来的必然结果。雾天时(2nss-SO42-+NO3-)/TFe为52.0 nmol·nmol-1,与霾天的(46.5±32.4)nmol·nmol-1基本相当,但雾天的溶解度却显著高于霾天;霾天时(2nss-SO42-+NO3-)/TFe明显高于晴天,但霾天的Fe溶解度与晴天的基本相当。这些结果表明除了酸化程度之外,还有其他因素控制Fe溶解度。
大气酸化过程也是提升气溶胶中P溶解度的关键机制[15]。P溶解度与气溶胶P的酸化程度(2nss-SO42-+NO3-)/TP之间呈显著相关关系(见图 6),拟合方程的斜率为0.07,是Fe的拟合方程斜率的1.5倍,表明大气酸化作用对P的溶解效率比对Fe的高约50%。其原因可能是气溶胶中Fe、P的矿物形态不同,酸化作用对其溶解速率不同。沙尘气溶胶中Fe主要存在于铝硅酸盐晶格中,化学键难以断裂,所以较难溶解[10, 35],在pH=2的HCl溶液中沙尘气溶胶Fe溶解度达到饱和(10%)需要约25 min[36];而沙尘气溶胶中P约80%以磷灰石的形态存在,磷灰石中的P在酸性条件下,几秒或者几分钟即可溶解,溶解度高达79%~96%[37]。P溶解度与酸化程度拟合方程的截距为17.94,表明未受到大气酸化过程影响的PM2.5中P初始溶解度约为18%,这与前文估计的青岛细颗粒矿物沙尘中P溶解度为16%基本一致。
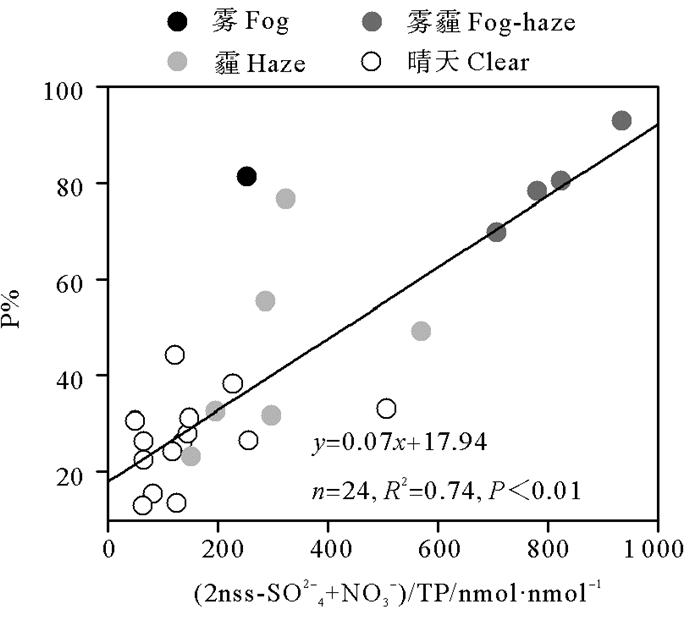
|
图 6 PM2.5中P溶解度(P%)与(2nss-SO42-+NO3-)/TP的关系 Fig. 6 Relationship of P solubility (P%) with (2nss-SO42-+NO3-)/TP in PM2.5 |
不同天气条件下P溶解度与(2nss-SO42-+NO3-)/TP的关系与Fe相似,雾霾天时(2nss-SO42-+NO3-)/TP最高,为(810.9±82.2) nmol·nmol-1,霾天和雾天次之,分别为(303.4±133.2) nmol·nmol-1和251.2 nmol·nmol-1,晴天最低,为(149.7±114.6) nmol·nmol-1。尽管雾天的(2nss-SO42-+NO3-)/TP略低于霾天,但P溶解度却显著高于霾天,约为霾天的1.8倍,表明除酸化程度外,P溶解度还受到其他因素控制。
2.3.3 相对湿度和酸化作用的协同效应Fe、P溶解度与酸化程度的关系均显示,雾天时的酸化程度与霾天基本相当,但溶解度却显著高于霾天。雾天与霾天最主要的区别是相对湿度高。分析Fe、P溶解度与RH的关系,发现二者均与RH呈显著正相关(r=0.74, P < 0.01; r=0.87, P < 0.01),表明RH是影响气溶胶中Fe、P溶解度的因素之一。高相对湿度下,气溶胶颗粒表面形成的水膜有助于酸组分与Fe、P酸化反应的进行从而提高其溶解度[13, 21]。
RH≥60%时,含有SO42-和NO3-的气溶胶颗粒通常会潮解,因此,RH=60%常作为气溶胶颗粒的潮解点[11]。分析Fe溶解度与RH和酸化程度的关系,发现当RH < 60%,Fe溶解度均在8%以下,其中约75%的样品溶解度在4%以下,平均约为3%(见图 7)。晴天和霾天采集的样品,RH基本小于60%,未潮解的气溶胶限制了Fe的酸化溶解,这可能是尽管霾天的酸化程度比晴天高1.7倍,但溶解度却与晴天基本相当的原因。当RH>60%,Fe溶解度多数在8%以上,平均约为10%。雾霾天采集的样品RH均大于70%, 其溶解度随着酸化程度和RH的增加而增加。雾天时,RH>85%、明显高于潮解点,这可能是尽管雾天的酸化程度与霾天相当,但溶解度却显著高于霾天的原因。这些结果表明,RH和酸化作用对Fe溶解度的影响具有协同效应。另外,雾天和雾霾天时RH均较高,雾霾天的酸化程度明显高于雾天,但雾天的溶解度却比雾霾天高近1倍。只与酸化程度相当的雾霾天的数据点(Fe溶解度3.2%,RH73%)比较,二者之间RH约13%的差别也不能完全解释P溶解度约5倍的差异,这可能预示了雾天的特殊天气过程能显著促进气溶胶Fe由不溶态向可溶态转化。因雾天只有一个样品,其代表性还需要更多的观测研究证明。

|
图 7 PM2.5中Fe溶解度(Fe%)与(2nss-SO42-+NO3-)/TFe和RH的关系 Fig. 7 Relationship of Fe solubility (Fe%) with (2nss-SO42-+NO3-)/TFe and RH in PM2.5 |
分析P溶解度与RH和(2nss-SO42-+NO3-)/TP的关系,发现当RH < 60%,无论酸化程度高低,P溶解度基本低于30%,当RH>60%,P溶解度均在30%以上,当RH>70%,溶解度均在50%以上(见图 8)。霾天时,RH接近60%的两个数据点的P溶解度为65%左右,这两个样品的酸化程度略高于雾天,但雾天时P溶解度(81%)明显高于这两个霾天样品,其原因可能是雾天明显高于潮解点的RH更有利于P的酸化溶解。雾霾天时RH为70%~85%,随着RH和(2nss-SO42-+NO3-)/TP的增强,P溶解度显著提升。雾天时的RH与雾霾天接近,酸化程度明显低于雾霾天样品,但是P溶解度却仍然达到81%,与Fe相似,这可能暗示了雾天的特殊天气过程显著促进气溶胶中不溶态P的酸化溶解。
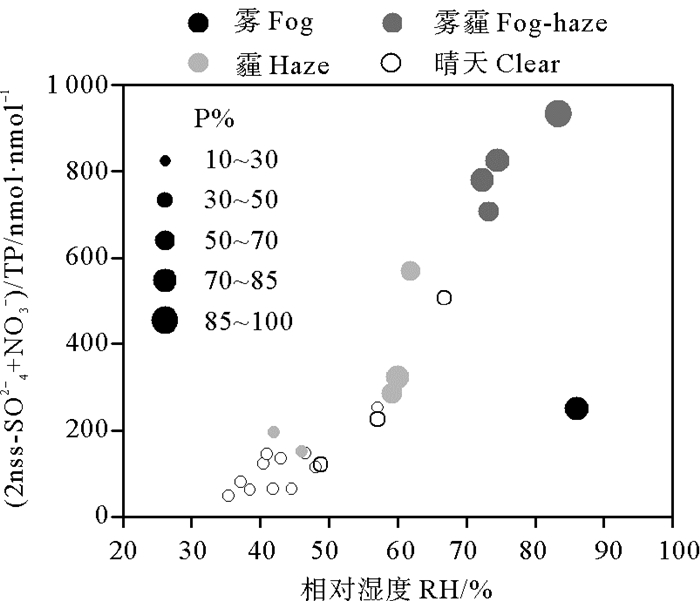
|
图 8 PM2.5中P溶解度(P%)与(2nss-SO42-+NO3-)/TP和RH的关系 Fig. 8 Relationship of P solubility (P%) with (2nss-SO42-+NO3-)/TP and RH in PM2.5 |
PM2.5中TFe和TP浓度均在雾天和雾霾天较低,晴天、霾天时较高,而SFe、SP和Fe、P溶解度则在雾天和雾霾天时较高,晴天、霾天较低。Fe溶解度与TFe、P溶解度与TAl之间均呈现显著的负指数幂函数关系。PM2.5中TFe和TP主要来自地壳源的贡献,未受人为活动影响时Fe和P溶解度分别为1.5%~2%和16%~18%,随着AQI增大、大气污染加剧,溶解度升高。大气酸化反应是Fe、P溶解度升高的主要机制,RH对酸化反应起制约作用。当RH < 60%时,无论酸化程度高低,Fe溶解度多数小于4%,P溶解度普遍大于30%。雾霾天时,超过70%的RH和较高酸化程度的协同效应使Fe、P溶解度显著提升。但霾天时,低于60%的RH对大气酸化作用的限制使得其Fe、P溶解度明显低于雾霾天。
| [1] |
Jickells T D, An Z S, Andersen K K, et al. Global iron connections between desert dust, ocean biogeochemistry, and climate[J]. Science, 2005, 308(5718): 67-71. DOI:10.1126/science.1105959
(  0) 0) |
| [2] |
Mahowald N, Jickells T D, Baker A R, et al. Global distribution of atmospheric phosphorus sources, concentrations and deposition rates, and anthropogenic impacts[J]. Global Biogeochemical Cycles, 2008, 22(4). DOI:10.1029/2008GB003240
(  0) 0) |
| [3] |
Ito A, Shi Z. Delivery of anthropogenic bioavailable iron from mineral dust and combustion aerosols to the ocean[J]. Atmospheric Chemistry and Physics, 2016, 16(1): 85-99. DOI:10.5194/acp-16-85-2016
(  0) 0) |
| [4] |
Anderson L D, Faul K L, Paytan A. Phosphorus associations in aerosols: What can they tell us about P bioavailability?[J]. Marine Chemistry, 2010, 120(1): 44-56.
(  0) 0) |
| [5] |
Baker A R, Croot P L. Atmospheric and marine controls on aerosol iron solubility in seawater[J]. Marine Chemistry, 2010, 120(1-4): 4-13. DOI:10.1016/j.marchem.2008.09.003
(  0) 0) |
| [6] |
Nenes A, Krom M D, Mihalopoulos N, et al. Atmospheric acidification of mineral aerosols: a source of bioavailable phosphorus for the oceans[J]. Atmospheric Chemistry and Physics, 2011, 11(13): 6265-6272. DOI:10.5194/acp-11-6265-2011
(  0) 0) |
| [7] |
Mahowald N M, Baker A R, Bergametti G, et al. Atmospheric global dust cycle and iron inputs to the ocean[J]. Global Biogeochemical Cycles, 2005, 19(4). DOI:10.1029/2004GB002402
(  0) 0) |
| [8] |
Ito A. Atmospheric processing of combustion aerosols as a source of bioavailable iron[J]. Environmental Science and Technology Letters, 2015, 2(3): 70-75. DOI:10.1021/acs.estlett.5b00007
(  0) 0) |
| [9] |
Baker A R, French M, Linge K L. Trends in aerosol nutrient solubility along a west-east transect of the Saharan dust plume[J]. Geophysical Research Letters, 2006, 33(7). DOI:10.1029/2005GL024764
(  0) 0) |
| [10] |
Baker A R, Jickells T D, Witt M, et al. Trends in the solubility of iron, aluminium, manganese and phosphorus in aerosol collected over the Atlantic Ocean[J]. Marine Chemistry, 2006, 98: 43-58. DOI:10.1016/j.marchem.2005.06.004
(  0) 0) |
| [11] |
Liu Y, Wu Z, Wang Y, et al. Submicrometer particles are in the liquid state during heavy haze episodes in the urban atmosphere of Beijing, China[J]. Environmental Science and Technology Letters, 2017, 4: 427-432. DOI:10.1021/acs.estlett.7b00352
(  0) 0) |
| [12] |
Meskhidze N, Chameides W L, Nenes A. Dust and pollution: A recipe for enhanced ocean fertilization?[J]. Journal of Geophysical Research: Atmospheres, 2005, 110(D3). DOI:10.1029/2004GB002402
(  0) 0) |
| [13] |
Li W, Xu L, Liu X, et al. Air pollution-aerosol interactions produce more bioavailable iron for ocean ecosystems[J]. Science Advances, 2017, 3(3): e1601749. DOI:10.1126/sciadv.1601749
(  0) 0) |
| [14] |
Ingall E D, Feng Y, Longo A F, et al. Enhanced iron solubility at low pH in global aerosols[J]. Atmosphere, 2018, 9(5): 201. DOI:10.3390/atmos9050201
(  0) 0) |
| [15] |
Herbert R J, Krom M D, Carslaw K S, et al. The effect of atmospheric acid processing on the global deposition of bioavailable phosphorus from dust[J]. Global Biogeochemical Cycles, 2018, 32(9): 1367-1385. DOI:10.1029/2018GB005880
(  0) 0) |
| [16] |
Zhang C, Ito A, Shi Z, et al. Fertilization of the Northwest Pacific Ocean by East Asia air pollutants[J]. Global Biogeochemical Cycles, 2019, 33(6): 690-702. DOI:10.1029/2018GB006146
(  0) 0) |
| [17] |
李佳慧, 张潮, 刘莹, 等. 沙尘和灰霾沉降对黄海春季浮游植物生长的影响[J]. 环境科学学报, 2017, 37(1): 112-120. Li J H, Zhang C, Liu Y, et al. Impacts of dust and haze particles deposition on phytoplankton growth in Yellow Sea during springtime[J]. Acta Scientiae Circumstantiae, 2017, 37(1): 112-120. (  0) 0) |
| [18] |
Mahowald N M, Hamilton D S, Mackey K R M, et al. Aerosol trace metal leaching and impacts on marine microorganisms[J]. Nature Communications, 2018, 9(1): 1-15. DOI:10.1038/s41467-017-02088-w
(  0) 0) |
| [19] |
Shi J H, Gao H W, Zhang J, et al. Examination of causative link between a spring bloom and dry/wet deposition of Asian dust in the Yellow Sea, China[J]. Journal of Geophysical Research: Atmospheres, 2012, 117(D17). DOI:10.1029/2012JD017983
(  0) 0) |
| [20] |
Shi J H, Zhang J, Gao H W, et al. Concentration, solubility and deposition flux of atmospheric particulate nutrients over the Yellow Sea[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2013, 97: 43-50. DOI:10.1016/j.dsr2.2013.05.004
(  0) 0) |
| [21] |
Shi J, Wang N, Gao H, et al. Phosphorus solubility in aerosol particles related to particle sources and atmospheric acidification in Asian continental outflow[J]. Atmospheric Chemistry and Physics, 2019, 19(2): 847-860. DOI:10.5194/acp-19-847-2019
(  0) 0) |
| [22] |
孟亚, 李鹏志, 曹婉婉, 等. 青岛大气气溶胶中微量元素浓度及溶解度的粒径谱分布[J]. 中国环境科学, 2017, 37(3): 851-858. Meng Y, Li P Z, Cao W W, et al. Size distributions of particulate trace elements in mass concentration and their size-dependent solubility in the atmosphere in Qingdao[J]. China Environmental Science, 2017, 37(3): 851-858. (  0) 0) |
| [23] |
Hu aY, Cheng Z, Wang S, et al. Characteristics and source apportionment of PM2.5 during a fall heavy haze episode in the Yangtze River Delta of China[J]. Atmospheric Environment, 2015, 123: 380-391. DOI:10.1016/j.atmosenv.2015.03.046
(  0) 0) |
| [24] |
Yu G H, Zhang Y, Cho S Y, et al. Influence of haze pollution on water-soluble chemical species in PM2.5 and size-resolved particles at an urban site during fall[J]. Journal of Environmental Sciences, 2017, 57: 370-382. DOI:10.1016/j.jes.2016.10.018
(  0) 0) |
| [25] |
Gao Y, Marsay C M, Yu S, et al. Particle-size variability of aerosol iron and impact on iron solubility and dry deposition fluxes to the Arctic Ocean[J]. Scientific Reports, 2019, 9(1): 1-11.
(  0) 0) |
| [26] |
Ooki A, Nishioka J, Ono T, et al. Size dependence of iron solubility of Asian mineral dust particles[J]. Journal of Geophysical Research: Atmospheres, 2009, 114(D3). DOI:10.1029/2008JD010804
(  0) 0) |
| [27] |
Myriokefalitakis S, Nenes A, Baker A R, et al. Bioavailable atmospheric phosphorous supply to the global ocean: A 3-D global modeling study[J]. Biogeosciences, 2016, 13(24): 6519-6543. DOI:10.5194/bg-13-6519-2016
(  0) 0) |
| [28] |
Wang R, Balkanski Y, Boucher O, et al. Significant contribution of combustion-related emissions to the atmospheric phosphorus budget[J]. Nature Geoscience, 2015, 8: 48-54. DOI:10.1038/ngeo2324
(  0) 0) |
| [29] |
Zamora L M, Prospero J M, Hansell D A, et al. Atmospheric P deposition to the subtropical North Atlantic: Sources, properties, and relationship to N deposition[J]. Journal of Geophysical Research-Atmospheric, 2013, 118: 1546-1562. DOI:10.1002/jgrd.50187
(  0) 0) |
| [30] |
Barkley A E, Prospero J M, Mahowald N, et al. African biomass burning is a substantial source of phosphorus deposition to the Amazon, Tropical Atlantic Ocean, and Southern Ocean[J]. Proceedings of the National Academy of Sciences, 2019, 116(33): 16216-16221. DOI:10.1073/pnas.1906091116
(  0) 0) |
| [31] |
Herut B, Collier R W, Krom M D. The role of dust in supplying nitrogen and phosphorus to the southeast Mediterranean[J]. Limnology and Oceanography, 2002, 47: 870-878. DOI:10.4319/lo.2002.47.3.0870
(  0) 0) |
| [32] |
Sholkovitz E R, Sedwick P N, Church T M, et al. Fractional solubility of aerosol iron: Synthesis of a global-scale data set[J]. Geochimica et Cosmochimica Acta, 2012, 89(4): 173-189.
(  0) 0) |
| [33] |
Takahashi Y, Higashi M, Furukawa T, et al. Change of iron species and iron solubility in Asian dust during the long-range transport from western China to Japan[J]. Change, 2011, 11: 19545-19580.
(  0) 0) |
| [34] |
Hsu S, Gong G, Shiah F, et al. Sources, solubility, and acid processing of aerosol iron and phosphorous over the South China Sea: East Asian dust and pollution outflows vs. Southeast Asian biomass burning[J]. Atmospheric Chemistry and Physics Discussions, 2014, 14(15): 21433-21472.
(  0) 0) |
| [35] |
Baker A R, Laskina O, Grassian V H. Processing and Ageing in the Atmosphere Mineral Dust[M]. Dordrecht: Springer, 2014: 75-92.
(  0) 0) |
| [36] |
常燕, 冯冲, 瞿建国, 等. 上海大气总悬浮颗粒物中金属的可溶性特征[J]. 环境科学, 2015, 36(4): 1164-1172. Chang Y, Feng C, Qu J G, et al. Soluble of metals within TSP in Shanghai[J]. Environmental Science, 2015, 36(4): 1164-1172. (  0) 0) |
| [37] |
Stockdale A, Krom M D, Mortimer R J, et al. Understanding the nature of atmospheric acid processing of mineral dusts in supplying bioavailable phosphorus to the oceans[J]. Proceedings of the National Academy of Sciences, 2016, 113(51): 14639-14644. DOI:10.1073/pnas.1608136113
(  0) 0) |
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2021, Vol. 51
2021, Vol. 51


