2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100
纳米银颗粒(Silver nanoparticles, AgNPs)由于其优异的抗菌性能而使其在各个领域应用广泛[1]。伴随AgNPs的生产、运输和使用,AgNPs将不可避免的进入到生态环境中,而目前关于AgNPs的安全性评价体系尚未建立。已有研究表明,吸入是AgNPs在生产制造或使用过程中进入人体的主要途径之一,颗粒进入肺部后接触肺上皮细胞并蓄积,诱导肺部细胞产生遗传毒性[2]。关于水环境中AgNPs对水生生物的毒性已经有诸多学者进行了深入的研究和讨论。就生态系统而言,Ward等[1]研究表明长时间的AgNPs暴露会导致湿地微生物多样性降低和群落组成的改变。就生物个体而言,AgNPs主要致毒机理是通过诱导生物机体活性氧的产生,如超氧自由基(·O2-)、羟基自由基(·OH-)等,使机体组织器官产生氧化胁迫[3-4]。生物体在环境胁迫等污染条件下通过改变体内抗氧化酶(超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT))水平,以清除细胞产生的过量的活性氧(Reactive oxygen species, ROS),维持细胞内正常的氧化还原环境。腐殖酸(Humic acid, HA)作为环境中广泛存在的溶解有机质(Dissolved organic matter, DOM)能通过各种官能团吸附在AgNPs的表面,促使颗粒之间的静电排斥和空间位阻发生改变,从而影响AgNPs在水环境中的物理化学行为[5]。在光照条件下,HA促进了水环境中AgNPs与Ag+之间的氧化还原反应,导致水环境中产生粒径更小的的AgNPs[6]。而有研究表明,粒径更小的AgNPs对生物的毒害作用更大[7-8]。所以人们迫切的需要了解环境中HA存在下AgNPs对生物的遗传毒性及其产生的生态毒理效应。
彗星实验(Comet assay)分为碱性处理和中性处理,中性处理条件下由于DNA不发生变性,所以不能用于检测DNA单链断裂的损伤。Singh于1988将细胞裂解和电泳改为在强碱性条件下进行。改进后的彗星实验具有经济灵活、操作简洁快速、灵敏等特点。只需要少量的细胞就能检测细胞核DNA单链或双链的损伤情况且适用于任何有核的单个细胞[9]。因此,碱性彗星实验常被用于水环境污染遗传毒理学检测。
近海岸地区水体中的悬浮颗粒物质能吸附大量的纳米颗粒或重金属离子并发生沉降,这种作用使得近海岸地区成为重金属污染物主要的“汇”。纳米颗粒或重金属离子并非永久的停留在沉积相中,而是会随着水体的流动从沉积相中再次释放至上层水相中不停的迁移转化。菲律宾蛤仔(Ruditapes philippinarum)是中国沿海分布比较广泛的底栖双壳类软体动物,能够通过大量过滤海水而捕获海水中的颗粒物质[10]。研究者所在的课题组之前发表的文章表明低浓度的AgNPs(10 μg·L-1)暴露环境下,银元素在蛤仔软体组织中发生了显著地富集集。因而蛤仔常被作为模式生物用于评估纳米材料的生态毒理效应及与其他物质之间的相互作用[4, 11]。本研究拟以菲律宾蛤仔为试验物种,将蛤仔单独和联合暴露至AgNPs和HA,通过改进彗星实验,评估HA存在下AgNPs对海洋双壳类软体动物鳃组织的致毒机制。
1 材料与方法 1.1 材料纳米银(AgNPs):纯度>99%,粒径 < 100 nm,比表面积约为5.0 m2·g-1,密度约为10.49 g·cm-3),用超纯水(18.25 MΩ·cm-1)制备成100 mg·L-1的储液,并超声1 h后4 ℃避光保存。
人工海水(ASW):将一定量的海水晶(潍坊市海佳海水晶厂)溶于自来水配制。使用前经0.45 μm膜过滤,并曝气24 h备用。
菲律宾蛤仔(R. philip pinarum)购买于青岛市崂山区李村海鲜市场。选取大小相近的个体(壳长约3.5 cm,壳宽约2.5 cm)。在实验室用ASW驯养5 d,即连续采用ASW暴露5 d后进行下一步的实验暴露,期间每隔24 h更换ASW,驯养和暴露期间持续曝气。
腐殖酸(HA):购买于上海巨枫化学科技有限公司。用超纯水配置成浓度为1 g·L-1的储备液,并用0.1 mol/L的NaOH溶液调节pH稳定至7,定容后避光4 ℃保存。
1.2 纳米银的表征将HA和AgNPs储备液超声(45 kHz)30 min后制备成30 mL终浓度为15、30 mg·L-1和20 μg·L-1的HA和AgNPs混合溶液,并在25 ℃环境下振荡24 h。振荡完成后,取一滴HA和AgNPs混合液在室温下置于碳涂层铜板上干燥,然后在透射电子显微镜(Hitachi H-7650, TEM)下观察并拍照。剩余的混合溶液用于Zeta电位的测定(Zetasizer Nano ZS90)。
1.3 暴露将驯养后的蛤仔随机分组(每组30只)后放置于塑料盆中,每个塑料盆加入5 L的ASW。实验共分为4组(见表 1),每组重复三次。实验期间不喂食,且无蛤仔死亡。暴露期间ASW的水质参数维持在水温(18±0.5) ℃、盐度32±0.5、pH=7.6±0.05。在暴露的第0、1、3、7、10天,从每个塑料盆中随机取5只蛤仔、并立即冰上解剖分离鳃组织并储存在-80 ℃超低温冰箱中。
|
|
表 1 不同处理组中HA和AgNPs浓度 Table 1 The concentration of HA and AgNPs in different treatment |
从超低温冰箱取出冻存的鳃组织,并于冰上缓慢解冻。称取适量解冻后的鳃组织,按质量体积比1∶9加入TRIS缓冲液(TRIS 50 mmol/L, NaCl 150 mmol/L, DTT 1 mmol/L, antiprotease mixture (Sigma P8340); pH=7.4)[11]。内切式组织匀浆机匀浆后离心(8 000 r·min-1, 4 ℃)20 min,用于测定CAT(U·mg)、SOD(U·mg)和MDA(nmol·mg)的活性或含量。上述生物标志物均采用南京建成生物工程研究所所生产的试剂盒进行测定[4]。操作过程严格按照说明书进行。
MT(ng·mL-1)采用酶联免疫吸附测定法:向预先包被了软体动物MT单克隆抗体的酶标板中加入匀浆液,再加入生物素标记的识别抗原,在37 ℃下孵育30 min。经PBS洗涤除去未结合的生物素抗原后加入亲和素-HRP,在37 ℃下孵育30 min。亲和素-HRP与生物素抗原结合,洗涤后结合的HRP催化四甲基联苯胺(TMB)成蓝色,随后在酸的作用下转换成黄色,在450 nm处有最大吸收峰,吸光值与样本中抗原的浓度成负相关。
1.5 彗星实验本研究采用碱性彗星实验法。(1)制作载玻片:取一块载玻片,用玻璃刀从载玻片上划取极细的玻璃条(1~1.5 mm),将切下来的玻璃条用玻璃胶粘在另一块载玻片上,围成长方形,玻璃条之间的空间即为为加样槽。(2)单细胞悬液:从各塑料盆中随机选取5只蛤仔并解剖,取鳃组织放置于5 mL离心管中,剪碎后加入2 mL胰蛋白酶(0.25%)消化液。于37 ℃的水浴中缓慢吹吸细胞悬液,使组织细胞分解为单细胞悬液。500 r·min-1离心,取上清液。然后1 500 r·min-1离心,除去上清液,并向离心管中加入1 mL PBS(0.1 mol/L),再次悬浮细胞,用台盼蓝染液检验细胞的活性并计数,用PBS调节细胞浓度为105个·mL-1后备用。(3)实验流程参照文献[9, 12]的版本。
1.6 数据处理彗星样本分析采用CASP(version 1.2.3 b2; CASPLab, Wroclaw, Poland)和CometScore(TriTek, VA, USA)软件,每个组分析50~100个细胞。每个指标测定结果以平均值±标准差表示,采用单因素方差分析(ANOVA)进行各组之间的显著性检验,不同的字母表示相同时间下不同处理之间存在显著差异,统计显著性水平为p < 0.05。通过R 4.0软件进行统计分析,OriginPro 9.2作图。
2 结果与讨论 2.1 HA对AgNPs行为的影响从图 1(a)中可以看出AgNPs呈球形,平均直径 < 10 nm,在水中的分散情况较好。加入15 mg·L-1(见图(b))和30 mg·L-1(见图 1(c))的HA之后,AgNPs在介质中的分布发生显著变化。在低浓度HA的情况下AgNPs发生显著地聚集,介质中存在许多粒径较小的颗粒。随着腐殖酸浓度的增加(30 mg·L-1),HA和AgNPs复合颗粒的粒径不再增大,且稳定的分布于介质中。图 1c中几乎不存在粒径小的颗粒,说明HA过饱和,能完全的吸附AgNPs。

|
图 1 不同HA浓度下(0(a)、15 mg·L-1(b)、30 mg·L-1(c))AgNPs(20 μg·L-1)的粒径 Fig. 1 TEM images of AgNPs (20 μg·L-1) and different concentration of HA (0(a)、15 mg·L-1 (b)、30 mg·L-1 (c)) |
从图中可以看出带负电荷的颗粒与带同种电荷的HA之间存在桥接(阴影部分)。这是由于腐殖酸的包裹使得介质中原始的纳米颗粒的粒径增加[13],而大的颗粒由于纳米材料的尺寸效应比小颗粒的纳米材料更容易发生聚集,所以介质中依然能观察到粒径较小的AgNPs[14-15]。AgNPs与HA溶液的Zeta电位值分别为(-18.53±1.10)和(45.63±1.15) mV(见表 2),表明AgNPs与HA表面净电荷为负[16]。而对于两者的混合溶液,Zeta电位分别是(-32.70±1.59) mV和(-48.06±2.99) mV,说明随着腐殖酸浓度的增加,Zeta电位值的绝对值随之增加。Neubauer等[17]研究指出具有大分子吸附层的球型颗粒在相互吸引靠近时,颗粒之间的范德华力是决定体系位能的主要因素。当HA吸附在颗粒表面后,颗粒的表面形成更稳定的负电位。同时,吸附HA后的颗粒之间的空间位阻效应增大,且颗粒之间空间位阻产生的排斥力大于静电排斥,在阻碍颗粒聚集中起主要作用[5]。所以在静电排斥力和空间位阻效应的共同作用下,混合体系中HA和AgNPs复合颗粒之间的排斥力大于颗粒之间的范德华力,导致复合颗粒能稳定的存在于介质中。而相对于低浓度的HA,复合颗粒之间的静电排斥力和空间位阻效应相对较小,所以体系的稳定性显著地低于高浓度的HA体系。
|
|
表 2 AgNPs在介质中的Zeta电位值 Table 2 The Zeta Potential of AgNPs |
金属硫蛋白(Mmetallothionein, MT)是一类存在丰富的含巯基(-SH)的半胱氨酸[18]非酶类小分子蛋白质,能有效结合重金属离子并降低其毒性,且生物体金属硫蛋白的活性与重金属浓度之间存在显著地效应剂量关系[19-20],即组织中MT的含量与重金属的含量呈正相关。
对于鳃组织,HA的存在降低了MT的含量。图 2表明,当海水中存在HA时,暴露第3天和第7天两种HA浓度下鳃组织中MT的含量与对照组无显著差异,且均显著地低于AgNPs暴露组。以上结果说明,HA存在下,HA抑制了鳃对Ag的蓄积作用。根据Ward等[21]的研究表明,鳃组织是双壳类软体动物捕获食物或颗粒的主要器官。在捕获浮游植物、藻类和不同类型的有机颗粒,包括吸附在纤毛表面营养价值较低的有机或无机颗粒后,将这些颗粒吸收并夹带在粘液基质中沿着消化道输送至消化腺。由于HA吸附在AgNPs表面形成稳定的聚集体[5, 22],鳃组织与AgNPs之间的接触降低,从而减少了银的吸收。暴露第10天,AgNPs和AgNPs-HA(15 mg·L-1)之间MT含量无显著差异,但是显著高于空白组和AgNPs-HA(30 mg·L-1)。以上结果表明高浓度的HA能有效的吸附介质中的AgNPs,从而显著地抑制了鳃组织中Ag的蓄积。而低浓度的HA不能充分的吸附介质中的AgNPs,导致介质中存在部分游离的AgNPs。所以,随着暴露时间的延长,鳃组织中也出现了Ag的蓄积。
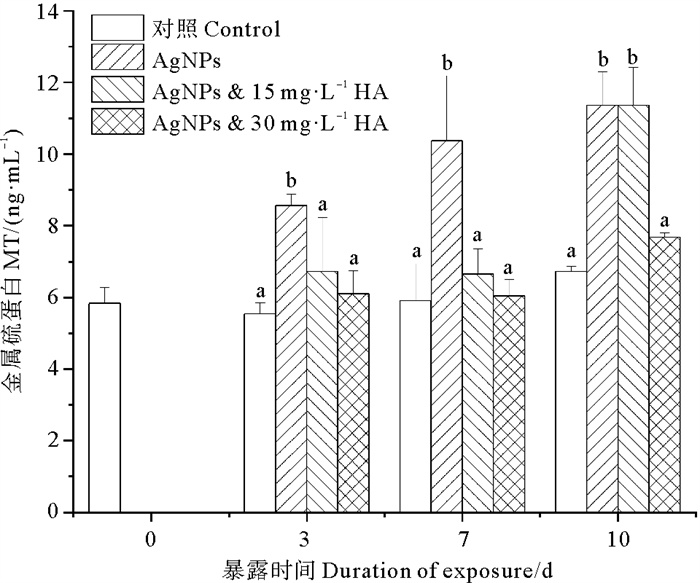
|
( 不同字母表示相同暴露时间下不同处理组之间存在显著差异(p < 0.05),下同。Different letters represent significant difference among treatment groups at the same exposure time (p < 0.05), similarly hereinafter. ) 图 2 HA存在下AgNPs对蛤仔鳃的MT含量的影响 Fig. 2 The content of MT in gill exposed to AgNPs in the presence of HA |
在暴露第3、7、10天,AgNPs单独暴露组的CAT活性比对照组分别增加了5.3%、10%、4.7%(见图 3(a))。而在整个暴露期内,不同浓度的HA处理之间无显著差异,且显著地低于AgNPs暴露组。图 3(b)显示,鳃组织SOD的活性与CAT类似。在暴露第1、3、7天之后受到显著地诱导,AgNPs暴露组分别是对照组的14%、18%、12%,且均显著地高于HA和AgNPs的联合暴露组。在暴露第7天,高浓度HA(30 mg·L-1)条件下SOD的活性显著地低于低浓度的HA(15 mg·L-1)和AgNPs暴露组。
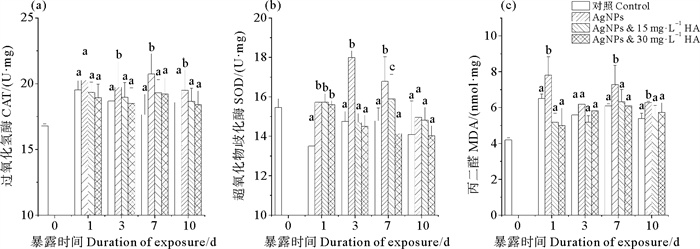
|
图 3 腐殖酸存在下AgNPs对蛤仔鳃的CAT (a)、SOD (b)、MDA (c)活性的影响 Fig. 3 The activity of CAT (a), SOD (b), MDA (c) in gill exposed to AgNPs in the presence of HA |
在AgNPs暴露组中(见图 3(c)),不同的暴露时间蛤仔鳃MDA浓度值分别为5.58、6.18、5.18、5.83 nmol·mg。未暴露在AgNPs的蛤仔鳃组织中MDA初始浓度是4.19 nmol·mg,暴露于AgNPs的蛤仔鳃组织中MDA的浓度出现出显著地上调。而存在HA的情况下,MDA的含量与对照组相比均无显著地差异,且均低于AgNPs暴露组。
一般来说,ROS所导致的脂质过氧化被认为是纳米颗粒对生物的主要致毒机制[23],这可能对暴露在纳米颗粒下的生物造成显著地亚致死毒性。在自然环境下,HA能显著地抑制AgNPs对生物的毒性。其原因在于HA能与AgNPs释放的银离子形成稳定的络合物,改变其生物利用度和毒性[6]。此外,HA包裹AgNPs后作为颗粒与颗粒之间的物理屏障,修饰AgNPs的反应表面,改变AgNPs在水相中的溶解和聚集[5]。在双壳类动物中,纳米金属及其聚集物可被吸引到鳃或虹吸上皮外表面的带负电荷的结合位点上,然后通过水化孔被动扩散,由载体介导转运,或通过内吞作用吸收[24-25]。因此,AgNPs单独暴露通常比HA包裹的AgNPs更容易与蛤仔鳃组织表面接触并随后被吸收。生物体内的SOD主要清除组织内的超氧阴离子自由基,将其转化成H2O2,而CAT则主要催化H2O2的水解[3]。这两种酶维持生物细胞内ROS的产生和清除的动态平衡中起到重要作用。本研究中,AgNPs显著地诱导了鳃组织中ROS的产生,从而导致了鳃组织中MDA的水平上调(见图 3(c))及CAT(见图 3(a))、SOD(见图 3(b))活性的上升。而HA和AgNPs的联合暴露显著降低了蛤仔鳃组织的氧化胁迫。这种变化与组织中MT(见图 2)含量的变化一致,表明HA和AgNPs共存下的蛤仔鳃组织的毒性减轻主要是由于HA抑制了鳃组织对银的接触和蓄积。从本研究结果可知,低浓度与高浓度HA处理组之间CAT、MDA的变化不显著。而这种效应可能与HA对AgNPs吸附强度有关。从图 1b和表 2中可以看出,当HA浓度为15 mg·L-1时,介质中游离的AgNPs数量较少,且Zeta电位绝对值为(32.70±1.59) mV,体系较稳定。所以,游离的AgNPs诱导产生的ROS能被机体抗氧化酶(SOD和CAT)迅速分解。
2.4 HA存在下AgNPs对遗传毒性的影响如图 4所示,暴露于AgNPs的蛤仔鳃组织细胞的遗传毒性随着暴露时间的延长而增加(p < 0.05)。AgNPs暴露1 d后,蛤仔鳃组织细胞产生的DNA片段属于分子量较大的片段,因此在低熔点的琼脂糖凝胶中的移动速率较慢。在暴露第一天后,由于蛤仔开始接触环境中的AgNPs,细胞的DNA损伤修复活性较强[27],未被修复的较大的DNA片段形成较短的彗尾(见图 4(b))[28]。暴露第3、7、10天,随着组织细胞中ROS的积累,使得DNA的损伤越来越严重。大量的ROS的使核DNA链断裂产生较小的片段。在电场作用下片段较短的DNA片段在低熔点的琼脂糖凝胶中移动速率较快,因此形成较长的彗尾(见图 4(b))。在遗传毒性最大的第7天,各实验组的头部DNA含量(HDNA)分别是:93.99%、71.93%、74.70%、77.38%(见图 5(a))。对照组的HDNA含量低于100%可能是因为在实验操作过程中不能做到全程完全的避光处理,紫外线的照射致使对照组中出现少量的彗尾。随着HA浓度的上升,HDNA的百分比显著增加,OTM中的值显著降低。暴露第7天AgNPs暴露组的OTM值分别是15 mg·L-1 HA暴露组以及30 mg·L-1 HA暴露组的4.06与3.33倍(见图 5(b))。AgNPs单独暴露组的遗传毒性在第7天达到最大。在暴露第3、7、10天HDNA值分别为71.93%、55.06%、79.12%,OTM值分别为12.38、20.52、12.73。
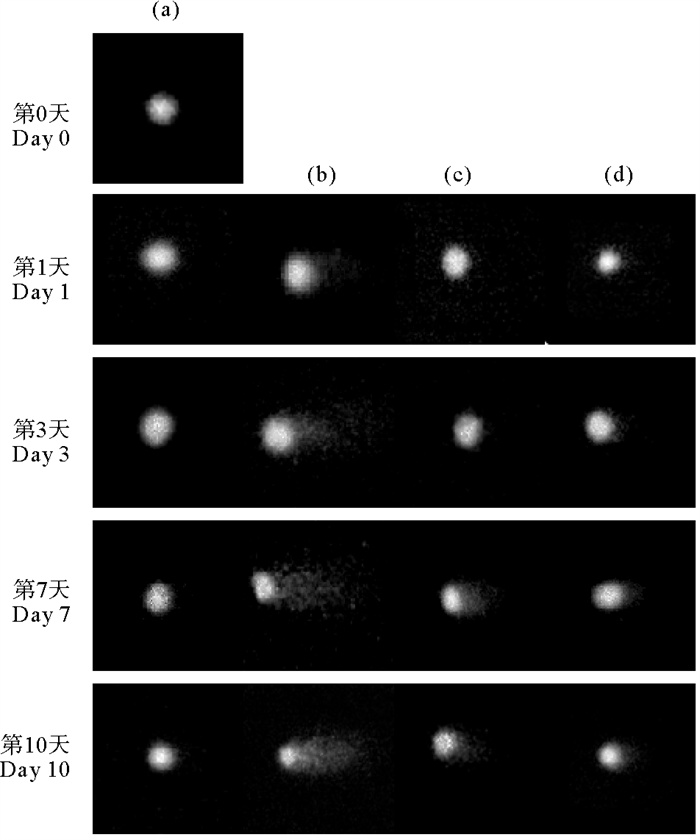
|
( (a)空白对照; (b)AgNPs; (c)AgNPs & 15 mg·L-1 HA; (d)AgNPs & 30 mg·L-1 HA。(a)Control; (b)AgNPs; (c)AgNPs & 15 mg·L-1 HA; (d)AgNPs & 30 mg·L-1 HA. ) 图 4 不同HA浓度存在下鳃组织细胞的彗星实验图 Fig. 4 Comet images for histocytes of gill in different concentration of HA |
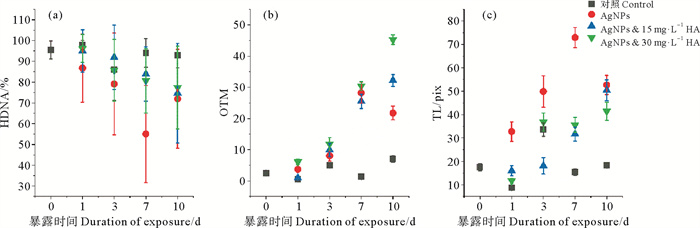
|
( HDNA:头部DNA百分比;OTM:Olive尾矩;TL:尾部DNA长度。HDNA: % DNA in head; OTM: Olive Tail Moment; TL: Tail Length; TM: Tail Moment ) 图 5 HA存在下AgNPs对鳃组织细胞的遗传毒性的影响 Fig. 5 Genotoxicity of AgNPs on histocytes of gill in the presence of HA |
结合上文的结论,HA通过吸附在AgNPs的表面而增加了颗粒的稳定性,从而降低了AgNPs的生物利用度。鳃组织中MT的浓度的降低也表明鳃组织对Ag的蓄积减少,抑制了鳃组织中ROS的累积而使MDA含量的降低。同时我们观察到HA存在下,鳃组织细胞的遗传毒性也受到显著地抑制(见图 5),而两种浓度的HA条件下鳃组织遗传毒性的差异不显著,这与氧化胁迫的结论一致。所以,在此研究中HA通过抑制鳃组织对Ag的蓄积,减弱了鳃组织中ROS的积累,从而降低了AgNPs对蛤仔鳃组织细胞的遗传毒性。ROS主要通过攻击DNA链的碱基来破坏DNA的原始结构或引发DNA链断裂,从而影响DNA复制和转录[26]。这种损伤可以通过碱基切除修复(Base excise repair, BER)的方式切除丧失功能的碱基[27]。
3 结语HA能有效的吸附在AgNPs的表面,并通过改变颗粒之间的静电排斥和空间位阻而显著地降低AgNPs在介质中的生物利用度。由于AgNPs稳定性的增加,鳃组织对Ag的蓄积减少,从而抑制了鳃组织中ROS的累积,减轻了组织的氧化胁迫,使组织中ROS的产生和清除维持在正常水平。本研究中,无HA存在的AgNPs暴露下,蛤仔鳃组织的氧化胁迫和遗传毒性均高于HA存在的AgNPs暴露。且不同HA浓度下,蛤仔鳃组织的氧化胁迫和遗传毒性均无显著地差异。说明ROS的累积导致了鳃组织的脂质过氧化,而过剩的ROS使核DNA链断裂引发鳃组织细胞的遗传毒性。所以,HA通过降低了AgNPs的生物活性,降低了蛤仔鳃组织中ROS的积累,从而减弱了鳃组织的氧化胁迫和遗传毒性。
| [1] |
Ward C S, Pan J F, Colman B P, et al. Conserved microbial toxicity responses for acute and chronic silver nanoparticle treatments in wetland mesocosms[J]. Environmental Science & Technology, 2019, 53(6): 3268-3276.
(  0) 0) |
| [2] |
Sung J H, Ji J H, Park J D, et al. Subchronic inhalation toxicity of silver nanoparticles[J]. Toxicological Sciences, 2009, 108(2): 452-61. DOI:10.1093/toxsci/kfn246
(  0) 0) |
| [3] |
Aouini F, Trombini C, Sendra M, et al. Biochemical response of the clam Ruditapes philippinarum to silver (AgD and AgNPs) exposure and application of an integrated biomarker response approach[J]. Marine Environmental Research, 2019, 152: 104783. DOI:10.1016/j.marenvres.2019.104783
(  0) 0) |
| [4] |
Zhang T, Pan J F, Hunt D E, et al. Organic matter modifies biochemical but not most behavioral responses of the clam Ruditapes philippinarum to nanosilver exposure[J]. Marine Environmental Research, 2018, 133: 105-113. DOI:10.1016/j.marenvres.2017.10.016
(  0) 0) |
| [5] |
Gunsolus I L, Mousavi M P S, Hussein K, et al. Effects of humic and fulvic acids on silver nanoparticle stability, dissolution, and toxicity[J]. Environmental Science & Technology, 2015, 49(13): 8078-8086.
(  0) 0) |
| [6] |
Zhang T, Lu D, Zeng L, et al. Role of secondary particle formation in the persistence of silver nanoparticles in humic acid containing water under light irradiation[J]. Environmental Science & Technology, 2017, 51(24): 14164-14172.
(  0) 0) |
| [7] |
Yang Y, Xu S, Xu G, et al. Effects of ionic strength on physicochemical properties and toxicity of silver nanoparticles[J]. Science of the Total Environment, 2018, 647: 1088-1096.
(  0) 0) |
| [8] |
Angel B M, Batley G E, Jarolimek C V, et al. The impact of size on the fate and toxicity of nanoparticulate silver in aquatic systems[J]. Chemosphere, 2013, 93(2): 359-365. DOI:10.1016/j.chemosphere.2013.04.096
(  0) 0) |
| [9] |
Singh N P, Mccoy M T, Tice R R, et al. A simple technique for quantitation of low levels of DNA damage in individual cells[J]. Experimental Cell Research, 1988, 175(1): 184-191. DOI:10.1016/0014-4827(88)90265-0
(  0) 0) |
| [10] |
Croteau M N, Dybowska A D, Luoma S N, et al. A novel approach reveals that zinc oxide nanoparticles are bioavailable and toxic after dietary exposures[J]. Nanotoxicology, 2011, 5(1): 79-90. DOI:10.3109/17435390.2010.501914
(  0) 0) |
| [11] |
Pan J F, Buffet P E, Poirier L, et al. Size dependent bioaccumulation and ecotoxicity of gold nanoparticles in an endobenthic invertebrate: The tellinid clam Scrobicularia plana[J]. Environmental Pollution, 2012, 168: 37-43. DOI:10.1016/j.envpol.2012.03.051
(  0) 0) |
| [12] |
Mccarrick S, Cunha V, Zapletal O, et al. In vitro and in vivo genotoxicity of oxygenated polycyclic aromatic hydrocarbons[J]. Environmental Pollution, 2019, 246: 678-687. DOI:10.1016/j.envpol.2018.12.092
(  0) 0) |
| [13] |
Dos Santos D S, Alvarez-Puebla R A, Oliveira O N, et al. Controlling the size and shape of gold nanoparticles in fulvic acid colloidal solutions and their optical characterization using SERS[J]. Journal of Materials Chemistry, 2005, 15(29): 3045-3049. DOI:10.1039/b506218g
(  0) 0) |
| [14] |
Afshinnia K, Baalousha M. Effect of phosphate buffer on aggregation kinetics of citrate-coated silver nanoparticles induced by monovalent and divalent electrolytes[J]. Science of the Total Environment, 2017, 581: 268-276.
(  0) 0) |
| [15] |
Afshinnia K, Marrone B, Baalousha M. Potential impact of natural organic ligands on the colloidal stability of silver nanoparticles[J]. Science of the Total Environment, 2018, 625: 1518-1526. DOI:10.1016/j.scitotenv.2017.12.299
(  0) 0) |
| [16] |
Chen C S, Le C, Chiu M H, et al. The impact of nanoplastics on marine dissolved organic matter assembly[J]. Science of the Total Environment, 2018, 634: 316-320. DOI:10.1016/j.scitotenv.2018.03.269
(  0) 0) |
| [17] |
Neubauer C M, Yang M, Jennings H M. Interparticle potential and sedimentation behavior of cement suspensions: Effects of admixtures[J]. Advanced Cement Based Materials, 1998, 8(1): 17-27. DOI:10.1016/S1065-7355(98)00005-4
(  0) 0) |
| [18] |
Viarengo A, Ponzano E, Dondero F, et al. A simple spectrophotometric method for metallothionein evaluation in marine organisms: An application to Mediterranean and Antarctic molluscs[J]. Marine Environmental Research, 1997, 44(1): 69-84. DOI:10.1016/S0141-1136(96)00103-1
(  0) 0) |
| [19] |
Moltedo O, Verde C, Capasso A, et al. Zinc transport and metallothionein secretion in the intestinal human cell line Caco-2[J]. Journal of Biological Chemistry, 2000, 275(41): 31819-31825. DOI:10.1074/jbc.M002907200
(  0) 0) |
| [20] |
林芃, 任宏伟, 茹炳根. 鱼体内金属硫蛋白与水环境关系的研究[J]. 北京大学学报(自然科学版), 2001, 37(6): 779-784. DOI:10.3321/j.issn:0479-8023.2001.06.006 (  0) 0) |
| [21] |
Ward J E, Levinton J S, Shumway S E, et al. Site of particle selection in a bivalve mollusc[J]. Nature, 1997, 390(6656): 131-132. DOI:10.1038/36481
(  0) 0) |
| [22] |
Yu S, Liu J, Yin Y, et al. Interactions between engineered nanoparticles and dissolved organic matter: A review on mechanisms and environmental effects[J]. Journal of Environmental Sciences, 2018, 63: 198-217. DOI:10.1016/j.jes.2017.06.021
(  0) 0) |
| [23] |
Nel A, Xia T, Madler L, et al. Toxic potential of materials at the nanolevel[J]. Science, 2006, 311(5761): 622-627. DOI:10.1126/science.1114397
(  0) 0) |
| [24] |
Pan J F, Wang W X. Comparison of the bioavailability of Cr and Fe bound with natural colloids of different origins and sizes to two marine bivalves[J]. Marine Biology, 2002, 141(5): 915-924. DOI:10.1007/s00227-002-0875-9
(  0) 0) |
| [25] |
Pan J F, Wang W X. Influences of dissolved and colloidal organic carbon on the uptake of Ag, Cd, and Cr by the marine mussel Perna viridis[J]. Environmental Pollution, 2004, 129(3): 467-477. DOI:10.1016/j.envpol.2003.11.015
(  0) 0) |
| [26] |
Sandrini J Z, Bianchini A, Trindade G S, et al. Reactive oxygen species generation and expression of DNA repair-related genes after copper exposure in zebrafish (Danio rerio) ZFL cells[J]. Aquatic Toxicology, 2009, 95(4): 285-291. DOI:10.1016/j.aquatox.2009.02.016
(  0) 0) |
| [27] |
Kienzler A, Bony S, Devaux A. DNA repair activity in fish and interest in ecotoxicology: A review[J]. Aquatic Toxicology, 2013, 134-135: 47-56. DOI:10.1016/j.aquatox.2013.03.005
(  0) 0) |
| [28] |
Wilson J T, Pascoe P L, Parry J M, et al. Evaluation of the comet assay as a method for the detection of DNA damage in the cells of a marine invertebrate, Mytilus edulis L. (Mollusca: Pelecypoda)[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1998, 399(1): 87-95. DOI:10.1016/S0027-5107(97)00268-6
(  0) 0) |
2. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China
 2022, Vol. 52
2022, Vol. 52


