2. 山东省海洋资源与环境研究院,山东 烟台 264006
许氏平鲉(Sebastes schlegelii,Hilgendorf)俗称黑寨、黑头、黑老婆,属于鲉形目(Scorpaeniformes)平鲉科(Sebastidae)平鲉属(Sebastes),是我国黄渤海区常见的卵胎生经济鱼类,国外主要分布在朝鲜半岛沿岸、日本和鄂霍次克海南部。近年来,许氏平鲉以其生长速度快、抗寒抗病力强、肉质鲜美、营养丰富以及养殖方式简单多样等优点,已成为我国北方重要海水养殖经济鱼种之一[1],且已作为主要增殖放流对象和重要游钓种类进行开发。目前,国内外已有对许氏平鲉早期胚胎发育[2]、早期生活史[3]、早期发育与摄食[4]、早期甲状腺激素[5-7]和消化酶[8-9]初步观察研究以及人工繁殖育苗的初步研究[1, 10-11];冯晓燕等[12]和李霞等[13]已报道过许氏平鲉消化道组织学和组织化学的相关研究;郭浩宇等[14]就许氏平鲉仔稚鱼的摄食特性及幼鱼胃排空率进行了相关研究;席丹等[15]做了许氏平鲉早期异速生长模式的研究。
在许氏平鲉育苗过程中,鱼苗时常会出现“危险期”的大量死亡、大小规格不整齐、残食严重、成活率较低等问题,这主要由于目前对其早期阶段的基础研究仍相对薄弱,特别是对其早期生长和摄食特性的研究亟待加强。为丰富许氏平鲉早期的生长和摄食特性研究,本实验开展了其早期阶段特别是“特定发育期”(“危险期”及“生长转折期”等)[16]的生长与摄食特性的研究,研究结果将丰富卵胎生鱼类早期生物学理论,为其人工繁育提供参考,更好的满足许氏平鲉近海资源增殖和养殖产业可持续发展的需要。
1 材料与方法 1.1 实验材料实验在山东省烟台泰华海洋科技有限公司进行。于4—5月从威海、烟台等地收购腹部膨大、性成熟的野生许氏平鲉怀仔亲鱼置于6 m×6 m×0.6 m的育苗池中,每池投放亲鱼1~2尾,用二级砂滤海水流水培育待产。采用原亲鱼池产仔育苗的方式,每池布放初产仔鱼2.1万~17万尾,稚鱼期(约20~25日龄)之前微流水培育,日流水量20%~60%,稚鱼期之后增大流量,日流水量1~6个循环。饲育水温14.2~23.4 ℃,平均水温18.8 ℃,盐度27~35,pH为7.1~8.2,溶解氧为7~8 mg/L,氨氮<0.156 mg/L,亚硝酸盐<0.01 mg/L,以日光灯照明,光照强度200~800 lx,每日21:00~6:00关灯。育苗饵料以裂壶藻营养强化后的褶皱臂尾轮虫(Brachionus plicatilis)(0~15日龄投喂)、卤虫(Artemia salina)无节幼体(10~50日龄投喂)和各种粒径的配合饵料(鱼宝牌,日本林兼产业株式会社;20日龄开始投喂)为主,后期辅助投喂少量的卤虫成体等,生物饵料每天投喂3~5次,配合饵料每天投喂4次,20日龄后每3天育苗池清底一次。
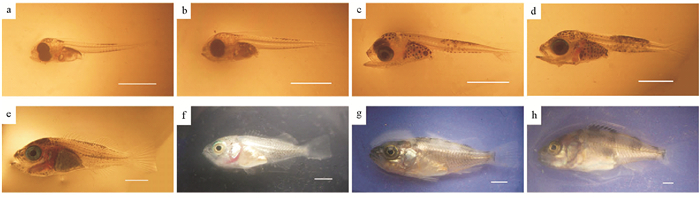
1.2 实验方法 1.2.1 仔、稚、幼鱼“特定发育期”形态与习性观察选取3个亲鱼同日产仔且仔鱼健壮,鱼苗密度均为5万尾左右的育苗池为实验池,各池每天分别取10条鱼苗用Nikon SMZ800N解剖镜进行显微观察,参照刘立明等对许氏平鲉仔稚幼鱼的分期方法[16],即早期可阶段划分为A~P共16个发育时期,其中A期(0日龄)~G期(15~17日龄)为仔鱼期,H期(18~19日龄)~O期(49~51日龄)为稚鱼期,P期(57~59日龄)为幼鱼期。本实验根据鱼苗全长及死亡率等的变化,确定许氏平鲉早期阶段的初产仔鱼期(A期)、4个“危险期”(B、E、L、N期)、2个“生长转折期”(G、O期)和幼鱼期(P期)为8个“特定发育期”,记录各期鱼苗形态特征并拍照。其中A(0日龄)、B(3日龄)、E(9日龄)、G(18日龄)、L(24日龄)期的鱼苗以解剖镜所联数码CCD拍照,N(30日龄)、O(39日龄)、P(48日龄)期的鱼苗则直接用Nikon COOLPIX S9200数码相机拍照,同时观察实验池中此8个“特定发育期”鱼苗的习性变化。
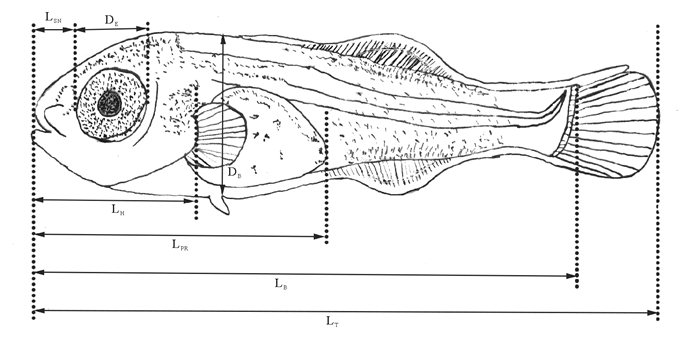
1.2.2 仔、稚、幼鱼生长指标的观测每3天从实验池中随机取鱼苗30尾(10尾/池),用MS-222(50 mg/L)麻醉后,在Nikon SMZ800N解剖镜下,用VImage2014联机软件测量其全长(Total length,LT)、体长(Body length,LB)、体高(Body depth,DB)、吻长(Snout length,LSN)、眼径(Eye orbit diameter,DE)、头长(Head length,LH)、肛前长(Preanal length,LPR)等生长指标[17-19](见图 1),用精密电子天平(LUCKY LQ-B2003,0.01g)测量每条鱼苗体重(Body weight, BW)。
|
(LT: 全长, LB: 体长, LSN: 吻长, DE: 眼径, LH: 头长, HH: 头高, DB: 体高, LPR: 肛前长。LT: Total length, LB: Body length, LSN: Snout length, DE: Eye orbit diameter, LH: Head length, DB: Body depth, LPR: Preanal length.) 图 1 许氏平鲉仔鱼生长指标测量示意图 Fig. 1 The growth index measured indicator diagram of S.schlegelii larvae |
摄食发生率、饱食量(率)及消化道充塞度的测定
分别于A、B、E、G、L、N、O、P期当天下午16:00取3个实验池的鱼苗各30尾,在Nikon SMZ800N解剖镜下解剖鱼苗,目测消化道充塞度(0~4级法,其中3、4级为摄食饱满[17]),并解剖鱼苗的消化道,计数其中的饵料生物数量。
摄食节律与日摄食量的测定 采用水体饵料减量法测定7个“特定发育期”的摄食节律与日摄食量。分别于B、E、G期当天早晨6:00之前从3个实验池中随机取60~90尾鱼苗(20~30尾/池)放于3个1000 mL大烧杯中,每烧杯20~30尾,烧杯置于10 L聚乙烯塑料桶中加池水水浴并吊挂于实验池中;L、N、O、P期分别取150~300尾鱼苗(50~100尾/池)放于3个10 L聚乙烯塑料桶中,每桶50~100尾,塑料桶吊挂于实验池中,微量充气,每天换水1~2次,每次换50%。B、E期投喂轮虫,密度保持5~15个/mL,G期之后投喂卤虫无节幼体,密度保持5~10个/mL,早晨6:00投饵后每3 h用玻璃吸管测定烧杯或水桶中饵料密度,每烧杯或水桶取样5次,B、E期每次取2 mL水样,G期之后每次取5 mL水样,用浮游生物计数框于Nikon SMZ800N解剖镜下观察计数,并计算出烧杯或塑料桶中饵料生物的数量,计算出每个时段的鱼苗个体摄食量(轮虫或卤虫无节幼体个数),每期连续测定24 h,将轮虫和卤虫无节幼体的平均湿重分别折算为3和11 μg[4],并以此计算出所有时段摄食量之和为日摄食量(mg),每次取样计数或换水后根据需要补充投喂并定量饵料密度,以保持饵料生物的合适密度。
饱食时间和消化时间的测定 分别于B、E、G、L、N、O、P期当天在每个实验池边设置1个聚乙烯水槽(0.4 m×0.3 m×0.25 m),共3个平行水槽,每池取30尾鱼苗放入水槽内,保持持续充气和全流水,待鱼苗胃肠排空后投喂饵料,停止流水,B、E期投喂轮虫(约20个/mL),G期之后投喂卤虫无节幼体(10~20个/mL)。投喂后开始计时,观察记录90%个体达到饱食所用的时间即为饱食时间。将饱食后的鱼苗转移至无饵料的2000 mL大烧杯内,观察并记录90%个体胃肠排空所用的时间即为消化时间。
1.3 数据分析及计算用Origin 9.0软件对全长和体重等生长指标变化速率不同的阶段进行分段拟合:y=kx+b,式中x为日龄,y为全长或体重等生长指标,b为截距,k为斜率(表示该阶段的生长速率)。用SPSS 19.0软件通过t检验比较某一日龄xi左右两侧的斜率k1、k2差异的显著性和相关系数R2的值,可确定全长和体重等生长指标随日龄生长速率变化的转折点[18-20]。
实验中仔、稚、幼鱼的摄食生态指标的计算方法如下[21]:
摄食发生率(%)为消化道内含有饵料的鱼苗数占总取样鱼苗数的比率。
饱食量(个)为所测鱼苗中摄食饵料生物最多的鱼苗所食饵料的个数。
饱食率(%)为所测鱼苗中饱食(消化道饱满度为3级和4级)个体占所测总鱼苗数的百分比。
饱食时长(min)为胃肠排空鱼苗至饱食状态(消化道饱满度为3级或4级)所需要的摄食时间。
消化时长(min)为饱食鱼苗在无饵料环境中消化道排空所需要的时间。
用SPSS 19.0进行摄食节律与日摄食量差异的显著性分析,P<0.05表示具有显著性差异,指标的测量数值用平均数±标准差表示。用Origin 9.0作摄食指标变化图,并用photoshop7.0进行“特定发育期”图片的整合处理。
2 结果 2.1 仔、稚、幼鱼“特定发育期”形态与习性特征A期:初产仔鱼,处于前仔鱼期,残存卵黄囊和油球,油球直径为(0.25±0.04)mm,头顶、腹腔背缘、颈部、躯干肌节中部上下侧分布少量星芒状黑色素细胞,奇鳍膜质,胸鳍圆形、宽大、膜质,无腹鳍(见图 2a)。具有较弱的趋光性,可以在水面颤动式平游,仔鱼已开口,当天下午开始摄食轮虫,少量鱼苗已能吞食卤虫无节幼体,但无法正常消化。
|
(a:0日龄,全长(6.47±0.19)mm;b:3日龄,全长(6.58±0.15)mm;c:9日龄,全长(7.33±0.35)mm;d:18日龄,全长(8.71±0.58)mm;e:24日龄,全长(12.56±1.48)mm;f:30日龄,全长(14.73±2.68)mm;g:39日龄,全长(18.48±2.75)mm;h:48日龄,全长(28.98±3.35)mm。比例尺=2 mm。a: 0 dpb, TL (6.47±0.19)mm; b: 3 dpb, TL (6.58±0.15)mm; c: 9 dpb, TL (7.33±0.35)mm; d: 18 dpb, TL (8.71±0.58)mm; e: 24 dpb, TL (12.56±1.48)mm; f: 30 dpb, TL (14.73±2.68)mm; g: 39 dpb, TL (18.48±2.75)mm; h: 48 dpb, TL (28.98±3.35)mm. dpb: Days post-birth, TL: Total length. Measuring scale=2 mm.) 图 2 许氏平鲉早期阶段“特定发育期”形态 Fig. 2 The morphology of S. schlegelii in the 'specific developmental periods' |
B期:进入后仔鱼期,黑色素增多,上下颌出现点状色素,并在脑颅后方(肌节开始处)增加一丛色素,卵黄囊吸收殆尽,油球几乎不可见,直径仅为(0.16±0.03)mm,尾鳍原基增厚,前鳃盖骨出现一枚棘(见图 2b)。摄食轮虫量开始增加,游泳能力开始逐步增强,但不明显。
E期:黑色素分布呈现出明显的头部和躯干两段,其中尤以躯干中部上下边缘黑色素细胞浓密。尾鳍条继续延长,脊索末端开始上翘,出现腹鳍芽,背、臀鳍鳍担增厚,具2列共4枚前鳃盖棘(见图 2c)。能大量摄食轮虫,多数也可摄食并充分消化卤虫无节幼体,性喜集群,常在池壁边聚成“黑球”状。
G期:背、臀鳍条开始出现,但不明显,尾鳍鳍担骨形成,脊索末端上翘约45°,躯干部密布星芒状黑色素,具2列共6枚前鳃盖棘(见图 2d)。摄食量显著增大,且能大量摄食卤虫无节幼体。
L期:稚鱼期,背鳍棘继续增高,除尾鳍基部仅余少量鳍膜与尾部鳍膜连接成片外,其他鳍膜完全吸收,肛门后的背鳍和臀鳍鳍条已经形成,尾柄正在形成(见图 2e)。在水层中敏捷地游动,且躲避迅速灵敏,开始逐渐转为底栖习性。
N期:全身密布星点状黑色素细胞,色素分布止于尾柄处,体中线处最密集,背鳍棘部相当发达,尾鳍原始鳍膜完全消失,胸鳍末端开始变得尖长(见图 2f)。能顺利摄食配合饵料,个体大小差异明显,开始出现残食现象。
O期:黑色素细胞明显消退,鱼体呈金黄色,并在躯干部出现4~5条横向色素带,背鳍棘部出现色素斑,具单列共5枚前鳃盖棘,2枚主鳃盖棘,鱼苗体型、各鳍形态基本类似成鱼(见图 2g)。完成变态发育过程,静止时常在池壁边栖息,残食严重,并积极抢食配合饵料。
P期:进入幼鱼期,侧线已出现,鱼苗全身披鳞,游泳能力大大增强,已具有逆流游动的能力,躯干部横带更明显,且背鳍棘部与软条部均出现色素斑,体型、鳍形更趋近成鱼(见图 2h)。集群明显,抢食行为激烈,与成鱼的生态习性基本相同。
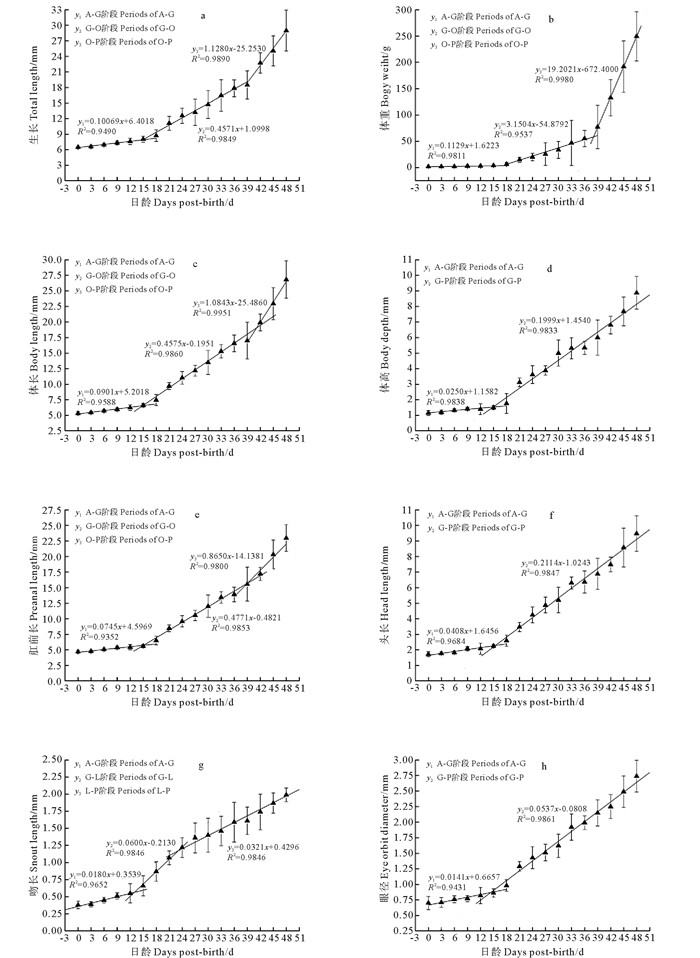
2.2 仔、稚、幼鱼生长指标变化 2.2.1 躯干参数的生长变化全长、体重、体长与肛前长随日龄的增长呈三段式直线增长(见图 3a、b、c、e),体高随日龄的增长呈两段式直线增长(见图 3d),并且增长速度均逐渐加快。全长、体重、体长、肛前长第一个生长转折点和体高的生长转折点都在15~18日龄左右,全长(8.71±0.58)mm,体重(5.42±2.97)mg,处于G期;全长、体重、体长、肛前长、体高的第二个生长转折点都在39日龄左右,全长(18.48±2.75)mm,体重(77.29±21.39)mg,处于O期。全长、体重、体长、肛前长3个阶段的生长速率之间的差异都达到显著水平(P<0.05),体高2个阶段的生长速率也差异显著(P<0.05),且各阶段生长曲线的相关系数R2的值均大于0.90。
|
图 3 许氏平鲉早期阶段生长指标的变化 Fig. 3 The growth pattern of the measurement index in early stages of S. schlegeliii |
头长、眼径随日龄的增加呈两段式直线增长(见图 3f、h),并且增长速度均逐渐加快;而吻长随日龄的增加呈三段式直线增长(见图 3g),其增长速率呈先上升后下降的趋势。其中头长、眼径的生长转折点和吻长的第一个生长转折点均出现在15~18日龄左右,处于G期;吻长的第二个生长转折点出现在24日龄左右,全长12.56±1.48 mm,体重(20.14±7.15) mg,处于L期。吻长3个阶段的生长速率之间的差异都达到显著水平(P<0.05),头长、眼径2个阶段的生长速率也差异显著(P<0.05),且各阶段生长曲线的相关系数R2的值均大于0.95。
2.3 仔、稚、幼鱼“特定发育期”摄食特征 2.3.1 摄食发生率、饱食量(率)及消化道充塞度通过比较不同“特定发育期”的仔、稚、幼鱼的消化道充塞度变化可以发现,初产仔鱼A期的摄食发生率和饱食率都较低,而从B期开始摄食发生率和饱食率迅速升高,摄食发生率在L期后达到100%,饱食率到N期达到100%,此后各期鱼苗的消化道充塞度都在3~4级,二者均保持100%(见表 1),并且A期和B期的摄食发生率和饱食率差异明显。通过解剖不同时期鱼苗的消化道发现,A~P期的饱食量总体呈增长趋势,G期即能大量摄食卤虫无节幼体,饱食量急剧增加;而且通过实验观察也能发现,初产仔鱼当天就可以摄食轮虫,少量鱼苗已能够摄入卤虫无节幼体,但虫体排出后仍保持活体状态,表明仔鱼此时尚无法正常消化卤虫无节幼体。
|
|
表 1 许氏平鲉仔、稚、幼鱼“特定发育期”摄食发生率、饱食量、饱食率及消化道充塞度 Table 1 The degree of digestive tract fullness, feeding incidence, satiation and satiation rate of larvae, juvenile and young S.schlegelii in the 'specific developmental periods' |
由图 4可知,B期仔鱼~P期幼鱼的日摄食量总体呈上升趋势,其中B、E、G三个时期增长较慢,差异不显著(P>0.05),从G期开始,日摄食量增长速度加快,且L期日摄食量(6.05±0.59) mg显著高于G期的日摄食量(2.48±0.24) mg(P<0.05),同时G期、L期、N期与O期相互之间的日摄食量差异也都达到显著水平(P<0.05),而O期日摄食量(15.68±1.98) mg与P期日摄食量(17.60±1.86) mg则差异不显著(P>0.05),由O期开始,日摄食量的增长速度有所降低。
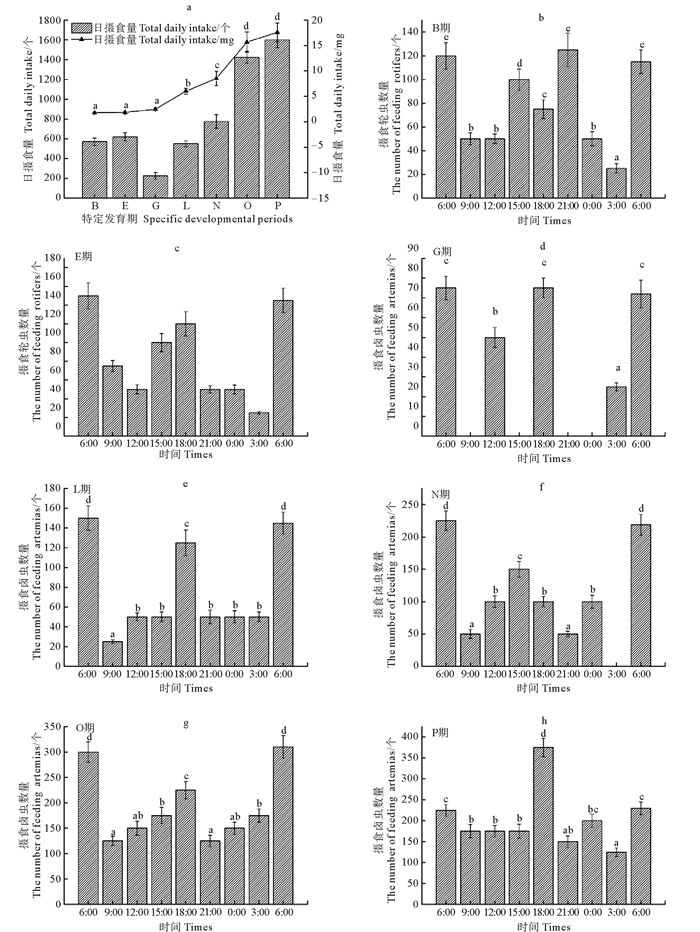
|
(数值釆用平均值±标准差(n=3)表示,各数据条的不同字母表示差异显著(P<0.05)。图 4-a: B、E期鱼苗摄食轮虫,G-P期鱼苗摄食卤虫无节幼体。Values were given as means ± SD (n=3), the bars with different letters indicate significant differences (P<0.05).Fig. 4-a: Larvae feed rotifers in stage B and E, and feed Artimiasalina nauplii from stage G to P.) 图 4 许氏平鲉仔、稚、幼鱼“特定发育期”的摄食节律与日摄食量 Fig. 4 The feeding rhythm and total daily intake of larvae, juvenile and young S. schlegeliii in the 'specific developmental periods' |
B期仔鱼~P期幼鱼一昼夜都出现2个摄食高峰,且2个高峰与其他各时间段的摄食量差异都达到显著水平(P<0.05)。各期的首个摄食高峰均出现在早晨6:00~9:00,该时间段的摄食量占日摄食量的14%~33%;E期~P期另一个摄食高峰出现在下午15:00~18:00或18:00~21:00,该时间段的摄食量占日摄食量的19%~33%,而B期的另一摄食高峰出现在晚上21:00~24:00,且该时间段的摄食量占日摄食量的21%;另外B、E期的15:00~18:00、G期的12:00~15:00摄食量也较多,分别占日摄食量的16%~17%、22%。除G期和N期某些时间段有不摄食情况,其他各期均全天摄食。
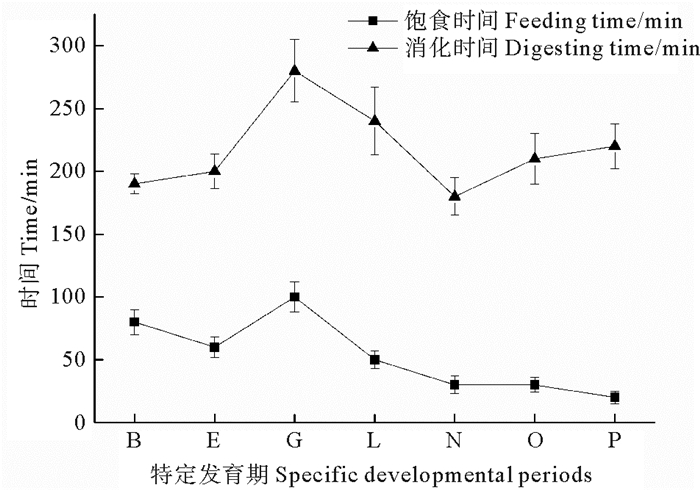
2.3.3 饱食时间和消化时间仔、稚、幼鱼“特定发育期”的饱食时间先从B期的(80±10) min缩短为E期的(60±5) min,然后增长到G期时的最大值(100±12) min,此后一直下降到P期幼鱼的(20±5) min。除G期外其他各期的饱食时间随日龄的增长总体呈递减的趋势;消化时间从B期的(190±8) min,随着摄食量的增大开始增长,到G期达到高峰值(280±25) min,此后开始下降,到N期降为(180±15) min达到最低后又转而上升,到P期达(220±18) min。消化时间随鱼苗的生长发育总体呈上升→下降→再上升的趋势(见图 5)。
|
图 5 许氏平鲉仔、稚、幼鱼“特定发育期”的饱食时间和消化时间 Fig. 5 The satiation feeding time and digesting time of larvae, juvenile and young S. schlegeliii in the 'specific developmental periods' |
前期研究发现,许氏平鲉早期阶段存在4个“危险期”和2个“生长转折期”[16]。“危险期”的发生通常伴随鱼体外部形态与消化、内分泌等内部器官剧烈的变态发育,这在鲆鲽类中表现得尤为突出[22]。作为底栖性鱼类,许氏平鲉早期同样要经历变态发育和由浮游到底栖生活方式转变的过程,特别是在死亡率最高的第三“危险期”所伴随的肠道折叠及第四“危险期”的幽门垂分化[16]等形态结构的变化,提示我们此时鱼苗正在经历极其深刻的生理转变。此前在人工育苗生产中多次发现,若投饵不足,会造成仔鱼在第一“生长转折期”(全长8~9 mm)之后大小规格差异急剧增大,鱼苗残食加剧,导致后期培育尤为困难,此后变态期间第三“危险期”的仔鱼也常会出现空腹漂浮,活力下降,乃至于大量死亡,也应归因于前期饵料摄食不足与营养缺乏,影响了仔鱼的生长发育和活力。参照已有分期方法[16],本文对许氏平鲉8个特定发育期——初产仔鱼(A期)、2个生长转折期(G期和O期)、4个“危险期”(B、E、L、N期)及幼鱼期(P期)生长、发育与摄食特性进行了较为深入的研究,这将有助于人工繁育生产中的科学投饵、促生长与育苗成活率的提高。
3.2 许氏平鲉早期阶段的生长特性许多鱼类的早期生长具有不均衡性,主要表现在早期阶段存在生长拐点或生长转折点,如变态期牙鲆(Paralichthys olivaceus)的生长模式表现为加速→减速→再加速的特征,具有2个生长拐点[22];横滨黄盖鲽(Limanda yokohamae)在变态期的生长停滞,同样造成变态前后出现生长拐点[23]。许氏平鲉早期的生长一直呈加速状态,其中全长、体重、体长、肛前长随日龄的增长出现2个生长转折点(G期和O期),在生长转折点鱼苗的生长速率明显提高,这与刘立明等[16]的报道相一致,其原因可能与G期和O期鱼苗的变态发育和食性变化有关。G期仔鱼的背、臀鳍鳍条开始出现,尾鳍担骨形成,消化道开始横向拉长,胃逐渐分化形成,摄食旺盛,大量吞食卤虫无节幼体,故而生长速率增大;O期稚鱼各鳍基本发育完善,形态类似成鱼,开始转归底栖,基本完成肠道的第一次折叠并开始第二次折叠,幽门垂完成了分化的过程,肝脏也发生了明显的形变,消化系统趋于完善,基本完成变态发育,能够积极摄食配合饵料,因而生长速率大大增加。体高、头长、眼径仅出现1个生长转折点(G期),吻长有2个生长转折点(G期和L期),这种生长特点可能与体高及头部器官的异速生长发育模式有关。席丹等[15]提出许氏平鲉头长与全长先等速后负异速生长,眼径与全长无明显异速生长拐点,整体呈负异速生长,吻长与全长先正异速生长后等速生长,本实验结果与其较为相似,比如,吻长在全长12 mm左右(L期)出现生长转折,此时其生长速率开始明显降低,这表明吻长等头部器官在12 mm之前可优先快速发育,这种生长特点似乎更有利于摄食功能的发挥。据报道,为了维持种群持续繁衍,鱼类在长期进化中形成了一种存活策略和个体发育机制,即优先发育那些对存活起首要作用的器官,如发育摄食、运动、呼吸和感觉等功能器官,并且这种生长的优先性会随着个体的发育而改变[24]。
与暗纹东方鲀(Takifugu obscurus)[25]和大口鲇(Silurus meridionalis)[26]等肉食性鱼类相似,许氏平鲉在早期发育阶段也会出现严重的残食现象,鱼苗在30日龄左右(N期)开始出现残食,死亡率大增,这主要归因于鱼苗生长的不同步性。许氏平鲉鱼苗从G期便开始进入第一个生长转折期,生长速度显著增大,若密度过大或投饵不足,将导致鱼苗大小差异迅速增大,N期鱼苗全长已达15 mm左右,游泳能力强,且捕食器官和消化系统的发育分化程度已较高,导致了残食的发生,生产中看似N期开始出现残食死亡,但根本原因是由于鱼苗自G期开始的快速生长期的生长差异所造成的。生产中保证充足的饵料供应,合适的育苗密度和适时大小分选是减轻残食的有效方法。
3.3 许氏平鲉早期阶段的摄食特性鱼类早期的摄食能力与其种类、个体大小以及饵料密度、大小、种类等密切相关[17]。在人工育苗条件下,当仔鱼开口后,育苗池内若有充足的饵料,鱼苗通常具有较高的摄食发生率。如云纹石斑鱼(Epinephelus moara)6日龄仔鱼的摄食发生率已达100%,仔、稚鱼的平均摄食发生率高达97.63%[27];斜带石斑鱼(E. coioides)4日龄以上鱼苗的摄食发生率均达到100%,饱食率达到60%~100%[28]。本研究表明,许氏平鲉初产仔鱼摄食发生率和饱食率不高,仅为57%和23%,2~3日龄(B期)后显著升高(见表 1),表明部分初产仔鱼已具有一定的摄食能力,吴光宗[29]认为,许氏平鲉仔鱼产出3~4 h后即可开口摄食,开口率达到60%~75%,并且可以直接摄食轮虫和卤虫无节幼体,张静等报道,在水温15.4~22.0 ℃的条件下,许氏平鲉仔鱼产出后当天就有摄食发生,但开口率较低,仅有25%,蔺玉珍等[30]观察到许氏平鲉仔鱼在产出后第1天即可以摄食轮虫,本实验结果与此基本一致,但与郭浩宇等报道的2日龄方开始摄食有所不同[14]。许氏平鲉的这种习性是由于仔鱼产出前在母体内卵黄囊和油球就已被大量吸收,产出后需尽快建立外源营养,因而从初产仔鱼(A期)开始,饱食量即持续增加,到G期饱食量出现转折性增长(见表 1),且与此时仔鱼生长的转折性加快是一致的。因此,在育苗生产中,仔鱼产出当天就需投喂轮虫,以顺利完成仔鱼内、外源营养的转换,在G期应加大投饵量,以满足鱼苗快速生长发育的需要。
摄食节律是鱼类的摄食感觉机能对温度、光照、饵料等周期性变动的外在生态因子的主动适应[31]。根据鱼类的日摄食情况,Helfman将鱼类的摄食分为白天摄食、晚上摄食、晨昏摄食和无明显节律4种类型[32]。许多鱼类仔、稚、幼鱼的摄食行为都表现出特定的节律性,这是其对所处的生活环境等的一种适应性。如牙鲆和瓦氏黄颡鱼(Pelteobagrus vachelli)早期阶段的摄食节律均属于晨昏摄食高峰并且以白天摄食为主的类型[33-34]。许氏平鲉B~P期都有2个摄食高峰,其中6:00~9:00均出现摄食高峰,另一个摄食高峰在15:00~18:00或18:00~21:00,除G期外的鱼苗在夜间也有少量摄食(见图 4),因此许氏平鲉的摄食节律与牙鲆类似,属于白天摄食型且具有晨昏摄食高峰,这与张静等[4]的研究结果相似。据Brett等报道,鱼类早期阶段个体较小,胃容量小且发育不完善,因而单次摄食量少,个体需要更高的摄食频率来满足生长发育所需的摄食量;较大个体的幼鱼或成鱼胃容量增大,单次摄食量多,因而需要更长的消化时间[35]。因而B期仔鱼摄食节律性不强估计可能与胃及摄食相关感觉器官(眼睛,皮肤感觉器等)尚未发育完善有关,G期的间断性摄食正是由于此时仔鱼的胃开始形成,单次摄食量增多,每次饱食后需要较长的消化时间。研究发现,同为全天摄食型的裸项栉鰕虎鱼(Bareneck goby)和革胡子鲶(Clarias Lazera),前者仔鱼在白天的摄食强度明显比夜间强烈,且光照对摄食影响显著[36],后者则正相反[37],许氏平鲉与前者较为相似,这种白天摄食比夜间活跃的习性,可能与其摄食的感觉方式或摄食器官的发育程度密切相关。有的鱼靠视觉捕食,如花鲈[28]和大菱鲆(Scophthalmus maximus)[38]等,也有的鱼类靠其他感觉器官(味蕾,侧线等)捕食,设想许氏平鲉主要依靠视觉捕食,B期仔鱼眼睛发育程度低,到G期仔鱼眼径的生长转折期,眼睛发育速率大增,具备了较强的视觉能力,对光照更为敏感,因而一昼夜内的摄食量和摄食时长均有所增加,许氏平鲉仔鱼的这种摄食特性可能与其所处环境的光照强度有关,也可能与不依赖于光照、温度及饵料丰度等外界环境条件的内源性节律变化有关[4]。据报道,半滑舌鳎(Cynoglossus semilaevis)的栖息习性由变态前的浮游生活转为变态后的底栖生活时,摄食节律也由变态伏底前的白天摄食为主,转为营底栖生活后的夜间活动与摄食[38],与此类似,许氏平鲉浮游期也主要在白天摄食,L期开始转归底栖生活后,鱼苗在夜间也有一定摄食,因而形成了其独特的昼夜摄食节律,另外,仔鱼在E期之前日摄食量较低,到G期和O期出现快速增长,这与生长的变化趋势是一致的。因而在育苗过程中,白天要保证充足的饵料,并且在6:00和15:00~18:00可适当增大投饵量,夜间也要保证一定的饵料密度,同时自G期和O期开始加大日投喂量,以促进鱼苗的生长和发育。
鱼类的饱食时间和消化时间受到多种因素的影响:鱼的种类、个体大小,摄食和消化器官的发育程度,摄食节律,饵料种类、质地和饵料大小,水质状况等。随着日龄的增大,许氏平鲉仔、稚、幼鱼饱食时间总体呈下降趋势,最后基本保持稳定(见图 5),G期仔鱼饱食时间的显著延长可能与其处于生长发育的转折期有关,此时仔鱼开始快速生长,胃开始分化形成,摄食量大增,所以饱食时间增长,G期后随着奇鳍和摄食器官的不断发育完善,运动能力和摄食能力得以持续增强,摄食时间逐渐减少。鱼苗的消化时间随着生长发育总体呈现上升→下降→再上升的趋势(见图 5),其中B期到G期仔鱼消化时间持续增长,并在G期达到高峰,可能也与其处于生长发育的转折期有关,G期仔鱼体长、体重开始快速增长,消化道容量增大,尤其是胃开始分化形成,致使摄食量大增,但是消化机能尚不完善,因而消化时间增长;L期和N期稚鱼消化时间开始降低,可能由于此时为鱼体消化系统形态机能变化最剧烈的时期,消化机能得以增强所致;而O期后稚幼鱼摄食量大大增加,致使消化时间延长,生长速度进一步加快。
4 结语许氏平鲉早期鱼苗各生长指标的增长速度均逐渐加快,且能够以某些“特定发育期”为界拟合为2~3段直线,其中全长、体重、体长和肛前长以2个生长转折点(G期和O期)为界呈3段式直线增长;体高以E期和O期为界呈3段式直线增长;头长、眼径以第一生长转折点(G期)为界呈2段式直线增长;吻长则以E期为界呈2段式直线增长。鱼苗的摄食指标也以某些“特定发育期”为节点出现显著变化,其中摄食发生率和饱食率自B期开始迅速升高,到N期后稳定地保持在100%;饱食量与日摄食量总体呈增长趋势,二者增长速度均自G期开始明显加快,且O期再次出现快速增长,这与此时鱼苗生长的转折性加快相一致;鱼苗摄食节律为白天摄食且晨昏为摄食高峰,自G期开始出现间断性摄食,L期营底栖生活后节律性更为明显,且与鱼苗消化道的发育和习性变化相关;随鱼苗的生长发育,消化时间以G期和N期为变化节点呈上升→下降→再上升的趋势,而饱食时间则总体呈下降趋势。了解许氏平鲉早期阶段的生长与摄食特性变化规律,可有效指导许氏平鲉人工育苗过程中鱼苗“特定发育期”的水环境和投饵管理,为促进鱼苗生长、摄食及提高育苗成活率提供参考。
| [1] |
刘立明, 杜荣斌, 孙颖民, 等. 黑鲪苗种培育关键技术的研究[J]. 海洋科学, 2010, 34(3): 1-5. Liu L M, Du R B, Sun Y M, et al. Key techniques of fry rearing for Sebastodes fuscescens[J]. Marine Science, 2010, 34(3): 1-5. (  0) 0) |
| [2] |
Yamada J, Kusakari M. Staging and the time course of embryonic development in kurosoi, Sebastes schlegelii[J]. Environmental Biology of Fishes, 1991, 30: 103-110. DOI:10.1007/BF02296881
(  0) 0) |
| [3] |
Nagasawa T, Domon K. The early life history of kurosoi, Sebastes schlegelii (Scorpaenidae), in the Sea of Japan[J]. Lchthyological Research, 1997, 44: 237-248. DOI:10.1007/BF02678703
(  0) 0) |
| [4] |
张静, 薛美岩, 姜海滨, 等. 黑鲪早期发育与摄食的初步观察[J]. 渔业科学进展, 2010, 31(2): 8-15. Zhang J, Xue M Y, Jiang H B, et al. Study on early development and feeding of larval Sebastodes fuscescens[J]. Progress in Fishery Sciences, 2010, 31(2): 8-15. (  0) 0) |
| [5] |
Kang D Y, Chang Y J. Effects of maternal injection of 3, 5, 3V-triiodo-Lthyronine(T3) on growth of newborn offspring ofrockfish, Sebastes schlegeli[J]. Aquaculture, 2004, 234: 641-655. DOI:10.1016/j.aquaculture.2004.01.011
(  0) 0) |
| [6] |
Kang D Y, Chang Y J, Chung E Y. Changes in thyroid hormone concentration and differentiation of thyroid gland during early development of rockfish, Sebastes schlegeli[J]. Dev Reprod, 2001, 5(1): 39-45.
(  0) 0) |
| [7] |
Chin B S, Yamashita Y, Nakagawa M, et al. Ontogenetic changes of habitat selection and thyroid hormone levels in black rockfish (Sebastes schlegelii) reared in captivity[J]. Ichthyological Research, 2010, 57: 278-285. DOI:10.1007/s10228-010-0165-3
(  0) 0) |
| [8] |
张静. 黑鲪(Sebastodes fuscescens)早期发育阶段摄食生长及主要消化酶活力的研究[D]. 上海: 上海海洋大学, 2010: 21-30. Zhang J. Study on Feeding, Growth and Main Digestive Enzyme Activities of the Early Development of Sebastodes fuscescens[D]. Shsnghai: Shanghai Ocean University, 2010: 21-30. (  0) 0) |
| [9] |
Lee B I. Comparative study of digestive enzyme in the artemia feeding step of the sweet fish Plecoglossus altivelis, rock fish Sebastes schlegelii, black seabream Acanthopagrus schlegeli, and olive flounder Paralichthys olivaeus[J]. Kor J Fish Aquat Sci, 2012, 45(1): 50-55.
(  0) 0) |
| [10] |
刘蝉馨. 黑鲪的人工育苗[J]. 水产科学, 1988, 7(1): 22-24. Liu C X. The artificial breeding of Sebastes schlegelii[J]. Fisheries Science, 1988, 7(1): 22-24. (  0) 0) |
| [11] |
毕庶万, 褚永红, 于炳礼, 等. 利用海带育苗池培育黑鳍苗及苗种的疾病防治[J]. 水产科技情报, 1995, 22(3): 102-106. Bi S W, Zhu Y H, Yu B L, et al. Fry rearing of Sebastodes fusceseens in kelp seeding pond and prevention of seed diseases[J]. Fisheries Science & Technology Information, 1995, 22(3): 102-106. (  0) 0) |
| [12] |
冯晓燕, 郑家声, 王梅林. 许氏平鲉消化道的组织化学研究[J]. 青岛海洋大学学报, 2003, 33(3): 399-404. Feng X Y, Zheng J S, Wang M L. A Study of the histochem is try on the digestive tract of the Sebastess chlegeli[J]. Journal of Ocean University of Qingdao, 2003, 33(3): 399-404. (  0) 0) |
| [13] |
李霞, 王霞. 许氏平鲉消化管上皮细胞及消化腺组织学和组织化学[J]. 大连水产学院学报, 2003, 18(4): 241-245. Li X, Wang X. Histology and histochemistry of the epithelia of a digestive tract and digestive glands of Sebastes schlegeli(Hilgendorf)[J]. Journal of Dalian Fisheries University, 2003, 18(4): 241-245. (  0) 0) |
| [14] |
郭浩宇, 张秀梅, 张宗航, 等. 许氏平鲉仔、稚鱼的摄食特性及幼鱼胃排空率[J]. 水产学报, 2017, 41(2): 285-296. Guo H Y, Zhang X M, Zhang Z H, et al. Study on feeding habits of Schlegelii larvae and gastric evacuation rate of juvenile[J]. Journal of Fisheries of China, 2017, 41(2): 285-296. (  0) 0) |
| [15] |
席丹, 张秀梅, 吕红健, 等. 许氏平鲉早期异速生长模式的研究[J]. 中国海洋大学学报(自然科学版), 2014, 44(12): 28-34. Xi D, Zhang X M, Lv H J, et al. Studies on obstructing effect of air-bubble curtain on sebastes schlegelii[J]. Periodical of Ocean University of China, 2014, 44(12): 28-34. (  0) 0) |
| [16] |
刘立明, 姜海滨, 王茂剑, 等. 黑鲪仔、稚、幼鱼生长、发育与成活率变化的研究[J]. 中国海洋大学学报(自然科学版), 2013, 43(3): 25-31. Liu L M, Jiang H B, Wang M J, et al. Study on the growth, development and survival rate of larval juvenile and young Sebastodes fuscescens[J]. Periodical of Ocean University of China, 2013, 43(3): 25-31. (  0) 0) |
| [17] |
殷名称. 鱼类仔鱼期的摄食和生长[J]. 水产学报, 1995, 19(4): 335-342. Yin M C. Feeding and growth of the larva stage offish[J]. Journal of Fisheries of China, 1995, 19(4): 335-342. (  0) 0) |
| [18] |
何滔, 肖志忠, 刘清华, 等. 条石鲷早期发育阶段的生长模式[J]. 水产学报, 2012, 36(8): 1242-1248. He T, Xiao Z Z, Liu Q H, et al. Allometric growth in rock bream larvae(Oplegnathus fasciatus Temminck et Schlegel 1844)[J]. Journal of Fisheries of China, 2012, 36(8): 1242-1248. (  0) 0) |
| [19] |
Choo C K, Liew H C. Morphological development and allometric growth patterns in the juvenile seahorse Hippocanpus kudaBleeker[J]. Journal of Fish Biology, 2006, 69(2): 426-445. DOI:10.1111/jfb.2006.69.issue-2
(  0) 0) |
| [20] |
何勇凤, 吴兴兵, 朱永久, 等. 鲈鲤仔鱼的异速生长模式[J]. 动物学杂志, 2013, 48(1): 8-15. He Y F, Wu X B, Zhu Y J, et al. Allometric growth pattern of Percocypris pingi pingi Larvae[J]. Chinese Journal of Zoology, 2013, 48(1): 8-15. (  0) 0) |
| [21] |
高小强, 洪磊, 刘志峰, 等. 美洲西鲜仔鱼不可逆点及仔、稚鱼摄食特性研究[J]. 水产学报, 2015, 39(3): 392-400. Gao X Q, Hong L, Chen Z F, et al. The definition of point of no return of larvae and feeding characteristics of Alosa sapidissima larvae and juveniles[J]. Journal of Fisheries of China, 2015, 39(3): 392-400. (  0) 0) |
| [22] |
刘立明. 不同温度条件下牙鲆变态期生长发育变化的研究[J]. 海洋科学, 1996(4): 58-63. Liu L M. Growth and development of Paralichthys olicaceus in metamorphosis period at different temperatures[J]. Marine Science, 1996(4): 58-63. (  0) 0) |
| [23] |
Fukuhara O. Morphological and functional development of larval and juvenile Limanda yokohamae (Pisces: Pleuronectidae) reared in the laboratory[J]. Marine Biology, 1988(99): 271-281.
(  0) 0) |
| [24] |
Osse J W M. Form changes in fish larvae in relation to changing demands of function[J]. Netherlands Journal of Zoology, 1990, 40: 362-385.
(  0) 0) |
| [25] |
华元渝, 陈亚芬, 钱林峰. 暗纹东方鲀苗种同类相残的研究[J]. 水生生物学报, 1998(2): 195-197. Hua Y Y, Chen Y F, Qian L F. Studies on cannibalism among fries of Takifugu obscurus[J]. Acta Hydrobiologica Sinica, 1998(2): 195-197. (  0) 0) |
| [26] |
邹桂伟, 罗相忠, 潘光碧. 大口鲇苗种同类相残的研究[J]. 中国水产科学, 2001(2): 55-58. Zou G W, Luo X Z, Pan G B. Studies on the cannibalism among Silurus meridionalislarvae[J]. Journal of Fishery Sciences of China, 2001(2): 55-58. (  0) 0) |
| [27] |
张雅芝, 郑金宝, 谢仰杰, 等. 花鲈仔、稚、幼鱼摄食习性与生长的研究[J]. 海洋学报, 1999(5): 110-119. Zhang Y Z, Zheng J B, Xie Y J, et al. The feeding habits and growth of larval, juvenile and young Lateolabrax japonicas[J]. Acta Oceanologica Sinica, 1999(5): 110-119. (  0) 0) |
| [28] |
刘银华, 张雅芝, 钟幼平, 等. 石纹石斑鱼仔稚鱼的摄食习性与生长特性[J]. 应用海洋学学报, 2015, 34(3): 388-396. Liu Y H, Zhao Y Z, Zhong Y P, et al. Studies on feeding habit and growth characteristic of larva and juvenile of Epinephelus moara[J]. Journal of Applied Oceanography, 2015, 34(3): 388-396. (  0) 0) |
| [29] |
雷霁霖. 海水鱼类养殖理论与技术[M]. 北京: 中国农业出版社, 2005, 716. Lei J L. Marine Fish Culture Theory and Techniques[M]. Beijing: China Agriculture Press, 2005, 716. (  0) 0) |
| [30] |
蔺玉珍, 于道德, 温海深, 等. 卵胎生许氏平鲉仔鱼与稚鱼发育形态学特征观察[J]. 海洋湖沼通报, 2014(2): 51-58. Lan Y Z, Yu D D, Wen H S, et al. Morphometrics development of ovoviviparous Sebastes schlegeli hilgendorf larvae and juvenile[J]. Transactions of Oceanology and Limnology, 2014(2): 51-58. (  0) 0) |
| [31] |
李大勇, 刘晓春, 何大仁. 真鲷早期发育阶段的摄食节律[J]. 热带海洋, 1994, 13(2): 82-87. Li D Y, Liu X C, He D R. Feeding rhythm of Pagrosomus major during the early development stage[J]. Tropic Oceanology, 1994, 13(2): 82-87. (  0) 0) |
| [32] |
Helfman G S. Fish Behaviour by Day, Night and Twilight[M]. US: Springer, 1986, 366-387.
(  0) 0) |
| [33] |
林利民, 李益云, 万瑞景, 等. 牙鲆早期发育阶段的摄食节律[J]. 水产学报, 2006(3): 329-334. Lin L M, Li Y Y, Wan R J, et al. A study on feeding rhythm of Paralichthys olivaceus during early developmental stage[J]. Journal of Fisheries of China, 2006(3): 329-334. (  0) 0) |
| [34] |
甘炼, 马旭州, 张文博, 等. 池养条件下瓦氏黄颡鱼仔稚鱼摄食节律和日摄食率研究[J]. 淡水渔业, 2007(6): 69-71. Gan L, Ma X Z, Zhang W B, et al. A study on the feeding rhythm and daily feeding rate of larval and juvenile darkbarbel catfish(Pelteobagrus vachelli)in pond[J]. Freshwater Fisheries, 2007(6): 69-71. (  0) 0) |
| [35] |
Brett J R, Groves T D. Physiological energetics[J]. Fish Physiology, 1979, 8: 279-352. DOI:10.1016/S1546-5098(08)60029-1
(  0) 0) |
| [36] |
李建军, 杨笑波, 魏社林, 等. 裸项栉鰕虎鱼仔鱼日摄食量及摄食节律研究[J]. 海洋环境科学, 2008(4): 352-354. Li J J, Yang X B, Wei S L, et al. Study on feeding rhythm and amount of larval Bareneck goby[J]. Marine Environmental Science, 2008(4): 352-354. (  0) 0) |
| [37] |
汪留全, 程云生. 池养条件下革胡子鲶仔幼鱼摄食习性与生长的初步研究[J]. 水产学报, 1990(2): 105-113. Wang L Q, Cheng Y S. On the feeding habits and growth for larval of Clarias lazera under pond nursery[J]. Journal of Fisheries of China, 1990(2): 105-113. (  0) 0) |
| [38] |
马爱军, 柳学周, 徐永江, 等. 半滑舌鳎(Cynoglossus semilaevis)早期发育阶段的摄食特性及生长研究[J]. 海洋与湖沼, 2005(2): 130-138. Ma A J, Liu X Z, Xiu Y J, et al. Study on feeding behavior and growth of tongue sole Cynoglossus semiliaevis in early development stage[J]. Oceanologia et Limnologia Sinica, 2005(2): 130-138. (  0) 0) |
2. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China
 2018, Vol. 48
2018, Vol. 48


