2. 中国海洋大学海洋生命学院,山东 青岛266003;
3. 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237
海洋微拟球藻(Nannochloropsis oceanica)属于大眼藻纲(Eustigmatophyceae)微拟球藻属(Nannochloropsis)[1],一般直径2~4 μm,是一种海洋单细胞真核微藻。由于其具有很高的光合作用速率,且生长速度快、二十碳五烯酸(Eicosapentaenoic acid, EPA)含量高,引起了学者们的广泛关注。为提高N.oceanica细胞得率和胞内EPA含量,国内外研究者已对其进行培养条件的优化[2-5],包括培养时间、盐度、pH、光照强度、氮源种类等。除此之外,某些除草剂能够抑制EPA等长链多不饱和脂肪酸合成途径中某些酶的活性。利用这种特性,可以在除草剂存在条件下,筛选到酶活性强、生命力旺盛且遗传性状稳定的优良藻株[6-9]。
Sandoz 9785又名baf3.338,化学名4-氯-5(二甲基氨基)-2-苯基-3(2H)哒嗪酮,是一种哒嗪酮类除草剂,可以抑制高等植物和藻类不饱和脂肪酸合成过程中△15去饱和酶(18:2ω6→18:3ω3)和△6去饱和酶(18:2ω6→18:3ω6)的活性[10-11],且破坏叶绿体结构,抑制电子传递[12]。已有研究表明,该除草剂可以筛选出高EPA含量的抗性藻株。邹立红等[7]用除草剂Sandoz 9785对紫外线诱变的后棘藻细胞进行处理,获得的优良藻株EPA含量比出发藻株显著提高了212%。魏东等[13]在群体水平研究了Sandoz 9785对微拟球藻生长和积累EPA的影响。目前,尚未见利用该除草剂筛选抗性微拟球藻单克隆藻株及其叶绿素荧光参数和脂肪酸组成影响等方面的研究。本研究确定了Sandoz 9785筛选抗性微拟球藻的有效性,并成功筛选出了EPA含量较出发藻株显著升高的优良藻株。
1 材料与方法 1.1 藻种来源与培养本研究使用微拟球藻(N. oceanica)来源于本实验室保存藻种,通过2次平板划线分离出单细胞,进而纯培养得到原始藻株用于本实验。培养条件:温度(25±1)℃;日光灯光源,光照强度60~80 μmol·m-2·s-1;光照周期12 h:12 h,每天早晚各摇瓶1次。
1.2 除草剂Sandoz 9785对微拟球藻敏感性分析以二甲基亚砜(DMSO)为溶剂配制浓度为100 μmol/mL的Sandoz 9785母液。实验设置5个组,每组3个重复,向每组f/2固体培养基加入不同量的Sandoz 9785母液和DMSO,使除草剂的终浓度分别为0、50、52、54、56和58 μmol/L,DMSO的终浓度为0.058%。用f/2液体培养基稀释指数生长期的微拟球藻至107个/L,取100 μL涂布平板,置于光照培养箱培养40 d后记录平板内的藻落数目。除草剂Sandoz 9785对微拟球藻生长的抑制率通过公式进行计算:W(%)=(对照组藻落数目-实验组平板藻落数目)/对照组藻落数目×100% [9]。
1.3 微藻生长指标检测抗性微拟球藻的筛选 从Sandoz 9785浓度为58 μmol/L的固体平板上筛选出2个抗性藻株SA1、SA2,在无添加除草剂的液体f/2培养基中培养至平台期,再以相同起始密度接种用于后续实验,每个藻株设3个重复。
生长曲线(Growth curve)绘制 用Hatachi U-3310型紫外分光光度计在750 nm波长下,每48 h测定藻液的吸光度值。
比生长速率(Specific growth rate) 通过公式K=(lnNt-lnN0)/(t2-t1)进行计算[9],其中N0、Nt分别为实验开始和结束时的吸光度值;t1和t2分别为实验开始和结束的时间(d)。
1.4 叶绿素荧光参数测定用德国Walz公司生产的Water-PAM水样叶绿素荧光仪(Walz, Effeltrich, Germany),分别选取指数期(第9天)和平台期(第17天)的微拟球藻进行叶绿素荧光各个参数的测定。微藻样品提前暗适应15 min。叶绿素荧光参数Fv/Fm、ΦPSⅡ、ETR、qP和NPQ可在荧光仪上直接读出,Fv/F0用公式( Fm-F0)/F0计算,其中F0 (基础荧光)用弱测量光(0.01 μmoL·m-2·s-1)测量可得,Fm (最大荧光)用饱和脉冲(4 000 μmol·m-2·s-1,持续时间为0.8 s)激发可得。
1.5 脂肪酸组成测定脂肪酸组成采用气相色谱法[14]。准确称取30 mg经真空冷冻干燥的藻粉,加入1 mL KOH-CH3OH(2 mol/L)溶液,于75℃水浴30 min,冷却至室温。加入1.5 mL HCl-CH3OH(3 mol/L)溶液充分震荡,75 ℃水浴30 min。冷却至室温后加入1 mL色谱纯正己烷,充分震荡,2 000 r/min、4 ℃离心10 min,取上清进行色谱分析。
脂肪酸组成分析采用美国Agilent 6890 series GC system气相色谱仪、氢火焰离子化检测器和HP-5毛细管柱。进样后程序升温:150 ℃恒温1 min,以15 ℃/min升到200 ℃,再以2 ℃/min升温至250 ℃,保持25 min。进样口温度为270 ℃。载气为高纯氮,流速40 mL/min,进样量5 μL。
2 结果 2.1 Sandoz 9785对微拟球藻的生长抑制效果由表 1可以看出,不同浓度的除草剂对微拟球藻具有不同程度的抑制作用,高浓度除草剂对微拟球藻抑制作用明显,浓度为58 μmol/L时,平板中藻细胞抑制率达到99.1%。
|
|
表 1 Sandoz 9785对微拟球藻生长的抑制作用 Table 1 Inhibition of Sandoz 9785 to the growth of N.oceanica |
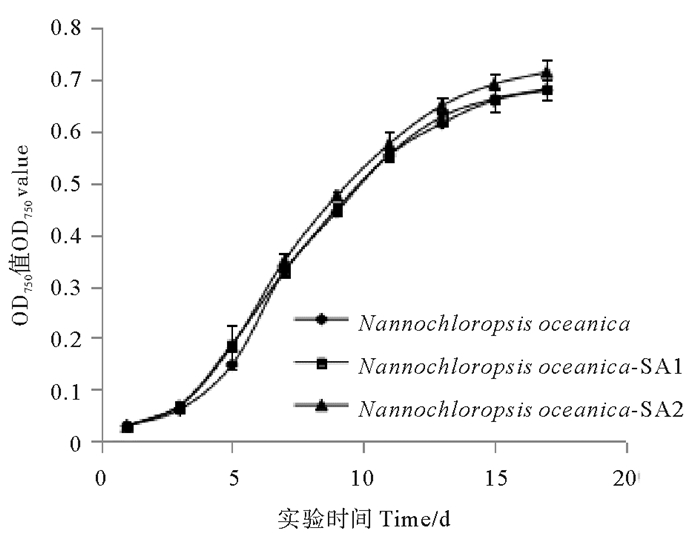
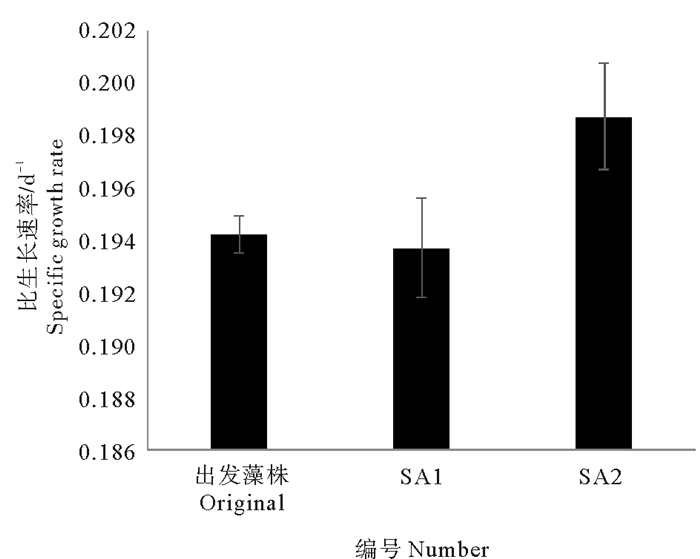
由图 1可以看出,SA1在前期生长较快,第3天OD值比出发藻株提高了13.59%(P < 0.05)。SA1第6天后生长放缓,与出发藻株持平。SA2生长较快,第9、13天的OD值较出发藻株分别提高了6.99%和5.53%(P < 0.05)比生长速率较出发藻株显著提高了2.31%(见图 2)。
|
图 1 抗性藻株和出发藻株的生长曲线 Fig. 1 Growth curves of resistant strains and the original |
|
(数据均表示为平均数±标准差,图中标有不同的字母表示存在显著性差异(P < 0.05)。Values are expressed as mean±standard deviation. Different letters indicate significant difference(P < 0.05).) 图 2 抗性藻株和出发藻株的比生长速率 Fig. 2 Specific growth rate of resistant strains and the original |
由表 2和3可以看出,在指数生长期(第9天),SA1和SA2的ΦPSⅡ、ETR、NPQ、Fv/Fm、Fv/F0值较出发藻株均有所提高,其中藻株SA1的NPQ、Fv/Fm、Fv/F0分别提高了74.6%、6.83%和21.15%(P < 0.05),藻株SA2的Fv/Fm、Fv/F0分别提高了3.17%、9.28%(P < 0.05)。SA1和SA2的qP值均有所下降,但差异不显著(P>0.05)。平台期(第17天),SA1、SA2的ΦPSⅡ、ETR、qP、Fv/Fm、Fv/F0值较出发藻都有所提高,其中SA1的NPQ显著高于出发藻163.16%(P < 0.05),SA2 NPQ低于出发藻株但差异不显著(P>0.05)。
|
|
表 2 抗性藻株和出发藻株在指数生长期(第9天)的叶绿素荧光参数 Table 2 The fluorescence parameters of resistant strains and the original at exponential growth phase |
|
|
表 3 抗性藻株和出发藻株在平台生长期的叶绿素荧光参数 Table 3 The fluorescence parameters of resistant strains and the original at the plateau growth phase |
微拟球藻的脂肪酸主要由C14、C16、C18和C20组成(见表 4),饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)占总脂肪酸的60%以上。SA2的EPA (C20:5)含量低于出发藻株,SA1的EPA含量比出发藻株显著提高了5.44%(P < 0.05),占总脂肪酸含量的27.35%。
|
|
表 4 抗性藻株和出发藻株的脂肪酸含量 Table 4 The fatty acid composition of resistant strains and the original |
本实验中微拟球藻对除草剂Sandoz 9785非常敏感,浓度为58 μmol/L时,平板中的藻细胞生长抑制率达到99.10%。从中挑取生长良好的SA1、SA2单克隆藻落接种到新鲜的液体培养基中,SA1和SA2的生长速率较出发藻株均有所增加。
叶绿素荧光参数能反映植物光合作用过程中的光能吸收、电子传递、能量耗散和分配等过程[15]。研究发现,除草剂Sandoz 9785可以使植物光系统复合物从光合膜上脱落,影响细胞的光合作用。本实验中,抗性藻株PSⅡ反应中心最大光能转换效率(Fv/Fm)和潜在活性(Fv/F0)均不同程度升高(见表 2和3),表明抗性藻株能抵抗除草剂对叶绿体PSⅡ结构的破坏,恢复培养后2种藻株PSⅡ基本没有受到伤害。ΦPSⅡ反映了PSⅡ反应中心部分关闭情况下实际原初光化学效率,ΦPSⅡ升高, 说明抗性藻细胞有较多同化力(NADPH,ATP)形成, 从而促进对碳的固定与同化[16],这与抗性藻株比生长速率升高是一致的。非光化学淬灭(NPQ)是光系统Ⅱ天线色素吸收的过剩光能以热能的形式耗散掉的部分。由于除草剂对叶绿体结构具有破坏作用[18],植物在胁迫条件下,叶绿素含量降低,电子传递受抑制导致活性氧积累,为降低活性氧增多而造成的损伤,酶促防御系统发挥了重要作用。高温胁迫能提高花椰菜叶片中抗氧化酶(超氧化物歧化酶、抗坏血酸过氧化物酶、愈创木酚过氧化物酶、过氧化氢酶)的活性,减少活性氧的损伤[19]。在62.5~500 μmol/L Sandoz 9785存在条件下,为防止光氧化伤害,小麦幼苗(Wheat seedlings)NADPH谷胱甘肽还原酶活力提高了6~8倍[17]。本实验中抗性藻株的非光化学淬灭(NPQ)显著高于出发藻株(见表 2和3),说明抗性藻株具有更强的自我保护能力。抗性藻株SA2的NPQ值在平台期略低于出发藻株,说明SA2具有较低的能量耗散。光化学淬灭(qP)表示PSⅡ天线色素吸收的光能用于化学电子传递的比例,与电子传递、光合氧化等过程直接相关。本实验中,抗性藻株的qP值在指数期(第9天)略有下降,但差异并不显著且在平台期(第17天)明显高于出发藻株,说明抗性藻株PSⅡQA重新氧化的能力较强,电子传递、光合氧化等效率较高。Sandoz 9785具有除草剂DCMU(二氯苯基二甲脲)类似的作用,它可以结合在PSⅡ光反应中心蛋白D1蛋白的QB位点上, 阻止QB还原, 使电子传递速率失去平衡[17, 23]。因此,在有除草剂存在的条件下,绝大多数藻细胞不能正常生长,但抗性藻株却表现出更强的生命力和更加优良的性状(本实验中SA1的EPA含量增加,SA2的比生长速率升高)。从叶绿素荧光参数(ΦPSⅡ、ETR、Fv/Fm、Fv/F0)来看,SA1提高显著但比生长率却略低于出发藻株,由于SA1的非光化学淬灭(NPQ)显著高于出发藻株,PSⅡ中心天线色素吸收的光能较大一部分以热的形式耗散掉了,导致其生长速率变慢,EPA合成增加。
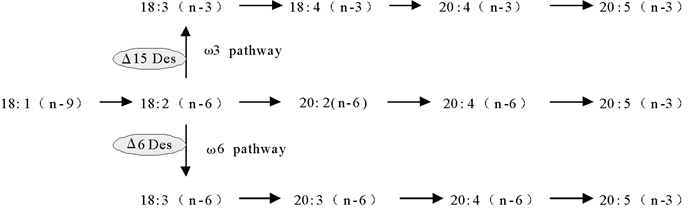
藻类长链多不饱和脂肪酸是在一系列去饱和酶和延伸酶作用下合成的。微拟球藻EPA的合成途径已有一些报道。由图 3可以看出,从C18:2开始,主要有n-6和n-3两条途径合成EPA[20],Δ15去饱和酶与Δ6去饱和酶在其中发挥重要作用,Sandoz 9785主要通过抑制这2个酶的活性从而对EPA的合成产生影响。Cohen等[10]从紫球藻中筛选到Sandoz 9785抗性藻株, 其EPA的含量从野生型的36.8%提高到40.4%,并可在无Sandoz 9785存在下稳定遗传50代以上。魏东等[13]在群体水平研究了Sandoz 9785对微拟球藻的影响, 得到抗性藻株EPA含量占细胞干重的3.51%,比野生株提高了30%。邹立红等[7]通过Sandoz 9785对紫外诱变的后棘藻细胞进行筛选,获得5株高产EPA的藻株,其中一株藻的EPA含量达总脂肪酸的26.22%,较出发藻株提高了212%。
到目前为止,有关微藻抗除草剂以及抗性藻株积累EPA的机理研究得还不够深入。已有的研究结果表明,抗性细胞中相关酶类经过修饰后,可能降低对抑制剂的亲和性,或者提高了相关酶基因的表达水平,酶活性升高[10]。本研究中,在含有除草剂Sandoz 9785的平板上正常生长的抗性藻株SA1和SA2,在无除草剂条件下培养,SA1EPA含量比出发藻株显著提高了5.44%,占总脂肪酸含量的27.35%, SA2 EPA含量略低于出发藻。抗性藻株EPA含量发生变化,有以下几种可能:(1)因为Δ15去饱和酶或Δ6去饱和酶的活性增强,促进C18:2转化为C18:3用于后续合成EPA,后面的研究将对相关酶基因的表达水平及酶活性进行测定;(2)抗性藻株SA1在Sandoz 9785胁迫条件下,激活了一个在正常情况下不会发生作用的途径,即C18:2通过C20:2(n-6)转化为C20:4(n-6)[13, 22],进而合成EPA;(3)Sandoz 9785能抑制叶绿体上Δ15去饱和酶的活性,对细胞质中EPA合成过程没有影响[21],而微拟球藻EPA只在细胞质中合成[20],同时,Sandoz 9785能抑制微拟球藻的光合作用,使光合作用显著增强的藻株得以存活,因此,通过该除草剂可筛选到EPA含量不同的抗性藻株。
目前,已有研究表明Sandoz 9785对藻细胞的作用机理主要有三方面,(1)破坏叶绿体结构,使光系统Ⅱ脱落[18];(2)作用PSⅡ光反应中心蛋白D1蛋白的QB位点上, 阻止QB的还原[17, 23];(3)抑制EPA合成通路中Δ15去饱和酶与Δ6去饱和酶的活性[10-11]。由于Sandoz 9785对藻细胞具有多种抑制作用,因此,可能获得生长速率提高或者EPA合成增加的优良藻株。本实验中,相对于出发藻株, SA1 EPA含量显著提高、比生长速率略低,SA2 EPA含量没有提高,比生长速率显著提高。由于SA1的EPA含量显著提高且比生长速率与出发藻株差异不显著,因此,达到了利用该除草剂筛选高EPA微拟球藻的目的。在后续实验中,我们会对SA1多次传代,观察其性状的稳定性。
4 结语本实验中筛选到抗性藻株SA1、SA2,将其接入液体f/2培养基中培养,测得其叶绿素荧光参数(ΦPSⅡ、ETR、Fv/Fm、Fv/F0)均高于出发藻株(见表 2、3),表明抗性藻株的PSⅡ基本没有受到除草剂的损害,其PSⅡ的实际光能转化效率和光合电子传递效率均有提高,其中SA2的比生长速率高于出发藻株,SA1的EPA含量显著高于出发藻株。本研究通过Sandoz 9785筛选到了EPA含量较高的优良微拟球藻,研究结果为筛选其他EPA含量较高的藻株提供参考。
| [1] |
Bína D, Gardian Z, Herbstová M, et al. Modular antenna of photosystem I in secondary plastids of red algal origin: A Nannochloropsis oceanica case study[J]. Photosynthesis Research, 2017, 131(3): 255-266. DOI:10.1007/s11120-016-0315-1
(  0) 0) |
| [2] |
Mitra M, Patidar S K, George B, et al. A euryhaline Nannochloropsis gaditana with potential for nutraceutical (EPA) and biodiesel production[J]. Algal Research, 2015, 8: 161-167. DOI:10.1016/j.algal.2015.02.006
(  0) 0) |
| [3] |
Rocha J M S, Garcia J E C, Henriques M H F. Growth aspects of the marine microalga Nannochloropsis gaditana[J]. Biomolecular Engineering, 2003, 20(4-6): 237-242. DOI:10.1016/S1389-0344(03)00061-3
(  0) 0) |
| [4] |
王玉仙, 王鑫, 赵犇, 等. 两阶段氮源补料策略促进微拟球藻EPA高效积累[J]. 工业微生物, 2017, 47(1): 10-16. Wang Y X, Wang X, Zhao B, et al. Efficient accumulation of EPA from N.oculata by two stage feeding of nitrogen[J]. Industrial Microbiology, 2017, 47(1): 10-16. (  0) 0) |
| [5] |
卢美贞, 沈林杰, 陆向红, 等. 培养条件对眼点拟微绿球藻油脂含量和EPA产率的影响[J]. 中国粮油学报, 2014, 29(5): 80-83. Lu M Z, Shen L L, Lu X H, et al. The effect of culture conditionsonthe lipid content and EPA productivity of Nannochloropis oculata[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(5): 80-83. (  0) 0) |
| [6] |
Henderson R J, Mackinlay E E, Hodgson P, et al. Differential effects of the substituted pyridazinone herbicide Sandoz 9785 on lipid composition and biosynthesis in photosynthetic and non-photosynthetic marine microalgae[J]. Journal of Experimental Botany, 1990, 41(227): 729-736.
(  0) 0) |
| [7] |
邹立红, 张学成. 除草剂San9785在高EPA后棘藻品系筛选中的应用[J]. 海洋学报(中文版), 2003, 25(3): 98-103. Zou L H, Zhang X C. Selection of high EPA content strains of Ellipsoidion sp. by using herbicide San9785[J]. Acta Oceanologica Sinica, 2003, 25(3): 98-103. (  0) 0) |
| [8] |
曹小红, 李松耀, 王春玲, 等. 除草剂精喹禾灵用于硅藻过量产生二十碳五烯酸[J]. 生物工程学报, 2007, 23(5): 885-890. Cao X H, Li S Y, Wang C L, et al. Potential use of the herbicide quizalofop-p-ethyl for eicosapentaenoic acid overproduction by the diatom nitzschia laevis[J]. Chinese Journal of Biotechnology, 2007, 23(5): 885-890. (  0) 0) |
| [9] |
曲晓梅, 宓文义, 朱葆华, 等. 精喹禾灵筛选高脂微藻的有效性研究[J]. 中国海洋大学学报(自然科学报), 2013, 43(6): 25-28. Qu X M, Mi W Y, Zhu B H, et al. Applicability of herbicide Quizalofop-p-ethyl to the screening of lipid rich Nannochloropsis oceanica[J]. Journal of Ocean University of China, 2013, 43(6): 25-28. (  0) 0) |
| [10] |
Cohen Z, Didi S, Heimer Y M. Overproduction of gamma-linolenic and eicosapentaenoic acids by algae[J]. Plant Physiol, 1992, 98(2): 569-572. DOI:10.1104/pp.98.2.569
(  0) 0) |
| [11] |
Cohen Z, Reungjitchachawali M, Siangdung W, et al. Herbicide-resistant lines of microalgae: Growth and fatty acid composition[J]. Phytochemistry, 1993, 34(4): 973-978. DOI:10.1016/S0031-9422(00)90696-4
(  0) 0) |
| [12] |
Samuel K, Bose S. Sites of action of pyridazinone herbicides (Sandoz9785 and 9789) on Chlorella protothecoides[J]. Proc Indian Acad Sci (Plant Sci), 1987, 97(5): 415-423.
(  0) 0) |
| [13] |
魏东, 张学成. 抗除草剂海洋微藻的生长和积累EPA的特性[J]. 中国海洋药物, 2003, 22(2): 11-16. Wei D, Zhang X C. Character of cell growth and EPA accumulation of marine microalgae resisted to herbicide[J]. Chinese Journal of Marine Drugs, 2003, 22(2): 11-16. (  0) 0) |
| [14] |
Lepage G, Roy C C. Improved recovery of fatty acid through direct transesterification without prior extraction or purification[J]. Journal of Lipid Research, 1984, 25(12): 1391-1396.
(  0) 0) |
| [15] |
李曼, 王丽红, 周青. 双酚A对大豆幼苗叶绿素荧光参数的影响[J]. 农业环境科学学报, 2012(6): 1256. Li M, Wang L H, Zhou Q. Effect of bisphenol a on chlorophyll fluorescence parameters of soybean seedlings[J]. Journal of Agro-Environment Science, 2012(6): 1256. (  0) 0) |
| [16] |
梁英, 冯力霞, 田传远, 等. 盐胁迫对塔胞藻生长及叶绿素荧光动力学的影响[J]. 中国海洋大学学报(自然科学版), 2006, 36(5): 726-732. Lang Y, Feng L X, Tian C Y, et al. Effects of salt stress on the growth and chlorophyll fluorescence of Pyramidomonas sp.[J]. Journal of Ocean University of China, 2006, 36(5): 726-732. (  0) 0) |
| [17] |
Mannan R M, Bose S. Alteration in the metabolism of free radicals in wheat seedlings grown in the presence of 4-chloro-5-dimethylamino-2-phenyl-3(2H) pyridazinone[J]. Journal of Biosciences, 1986, 10(3): 283-291. DOI:10.1007/BF02716644
(  0) 0) |
| [18] |
Bose S, Vijayan P, Santhanam R, et al. Inhibition of the cation-induced reversible changes in excitation energy distribution in thylakoids of BASF 13.338-grown plants[J]. Biochim Biophys Acta, 1992, 1098(3): 351-358. DOI:10.1016/S0005-2728(09)91017-9
(  0) 0) |
| [19] |
汪炳良, 徐敏, 史庆华, 等. 高温胁迫对早熟花椰菜叶片抗氧化系统和叶绿素及其荧光参数的影响[J]. 中国农业科学, 2004, 37(8): 1245-1250. Wang B L, Xu M, Shi Q H, et al. Effects of high temperature stress on antioxidant systems, chlorophyll and chlorophyll fluorescence parameters in early cauliflower leaves[J]. Scientia Agriculture Sinica, 2004, 37(8): 1245-1250. (  0) 0) |
| [20] |
Schneider J C, Roessler P. Radiolabeling studies of lipids and fatty acids in Nannochloropsis(eustigmatophyceae), an oleaginous marine alga[J]. Journal of Phycology, 1994, 30(4): 594-598. DOI:10.1111/j.0022-3646.1994.00594.x
(  0) 0) |
| [21] |
Khozin I, Cohen Z. Differential response of microalgae to the substituted pyridazinone, San9785, reveal different pathways in the biosynthesis of eicosapentaenoic acid[J]. Phytochemistry, 1996, 42(4): 1025-1029. DOI:10.1016/0031-9422(96)00053-2
(  0) 0) |
| [22] |
Cohen Z, Heimer Y M. Δ6 desaturase inhibition: A novel mode of action of norflurazone[J]. Plant Physiol, 1990, 93(1): 347-349. DOI:10.1104/pp.93.1.347
(  0) 0) |
| [23] |
Biswal A K, Dilnawaz F, David K A V, et al. Increase in the intensity of thermoluminescence Q-band during leaf ageing is due to a block in the electron transfer from QA to QB[J]. Luminescence, 2001, 16(5): 309-313. DOI:10.1002/(ISSN)1522-7243
(  0) 0) |
2. College of Marine Life Science, Ocean University of China, Qingdao 266003, China;
3. Laboratory for Marine Fisheries and Aquaculture, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China
 2018, Vol. 48
2018, Vol. 48