2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237
二甲基硫(Dimethylsulfide,DMS)是从海洋释放到大气中最重要的挥发性生源含硫有机物[1-3]。浮游植物产生的DMS释放到大气中,被氧化成为二氧化硫和甲基磺酸盐,形成硫酸盐气溶胶,增加云凝结核数量,进而影响云层对太阳光的反照率,对气候变化起负反馈作用,在全球气候变化中扮演了重要角色。同时,硫酸盐气溶胶对酸雨、酸雾的形成具有重要贡献[4]。二甲巯基丙酸内盐(Dimethylsulfoniopropionate,DMSP)是DMS的主要前体物质[5],海洋中浮游微藻、大型藻类和盐生植物都是DMSP的重要来源,但DMSP含量具有明显的种间或株间差异性[6-7]。在高盐缺氮条件下DMSP可作为藻类维持自身渗透压平衡的调节剂,在低温下DMSP具有抗冷冻作用,用于维持生物酶活性,与藻类生理胁迫有直接关系[8-10]。丙烯酸(Acrylic acid,AA)是DMSP的降解产物之一,DMSP可以通过裂解酶催化产生等摩尔的DMS和AA,还可以通过去甲基化途径产生甲基硫醇盐(3-methiolpropionate,MMPA),MMPA再转化为甲硫醇和AA[11]。DMS/AA代表DSMP酶裂解途径占两种降解途径的比例,DMS/(DMSP+AA)代表DMS生产百分比,AA/(DMSP+AA)代表总DMSP的降解率。AA可作为细菌的主要碳源[12],但在AA浓度较高时又可抑制细菌生长[13]。Yang等[14]发现夏季南极沿海棕囊藻暴发现场的AA浓度为0.001~0.510 μmol·L-1,与藻细胞密度呈现显著的相关性。Gibson等[15]在南极浮游植物藻华期间测定表层海水AA浓度可以达到1.2 μmol·L-1。AA降解去除主要通过两种途径:微生物降解[16]和光化学氧化[17]。海洋环境中物理和化学因素,如温度、盐度、光照、微量元素和营养盐等,都会对藻类生成DMSP、DMS和AA产生影响[18-21],但目前没有一致的定论。
球形棕囊藻(Phaeocystis globosa)隶属于定鞭藻门,是一种具有独特形态和生态学特征广泛分布于全球海洋的赤潮藻。该藻种是DMS和DMSP的高产藻种[22-25]。特别是在大规模球形棕囊藻藻华暴发的后期,会释放高浓度的DMS和DMSP到环境中[22]。目前,对海洋中DMS分布与海-气通量的研究较多[26-27],而对球形棕囊藻藻华发生现场的DMS与DMSP通量研究较少。齐雨藻等[23]研究发现渤海海域球形棕囊藻藻华暴发现场DMSP浓度可达到354~471 nmol·L-1,DMS浓度在34~60 nmol·L-1之间,远高于非藻华发生期间的DMS浓度(1.3~3.4 nmol·L-1)[28],藻华发生期间的DMS浓度可达到非藻华期间的10~100倍[29]。Noordkamp等[30]发现球形棕囊藻体内的AA浓度高达1.3~6.5 μmol·L-1,原因在于高浓度的AA吸附在粘液层上从而影响其扩散。到目前为止,有关球形棕囊藻释放生源硫化物的影响因素报道甚少。
在藻类的硫酸盐同化还原释放含硫化合物的过程中,营养盐对藻类的光合作用有重要的影响。目前,对海洋大型藻类的研究较多[31-35],而对浮游微藻研究较少。Li等[31]研究发现高氮高磷促进了浒苔对海水中溶解无机碳(DIC)的吸收同时导致海水pH的升高,对DIC吸收量达0.70 mmol·L-1,pH提升量为1.43。林庆莹等[32]研究发现氮磷加富会促进瓦氏马尾藻光合固碳能力,降低海水中DIC的浓度,提升海水pH。本论文以球形棕囊藻为研究对象,探究营养盐对典型赤潮藻光合作用、生长状况、释放生源硫化物以及DMSP降解途径的影响,从而为完善海洋硫循环的研究提供参考数据。
1 材料与方法 1.1 实验方案球形棕囊藻藻种取自于中国海洋大学海洋污染与生态化学实验室。培养所用海水采自于中国东海(盐度为32),经0.45 μm醋酸纤维滤膜过滤,装入2 L的锥形瓶中,并在121 ℃下高压灭菌(高压灭菌锅,LDZX-50KBS,上海申安医疗器械厂)20 min,静置冷却至室温后充分摇动以恢复溶解气体含量。按照f/2配方[36]加入相应的营养物质,放置于光照培养箱(GXZ-380B,宁波江南仪器厂)中静置培养。光暗比为12 h∶12 h,温度为20 ℃,光照强度为6 000 Lux。为防止微藻沉淀以及保持藻液中的溶解气体含量,每天充分摇晃培养瓶3~6次。进行预培养后取生长状况良好的处于指数生长期的200 mL藻液以1∶10的比例接入预先配好的培养基中。培养基中氮磷比的设置以Redfield比值为基础,设置硝氮浓度为883 μmol·L-1,调整培养液中的磷酸盐浓度,使得氮磷比分别为4∶1、16∶1、40∶1和80∶1。
取样分析: 连续培养20 d,隔天定时(上午9:00)取样,每组实验设三个平行样[37-38]。测定培养液的pH值、DIC浓度、球形棕囊藻细胞密度以及DMS、DMSP和AA的含量。
1.2 测定方法pH的测定 利用Fisher-AR15 pH计和Ross-8102 pH电极对藻液pH(NBS标度)进行测定,仪器的精度为:±0.002,并根据温度进行校正。
DIC的测定 采用溶解无机碳分析仪(AS-C2型,美国Apollo科技公司)进行测定,再根据美国Scripps海洋研究所生产的CRMs标准海水进行标定,精密度为0.1%。
藻细胞密度的测定 取5 mL藻液摇匀,用Lugol试剂对藻细胞固定、染色,然后用光学显微镜(CX31,日本Olympus公司)进行计数,每个样品做三个平行样,取其平均值换算为相应的藻细胞密度(藻细胞密度=藻细胞数目×104 cells·mL-1)[39]。
DMS的测定 用无菌注射器取2 mL藻液于洁净干燥的10 mL血清瓶中加盖密封。用高纯氮气对样品进行吹扫,定时3 min,样品中的DMS被吹出后经Nafion干燥管进行干燥,然后于浸没在液氮冷阱中的捕集管中富集。吹扫结束后,把捕集管取出迅速放入热水浴(温度>80℃)中进行加热解析,使得载气将捕集管中的DMS气体携带进入气相色谱仪(GC-6850,美国安捷伦公司),经FPD检测器进行检测[40]。此方法的检出限为0.4 nmol·L-1,精密度为5%[41]。
DMSP的测定 DMSP在pH>13的强碱条件下按1∶1的比例完全裂解为DMS和AA,所以可通过测定DMS的浓度间接测定藻液中的DMSP的浓度[42]。取2 mL的藻液,经玻璃纤维滤膜(Whatman GF/F,0.7 μm)减压过滤(压力<5 kPa),过滤后的滤膜用于颗粒态DMSP(DMSPp)的测定,滤液用于溶解态DMSP(DMSPd)的测定。将滤膜置于42 mL的棕色瓶中,向瓶内加入2 mL 10 mol·L-1的NaOH溶液,加高纯水至无顶空,并置于冰箱冷藏保存24 h以上;在含有滤液的棕色瓶中加入40 μL 50%的浓硫酸冷藏保存24 h后,向瓶中加入2 mL 10 mol·L-1的NaOH溶液,加高纯水至无顶空,冷藏保存24 h后,此时DMSP完全碱解为DMS,然后根据测定DMS的方法间接测定藻液中的DMSPp和DMSPd。
AA的测定 将藻液经孔径为0.2 μm的聚醚砜滤器过滤,密封冷藏保存。用高效液相色谱仪(L-2000,日本日立公司)测定[43],流动相为0.35%的磷酸溶液和甲醇,采用流速为0.5 mL·min-1的微量进样针,通过柱温为40 ℃的Agilent SB-Aq-C18柱,用检测波长为210 nm的紫外检测器进行检测。此方法的检出限为4 nmol·L-1,精密度为1.3%~1.6%[44]。
1.3 统计分析采用SPSS 16.0软件中无重复双因素方差分析法对不同氮磷比条件下的藻细胞密度、DMSP、DMS和AA含量进行显著性差异分析。
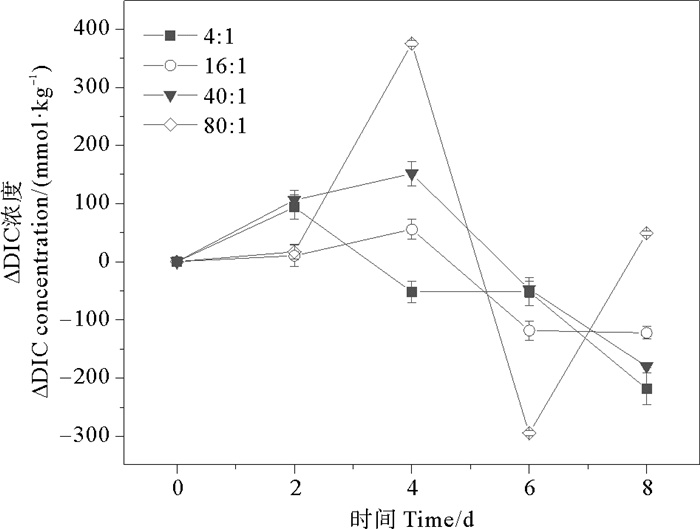
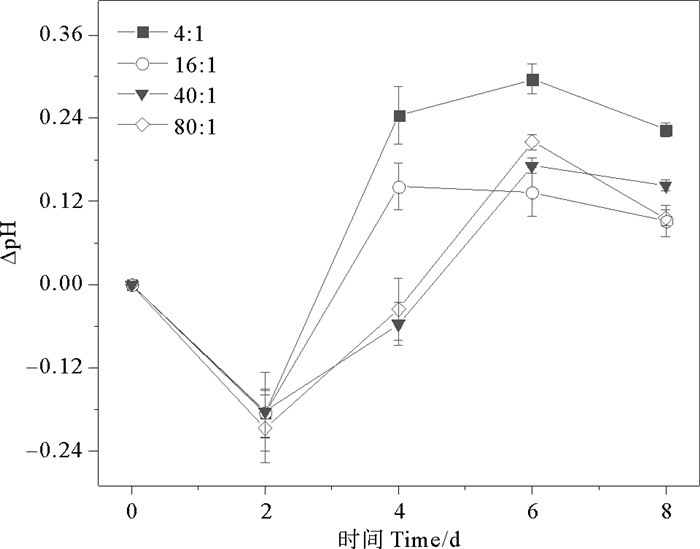
2 结果与讨论 2.1 不同氮磷比培养液对球形棕囊藻光合作用的影响通过分析稳定期前(0~8 d)球形棕囊藻培养液的DIC和pH变化,探讨不同氮磷比对球形棕囊藻光合作用的影响。DIC和pH相邻两次取样的差值记为ΔDIC和ΔpH。培养体系初始DIC是2 100 μmol·kg-1,pH是8.10。除80∶1组外,各组ΔDIC均呈现先上升后下降的趋势(见图 1)。而各组在2~8 d内ΔpH总体呈现上升的趋势(见图 2)。各组单位时间DIC吸收量由大到小依次为:80∶1(147 μmol·kg-1·d-1)>16∶1(60 μmol·kg-1·d-1)>40∶1(57 μmol·kg-1·d-1)>4∶1(54 μmol·kg-1·d-1),而单位时间pH提升量由大到小依次为:4∶1(0.13 d-1)>40∶1/80∶1(0.08 d-1)>16∶1(0.06 d-1)。不同培养组之间,随氮磷比增加单位时间DIC吸收量呈现不同程度的增加(1.11倍;1.06倍;2.72倍);而单位时间pH提升量呈现不同程度的减少(53.8%;38.5%;38.5%)。氮和磷作为重要的营养成分,对藻类的生理生化过程起着重要作用。适当增加营养盐的浓度可以促进藻类对DIC的吸收,提升海水的pH,这与国内外的研究报道是一致的。已有大量研究发现,氮磷浓度增加对石莼[34-35]、龙须菜、孔石莼、海带[45]以及浒苔[46]等的生长和光合固碳能力具有促进作用,而氮加富的促进能力强于磷,会提高藻类的最大光合作用速率,从而增强其对DIC的吸收能力。
|
图 1 不同氮磷比条件下球形棕囊藻的ΔDIC变化 Fig. 1 Variations of ΔDIC in P. globosa cultures under different N/P ratio conditions |
|
图 2 不同氮磷比条件下球形棕囊藻的ΔpH变化 Fig. 2 Variations of ΔpH in P. globosa cultures under different N/P ratio conditions |
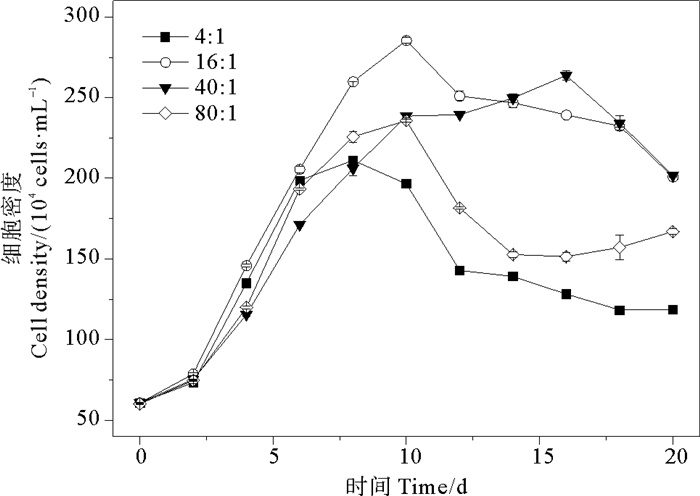
在氮磷比为4∶1、16∶1、40∶1和80∶1条件下,球形棕囊藻的细胞密度总体变化范围为(60~285)×104 cells·mL-1。各组藻细胞密度平均值分别为(138±48、201±74、187±72和156±55) ×104 cells·mL-1。随培养时间的增加,藻细胞密度呈现出先升高后降低的变化趋势(见图 3)。四组氮磷比之间存在有明显差异(P<0.05)。当氮磷比为16∶1和40∶1时,细胞密度达到峰值的时间相对延长,分别为第10和16天,其峰值分别为285×104和264×104 cells·mL-1,大于其余两组。当氮磷比为4∶1和80∶1时,藻细胞密度峰值相对较低,这可能是由于氮和磷浓度过低降低藻细胞的光合作用能力,阻碍藻细胞内谷氨酸、半胱氨酸络合形成螯合物的过程[47],从而影响藻类生长。当氮磷比为40∶1时,藻细胞密度在衰亡期降低幅度较大,这与朱蓉等[37]的研究结果一致,在超过最适宜的氮磷比(16∶1)后,过量吸收氮不利于藻细胞的生长[48]。
|
图 3 不同氮磷比条件下球形棕囊藻的细胞密度变化 Fig. 3 Variations of cell densities in P. globosa cultures under different N/P ratio conditions |
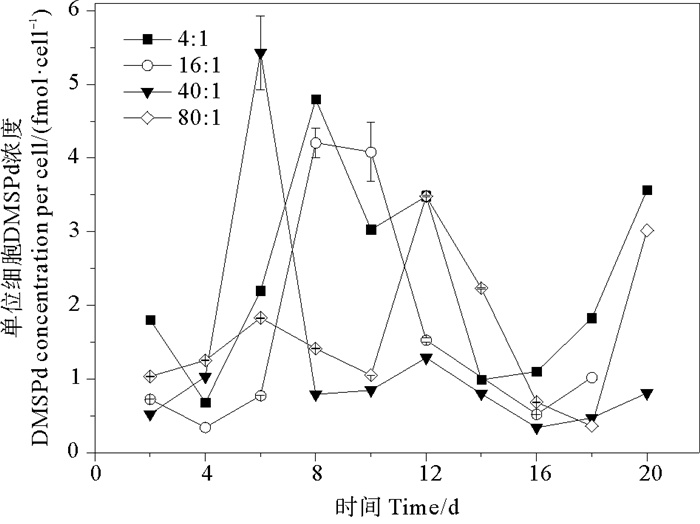
培养液中单位细胞DMSPd浓度的变化范围为0.034~0.543 fmol·cell-1。氮磷比为4∶1、16∶1、40∶1和80∶1条件下DMSPd的平均值分别为(0.235±0.133)、(0.165±0.158)、(0.128±0.150)和(0.148±0.101) fmol·cell-1,组间无明显差异(P>0.05)。DMSPd浓度变化的趋势为先稳定在较低值,后迅速增加至峰值,再降低至较低值,生长后期再升高(见图 4)。DMSPd浓度的峰值出现在指数生长期或稳定期。DMSPd浓度增加的原因可能是在指数生长期细胞活性强,光合作用产生的DMSPd释放到水体中;在生长后期细胞破裂,释放出储存在胞内的DMSP。不同氮磷比条件下,球形棕囊藻的单位细胞DMSPd浓度达到峰值的时间不同。当氮磷比为4∶1、16∶1、40∶1和80∶1时,分别在第8、8、6和12天达到最大值,最大值分别为0.480、0.421、0.543和0.348 fmol·cell-1。藻细胞培养液中的DMSPd主要由于细胞内的DMSP的自然渗透或细胞衰老分解而得到,所以DMSPd的变化主要取决于细胞内DMSP的生产能力[49]。
|
图 4 不同氮磷比条件下球形棕囊藻单位细胞DMSPd浓度的变化 Fig. 4 Variations of DMSPd per cell in P. globosa cultures under different N/P ratio conditions |
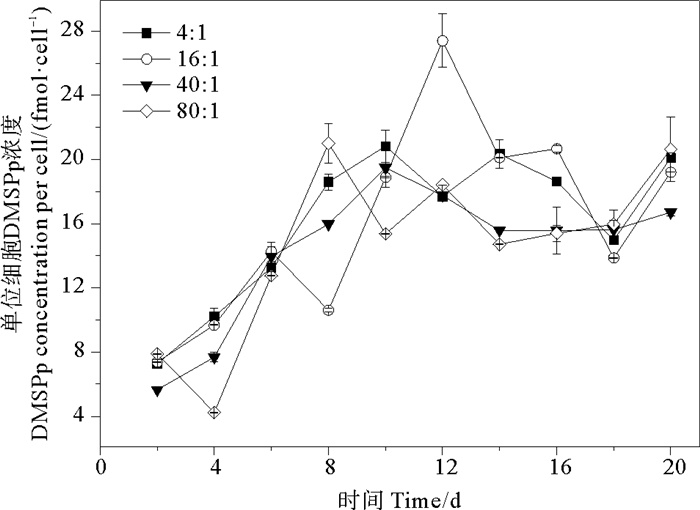
培养液中单位细胞DMSPp的变化范围为0.393~2.741 fmol·cell-1。氮磷比为4∶1、16∶1、40∶1和80∶1条件下DMSPd的平均值分别为(1.515±0.559)、(1.515±0.680)、(1.347±0.516)、(1.367±0.596) fmol·cell-1,组间无明显差异(P>0.05)。相比于DMSPd,DMSPp与球形棕囊藻细胞密度变化趋势更相近,都是先升高后降低,生长期后期小幅升高(见图 5)。DMSPp浓度的峰值出现在指数生长期后期或稳定期。当氮磷比为16∶1时,DMSPp在第12天出现峰值2.741 fmol·cell-1,明显高于其他氮磷比条件下DMSPp的最大值。这说明磷和氮需要满足一定比例才会促进细胞产生DMSPp,在本研究中当氮磷比为16∶1时会最大程度产生DMSPp。在DMSPp合成过程中,球形棕囊藻细胞生长对磷需求较高,磷直接参与光合作用的各个环节,包括光能吸收与碳同化、卡尔文循环以及对一些酶的活性调节等[50]。
|
图 5 不同氮磷比条件下球形棕囊藻单位细胞DMSPp浓度的变化 Fig. 5 Variations of DMSPp per cell in P. globosa cultures under different N/P ratio conditions |
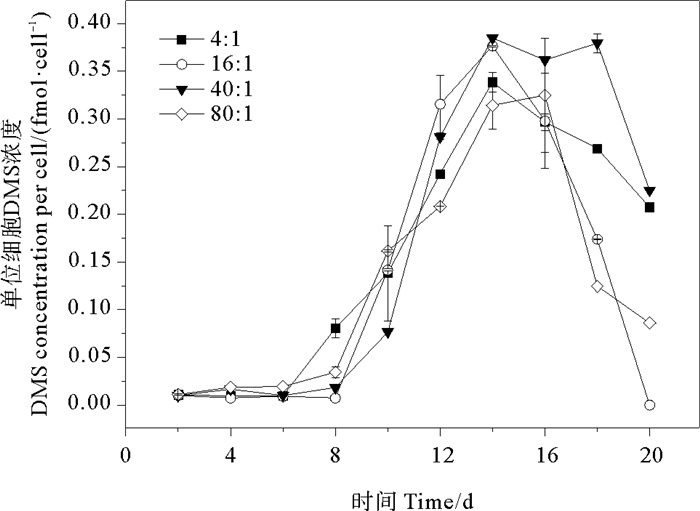
培养液中单位细胞DMS浓度的变化范围为0~0.038 fmol·cell-1。氮磷比为4∶1、16∶1、40∶1和80∶1条件下DMS的平均值分别为(0.016±0.013)、(0.013±0.015)、(0.018±0.017)、(0.013±0.012) fmol·cell-1,组间无明显差异(P>0.05)。在生长早期单位细胞释放的DMS很少,在指数生长期后期迅速增加,稳定期或衰亡期前期达到峰值后又迅速减少(见图 6)。不同氮磷比条件下,DMS的最大值均出现在稳定期(第14天),最大值分别为0.034、0.038、0.038和0.033 fmol·cell-1。氮磷比16∶1组和40∶1组的DMS浓度峰值较高,而这两组的藻细胞密度也比另外两组高,说明球形棕囊藻DMS释放与藻类生长状况有关。DMS释放量在不同生长时期内的变化趋势同时会受到DMSP浓度和DMSP裂解酶活性的影响,而DMSP裂解酶活性与藻细胞密度存在高度的相关性[51]。在稳定期和衰亡期前期,藻细胞密度达到峰值,细胞死亡破裂释放DMSP裂解酶裂解DMSP,使其转化为DMS从而导致DMS释放量增加[52]。
|
图 6 不同氮磷比条件下球形棕囊藻单位细胞DMS变化 Fig. 6 Variations of DMS at per cell in P. globosa cultures under different N/P ratio conditions |
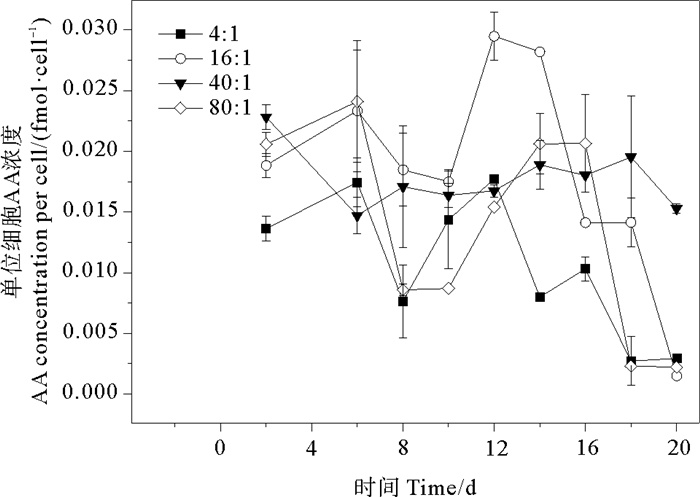
培养液中单位细胞AA浓度的变化范围为0.150~2.949 fmol·cell-1。氮磷比为4∶1、16∶1、40∶1和80∶1条件下AA的平均值分别为(1.053±0.567)、(1.840±0.842)、(1.771±0.247)、(1.368±0.842) fmol·cell-1,组间存在有明显差异(P<0.05)。AA呈现出先升高再降低又升高,衰亡期再降低的趋势(见图 7)。通常情况下,藻类释放AA的浓度在生长后期达到最大值[19]。Yang等[16]调查发现球形棕囊藻藻华初期水体内含AA,但进入衰亡期后迅速降低至检出限以下。Davidson等[53]研究发现细菌会侵入衰亡期的微藻,仅在指数生长期的水体内检出AA。然而Noordkamp等[12]在无菌环境下培养球形棕囊藻,发现在衰亡期AA产生速率增加,藻细胞内AA浓度高于培养液,表明球形棕囊藻在衰亡期没有检出AA是由于细菌消耗而不是没有产生。球形棕囊藻单位细胞释放的AA对不同氮磷比变化较为敏感。本研究中当氮磷比为4∶1、16∶1时释放的AA含量均在稳定期达到最大值,原因在于藻细胞破裂释放DMSP裂解酶,引起DMSP大量裂解,导致AA浓度增加。另外,细胞内AA会被吸附在藻细胞内部的粘液层,当细胞破裂AA释放到培养液中,AA浓度随之增加。当氮磷比为16∶1时,AA释放量在第12天达到最大值2.949 fmol·cell-1,与Gibson等[17]测定的夏季南极洲球形棕囊藻AA含量(9.76 fmol·cell-1)为同一数量级。当氮磷比为4∶1和16∶1时,AA释放量整体上随着氮磷比的升高而升高。当氮磷比为40∶1时,AA在整个生长周期内波动较小。而当氮磷比为80∶1时,AA浓度比16∶1和40∶1组小。这是由于磷浓度过低,影响了微藻的光合作用[12],从而抑制了AA的产生。由氮磷比和球形棕囊藻单位细胞AA浓度的关系可看出,当氮磷比小于16∶1时,两者成正比关系;当氮磷比大于16∶1时,两者不存在线性关系。
|
图 7 不同氮磷比条件下球形棕囊藻的单位细胞AA变化 Fig. 7 Variations of AA at per cell in P. globosa cultures under different N/P ratio conditions |
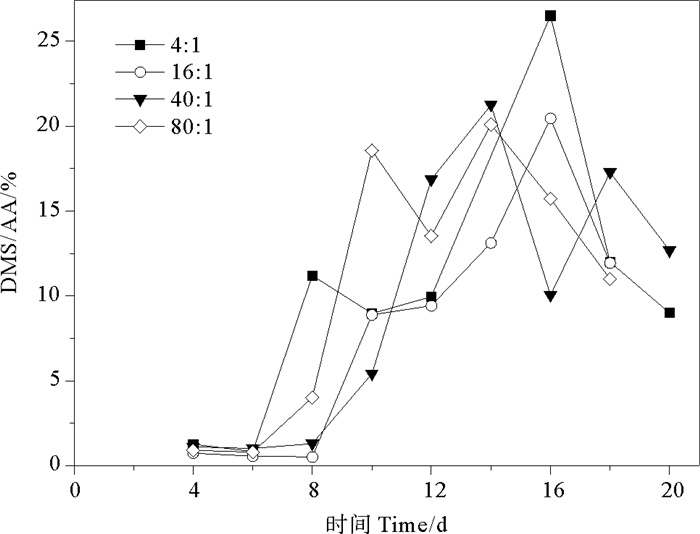
由DMSP两种降解途径可知,DMS/AA表示为DMSP酶裂解途径占两种降解途径中的比例。DMS/AA的总体变化范围为0.51%~26.53%。氮磷比为4∶1、16∶1、40∶1和80∶1条件下AA/(DMSP+AA)比值分别为0.82%~26.53%、0.51%~20.46%、1.01%~21.25%、0.80%~21.10%,平均值分别为(9.97±7.94)%、(8.21±7.21)%、(9.66±7.82)%、(10.58±7.77)%。球形棕囊藻的DMS/AA在指数生长期呈现上升趋势,稳定期达到峰值,在衰亡期下降,与藻类生长曲线相似(见图 8)。当氮磷比为4∶1和16∶1时,DMS/AA比值的最大值出现在第16天,分别为26.53%和20.46%。当氮磷比为40∶1和80∶1时,DMS/AA比值的最大值较另外两组提前(第14天),且出现两个峰值。在整个生长周期中,DMSP降解途径各不相同,指数生长期前期DMS/AA较小,DMSP的去甲基化途径为主要途径。随着藻细胞密度增加,DMSP酶裂解途径也增加。在稳定期和衰亡期前期,细胞死亡破裂释放裂解酶,DMSP酶裂解途径达到最大但仍不是主要的降解途径,此时DMS/AA达到峰值。Liu等[54]研究发现,海洋原甲藻、大洋桥石藻和亚心形扁藻的DMS/AA比值在整个生长期中均小于25%,表明DMS的酶裂解途径不是DMSP的主要降解途径。
|
图 8 不同氮磷比条件下球形棕囊藻的DMS/AA变化 Fig. 8 Variations of DMS/AA in P. globosa cultures under different N/P ratio conditions |
DMS代表DMSP通过酶裂解方式的含量,(DMSP+AA)代表DMSP已裂解和未裂解含量的总和,因而DMS/(DMSP+AA)表示为酶裂解途径产生DMS所占百分比。DMS/(DMSP+AA)的总体变化范围为0.25%~11.89%。氮磷比为4∶1、16∶1、40∶1和80∶1条件下AA/(DMSP+AA)比值分别为0.36%~8.13%、0.25%~8.95%、0.34%~11.16%、0.41%~11.89%,平均值分别为(3.43±2.96)%、(4.10±3.57)%、(5.14±4.24)%、(5.05±4.67)%。球形棕囊藻的DMS/(DMSP+AA)在指数生长期前期稳定在低值后期迅速上升,稳定期达到峰值,在衰亡期下降,与DMS变化曲线相似(见图 9)。当氮磷比为40∶1和80∶1时,第8~14天DMS/(DMSP+AA)比值迅速增加至峰值(0.60%~11.16%、0.99%~11.89%),其他两组变化相似但幅度较小。由于受到DMSP浓度和DMSP裂解酶活性的影响,DMS产生所占百分比在不同生长时期内的变化与藻细胞密度密切相关[51]。Tan等[55]研究夏季长江口及邻近海域时发现,该地区DMS/(DMSP+AA)的平均比值小于20%,说明DMS产生过程是DMSP降解的次要途径,与本研究结果一致。
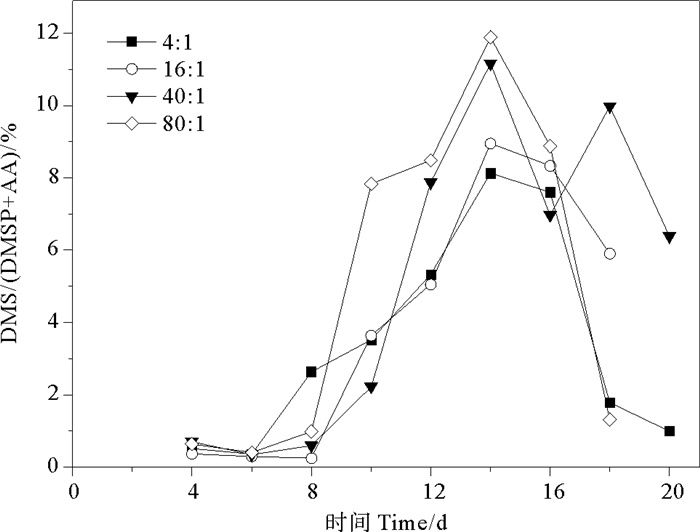
|
图 9 不同氮磷比条件下球形棕囊藻的DMS/(DMSP+AA)变化 Fig. 9 Variations of DMS/(DMSP+AA) in P. globosa cultures under different N/P ratio conditions |
AA代表DMSP通过两种降解途径的含量,AA/(DMSP+AA)表示为DMSP表观降解百分比。AA/(DMSP+AA)的总体变化范围为6.02%~70.04%。氮磷比为4∶1、16∶1、40∶1和80∶1条件下AA/(DMSP+AA)比值分别为11.03%~53.50%、6.02%~68.19%、33.87%~69.34%、8.10%~70.04%,平均值分别为(32.22±13.95)%、(45.71±16.91)%、(51.15±11.00)%、(42.86±22.73)%。球形棕囊藻的AA/(DMSP+AA)在指数生长期前期先下降,再升高至稳定期达到峰值,后在衰亡期下降(见图 10)。当氮磷比为16∶1和40∶1时,DMSP降解百分数较高。当氮磷比为16∶1和40∶1时,AA/(DMSP+AA)比值的最大值出现在第14和16天,分别为68.19%和69.34%。当氮磷比为4∶1和80∶1时,AA/(DMSP+AA)的最大值较另外两组提前(第12天),且峰值较小(53.50%和62.64%)。不同氮磷比可能对酶的活性和含量以及初始DMSP浓度产生影响,从而导致DMSP表观降解百分比的不同。Liu等[56]研究冬季黄渤海海域时发现,该区域AA/(DMSP-AA)平均比值为53.98%,与氮磷比为40∶1组结果接近。

|
图 10 不同氮磷比条件下球形棕囊藻的AA/(DMSP+AA)变化 Fig. 10 Variations of AA/(DMSP+AA) in P. globosa cultures under different N/P ratio conditions |
不同氮磷比对球形棕囊藻光合作用、生长状况、释放生源硫化物以及DMSP降解途径会产生影响。氮磷比为80∶1时,培养液中单位时间DIC吸收量最大(147 μmol·kg-1·d-1);而氮磷比为4∶1时,单位时间pH提升量最大(0.13 d-1)。氮磷比为16∶1和40∶1时,最大藻细胞密度较高(285×104和264×104 cells·mL-1),且稳定生长期相对延长。氮磷比为40∶1时,培养液中单位细胞DMSPd和DMS浓度达到峰值(0.543和0.038 fmol·cell-1);氮磷比为16∶1时,DMSPp、DMS和AA浓度达到峰值(2.741、0.038和2.949 fmol·cell-1)。氮磷比为4∶1时,DMS/AA达到峰值26.53%,DMSP酶裂解途径占比最大。氮磷比为80∶1时,DMS/(DMSP+AA)达到峰值11.89%,DMS生产百分比最大。氮磷比为40∶1时,AA/(DMSP+AA)达到峰值69.34%,总DMSP降解率最大。总体而言,16∶1是球形棕囊藻释放含硫化合物的最佳氮磷比值,不同氮磷比条件会影响DMSP降解途径。
| [1] |
Yang G P, Watanabe S, Tsunogai S. Distribution and cycling of dimethylsulfide in surface microlayer and subsurface seawater[J]. Marine Chemistry, 2001, 76: 137-153. DOI:10.1016/S0304-4203(01)00054-8 (  0) 0) |
| [2] |
Yang G P, Tsunogai S. Biogeochemistry of dimethylsulfide(DMS) and dimethylsulfoniopropionate(DMSP) in the surface microlayer of the western North Pacific[J]. Deep-Sea Research I, 2005, 52: 553-567. DOI:10.1016/j.dsr.2004.11.013 (  0) 0) |
| [3] |
Yang G P, Levasseur M, Michaud S, et al. Biogeochemistry of dimethylsulfide(DMS) and dimethylsulfoniopropionate(DMSP) in the surface microlayer and subsurface water of the western North Atlantic during spring[J]. Marine Chemistry, 2005, 96: 315-329. DOI:10.1016/j.marchem.2005.03.003 (  0) 0) |
| [4] |
Charlson R J, Lovelock J E, Andreae M O, et al. Oceanic phytoplankton, atmospheric sulfur, cloud albedo and climate[J]. Nature, 1987, 326: 655-661. DOI:10.1038/326655a0 (  0) 0) |
| [5] |
Challenger F, Simpson M I. Studies on biological methylation. Part XⅡ. A precursor of the dimethylsulphide evolved by Polysiphonia fastigiata, Dimethyl-2-carboxyethyl-sulphonium hydroxide and its salts[J]. Journal of the Chemical Society, 1948, 3: 1591-1597. (  0) 0) |
| [6] |
Matrai P A, Keller M D. Total organic sulfur and dimethylsulfoniopropionate in marine phytoplankton: Intracellular variations[J]. Marine Biology, 1994, 119: 61-68. DOI:10.1007/BF00350107 (  0) 0) |
| [7] |
Matrai P A, Vernet M. Dynamics of the vernal bloom in the marginal ice-zone of the Barents Sea: Dimethylsulfide and dimethylsulfoniopropionate budgets[J]. Journal of Geophysical Research, 1997, 102: 22965-22979. DOI:10.1029/96JC03870 (  0) 0) |
| [8] |
Sunda W, Kieber D J, Kiene R P, et al. An antioxidant function for DMSP and DMS in marine algae[J]. Nature, 2002, 418(6895): 317-320. DOI:10.1038/nature00851 (  0) 0) |
| [9] |
Stefels J. Physiological aspects of the production and conversion of DMSP in marine algae and higher plants[J]. Jourmal of Sea Research, 2000, 43(3-4): 183-197. DOI:10.1016/S1385-1101(00)00030-7 (  0) 0) |
| [10] |
Karsten U, Kück K, Vogt C, et al. Dimethylsulfoniopropionate production in phototrophic organisms and its physiological functions as a cryoprotectant[C]//Kiene R P, Visscher P T, Keller M D, et al. Biological and Environmental Chemistry of DMSP and Related Sulfonium Compounds. New York: Plenum, 1996: 143-153.
(  0) 0) |
| [11] |
Taylor B F. Bacterial transformation of organic sulfur compounds in marine environments[J]. Biogeochemistry of Global Change, 1993, 745-781. (  0) 0) |
| [12] |
Taylor B F, Gilchrist D C. New routes for aerobic biodegradation of dimethsulfoniopropionate[J]. Applied and Environmental Microbiology, 1991, 57(12): 3581-3584. DOI:10.1128/aem.57.12.3581-3584.1991 (  0) 0) |
| [13] |
Sieburth J M. Acrylic acid, an "antibiotic" principle in Phaeocystis blooms in Antarctic waters[J]. Science, 1960, 132(3428): 676-677. DOI:10.1126/science.132.3428.676 (  0) 0) |
| [14] |
Yang H F, Mctaggart A R, Davidson A. Primary productivity of acrylic acid and dimethylsulfide during a summer bloom of Phaeocystis pouchetii in Antarctic coastal water[J]. Antarctic Research, 1992, 4(2): 36-42. (  0) 0) |
| [15] |
Gibson J A E, Swadling K M, Burton H R. Acrylate and dimethylsulfoniopropionate(DMSP) concentrations during an Antarctic phytoplankton bloom[J]. Chemical Sciences, 1996, 213-222. (  0) 0) |
| [16] |
Noordkamp D J B, Gieskes W W C, Gottschal J C, et al. Acrylate in Phaeocystis colonies does not affect the surrounding bacteria[J]. Journal of Sea Research, 2000, 43(3): 287-296. (  0) 0) |
| [17] |
Bajt O, Šket B, Faganeli J. The aqueous photochemical transformation of acrylic acid[J]. Marine Chemistry, 1997, 58(3-4): 255-259. DOI:10.1016/S0304-4203(97)00052-2 (  0) 0) |
| [18] |
杨桂朋, 康志强, 景伟文. 海洋中二甲基硫的生物生产与消费过程[J]. 中国海洋大学学报(自然科学版), 2006, 36(1): 42-48. Yang G P, Kang Z Q, Jing W W. Biological production and consumption processes of dimethylsulfide(DMS) in the ocean[J]. Periodical of Ocean University of China, 2006, 36(1): 42-48. (  0) 0) |
| [19] |
Liu C Y, Gao C X, Zhang H B, et al. Production of dimethylsulfide and acrylic acid from dimethylsulfoniopropionate during the growth of three marine microalgae[J]. Chinese Journal of Oceanology and Limnology, 2014, 32(6): 1270-1279. DOI:10.1007/s00343-015-4029-6 (  0) 0) |
| [20] |
谭婷婷, 刘春颖, 刘涛, 等. 环境因子对浒苔生长及生源硫释放的影响[J]. 海洋与湖沼, 2018, 49(4): 793-801. Tan T T, Liu C Y, Liu T, et al. Effects of environmental factors on the growth of Enteromorpha and biogenic sulfur release[J]. Oceanologia et Limnologia Sinica, 2018, 49(4): 793-801. (  0) 0) |
| [21] |
韩露, 邓雪, 李培峰, 等. 海水温度对衰亡期浒苔释放生源硫影响的模拟研究[J]. 海洋学报, 2018, 40(10): 110-118. Han L, Deng X, Li P F, et al. Simulation study on the influence of seawater temperature on the release of biogenic sulfur from Enteromorpha during the decay period[J]. Acta Oceanologica Sinica, 2018, 40(10): 110-118. DOI:10.3969/j.issn.0253-4193.2018.10.011 (  0) 0) |
| [22] |
齐雨藻, 徐宁, 王艳, 等. 中国赤潮研究的新进展——球形棕囊藻赤潮及其产硫的研究[J]. 中国基础科学, 2002(4): 23-28. Qi Y Z, Xu N, Wang Y, et al. Progress of studies on red tide in China——studies on Phaeocystis globosa red tide and its DMS(DMSP) production[J]. China Basic Science, 2002(4): 23-28. DOI:10.3969/j.issn.1009-2412.2002.04.005 (  0) 0) |
| [23] |
沈萍萍, 齐雨藻, 欧林坚. 中国沿海球形棕囊藻的分类、分布及其藻华[J]. 海洋科学, 2018, 42(10): 146-162. Shen P P, Qi Y Z, Ou L J. Classification, distribution and algae bloom of Phaeocystis globosa along the coast of China[J]. Marine Science, 2018, 42(10): 146-162. DOI:10.11759/hykx20171225004 (  0) 0) |
| [24] |
Liss P S, Malin G, Turner S M, et al. Dimethylsulphide and Phaeocystis: A review[J]. Journal of Marine System, 1994, 5(1): 41-53. DOI:10.1016/0924-7963(94)90015-9 (  0) 0) |
| [25] |
Stefels J, Dijkhuizen L, Gieskes W W C. DMSP-lyase activity in a spring phytoplankton bloom off the Dutch coast, related to Phaeocystis sp. abundance[J]. Marine Ecology Progress Series, 1995, 123: 235-243. DOI:10.3354/meps123235 (  0) 0) |
| [26] |
Yang G P, Zhang H H, Zhu T. Distribution and cycling of dimethylsulfide(DMS) and dimethylsulfoniopropionate(DMSP) in the sea-surface microlayer of the Yellow Sea, China, in spring[J]. Continental Shelf Research, 2008, 28: 2417-2427. DOI:10.1016/j.csr.2008.06.003 (  0) 0) |
| [27] |
Zhuang G C, Yang G P, Yu J, et al. Production of DMS and DMSP in different physiological stage and salinity conditions in two marine algae[J]. Oceanology and Limnology, 2011, 29: 369-377. DOI:10.1007/s00343-011-0046-2 (  0) 0) |
| [28] |
胡敏, 马奇菊, 朱彤. 海洋排放二甲基硫通量的研究进展[J]. 海洋环境科学, 2002, 21(3): 70-75. Hu M, Ma Q J, Zhu T. Research on the flux dimethylsulfide from ocean[J]. Marine Environmental Science, 2002, 21(3): 70-75. DOI:10.3969/j.issn.1007-6336.2002.03.016 (  0) 0) |
| [29] |
van Duyl F C, Gieskes W W C, Kop A J, et al. Biological control of short-term variations in the concentration of DMSP and DMS during a Phaeocystis spring bloom[J]. Journal of Sea Research, 1998, 40(3-4): 221-231. DOI:10.1016/S1385-1101(98)00024-0 (  0) 0) |
| [30] |
Noordkamp D J B, Schotten M, Gieskes W W C, et al. High acrylate concentrations in the mucus of Phaeocystis globosa colonies[J]. Aquatic Microbial Ecology, 1998, 16(1): 45-52. (  0) 0) |
| [31] |
Li S X, Yu K F, Huo Y Z, et al. Effects of nitrogen and phosphorus enrichment on growth and photosynthetic assimilation of carbon in a green tide-forming species(Ulva prolifera) in the Yellow Sea[J]. Hydrobiologia, 2016, 776(1): 161-171. DOI:10.1007/s10750-016-2749-z (  0) 0) |
| [32] |
林庆莹, 吴海龙, 刘媛媛, 等. 环境因子对瓦氏马尾藻吸收溶解性无机碳及提升海水pH的影响[J]. 上海海洋大学学报, 2018, 27(2): 221-229. Lin Q Y, Wu H L, Liu Y Y, et al. The effect of environmental factors on the absorption of dissolved inorganic carbon by Sargassum vachini and the increase of seawater pH[J]. Journal of Shanghai Ocean University, 2018, 27(2): 221-229. (  0) 0) |
| [33] |
李枫, 邹定辉, 刘兆普, 等. 氮磷水平对龙须菜生长和光合特性的影响[J]. 植物生态学报, 2009, 33(6): 1140-1147. Li F, Zou D H, Liu Z P, et al. Effects of nitrogen and phosphorous levels on growth and photosynthetic traits of Gracilaria lemaneiformis(Rhodo-Phyta)[J]. Chinese Journal of Plant Ecology, 2009, 33(6): 1140-1147. DOI:10.3773/j.issn.1005-264x.2009.06.014 (  0) 0) |
| [34] |
邹定辉, 高坤山, 阮祚禧. 高CO2浓度对石莼光合作用及营养盐吸收的影响[J]. 青岛海洋大学学报, 2001, 31(6): 877-882. Zou D H, Gao K S, Ruan Z X. Effects of elevated CO2 concentration on photosynthesis and nutrients uptake of Ulva lactuca[J]. Journal of Ocean University of Qingdao, 2001, 31(6): 877-882. DOI:10.3969/j.issn.1672-5174.2001.06.009 (  0) 0) |
| [35] |
Pedersen M F. Nitrogen limitation of photosynthesis and growth: comparison across aquatic plant communities in a Danish estuary(Roskilde Fjord)[J]. Ophelia, 1995, 41(1): 261-272. DOI:10.1080/00785236.1995.10422047 (  0) 0) |
| [36] |
Guillard R R L, Ryther J H. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacrea Cleve[J]. Canadian Journal of Microbiology, 1962, 8: 229-239. DOI:10.1139/m62-029 (  0) 0) |
| [37] |
朱蓉, 杨桂朋, 于娟, 等. 不同氮磷比及铁浓度对球形棕囊藻二甲基硫和二甲巯基丙酸内盐生产的影响[J]. 中国海洋大学学报(自然科学版), 2013, 43(10): 67-75. Zhu R, Yang G P, Yu J, et al. The effects of different nitrogen-phosphorus ratios and iron concentrations on the production of Phaeocystis globosa dimethylsulfide and dimethylsulfoniopropionate[J]. Periodical of Ocean University of China, 2013, 43(10): 67-75. (  0) 0) |
| [38] |
朱蓉, 张洪海, 张婧, 等. 不同氮磷比和铁浓度对两种海洋微藻生产二甲基硫和二甲巯基丙酸内盐的实验研究[J]. 中国海洋大学学报(自然科学版), 2018, 48(12): 62-70. Zhu R, Zhang H H, Zhang J, et al. Experimental study on the production of dimethylsulfide and dimethylsulfoniopropionate by two marine microalgae with different ratios of nitrogen to phosphorus and iron concentrations[J]. Periodical of Ocean University of China, 2018, 48(12): 62-70. (  0) 0) |
| [39] |
厉丞烜. 海水中DMS和DMSP的生物生产与消费的研究[D]. 青岛: 中国海洋大学, 2010. Li C X. Research on the Biological Production and Consumption of DMS and DMSP in Seawater[D]. Qingadao: Ocean University of China, 2010. (  0) 0) |
| [40] |
杨桂朋, 康志强, 景伟文, 等. 海水中痕量DMS和DMSP分析方法的研究[J]. 海洋与湖沼, 2007, 38(4): 322-328. Yang G P, Kang Z Q, Jing W W, et al. An analytical method of determining trace quantities of dimethylsulfide and dimethylsulfoniopropionate in seawater[J]. Oceanologia et Limnologia Sinica, 2007, 38(4): 322-328. DOI:10.3321/j.issn:0029-814X.2007.04.005 (  0) 0) |
| [41] |
Oremland R S. Biogeochemistry of Global Change: Radiatively Active Trace Gases Selected Papers from the Tenth International Symposium on Environmental Biogeochemistry, San Francisco, August 19-24, 1991[M]. New York: Chapman & Hall, 1993.
(  0) 0) |
| [42] |
Yang G P, Jing W W, Kang Z Q, et al. Spatial variations of dimethylsulfide and dimethylsulfoniopropionate in the surface microlayer and in the subsurface waters of the South China Sea during spring time[J]. Marine Environmental Research, 2008, 65(1): 85-97. DOI:10.1016/j.marenvres.2007.09.002 (  0) 0) |
| [43] |
刘春颖, 王莉莉, 杨桂朋, 等. 海水中丙烯酸的高效液相色谱法建立及应用[J]. 海洋学报, 2013, 35(1): 172-176. Liu C Y, Wang L L, Yang G P, et al. Determination of acrylic acid in seawater by high performance liquid chromatography and its application[J]. Acta Oceanologica Sinica, 2013, 35(1): 172-176. DOI:10.3969/j.issn.0253-4193.2013.01.020 (  0) 0) |
| [44] |
Mehrbach C, Culberson C H, Hawley J E, et al. Measurement of the apparent dissociation constants of carbonic acid in seawater at atmospheric pressure[J]. Limnology and Oceanography, 1973, 18(6): 897-907. DOI:10.4319/lo.1973.18.6.0897 (  0) 0) |
| [45] |
韩婷婷. 大型海藻对不同CO2浓度的光合生理响应及其生态效应[D]. 青岛: 中国科学院研究生院(海洋研究所), 2013. Han T T. Photosynthetic Physiological Responses of Macroalgae to Different CO2 Concentrations and Their Ecological Effects[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2013. (  0) 0) |
| [46] |
李少香. 浒苔光合固碳影响因子及海区评估研究[D]. 上海: 上海海洋大学, 2014. Li S X. Studies on Influencing Factors of Photosyntheticcarbon Fixtation and Evaluation of Sea Area by Ulva prolifera[D]. Shanghai: Shanghai Ocean University, 2014. (  0) 0) |
| [47] |
Morelli E, Scarano G. Synthesis and stability of phytochelatins induced by cadmium and lead in the marine diatom[J]. Marine Environment Research, 2001(52): 393-395. (  0) 0) |
| [48] |
Kolber Z S, Zehr J, Falkowski P G. Effects of growth irradiance and nitrogen limitation on photosynthetic energy conversion in photosystem Ⅱ[J]. Plant Physiology, 1988, 88: 923-929. DOI:10.1104/pp.88.3.923 (  0) 0) |
| [49] |
Li C X, Yang G P, Pan J F, et al. Experimental studies on dimethylsulfide(DMS) and dimethylsulfoniopionate(DMSP) production by four marine microalgae[J]. Acta Oceanologica Sinica, 2010, 29(4): 78-87. DOI:10.1007/s13131-010-0052-9 (  0) 0) |
| [50] |
Redfield A C. The biological control of chemical factorsin the environment[J]. American Scientist, 1958, 46: 205-222. (  0) 0) |
| [51] |
Stefels J, Steinke M, Turner S, et al. Environmental constraints on the production and removal of the climatically active gas dimethylsulphide(DMS) and implications for ecosystem modelling[J]. Biogeochemistry, 2007, 83(1-3): 245-275. (  0) 0) |
| [52] |
杨桂朋, 厉丞烜. 海洋生物对二甲基硫生产的控制作用研究[J]. 中国海洋大学学报(自然科学版), 2009, 39(3): 453-460. Yang G P, Li C X. Research on the control effect of marine organisms on the production of dimethyl sulfide[J]. Periodical of Ocean University of China, 2009, 39(3): 453-460. (  0) 0) |
| [53] |
Gibson D M J, Kirst G O. The role of β-dimethylsulphoniopropionate, glycine betaine and homarine in the osmoacclimation of Platymonas subcordiformis[J]. Planta, 1986, 167(4): 536-543. DOI:10.1007/BF00391230 (  0) 0) |
| [54] |
Liu C Y, Gao C X, Zhang H B, et al. Production of dimethylsulfide and acrylic acid from dimethylsulfoniopropionate during growth of three marine microalgae[J]. Chinese Journal of Ocea-nology and Limnology, 2014, 32(6): 1270-1279. (  0) 0) |
| [55] |
Tan T T, Wu X, Liu C Y, et al. Distributions of dimethylsulfide and its related compounds in the Yangtze(Changjiang) River Estuary and its adjacent waters in early summer[J]. Continental Shelf Research, 2017, 146: 89-101. (  0) 0) |
| [56] |
Liu Y, Liu C Y, Yang G P, et al. Biogeochemistry of dimethylsulfoniopropionate, dimethylsulfide and acrylic acid in the Yellow Sea and the Bohai Sea during autumn[J]. Environmental Chemistry, 2016, 13(1): 127-139. (  0) 0) |
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
 2022, Vol. 52
2022, Vol. 52


