2. 中国海洋大学食品科学与工程学院,山东 青岛 266003;
3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237
硬头鳟(Oncorhynchus mykiss)是典型的冷水性鱼类[1],由于中国开放海域夏季表层水温较高,难以保证养殖的鲑鳟鱼类安全度夏,因此也就无法利用常规模式在开放海域进行养殖。而本实验室调查数据显示,黄海冷水团7—9月水温保持在8~15 ℃,通过养殖工船和全潜式网箱能够充分利用其优质冷水资源开展鲑鳟鱼类养殖[2]。Korsøen等[3]研究发现,长期下潜养殖中的大西洋鲑其脊椎骨变形增多,畸形率达到2.53%,远高于在常规养殖模式中的畸形率(0.88%)。
钙和磷是鱼类骨骼正常形成和发育的必需元素。长时间喂以低磷饲料,会使鱼类调用骨骼系统中以磷酸钙形式储存的磷,用于软组织的生长,从而造成骨骼钙流失[4]。Skonberg[5]等研究发现,尽管饲料中有足够的钙、镁元素,投喂低磷饲料也会导致虹鳟身体钙、镁元素的流失。饲料中磷含量严重不足,会导致虹鳟幼鱼在5周后表现出厌食、体色变深色、嗜睡和生长减慢等症状[4]。类似地,Baeverfjord[6]等报道大西洋幼年鲑鱼经投喂低磷饲料9周后,鱼体钙磷含量分别为初始含量的65%和40%,并且生长几乎停止。Rodehutscord[7-8]等报道能够满足虹鳟正常生长的饲料磷添加水平为0.25 g/MJ。充足的磷含量是维持成骨细胞及骨细胞活性的主要因素,是骨骼发育、重塑及矿化中的关键[9],反之,投喂低磷饲料会导致鱼类出现骨骼矿化不足[10-11]、自发性骨折[12]以及脊椎骨畸形[11, 13-14]。
在黄海冷水团中长期下潜养殖的硬头鳟出现骨骼畸形的症状,这一症状与鲑科鱼类因饲料中磷含量不足产生的骨骼侵蚀性缺陷、骨骼机械性强度降低、椎骨出现压缩等症状[3, 11, 15]相同。为探究硬头鳟出现的这种畸形、生长减缓是否与饲料缺磷有关,本实验模拟全潜式网箱养殖环境,研究了饲料磷含量对不同补气方式中硬头鳟生长、骨骼组成的影响,以及两者在影响硬头鳟骨骼发育中的交互作用,以确定长期下潜养殖是否影响硬头鳟的磷代谢最终导致其骨骼畸形。
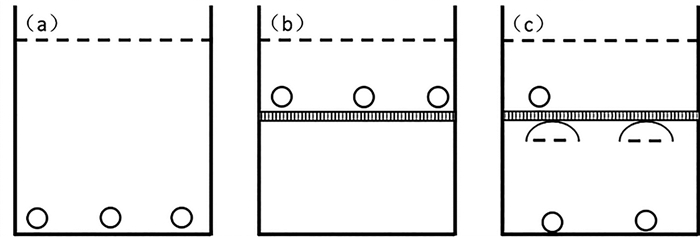
1 实验材料及设计 1.1 实验设备硬头鳟(Oncorhynchus mykiss)为临沂鸢柳淡水鱼养殖场的一龄鱼。如图 1所示,本实验设置3种不同补气方式的圆柱形玻璃纤维水槽(直径90 cm,桶高80 cm;实验水深70 cm)。对照组(Control)在水槽中设置气石以维持溶解氧含量(见图 1(a));网罩组(M)为在水槽中设置聚丙烯网(网目孔径1.50 cm,水面下15 cm),以阻止鱼类接触水面,并在网罩上方放置气石,以防止鱼吞食气泡,模拟全潜式网箱养殖条件(见图 1(b));补气组(R)在网罩下增加2个补气罩(直径20 cm,高度7 cm)和气石,以用于补充实验鱼类鱼鳔的气体(见图 1(c))。
|
( (a)对照组,(b)网罩组,(c)补气组;虚线代表水气界面;圆形代表气石;网格图案代表网罩;半圆弧形代表水下气罩。(a) The control group, (b) The mesh group, (c) The replenisher group. The dotted line indicates the air-water interface. The circle indicates airstone. The grid pattern indicates mesh. The semicircle indicates the underwater air-doom. ) 图 1 实验设计的具有不同养殖设备的水槽 Fig. 1 The design of tank with different equipment used in the experiment |
以鱼粉、豆粕、玉米蛋白粉和谷朊粉为蛋白源,以鱼油、豆油和卵磷脂为脂肪源,以玉米淀粉为糖源,通过调节饲料中磷酸二氢氨的添加量,配制出了有效磷含量分别为0.65%(P1)、1.40%(P2)和2.15%(P3)的3种等氮饲料(见表 1)。
|
|
表 1 实验饲料配方 Table 1 Formulation of experimental diets |
养殖实验中所使用的饲料生产流程为:首先,将各种固体原材料通过粉碎机粉碎后过50目筛网;其次,将所有过筛后的原材料粉末按比例从小到大顺序逐级拌匀;然后,在其中加入鱼油和卵磷脂充分搅拌均匀,再加入适量的清水(30%)揉搓均匀;最后,将混合料通过制粒机加工成为颗粒饲料(粒径3.0 mm),随后于55 ℃温度下烘干至饲料含水量低于百分之十,用塑胶袋包装,储存在-20 ℃的冰箱中。
1.3 实验设计养殖实验开始前,将硬头鳟放入实验水槽中暂养一周(50尾/水槽)。实验在流水式养殖系统中进行(盐度8~11,pH 7.0~7.5),所有水槽的补水量为1.19 L/min,确保养殖水体溶解氧超过7.5 mg/L,水温保持在15~16 ℃,光照条件为室内自然光照。暂养期间每天于8:00和17:00饱食投喂2次,饵料为商品饲料(粗蛋白≥ 40.0%,粗脂肪≥8.0%,灰分≤ 18.0%,水分≤ 12.0%)。
暂养结束后,挑选规格相近的健康鱼类((75.01±1.36) g,8尾/缸)分别放入3种不同补气方式的水槽进行70 d养殖实验。实验采用表 1的3种不同磷含量的饲料,投喂方式保持与暂养期内相同,每个处理组设置4个重复。实验期间与暂养期间保持相同的实验用水(补水量、溶氧含量、水温等)、光照条件和日常管理。
养殖实验结束,在停食1 d后进行采样工作。使用麻醉剂MS-222(浓度为70 mg/L)将鱼麻醉,测量每条鱼的体质量。随后每个水槽挑选3条鱼,在冰盘上去除肌肉和内脏,取下完整脊椎骨后迅速放到液氮中进行急冻,随后转移到-80 ℃冰箱中。
1.4 骨骼成分组成将完整脊椎骨样品使用冷冻干燥剂去除水分,随后使用冷冻研磨机将其粉碎用于检测。骨骼中钙磷含量的检测方法根据GB5009.268—2016中电感耦合等离子体质谱法(ICP-MS)法进行检测[16]。
1.5 统计方法和数据分析鱼体生长、摄食、形态等指标计算如下:
增重率(Weight gain)=(Wt -W0)/W0×100%;
特定生长率(Specific growth ratio,SGR,%/d)= 100 ×(ln Wt-ln W0)/t;
饲料系数(Feed conversion ratio,FCR)=F/(Wt-W0);
肥满度(Condition factor,CF)= 100 ×Wt/L3;
存活率(Survival)=Nf/Ni×100%。
式中:W0:实验开始时鱼体质量(g);Wt:实验结束时鱼体质量(g);F:饲料摄入量(g);t:养殖实验天数(d);Ni:初始鱼尾数;Nf:最终鱼尾数;L: 实验结束时鱼体长(cm)。
所有数据分析均使用SAS 9.4(SAS Institute,North Carolina,USA)统计软件分析数据的正态分布和同质性(Levene’s test)。随后,使用单因素与双因素方差分析法和Student-Newman-Keuls(SNK)多重检验对数据进行差异性分析。P < 0.05时,存在显著性差异。
2 结果 2.1 生长指标本实验中硬头鳟成活率为43.75%~100%(见表 2),受饲料磷含量影响显著(P < 0.05)。饲料磷含量对硬头鳟的平均终末体质量和特定生长率(SGR)的影响显著(P < 0.05);不同的补气方式也均显著影响硬头鳟的平均终末体质量和SGR(P < 0.05)。饲料磷含量和不同的补气方式对硬头鳟的各项生长指标的交互作用不显著(P > 0.05,见表 3)。
|
|
表 2 饲料磷含量和补气方式及两者交互作用对硬头鳟生长性能的影响 Table 2 Effects of dietary phosphorus content and air replenisher and their interaction on growth performance of steelhead trout |
|
|
表 3 不同饲料磷含量和补气方式对硬头鳟生长指标、骨骼组成影响的单、双因素分析结果 Table 3 The P values of growth, bone composition of steelhead trout with different dietary phosphorus content and air replenisher, analyzed using one-way ANOVA and combined effects determined by two-way ANOVA |
投喂低磷饲料时,网罩组硬头鳟(M)的平均终末体质量、增重率和SGR显著低于对照组和气罩组(P < 0.05)。随着饲料磷含量从0.65%增加到2.15%,对照组、网罩组和气罩组硬头鳟的增重率分别下降了29.7%、27.3%和32.6%,SGR分别下降了18.3%、18.6%和21.1%。在投喂高磷饲料(P3)时,网罩组硬头鳟的各项生长指标均与其余2组无显著差异(P > 0.05)。在不同饲料磷含量下,对照组与气罩组的差异均不显著(P > 0.05)。
2.2 骨骼组成如表 4所示,硬头鳟脊椎骨的灰分、钙和磷含量受到饲料磷含量的显著影响;而不同补气方式仅对脊椎骨的灰分有显著影响(P < 0.05)。随着饲料磷含量的增加,对照组和气罩组中的硬头鳟鱼体的灰分和钙含量均出现先上升后下降的趋势,磷含量出现下降。在每个饲料磷含量下,网罩组和气罩组硬头鳟脊椎骨的灰分含量均显著高于对照组(P < 0.05)。
|
|
表 4 饲料磷含量和补气方式及两者交互作用对硬头鳟骨骼组成的影响 Table 4 Effects of dietary phosphorus content and air replenisher and their interaction on bone composition of steelhead trout |
随着饲料磷含量从0.65%增加到2.15%,各处理组的硬头鳟脊椎骨粗灰分和钙含量均出现先上升后下降的趋势。而对照组和气罩组硬头鳟脊椎骨的磷含量呈下降趋势。饲料磷含量和不同补气方式仅对硬头鳟脊椎骨的灰分和钙磷含量未表现出显著的交互作用(P> 0.05)(见表 3)。
3 讨论为了发展深远海养殖,拓展海洋渔业空间,近年来,在中国各级政府大力支持下,中国水产养殖工作者在夏季将网箱“深蓝1号”沉入黄海冷水团,使鲑鳟鱼类在中国温暖海域成功度夏[17-19],但在深水中生活2周以上的大西洋鲑会因鱼鳔失气而失去平衡,最终出现食欲降低、生长减慢、游泳姿态异常等症状[15]。本实验中,在不同饲料磷含量水平下,网罩组硬头鳟生长显著低于对照组,而气罩组硬头鳟生长优于网罩组,并接近对照组,与之前我们实验结果一致[20-21],表明长期无法接触水面,使硬头鳟鱼鳔气体无法得到补充,处于负浮力状态,而设置水下补气罩能够有效缓解下潜养殖对硬头鳟的负面影响。
磷是鱼类生长所必需的矿物元素,在维持鱼类新陈代谢和生理功能的正常运转中发挥着重要作用[12]。鱼类获取磷的主要来源是食物,磷摄入量过低会导致骨矿化减少、骨骼异常和生长减慢[22]。本实验中,随着饲料磷含量由0.65%(P1)增加至2.15%(P3),硬头鳟的各项生长指标呈下降趋势,未出现补偿性生长现象。投喂高磷饲料(2.15% P)14 d以后硬头鳟出现食欲减退、体色发黑、行动迟缓等现象,开始出现死亡,至实验结束,高磷组硬头鳟的死亡率已接近50%,这与Sugiura等[23]报道的鱼类磷中毒症状相似;其次出现相似症状的是中磷组(1.40% P),而低磷组(0.65% P)始终没有出现类似的状况。这表明长期下潜养殖硬头鳟生长速度减慢不是饲料中磷缺乏所致。黄海冷水团养殖硬头鳟饲料含磷量在1%左右,高于低磷饲料,低于中磷饲料(P2),基本可以满足硬头鳟对饲料磷的需求[7-8]。本实验中,随着饲料磷含量由1.40%(P2)减少至0.65%(P1),硬头鳟各项生长指标没有显著增加,网罩组硬头鳟的生长性能均显著低于对照组,且随着饲料磷含量的减少未出现恢复趋势(网罩组硬头鳟的增重率分别为对照组的74.1%(P2)和74.4%(P1))。因此,本实验结果表明,实际生产中长期下潜养殖硬头鳟的生长速度减慢不是饲料磷过量所致。
骨骼的矿化过程,就是钙、磷矿物质元素在骨组织中不断沉积的过程[24]。作为骨骼的重要组分鱼体内绝大多数的磷,以羟基磷灰石的的形式积累在骨基质中。本实验中,随着饲料磷含量的增加,相同养殖设备中硬头鳟骨骼灰分含量增加,表明饲料适量添加磷有助于硬头鳟骨骼矿化,这与Roy等[25]关于黑线鳕(Melanogrammus aeglefinus)的研究结果类似;同时本实验中,硬头鳟骨骼钙、磷含量均不受补气方式的影响,这说明长期下潜养殖没有干扰硬头鳟骨骼的磷代谢稳态,硬头鳟骨骼钙化加深不是饲料磷缺乏或过量所导致的;此外,网罩组和补气组硬头鳟骨骼灰分含量均显著高于对照组,表明硬头鳟受到负浮力胁迫后骨骼矿化程度加深,而增加水下气罩并未完全缓解负浮力造成的负面影响,为了获取更多升力而进行的倾斜游泳,可能是造成硬头鳟骨骼矿化程度加深和出现畸形的主要原因[3, 26-27]。
4 结语本文通过单因素与双因素方差分析法和Student-Newman-Keuls多重检验对不同养殖设备中硬头鳟的生长和骨骼组分进行分析,结果表明长期下潜养殖中硬头鳟的生长速度减慢不是饲料磷缺乏或过量所致,长期下潜的硬头鳟骨骼的磷代谢以及钙、磷含量保持稳定,骨骼发育不受影响。全潜式网箱中硬头鳟饲料磷含量不宜超过1.40%。本研究初步确定了长期下潜养殖的硬头鳟饲料中磷含量的适宜范围,为黄海冷水团鲑鳟鱼类养殖提供了基础资料和理论支持。
| [1] |
孙大江, 王炳谦. 鲑科鱼类及其养殖状况[J]. 水产学杂志, 2010, 23(2): 56-63. Sun D J, Wang B Q. Aquaculture of salmonids in China[J]. Chinese Journal Fisheries, 2010, 23(2): 56-63. DOI:10.3969/j.issn.1005-3832.2010.02.014 (  0) 0) |
| [2] |
张恭. 黄海冷水团硬头鳟(Oncorhynchus mykiss)网箱养殖容量研究[D]. 青岛: 中国海洋大学, 2021. Zhang G. The Carrying Capacity of the Cage Farm for Steelhead Trout (Oncorhynchus mykiss) in Yellow Sea Cold Water Mass[D]. Qingdao: Ocean University of China, 2021. (  0) 0) |
| [3] |
Korsøen Ø J, Dempster T, Fjelldal P G, et al. Long-term culture of Atlantic salmon (Salmo salar L.) in submerged cages during winter affects behaviour, growth and condition[J]. Aquaculture, 2009, 296(3-4): 373-381. DOI:10.1016/j.aquaculture.2009.08.036 (  0) 0) |
| [4] |
Shearer K D. Factors affecting the proximate composition of cultured fishes with emphasis on salmonids[J]. Aquaculture, 1994, 119(1): 63-88. DOI:10.1016/0044-8486(94)90444-8 (  0) 0) |
| [5] |
Skonberg D I, Yogev L, Hardy R W, et al. Metabolic response to dietary phosphorus intake in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1997, 157(1-2): 11-24. DOI:10.1016/S0044-8486(97)00141-5 (  0) 0) |
| [6] |
Baeverfjord G, Asgard T, Shearer K D. Development and detection of phosphorus deficiency in Atlantic salmon, Salmo salar L., parr and post-smolts[J]. Aquaculture Nutrition, 1998, 4(1): 1-11. DOI:10.1046/j.1365-2095.1998.00095.x (  0) 0) |
| [7] |
Rodehutscord M, Pfeffer E. Requirement for phosphorus in rainbow-trout (Oncorhynchus mykiss) growing from 50 to 200 g[J]. Water Science & Technology, 1995, 31(10): 137-141. (  0) 0) |
| [8] |
Rodehutscord M. Response of rainbow trout (Oncorhynchus mykiss) growing from 50 to 200 g to supplements of dibasic sodium phosphate in a semipurified diet[J]. Journal of Nutrition, 1996, 126(1): 324-331. DOI:10.1093/jn/126.1.324 (  0) 0) |
| [9] |
Heaney R P. Phosphorus nutrition and the treatment of osteoporosis[J]. Mayo Clinic Proceedings, 2004, 79(1): 91-97. DOI:10.4065/79.1.91 (  0) 0) |
| [10] |
Fjelldal P G, Hansen T, Breck O, et al. Vertebral deformities in farmed Atlantic salmon (Salmo salar L.) - etiology and pathology[J]. Journal of Applied Ichthyology, 2012, 28(3): 433-440. DOI:10.1111/j.1439-0426.2012.01980.x (  0) 0) |
| [11] |
Smedley M A, Migaud H, Mcstay E L, et al. Impact of dietary phosphorous in diploid and triploid Atlantic salmon (Salmo salar L.) with reference to early skeletal development in freshwater[J]. Aquaculture, 2018, 490: 329-343. DOI:10.1016/j.aquaculture.2018.02.049 (  0) 0) |
| [12] |
Sugiura S H, Hardy R W, Roberts R J. The pathology of phosphorus deficiency in fish-a review[J]. Journal of Fish Diseases, 2004, 27(5): 255-265. DOI:10.1111/j.1365-2761.2004.00527.x (  0) 0) |
| [13] |
Smedley M A, Clokie B G J, Migaud H, et al. Dietary phosphorous and protein supplementation enhances seawater growth and reduces severity of vertebral malformation in triploid Atlantic salmon (Salmo salar L.)[J]. Aquaculture, 2016, 451: 357-368. DOI:10.1016/j.aquaculture.2015.10.001 (  0) 0) |
| [14] |
Fjelldal P G, Hansen T J, Lock E J, et al. Increased dietary phosphorous prevents vertebral deformities in triploid Atlantic salmon (Salmo salar L.)[J]. Aquaculture Nutrition, 2016, 22(1): 72-90. DOI:10.1111/anu.12238 (  0) 0) |
| [15] |
Baeverfjord G, Prabhu P A J, Fjelldal P G, et al. Mineral nutrition and bone health in salmonids[J]. Reviews in Aquaculture, 2019, 11(3): 740-765. DOI:10.1111/raq.12255 (  0) 0) |
| [16] |
中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中多元素的测定: GB5009.268—2016[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China, China Food and Drug Administration. National food safety standard Determination of multi-elements in foods: GB5009.268—2016[S]. Beijing: China Standards Press, 2016. (  0) 0) |
| [17] |
董双林, 董云伟, 黄六一, 等. 迈向远海的中国水产养殖: 机遇、挑战和发展策略[J/OL]. 水产学报, (2022-10-10). https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C45S0n9fL2suRa-dTyEVl2pW9UrhTDCdPD67GiICSQCPb6l5o3KkYI5iM8Xp353w-Oedz0CMFZGyPPp9QQ4lroaOwx&uniplatform=NZKPT. Dong S L, Dong Y W, Huang L Y, et al. Toward offshore aquaculture in China: Opportunities, challenges and development strategies[J]. Journal of Fisheries of China, (2022-10-10). https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C45S0-n9fL2suRadTyEVl2pW9UrhTDCdPD67GiICSQCPb6l5o3KkYI5i-M8Xp353wOedz0CMFZGyPPp9QQ4lroaOwx&uniplatform=NZKPT. (  0) 0) |
| [18] |
Naylor R L, Hardy R W, Buschmann A H, et al. A 20-year retrospective review of global aquaculture[J]. Nature, 2021, 591: 551-555. DOI:10.1038/s41586-021-03308-6 (  0) 0) |
| [19] |
董双林. 黄海冷水团大型鲑科鱼类养殖研究进展与展望[J]. 中国海洋大学学报(自然科学版), 2019, 49(3): 4-9. Dong S L. Researching progresses and prospects in large salmonidae farming in Cold Water Mass of Yellow Sea[J]. Periodical of Ocean University of China, 2019, 49(3): 4-9. DOI:10.16441/j.cnki.hdxb.20180303 (  0) 0) |
| [20] |
Yu J F, Dong S L, Zhou Y G, et al. Effects of different types of air supplementation on rainbow trout confined underwater[J]. Aquacultural Engineering, 2022, 96: 102214. DOI:10.1016/j.aquaeng.2021.102214 (  0) 0) |
| [21] |
Yu J F, Zhou Y G, Guo Y K, et al. Effects of air replenishers on the growth and body morphology of four fish species in an underwater aquaculture system[J]. Aquaculture, 2022, 559: 738377. DOI:10.1016/j.aquaculture.2022.738377 (  0) 0) |
| [22] |
Lall S P, Kaushik S J. Nutrition and metabolism of minerals in fish[J]. Animals, 2021, 11(9): 41. (  0) 0) |
| [23] |
Sugiura S H, Dong F M, Hardy R W. Primary responses of rainbow trout to dietary phosphorus concentrations[J]. Aquaculture Nutrition, 2000, 6: 235-245. DOI:10.1046/j.1365-2095.2000.00142.x (  0) 0) |
| [24] |
Davesne D, Meunier F J, Schmitt A D, et al. The phylogenetic origin and evolution of acellular bone in teleost fishes: Insights into osteocyte function in bone metabolism[J]. Biological Reviews, 2019, 94(4): 1338-1363. (  0) 0) |
| [25] |
Roy P K, Lall S P. Dietary phosphorus requirement of juvenile haddock (Melanogrammus aeglefinus L.)[J]. Aquaculture, 2003, 221: 451-468. DOI:10.1016/S0044-8486(03)00065-6 (  0) 0) |
| [26] |
Danos N, Staab K L. Can mechanical forces be responsible for novel bone development and evolution in fishes?[J]. Journal of App-lied Ichthyology, 2010, 26(2): 156-161. (  0) 0) |
| [27] |
Wittkowske C. The Role of Mechanical Forces in Bone Formation: Evaluation of Long-Term Responses by Osteoblasts to Low Fluid Shear Stress in vitro[D]. Sheffield: University of Sheffield, 2017.
(  0) 0) |
2. College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China
 2023, Vol. 53
2023, Vol. 53


