2. 山东省海洋环境地质工程重点实验室,中国海洋大学环境科学与工程学院,山东 青岛 266100
地下水硝酸盐污染已成为国际上普遍关注的、最严重的环境地质问题之一。自1960年代以来,硝酸盐成为许多国家如美国、英国、德国等地表水和地下水中常见的污染物[1-2]。赵同科[3]等的调查表明,我国北方环渤海七省(市)地下水中硝态氮平均含量达到11.9 mg·L-1,约34.1%的地下水硝态氮超标,蔬菜大棚种植区尤为严重[4]。硝酸盐在人体内可转化为亚硝酸盐,导致人体出现高铁血红蛋白病或其它疾病[5-6]。因此,世界卫生组织(WHO)和一些国家制定了相应的饮用水标准,限制硝态氮的最大浓度(以N计)为10~11.3 mg·L-1;我国的饮用水标准规定,硝态氮的最大允许浓度(以N计)为10 mg·L-1,农村小型集中式供水和分散式供水规定为20 mg·L-1。
不少学者研究发现[7-8],纳米铁铜材料因具有较大的比表面积和较高的催化还原反应活性,对硝酸盐有较好的去除效果。Liou[9]等对比研究了纳米铁和不同负载率的纳米铁铜颗粒对硝酸盐的去除,发现当纳米铁铜负载率为5%时,对硝酸盐的去除效果最好。康海彦[10]等用Cu,Pd,Ni三种金属负载的纳米铁(负载率均为5%)去除硝酸盐,发现纳米铁铜比纳米铁钯和纳米铁镍的反应活性要高的多。
但是,纳米材料在修复地下水中硝酸盐的实际工程应用中,受地下水中多种共存阴离子的影响(阳离子影响作用较小),其影响机制仍不清楚[11]。关于共存阴离子对纳米材料还原污染物是抑制还是促进这一问题,说法不一[12-13]。有部分学者认为,这些无机阴离子可以加速铁的溶解,并能够除去铁表面钝化的氧化铁层,从而促进污染物的还原;也有部分学者认为,这些离子可以形成铁的沉淀物,减少了铁表面的反应位点,抑制了污染物的还原。比如唐次来[12]在分析共存离子对纳米铁去除硝酸盐的影响过程中,认为除PO43-抑制纳米铁对硝酸盐的去除外,Cl-,SO42-,HCO3-以及C2O42-,C6H5O73-和CH3COO-等离子都可不同程度的起到促进作用,然而,Kang[14]在分析纳米铁镍对硝酸盐的还原过程中指出,HCO3-、SO42-、Cl-等离子在不同程度上抑制了纳米铁镍对硝酸盐的还原。由此可见,共存阴离子对纳米材料活性的影响,是工程实际应用中不容忽视的难点。目前,关于共存离子对纳米铁铜去除硝酸盐的影响机制仍不清楚,为了使纳米铁铜能更好的应用于实际工程中,非常有必要探究共存离子对其去除硝酸盐的影响。
本文采用液相还原法制备了纳米级铁铜金属复合材料,利用透射电子显微镜(TEM)对合成的纳米材料颗粒形态进行了表征,并考察了地下水中常见的几种无机阴离子(Cl-,SO42-,HCO3-和PO43-)对纳米铁铜去除硝酸盐的影响机制,旨在为纳米铁铜原位修复地下水中的硝酸盐污染提供科学依据。
1 材料与方法 1.1 实验材料七水合硫酸亚铁(FeSO4·7H2O),硼氢化钠(NaHB4),聚乙烯吡咯烷酮(PVP-K30),无水乙醇,六水合氯化铜(CuCl2·6H2O),氮气(99.999%),KNO3(优级纯),NaCl,K2SO4,NaHCO3,Na3PO4·12H2O。以上试剂均为分析纯,实验用水为去离子水。
1.2 实验方法纳米铁铜(5%)的制备:配置0.036 mol·L-1 FeSO4溶液50 mL(V水/V乙醇=4:1),加入0.5 g聚乙烯吡咯烷酮PVP- K30,在氮气保护和机械搅拌的条件下,缓慢注入50 mL NaHB4(0.107 mol·L-1)溶液,反应5 min,用0.22 μm滤膜真空抽滤,制得颗粒纳米铁,溶于无氧水中,超声得到纳米铁悬浊液,在氮气保护和机械搅拌条件下缓慢注入0.2 g·L-1CuCl2溶液,反应4 min,再次真空抽滤,并溶于无氧水中,超声制得纳米铁铜悬浊液。
纳米铁铜还原硝酸盐:分别将含有一定浓度阴离子的硝酸盐溶液,与纳米铁铜悬浊液混合后,立即封闭,放入恒温振荡器中,在温度为(20±1)℃,转速为220 r·min-1条件下振荡,定时取样,测定pH值、硝态氮、氨氮和亚硝态氮含量。实验中所有样品的采集和分析均在室温下完成,每组实验均进行了平行实验。
1.3 分析方法纳米铁铜颗粒的形态用JEM-1200EX型透射电子显微镜(TEM)表征,再通过粒径计算软件分析纳米颗粒的平均粒径;溶液pH用PHS-3C型精密pH计(雷磁)测定,硝态氮用紫外法在220和275 nm波长处同时测定,氨氮用纳氏试剂比色法在420 nm波长下测定;亚硝态氮用N-(1萘基)乙二胺比色法在540 nm波长下测定。
纳米铁铜对硝酸盐的去除率可按照公式(1)进行计算:
| $ \eta = \left( {{\rho _0} - {\rho _t}} \right)/{\rho _0} \times 100\% 。$ | (1) |
其中:η为硝酸盐的去除率,%;ρ0为溶液中硝酸盐的初始质量浓度,mg·L-1;ρt为反应t min后溶液中的硝酸盐质量浓度,mg·L-1。
2 结果与分析 2.1 纳米铁铜复合材料的表征新鲜制备的纳米铁、纳米铁铜复合材料的透射电镜如图 1所示。纳米颗粒粒径通过软件Nano Measurer 1.2对多幅TEM照片中纳米颗粒的粒径统计分析得到。纳米铁颗粒表面光滑,平均粒径约45 nm,且颗粒间呈链状聚集(见图 1a),这是纳米零价铁颗粒具有磁性的缘故[15];相比之下,纳米铁铜颗粒表面粗糙,出现很多小颗粒(见图 1b),这是纳米铜负载在纳米铁表面的缘故,其平均粒径约35 nm,在纳米颗粒表面有一个约3 nm厚的灰色包覆层,这是由分散剂PVP-K30形成的有机膜层,该膜可在一定程度上增强纳米颗粒的稳定性[16]。
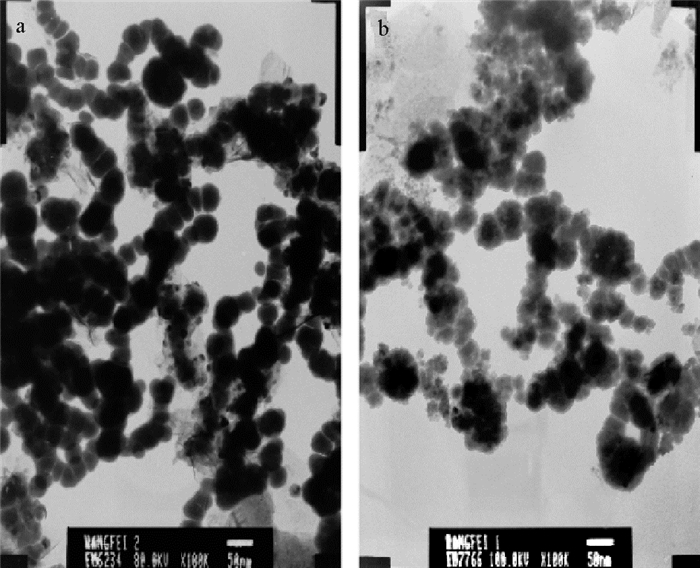
|
(a, 纳米铁×100 000倍;b, 纳米铁铜×100 000倍;a, nano-iron ×100 000 times; b, nano-Fe/Cu ×100 000 times.) 图 1 纳米铁和纳米铁铜复合材料的透射电镜图 Fig. 1 TEM of nano-iron and nano-Fe/Cu |
使用新鲜制备的纳米铁铜,分别与不同浓度的硝酸盐溶液(40,50,60,80,150 mg·L-1)进行反应。实验中纳米铁铜双金属复合材料,投加浓度为500 mg·L-1(以铁的质量计,质量误差约4%),初始溶液pH为7.0,反应过程中未对溶液pH进行调节和控制[10]。
从图 2可以看出,纳米铁铜对硝酸盐的去除率随着硝酸盐初始浓度的增加而逐渐减低。当硝酸盐初始浓度分别为40,50,60 mg·L-1时,反应进行30 min后,硝酸盐的去除率即可达到98%以上,而初始浓度为80和150 mg·L-1时,反应30 min后去除率仅为84%,58%,反应进行到60 min时,初始浓度为80 mg·L-1的硝酸盐去除率可达到94%,而150 mg·L-1硝酸盐的去除率仅达到66%,这是因为当纳米铁铜投加量一定时,随着硝酸盐浓度的增加,体系中存在的纳米铁铜量不足以将较高浓度的硝酸盐完全去除,导致去除率降低。
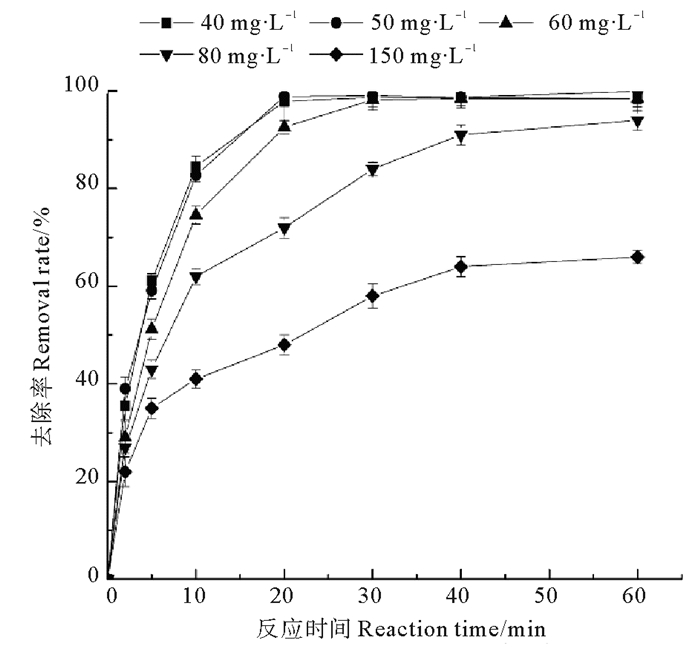
|
图 2 纳米铁铜对不同初始浓度硝酸盐的去除率曲线图 Fig. 2 Curves of nano-Fe/Cu on nitrate removal rate under different initial concentrations |
纳米铁铜与不同浓度硝酸盐反应过程中,硝态氮、亚硝态氮、氨氮和总氮(硝态氮、亚硝态氮的氨氮之和)的变化曲线如图 3所示,C/C0为溶液中t时刻硝态氮、亚硝态氮、氨氮、总氮浓度与初始硝态氮浓度的比值。当初始硝态氮浓度为40 mg·L-1时,产物主要为氨氮,亚硝态氮作为中间产物,最终全部被还原为氨氮;当硝态氮浓度为50和60 mg·L-1时,产物主要为氨氮和亚硝态氮,仅有部分亚硝态氮转化为氨氮;当硝态氮浓度为80和150 mg·L-1时,产物中亚硝态氮的含量高于氨氮的含量,且硝酸盐的含量也较高。当硝酸盐浓度较低时,总氮的含量均低于理论值,这是因为硝酸盐的还原有电子参与,使得反应后溶液pH为10左右,碱性条件下有部分氨气或其它气体生成,以及铁腐蚀产物的吸附作用使得总氮含量略有降低[12]。由于反应中没有加入缓冲剂,体系pH值会逐渐增加到9~10。康海彦等的研究表明,调节溶液初始pH值而未对反应体系酸度的变化进行控制,这种作用仅在反应初期有明显效果;随着反应的进行,初始pH不同带来的影响与纳米铁相比要小的多,所以实验过程中无需进行pH调节[10]。由图 3可知,亚硝态氮是还原过程的中间产物,最终产物氨氮、亚硝态氮的量受硝酸盐初始浓度影响较大。当初始硝酸盐浓度较小,即纳米铁铜投加量充足情况下(见图 3C~E),硝酸盐的还原产物主要是氨氮;当初始硝酸盐浓度较大,即纳米铁铜投加量不足时(见图 3A、B),硝酸盐的还原产物中亚硝态氮的含量高于氨氮。总之,纳米铁铜足量时,硝酸盐被彻底还原,产物只有氨氮;纳米铁铜不足时,硝酸盐不能被全部还原,产物为氨氮和亚硝态氮。
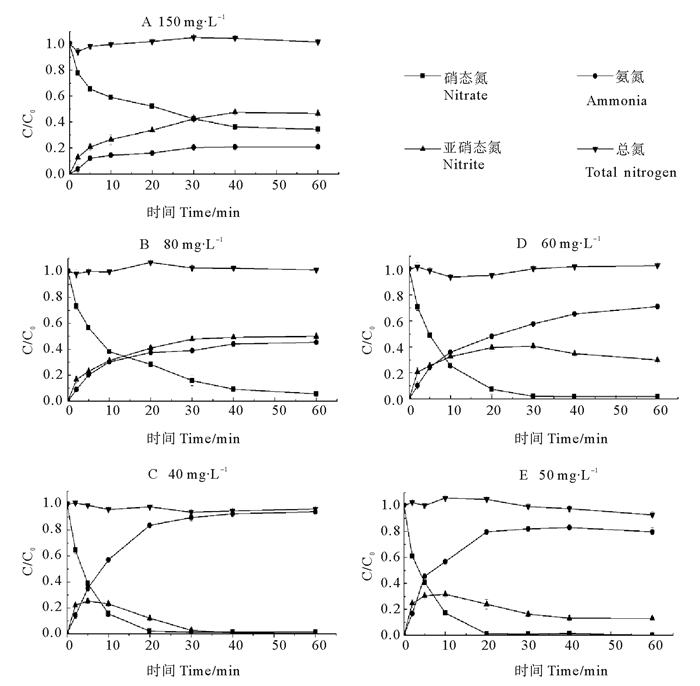
|
图 3 纳米铁铜足量与不足量时,硝态氮、亚硝态氮、氨氮和总氮的浓度变化曲线图 Fig. 3 Concentrationscurves of nitrate, nitrite and ammonia, and total nitrogen whennano-Fe/Cu is sufficient or insufficient |
图 4所示为初始硝态氮浓度为40 mg·L-1,不同浓度的SO42-,Cl-,HCO3-和PO43-对纳米铁铜去除硝酸盐的影响。初始状态,添加500 mg·L-1纳米铁铜,硝酸盐的去除率可达到100%。当分别投加不同浓度的SO42-,Cl-,HCO3-和PO43-后,由图 4可以看出,PO43-对硝酸盐的抑制作用最强,HCO3-和SO42-次之,Cl-对硝酸盐去除率的影响不明显。
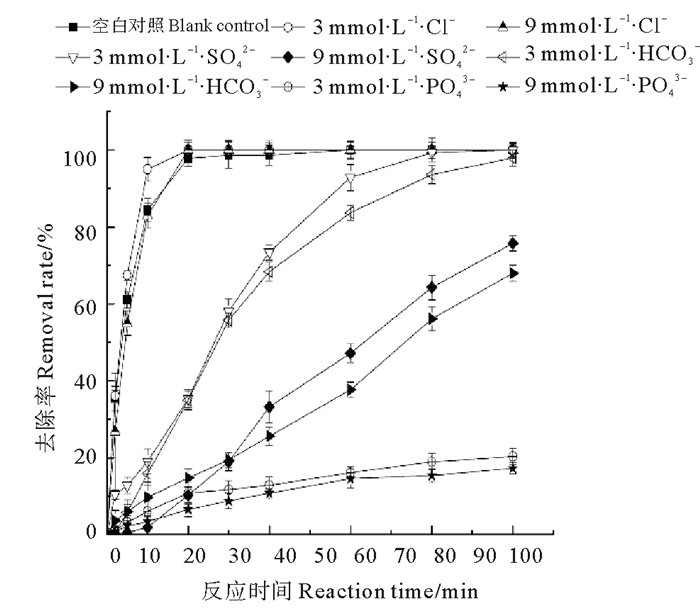
|
图 4 不同浓度无机阴离子对硝酸盐去除率的影响 Fig. 4 Effect of inorganic anions on nitrate removal rateunder different initial concentrations |
当加入3和9 mmol·L-1PO43-,反应进行60 min时,纳米铁铜对硝酸盐的去除率由100%分别降至16%和15%,对硝酸盐的抑制作用最强,且抑制作用随着离子浓度的增大而增强。同样地,分别加入3 mmol·L-1HCO3-、SO42-溶液,反应60 min后,硝酸盐的去除率也由100%分别降至84%、93%,抑制了硝酸盐的去除。这与Hwang[17]以及Kim等[18]利用纳米铁去除硝酸盐时的研究结果一致。
2.4 无机阴离子对催化还原反应产物的影响图 5所示为无机阴离子对催化还原产物亚硝态氮的影响。当初始硝态氮浓度为40 mg·L-1,添加500 mg·L-1纳米铁铜时,大约10 min后亚硝态氮的浓度达到最高值10 mg·L-1,然后其浓度迅速降低,40 min后溶液中的亚硝态氮消失,全部转化为氨氮。当加入3和9 mmol·L-1的Cl-后,亚硝态氮的峰值浓度有所降低,且体系中最终亚硝态氮的含量可降为0;当加入3和9 mmol·L-1的SO42-后,受离子的抑制作用,亚硝态氮浓度的最大值有所降低,100 min后,体系中的亚硝酸盐并不能完全被还原为氨氮,仍存在少量的亚硝酸盐;当加入3和9 mmol·L-1的HCO3-后,达到亚硝态氮浓度最大值的时间明显增加,100 min后,体系中存在大量的亚硝酸盐;当加入3和9 mmol·L-1的PO43-后,明显抑制了硝酸盐还原为亚硝酸盐的过程,且抑制作用随着浓度的增加而增强。
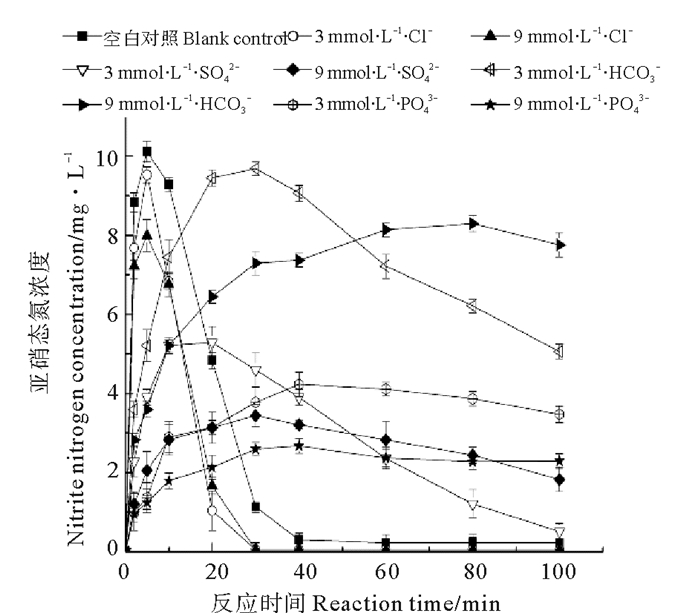
|
图 5 无机阴离子对催化还原产物亚硝态氮的影响 Fig. 5 Effect of inorganic anions on nitrite nitrogen of catalytic reduction products |
图 6所示为无机阴离子对催化还原产物氨氮的影响。当初始硝态氮浓度为40 mg·L-1,添加500 mg·L-1纳米铁铜,大约40 min后氨氮的含量达到最大值36 mg·L-1,而后趋于稳定。当加入3和9 mmol·L-1的Cl-后,最终生成的氨氮浓度接近空白实验生成的氨氮量,反应进行100 min时,生成的氨氮浓度分别为37和35 mg·L-1,对氨氮的生成量影响不明显;当分别加入SO42-、HCO3-后,氨氮的生成速率明显降低;当加入3和9 mmol·L-1的PO43-,30min后才有少量的氨氮生成,100 min时,加入9 mmol·L-1的PO43-中,生成氨氮的浓度仅有3 mg·L-1,抑制作用较强。
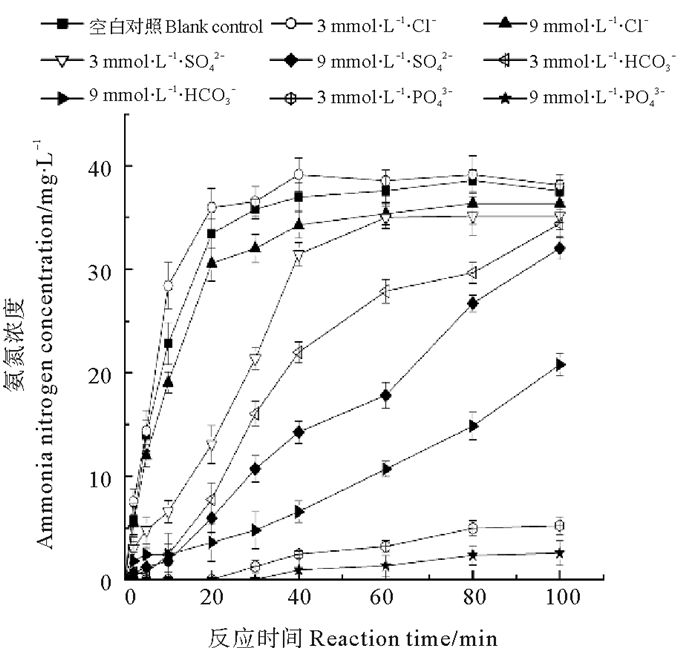
|
图 6 无机阴离子对催化还原产物氨氮的影响 Fig. 6 Effect of inorganic anions on ammonia nitrogen of catalytic reduction products |
不同浓度阴离子影响下纳米铁铜对硝酸盐的去除过程,分别用伪一级动力学方程[19](式2)和伪二级动力学方程(式3)[20-21]进行拟合。
| $ \ln C - \ln {C_0} = - {K_1}t。$ | (2) |
| $ \frac{t}{{{q_t}}} = \frac{1}{{{K_2}q_e^2}} + \frac{t}{{{q_e}}}。$ | (3) |
其中:C为t时刻溶液中硝酸盐的浓度(mg·L-1);C0为溶液中硝酸盐的初始浓度(mg·L-1);qe和qt分别是在平衡时和在t时间(min)纳米铁铜对硝酸盐的去除量(mg·g-1),K1(min-1)、K2(g·mg-1·min-1)分别是伪一级、伪二级反应动力学的反应速率常数;K1可以由ln(C/C0)对时间t的曲线斜率得到;K2可以由t/qt对时间t的曲线计算得到。
反应动力学模型拟合结果如表 1所示。在不同阴离子的影响下,伪一级反应动力学模拟曲线相关系数的平方(R2)在0.91~0.99之间,伪二级反应动力学模拟曲线的R2在0.21~0.86之间,由此可知,纳米铁铜对硝酸盐的去除过程基本符合伪一级动力学方程。当溶液中加入Cl-后,硝酸盐的反应速率常数变化不大,然而,当加入SO42-、HCO3-、PO43-等离子后,硝酸盐的反应速率均有明显的降低,说明这些离子抑制了硝酸盐的还原,且抑制程度随离子浓度增大而增强。
|
|
表 1 不同阴离子影响下纳米铁铜对硝酸盐还原的动力学模型 Table 1 Kinetic analysis of nitrate reduction by nano-Fe/Cu as affected by different anions |
Hosseini等[22]建立了纳米铁铜还原硝酸盐的概念模型,指出负载的金属铜可以使电子更好的从铁颗粒表面转移,以达到去除NO3-的目的。溶液中的NO3-转移到铜和水界面的边界层后,吸附在金属铜上,得到来自Fe0和H+的电子,还原为NH4+和NO2-。当加入无机阴离子后,除低浓度的Cl-外,PO43-、SO42-和HCO3-均不同程度地抑制了硝酸盐的还原。
PO43-的吸附作用很强,能够与铁的氧化物形成共沉淀,占据铁表面的活性点位,影响铁腐蚀的持续进行,从而抑制污染物的去除。实验过程中测得反应体系最后的pH为10左右,当溶液pH>4时,PO43-能够与铁腐蚀离子形成双核配合物,并通过架桥作用链接表面官能团,也会明显抑制铁的腐蚀,从而抑制硝酸盐的还原过程[23-24]。
Sugomoto[25]等认为,当SO42-浓度大于50 mg·L-1时,可以形成硫酸铁沉淀以及铁的氢氧化物沉淀,这些沉淀也可以抑制还原反应的进行,且SO42-具有电动附着力[26],可以吸附在纳米材料表面,使活性点位的数量减少,降低纳米铁铜与NO3-接触的可能,从而抑制还原反应的进行。
研究表明[24],HCO3-对污染物去除的影响与HCO3-浓度大小有关,低浓度的HCO3-最高可以除去93.6%的硝基苯,然而当HCO3-的浓度大于50 mg·L-1时,去除率随浓度增大而逐渐降低,这是因为当HCO3-浓度较低时,由H2CO3/ HCO3-组成的缓冲体系可以加速铁的腐蚀,促进反应进行[27];当HCO3-浓度较高时,会在纳米材料的表面生成菱铁矿[28],形成一层绝缘体,降低了离子间的电子转移,抑制了反应的进行。
当溶液中加入Cl-后,对硝酸盐的去除影响比较复杂。一方面,Cl-可以促进铁的局部腐蚀,在铁表面形成不规则的点坑,增大了纳米材料的表面积,提供更多的活性位点与NO3-反应;另一方面,Cl-能与NO3-竞争活性点位,增大了亥姆霍兹层与扩散层上未转化的硝酸盐和氯化物之间的斥力,抑制了NO3-的吸附[17],不利于还原反应的进行,实验结果显示Cl-对硝酸盐去除率的影响不明显。
纳米铁铜还原硝酸盐的过程是分步进行的,亚硝态氮为中间产物,最终还原为氨氮。这是因为NO3-还原为NO2-的活化能低于NO2-还原为NH4+的活化能[12],所以在反应前期,NO2-的反应速率低于它的生成速率,在反应前期有所积累。此外Prüsse[23]等指出,在金属铜表面,NO3-主要还原为NO2-。由于NO2-在双金属表面弱的吸附性,部分NO2-解吸到溶液中,只有重新吸附到铁表面时,NO2-才会被还原为NH4+。当溶液中加入不同阴离子后,促进或抑制了硝酸盐的还原过程,使得最终体系中氨氮和亚硝态氮的含量不同。
4 结论(1) 纳米铁铜足量时,硝酸盐被彻底还原,产物只有氨氮;纳米铁铜不足时,硝酸盐不能被全部还原,产物为氨氮和亚硝酸盐。纳米铁铜对硝酸盐的反应表现出伪一级反应动力学的特性。
(2) 硝酸盐的去除过程是分步进行,亚硝态氮为中间产物,最终被还原为氨氮。最终产物氨氮、亚硝态氮的量明显受硝酸盐的初始浓度、阴离子的种类及浓度影响。
(3) Cl-对纳米铁铜去除硝酸盐的影响不明显,而SO42-,HCO3-,PO43-等离子都不同程度地抑制了硝酸盐的还原,且抑制作用大小随着阴离子浓度的增加而增强。
(4) PO43-对硝酸盐的抑制作用最强,当PO43-浓度为3 mmoL·L-1时,纳米铁铜对硝酸盐的去除率仅有10%;HCO3-和SO42-对硝酸盐的抑制作用次之。
| [1] |
Ellis R A, Jacob D J, Payer M, et al. Present and future nitrogen deposition to national parks in the United States: Critical load exceedances[J]. Atmospheric Chemistry & Physics Discussions, 2013, 13(17): 9083-9095.
(  0) 0) |
| [2] |
Hamlin H J, Edwards T M, Mccoy J, et al. Environmentally relevant concentrations of nitrate increase plasma testosterone concentrations in female American alligators (Alligator mississippiensis)[J]. General and Comparative Endocrinology, 2016, 238: 55-60. DOI:10.1016/j.ygcen.2016.04.023
(  0) 0) |
| [3] |
赵同科, 张成军, 杜连凤, 等. 环渤海七省(市)地下水硝酸盐含量调查[J]. 农业环境科学学报, 2007, 26(2): 779-783. Zhao T X, Zhang C J, Du L F, et al. Investigation on nitrate noncentration in groundwater in seven provinces (city) surrounding the Bo-Hai sea[J]. Journal of Agro-Environment Science, 2007, 26(2): 779-783. DOI:10.3321/j.issn:1672-2043.2007.02.072 (  0) 0) |
| [4] |
马洪斌, 李晓欣, 胡春胜. 中国地下水硝态氮污染现状研究[J]. 土壤通报, 2012, 43(6): 1532-1536. Ma H B, Li X X, Hu C S. Status of nitrate nitrogen contamination of groundwater in China[J]. Chinese Journal of Soil Science, 2012, 43(6): 1532-1536. (  0) 0) |
| [5] |
李发东, 冷佩芳, 张秋英, 等. 地表水硝酸盐污染影响因素的研究进展[J]. 石河子大学学报(自科版), 2017, 35(1): 1-11. Li F D, Leng P F, Zhang Q Y, et al. A review on the influence factors of nitrate pollution in surface-water[J]. Journal of Shihezi University: Natural Science, 2017, 35(1): 1-11. (  0) 0) |
| [6] |
Sevda S, Sreekishnan T R, Pous N, et al. Bioelectroremediation of perchlorate and nitrate contaminated water: A review[J]. Bioresour Technology, 2018, 255: 331-339. DOI:10.1016/j.biortech.2018.02.005
(  0) 0) |
| [7] |
Shi J, Chao L, Li A. Selective reduction of nitrate into nitrogen using Fe-Pd bimetallic nanoparticle supported on chelating resin at near-neutral pH[J]. Chemical Engineering Journal, 2016, 286: 408-415. DOI:10.1016/j.cej.2015.10.054
(  0) 0) |
| [8] |
Su Y, Adeleye A S, Zhou X, et al. Effects of nitrate on the treatment of lead contaminated groundwater by nanoscale zerovalent iron[J]. Journal of Hazardous Materials, 2014, 280: 504-513. DOI:10.1016/j.jhazmat.2014.08.040
(  0) 0) |
| [9] |
Liou Y H, Lo S L, Lin C J, et al. Chemical reduction of an unbuffered nitrate solution using catalyzed and uncatalyzed nanoscale iron particles[J]. Journal of Hazardous Materials, 2005, 127(1-3): 102. DOI:10.1016/j.jhazmat.2005.06.029
(  0) 0) |
| [10] |
康海彦.纳米铁系金属复合材料去除地下水中硝酸盐污染的研究[D].天津: 南开大学, 2007. Kang H Y. Removal of Nitrate Pollution in Groundwater by Nanometer Iron-Based Metal Composites[D]. Tianjin: Nankai University, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10055-2007211290.htm (  0) 0) |
| [11] |
Tang C, Zhang Z, Sun X. Effect of common ions on nitrate removal by zero-valent iron from alkaline soil[J]. Journal of Hazardous Materials, 2012, 231-232: 114-119. DOI:10.1016/j.jhazmat.2012.06.042
(  0) 0) |
| [12] |
唐次来, 张增强, 李荣华. 不同阴离子对FeO还原硝酸盐的影响[J]. 环境科学学报, 2009, 29(4): 732-739. Tang C L, Zhang Z Q, Li R H. Effectofanionsonnitratereductionbyzero-valentiron[J]. Acta Scientiae Circumstantiae, 2009, 29(4): 732-739. DOI:10.3321/j.issn:0253-2468.2009.04.009 (  0) 0) |
| [13] |
Su Y F, Hsu C Y, Shih Y H. Effects of various ions on the dechlorination kinetics of hexachlorobenzene by nanoscale zero-valent iron[J]. Chemosphere, 2012, 88(11): 1346-1352. DOI:10.1016/j.chemosphere.2012.05.036
(  0) 0) |
| [14] |
Kang H, Xiu Z, Chen J, et al. Reduction of nitrate by bimetallic Fe/Ni nanoparticles[J]. Environmental Technology, 2012, 33(16-18): 2185-2192.
(  0) 0) |
| [15] |
庞龙, 周庆祥, 苏现伐. 纳米零价铁修饰技术研究进展[J]. 化工进展, 2011, 30(6): 1361-1368. Pang L, Zhou Q X, Su X D. Progress of in-situ modification techniques of nanoscale zero-valent iron[J]. Chemical Industry and Engineering Progress, 2011, 30(6): 1361-1368. (  0) 0) |
| [16] |
王雪, 丁庆伟, 刘宏芳, 等. 不同分散剂作用下制备纳米铁及表征[J]. 太原科技大学学报, 2010, 31(5): 432-435. Wang X, Ding Q W, Liu H F, et al. Preparationandcharacterizationof nanometer iron particles under different dispersing agents[J]. Journal of Taiyuan University of Science and Technology, 2010, 31(5): 432-435. DOI:10.3969/j.issn.1673-2057.2010.05.020 (  0) 0) |
| [17] |
Hwang Y, Kim D, Shin HS. Inhibition of nitrate reduction by NaCl adsorption on a nano-zero-valent iron surface during a concentrate treatment for water reuse[J]. Environmental Technology, 2015, 36(9): 1178-1187. DOI:10.1080/09593330.2014.982723
(  0) 0) |
| [18] |
Kim H S, Ahn J Y, Kim C, et al. Effect of anions and humic acid on the performance of nanoscale zero-valent iron particles coated with polyacrylic acid[J]. Chemosphere, 2014, 113: 93-100. DOI:10.1016/j.chemosphere.2014.04.047
(  0) 0) |
| [19] |
Luo F, Chen Z L, Megharaj M, et al. Simultaneous removal of trichloroethylene and hexavalent chromium by green synthesized agarose-Fe nanoparticles hydrogel[J]. Chemical Engineering Journal, 2016, 294: 290-297. DOI:10.1016/j.cej.2016.03.005
(  0) 0) |
| [20] |
Wang T, Lin J, Chen Z, et al. Green synthesized iron nanoparticles by green tea and eucalyptus leaves extracts used for removal of nitrate in aqueous solution[J]. Journal of Cleaner Production, 2014, 83(83): 413-419.
(  0) 0) |
| [21] |
郭兵毅, 刘桂梅, 曾玉彬, 等. 磁性石墨烯负载纳米铁铜去除硝态氮动力学研究[J]. 水处理技术, 2017(7): 38-43. Guo B Y, Liu G M, Zeng Y B, et al. Study on forward osmosis performance of quaternary ammonium salt of chitosan as a draw solution[J]. Technology of Water Treatment, 2017(7): 38-43. (  0) 0) |
| [22] |
Hosseini S M, Ataie-Ashtiani B, Kholghi M. Nitrate reduction by nano-Fe/Cu particles in packed column[J]. Desalination, 2011, 276(1-3): 214-221. DOI:10.1016/j.desal.2011.03.051
(  0) 0) |
| [23] |
Prüsse U, Vorlop K D. Supported bimetallic palladium catalysts for water-phase nitrate reduction[J]. Journal of Molecular Catalysis A Chemical, 2001, 173(1-2): 313-328. DOI:10.1016/S1381-1169(01)00156-X
(  0) 0) |
| [24] |
Yin WZ, Wu JH, Li P, et al. Experimental study of zero-valent iron induced nitrobenzene reduction in groundwater: The effects of pH, iron dosage, oxygen and common dissolved anions[J]. Chemical Engineering Journal, 2012, 184(3): 198-204.
(  0) 0) |
| [25] |
Sugimoto T, Wang Y. Mechanism of the Shape and Structure Control of Monodispersed alpha-Fe2O3 Particles by Sulfate Ions[J]. Journal of Colloid and Interface Science, 1998, 207(1): 137-149. DOI:10.1006/jcis.1998.5741
(  0) 0) |
| [26] |
Jing F, Guo Y, Wang J, et al. Rapid decolorization of azo dye methyl orange in aqueous solution by nanoscale zerovalent iron particles[J]. Journal of Hazardous Materials, 2009, 166(2-3): 904. DOI:10.1016/j.jhazmat.2008.11.091
(  0) 0) |
| [27] |
Liu T, Rao P, Mak M S, et al. Removal of co-present chromate and arsenate by zero-valent iron in groundwater with humic acid and bicarbonate[J]. Water Research, 2009, 43(9): 2540-2548. DOI:10.1016/j.watres.2009.03.005
(  0) 0) |
| [28] |
Carlos L, Fabbri D, Capparelli A L, et al. Intermediate distributions and primary yields of phenolic products in nitrobenzene degradation by Fenton's reagent[J]. Chemosphere, 2008, 72(6): 952-958. DOI:10.1016/j.chemosphere.2008.03.042
(  0) 0) |
2. Shandong Provincial Key Laboratory of Marine Environment and Geological Engineering, College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China
 2018, Vol. 48
2018, Vol. 48

