2. 青岛海洋科学与技术试点国家实验室,海洋生态与环境科学功能实验室,山东 青岛 266071
近岸海域铜污染问题由来已久。例如中国南海北部湾、珠江三角洲南岸的澳门近岸水域及天津汉沽养殖区的海水中Cu2+浓度最高分别达到了31.70、37.40和17.22 μg·L-1[1-3],均超过了文献[4]10 μg·L-1的水平,甚至某些水域接近第三类标准50 μg·L-1。而靠近工业区且水产养殖区密集的印度尼西亚雅加达湾海水中Cu2+浓度竟高达380~744 μg·L-1 [5]。重金属具有难降解和生物蓄积性,能够通过食物链放大在不同营养级生物体内富集作用[6]。重金属在海洋生物体内过量累积会引发氧化应激、炎症反应、DNA损伤和细胞凋亡等毒性效应,抑制海洋生物的生长和繁殖,影响种群动态和生态系统稳定性[7]。
海洋浮游动物轮虫具有繁殖快、数量巨大、体内脂质储备丰富等特点,是自然海域和水产养殖环境经济鱼类、贝类等重要的活饵[8],其种群动态变化控制着海洋生态系统初级生产力的节律和规模,直接或间接地影响着生态系统的结构和功能稳定性[9-10]。因此,研究重金属污染物对轮虫的多世代毒性和代际效应有助于理解其对轮虫长期的种群动态的影响。已有文献研究报道了有机污染物对轮虫的多世代毒性效应。有机农药乐果对亲代到子2代萼花臂尾轮虫(Brachionus calyciflorus)种群增长速率的抑制效应随暴露世代增加而增强[11];4-壬基酚对两种轮虫Plationus patulus和Brachionus havanaensis的子1代总繁殖率和净生殖率的抑制作用大于亲代[12];抗癌药物阿霉素对萼花臂尾轮虫(B. calyciflorus)种群增长速率的抑制作用随世代增加而增强,子2代种群生存能力丧失[13]。以上研究表明,有机农药乐果、4-壬基酚和药物阿霉素均对轮虫产生世代毒性和代际效应。这表明仅仅研究污染物对轮虫单一世代的毒性效应可能低估其生态风险。作为近岸海域主要污染物的重金属具有不可降解性和生物蓄积性的特点,使其可能从轮虫母体转移至后代,产生多世代毒性和代际效应,从而影响轮虫的种群稳定性。但目前研究多关注铜对轮虫的单一世代影响[14],很少关注其对轮虫多世代的毒性效应。因此,本研究以褶皱臂尾轮虫(Brachionus plicatilis)为受试对象,通过重金属铜连续多代暴露和净化实验,探讨了铜污染对褶皱臂尾轮虫繁殖能力和生活史特征的影响,以及可能的代际效应,为更客观地评估重金属污染对海洋生态系统次级生产力和食物网结构功能稳定性的影响提供基础数据。
1 材料与方法 1.1 实验生物的培养褶皱臂尾轮虫(B. plicatilis)由青岛农业大学水生生物学课题组提供。轮虫在过滤灭菌的天然海水(盐度约为30)中培养,光照周期为12 h光照∶12 h黑暗,温度为(25±1)℃。每天喂食一次小球藻、盐藻和扁藻的混合浓缩藻液,藻密度约为1×106个·mL-1。暴露实验中所用的轮虫均为0~2 h龄的健康轮虫幼虫。
1.2 Cu2+对轮虫的急性毒性实验优级纯无水CuSO4购买自上海阿拉丁生化科技股份有限公司。使用24孔加盖培养板作为暴露体系,每孔分别加入1 mL不同浓度Cu2+溶液和10只轮虫幼虫,Cu2+浓度分别为0、5、10、40、50、60、70、80、100、150、200、250、300、400和500 μg·L-1,每个处理设置6个平行。参照美国实验材料协会(ASTM)的《臂尾轮虫属急性毒性实验指南》,将轮虫置于(25 ± 1) ℃恒温培养箱中,暴露过程中不喂食[15]。24和48 h后,在体视显微镜(品牌型号:桂光,XTB-01)下计数死亡轮虫的数量。
1.3 Cu2+对轮虫的世代毒性实验使用24孔加盖培养板作为暴露体系。每孔分别加入1 mL 0、5和50 μg·L-1 Cu2+溶液和10只轮虫幼虫作为亲代(F0代),每个处理设置6个平行。F0代产幼后挑取幼虫至对应浓度Cu2+溶液或清洁海水中分别作为子一代(F1代)暴露组和对照组,以相同方式挑取子二代(F2代)和子三代(F3代)幼虫至对应浓度溶液或清洁海水中作为F2和F3代暴露组和对照组。每8 h在体视显微镜下计数每孔中活的轮虫数、轮虫带卵个数和幼虫数,至每代的轮虫成虫全部死亡,计数的同时将各孔的幼虫和掉落的卵移除。每天喂食一次藻液,每天更换50%的培养溶液[16]。
根据实验结果计算各组轮虫的产卵数、孵化成功率、世代时间、寿命、净生殖率、内禀增长率和生殖价等生活史参数。其中:产卵数为每个轮虫在整个生命周期内的总产卵数;孵化成功率为产幼数/产卵数;世代时间为从某世代到下一世代平均所需的时间;寿命为轮虫从出生到死亡的时间;净生殖率是种群在一定条件下经过一个世代后的增殖倍数;内禀增长率是在给定的物理和生物的条件下,具有稳定的年龄组配的种群的最大瞬时增长率(单位:d-1)。世代时间T(单位:d)、净生殖率R0和内禀增长率r的计算公式[17-18]为:
| $ T=\left(\sum x l_x m_x\right) /\left(\sum l_x m_x\right), $ | (1) |
| $ R_0=\sum\left(l_x m_x\right), $ | (2) |
| $ r=\left(\ln R_0\right) / T, l_x=n_x / n_0, m_x=F_x / n_x。$ | (3) |
式中:x为轮虫的存活日龄(单位:d);lx为第x天轮虫的存活率;mx为第x天每个轮虫个体平均产幼数;nx和n0为分别第x天和第0天轮虫的存活数;Fx为第x天的产幼数。
生殖价Vx的计算公式[19]为:
| $ {V_x} = {m_x} + \sum\nolimits_{t = x + 1}^w {\frac{{{l_t}}}{{{l_x}}}} {m_t}。$ | (4) |
式中:x为估计生殖价时轮虫的日龄;t为x龄以后的日龄;w为最后一次生殖的日龄。
1.4 数据分析本文数据借助Excel 2016软件进行作图和统计分析,借助Origin 2021软件进行雷达图的绘制。采用IBM SPSS Statistics 20.0统计分析软件通过单因素方差分析(ANOVA)的最小显著差数法(LSD)对实验数据进行显著性差异分析,P < 0.05被认为数据间具有显著性差异。利用IBM SPSS Statistics 20.0软件probit回归计算Cu对轮虫的半数致死浓度(LC50)。
2 结果 2.1 Cu2+对轮虫的急性毒性图 1为Cu2+暴露24和48 h轮虫的死亡率。暴露24 h(见图 1(a))结果显示,当Cu2+浓度为80 μg·L-1时,轮虫开始出现死亡,Cu2+浓度为400 μg·L-1时轮虫死亡率高达98.33%。Cu2+对轮虫的24 h的LC50为235.1 μg·L-1,95%置信区间是205.3~266.1 μg·L-1。暴露48 h(见图 1(b))结果显示,当Cu2+浓度为100 μg·L-1时轮虫死亡率已高达100%,Cu2+对轮虫的48 h LC50为63.7 μg·L-1,95%置信区间是61.4~66.0 μg·L-1。可见,随着暴露时间的延长,轮虫对Cu2+的耐受性降低。
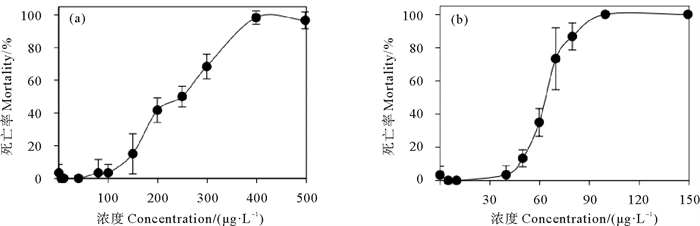
|
图 1 Cu2+暴露24 h(a)和48 h(b)轮虫的死亡率 Fig. 1 Mortality of rotifers exposed to Cu2+ for 24 h (a) and 48 h (b) |
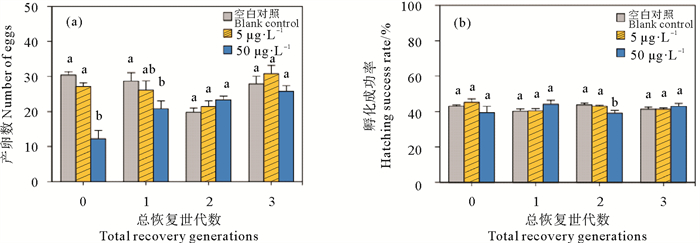
图 2为5和50 μg·L-1多代Cu2+暴露对轮虫繁殖能力的影响。同空白对照组(CK)相比,50 μg·L-1的高浓度组Cu2+显著地降低了各代轮虫的产卵数(P < 0.05)(见图 2(a)),但对各代轮虫卵的孵化成功率无显著影响(P>0.05)(见图 2(b))。这表明Cu2+暴露对轮虫卵的质量无显著影响,而是通过减少轮虫产卵数降低轮虫的繁殖能力。50 μg·L-1 Cu2+暴露后F0~F3代轮虫的产卵数相比于其空白对照组分别降低了40.9%、18.3%、45.0%和59.7%,高浓度Cu2+对F1~F3代轮虫繁殖能力的抑制作用随世代增加而增强,存在显著的代际效应。
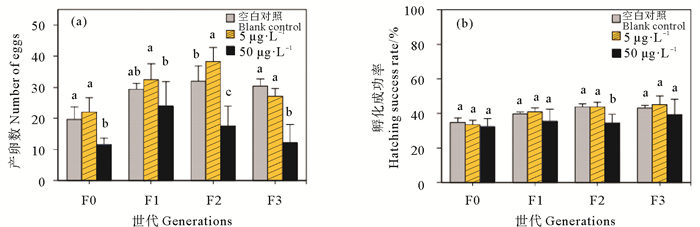
|
(不同字母表示同一世代不同处理组之间存在显著差异(P < 0.05),下同。Different letters represent significant difference among treatment groups for the same generation (P < 0.05), similarly here-inafter.) 图 2 Cu2+多世代暴露对轮虫的产卵数(a)和孵化成功率(b)的影响 Fig. 2 Effects of Cu2+ multigenerational exposure on egg number (a) and hatching success rate (b) of rotifers |
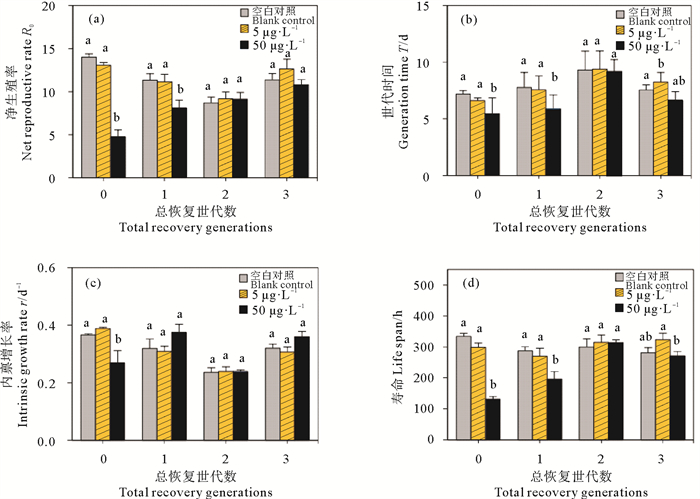
在污染物胁迫下的大多数轮虫生命表参数和种群统计学参数呈现出的变化,可敏感地反映出环境细微变化对种群的影响,是对污染物的重要响应,因此本研究进一步分析了多代Cu2+暴露对轮虫生活史特征的影响。结果表明,连续多世代Cu2+暴露后,同对照组相比,高浓度Cu2+处理组轮虫的净生殖率显著降低(P < 0.05),这与其产卵数降低的结果一致,F0~F3代轮虫的净生殖率相比于其空白对照组分别降低了45.2%、11.3%、49.7%和66.2%(见图 3(a))。连续2代高浓度Cu2+暴露后,F1、F2代轮虫的世代时间显著缩短(P < 0.05)(见图 3(b))。轮虫的内禀增长率反映了生物种群在理想状态下,即食物、空间条件不受限,环境适宜且无天敌存在时种群的最大增长速率,同时也能够反映出种群净生殖率和世代时间之间的关系。本研究结果表明,同对照组相比,F0代轮虫的内禀增长率随着Cu2+暴露浓度增加而显著降低(P < 0.05)(见图 3(c)),这说明Cu2+暴露降低了轮虫种群的繁殖能力。然而暴露至F1代时,高浓度Cu2+处理组轮虫的内禀增长率同对照组相比显著增加(P < 0.05),这同轮虫个体寿命缩短有关(见图 3(d))。综上所述,连续多代Cu2+暴露能够改变轮虫各世代的生活史特征。
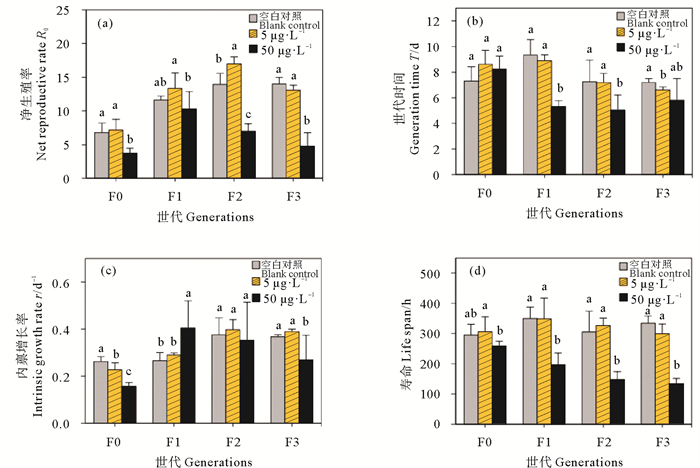
|
图 3 多世代Cu2+暴露对轮虫的净生殖率(a)、世代时间(b)、内禀增长率(c)和寿命(d)的影响 Fig. 3 Effects of Cu2+ multigenerational exposure on net reproductive rate (a), generation time (b), intrinsic growth rate (c) and life span (d) of rotifers |
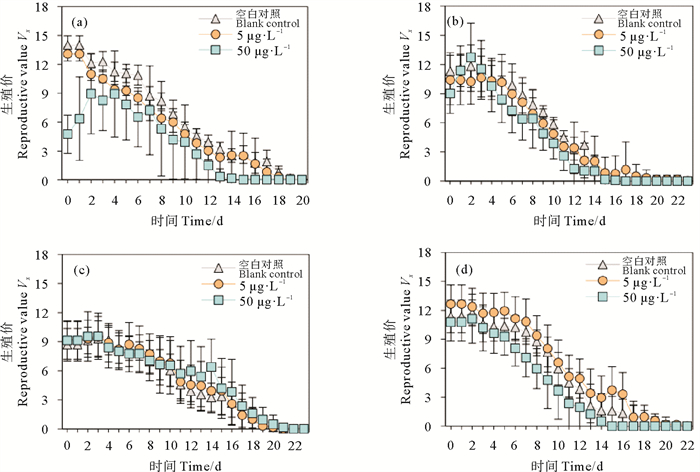
图 4所示为Cu2+暴露对F0~F3代轮虫的生殖价的影响。总体上轮虫的生殖价随时间推移而逐渐降低,空白对照组和低浓度组轮虫的生殖价各个时间段差异不明显,但50 μg·L-1 Cu2+暴露组的生殖价在培养的前14 d明显低于对照组和低浓度组,这说明高浓度Cu2+暴露明显降低了轮虫的繁殖潜力。14 d后各处理组轮虫的生殖价无显著差异,均降低至很低水平。
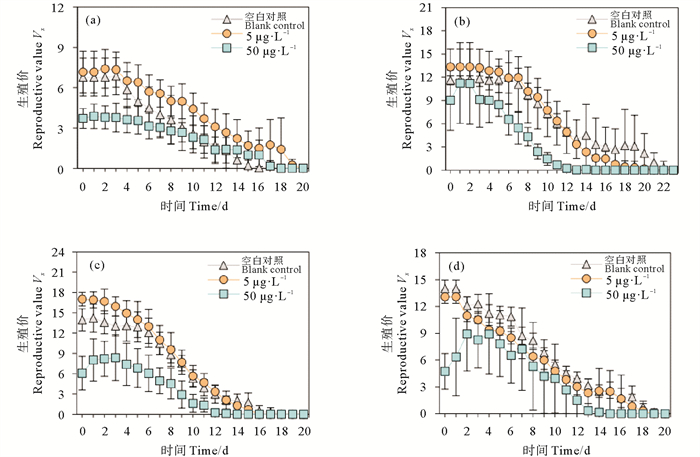
|
图 4 不同Cu2+处理组F0(a)、F1(b)、F2(c)、F3(d)代轮虫的生殖价 Fig. 4 Reproductive value of F0 (a), F1 (b), F2 (c), F3 (d) rotifers in different Cu2+ treatments |
为了验证Cu2+对轮虫繁殖的抑制效应是否为持续且不可逆的,本研究进一步探究了经过连续几个世代净化后F3代轮虫的繁殖能力。同持续暴露组相比,经过1个世代的净化后,50 μg·L-1 Cu2+处理组轮虫的产卵数部分恢复,但仍显著低于空白对照组(P < 0.05),但经过2~3个世代的净化后,轮虫的产卵数增加了90.01%~109.72%,且同空白组相比无显著差异(P>0.05)(见图 5(a))。轮虫的种群繁殖能力在净化到2~3代后逐步恢复,这可能反映Cu2+对轮虫繁殖的不利影响是可逆的。同连续暴露组相似,经过多代净化后轮虫的孵化成功率并未出现显著变化(P>0.05)(见图 5(b)),进一步证实了多代暴露引起的繁殖力降低是由产卵数下降所主导的。
|
图 5 多代净化后Cu2+对F3代轮虫的产卵数(a)和孵化成功率(b)影响 Fig. 5 Effects of Cu2+ on egg number (a) and hatching success rate (b) of F3 rotifers after multigenerational recovery |
图 6为连续几个世代净化后F3代轮虫的生活史特征。结果表明,经过1~3个世代的净化后,50 μg·L-1 Cu2+处理组轮虫的净生殖率增加了70.98%~127.62%,世代时间增加了8.28%~68.50%,内禀增长率增加了-11.18%~39.62%,寿命延长49.23%~138.90%。同对照组相比,净化后高浓度组F3代轮虫的世代时间、净生殖率、内禀增长率和寿命均无显著差异(P>0.05)(见图 6),进一步从生活史特征的角度证明了Cu2+对轮虫的不利影响是可逆的。
|
图 6 多代净化后Cu2+对F3代轮虫的净生殖率(a)、世代时间(b)、内禀增长率(c)和寿命(d)的影响 Fig. 6 Effects of Cu2+ on net reproductive rate (a), generation time (b), intrinsic growth rate (c) and life span (d) of F3 rotifers after multigenerational recovery |
图 7所示为0~3个恢复世代后F3代轮虫的生殖价。总体上轮虫的生殖价随时间逐渐降低,相比于对照组,0个恢复世代50 μg·L-1 Cu2+暴露组轮虫的生殖价曲线整体水平下降,而经过连续几个世代净化后,F3代Cu2+暴露组轮虫的生殖价曲线同对照组呈现相同趋势并且几乎重叠(见图 7)。这说明环境压力刺激消失后,轮虫的繁殖潜力恢复到污染前的正常水平。
|
图 7 不同Cu2+处理组0(a)、1(b)、2(c)和3(d)个恢复世代后F3代轮虫的生殖价 Fig. 7 Reproductive value of F3 rotifers in different Cu2+ treatments with 0 (a), 1 (b), 2 (c), 3 (d) total recovery generations |
在近海海洋生态系统中移动性弱、分布广泛的浮游动物轮虫易受到重金属污染的风险。本研究急性实验结果表明,轮虫对Cu2+的耐受性随着暴露时间的延长而降低,推测这是由于随着暴露时间的延长,Cu2+在轮虫体内累积量增加而导致。当生物体的金属离子排毒系统未能有效地将摄入的金属离子转化为排毒形式,或者当补偿过程本身带来相当大的生理成本时,微量Cu2+即对生物体产生毒性效应[20],引发氧化应激效应,诱导DNA损伤和细胞凋亡等[7],从而产生急性致死效应。
本研究结果发现Cu2+显著降低了轮虫的产卵数。这可能是由于在重金属离子刺激下,轮虫分配更多的能量用于抵御应激源的影响来维持正常的生命活动,减少了用于繁殖的能量[21]。多代暴露实验结果表明,Cu2+对轮虫繁殖能力产生了多代毒性和代际效应。这可能与重金属在轮虫体内累积有关。例如,汞对剑水蚤(Tigriopus japonicus)繁殖的多代毒性效应归因于随暴露世代增加汞的生物累积量增加[22]。重金属还能够通过抑制卵的发育从而引起生殖毒性。例如Hg能通过抑制剑水蚤(T. japonicus)卵黄蛋白原的表达,并下调角质层蛋白和几丁质修饰酶的表达,抑制卵角质层的发育和形成,从而引起多代生殖毒性[22-23]。除此之外,重金属能够诱导DNA损伤产生遗传毒性,从而产生代际效应。研究表明,Ag纳米颗粒诱导的相关组蛋白甲基化水平的变化[24]和Ag诱导的突变累积[25]是引起秀丽隐杆线虫(Caenorhabditis elegans)后代生殖敏感性提高的重要原因。
研究发现Cu2+暴露后轮虫各世代的生活史特征发生了变化。本文利用50 μg·L-1 Cu2+处理后F0~F3代轮虫生活史参数的倍数变化同对照组相比,来反映Cu2+暴露对轮虫各世代生活史特征的影响程度,即Cu2+连续多世代暴露同净化后对轮虫生活史参数影响(见图 8)。图 8(a)中,Cu2+暴露后F0~F1代轮虫的产卵数、净生殖率和内禀增长率增加,寿命和世代时间则呈降低趋势,说明持续两代Cu2+暴露使轮虫向高繁殖力、早性成熟和低存活率的生活史特征发展,这可被看作是一种应对外界环境刺激的种群适应策略,使得其种群在不断变化的生境中能够保持最大的拓殖能力[26]。随着Cu2+暴露世代增加,F1~F3代高浓度组轮虫的产卵数、净生殖率、内禀增长率和寿命随暴露世代增加而降低,世代时间呈上升趋势,表明Cu2+多代暴露后轮虫的耐受性降低,Cu2+对轮虫的生活史特征产生了代际效应。这可能是由于在持续Cu2+应激下,轮虫分配更多的能量用于解毒和修复作用,如金属硫蛋白和抗氧化酶和合成,减少了用于繁殖的能量[27-28]。此外,Cu2+暴露提高了轮虫生命阶段初期的繁殖潜力。繁殖对生物来说是一个能量消耗较大的生物过程,因此未来生存的可能性或者未来繁殖概率的降低是生物目前在生产后代上投资的结果。在重金属应激下,轮虫在维持机体存活的同时需分配能量用于抵御外界环境压力,这必将会增加其繁殖代价,因此高浓度Cu2+暴露后轮虫的生殖价会在短暂升高后快速降低,说明轮虫对未来种群增长的贡献降低,进而使轮虫的种群增长受到抑制。
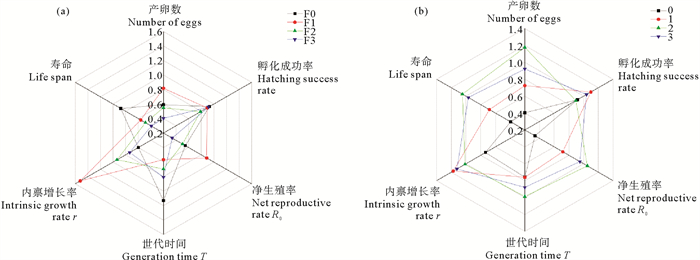
|
图 8 Cu2+连续多世代暴露(a)与净化后(b)对轮虫生活史参数的影响总览图 Fig. 8 Overview of the effects of Cu2+ multigenerational exposure (a) and recovery (b) on life history parameters of rotifers |
轮虫是近海浮游动物的重要物种之一,Cu2+长期暴露不仅会影响浮游动物的种类和数量,作为海洋生态系统的初级消费者,浮游动物的种群动态变化还会影响各营养级的节律和规模[29],并会进一步影响海洋生态系统的物质循环和能量流动。在重金属胁迫下,初级消费者和初级生产者的种群动态以及两者之间的能量流动会发生改变,轮虫对海洋生态系统中初级生产者浮游藻类的控制作用会减弱,这将会增加赤潮暴发的风险[9]。此外,浮游动物种群动态变化也会影响鱼类、甲壳类和软体动物等高营养级生物的种群动态,从而影响海洋生态系统的稳定性[30]。
图 8(b)表明,经过连续几个世代净化后,轮虫的寿命、产卵数、净生殖率和内禀增长率显著增加,Cu2+对轮虫的不利影响逐步消失。这可能是由于在清洁的海水中轮虫逐渐排出了累积在其体内的Cu2+。Cu2+的大量累积可能诱导轮虫体内的解毒机制,例如外排泵的诱导、内流泵的下调和排泄机制的上调,使轮虫体内铜的含量降低[31]。前人的研究也得到了类似的结果。例如,镉暴露的剑水蚤(T. japonicus)经过1个恢复世代后,其繁殖仍受到抑制,而经过2个恢复世代后,剑水蚤的繁殖能力得以恢复,该现象被认为同恢复世代期间剑水蚤体内镉累积量逐渐降低有关[32]。此外,表型可塑性也可能在轮虫恢复世代的性状恢复中起重要作用。例如轮虫可能通过增加金属硫蛋白的转录水平等提高排泄效率[33],增强碳水化合物代谢、肌球蛋白重组和应激相关防御途径等相关蛋白质的表达[23],使重金属离子对其生活史特征的影响减弱。本研究结果表明当铜胁迫消失后,轮虫的繁殖能力和生活史特征逐渐恢复,这说明海产养殖环境中重金属污染修复的重要性,亟需开发一种安全、环保、高效和低价的重金属离子修复技术以保证海产养殖业的可持续发展。
4 结论(1) 高浓度重金属Cu2+暴露显著降低了褶皱臂尾轮虫的产卵数和净生殖率;Cu2+暴露初期,轮虫为保持最大拓殖能力,F0~F1代轮虫的产卵数、净生殖率和内禀增长率增大,寿命和世代时间降低;但F1~F3代轮虫的产卵数、净生殖率、内禀增长率和寿命随暴露世代增加而降低,世代时间呈上升趋势,这表明Cu2+多代暴露后轮虫的耐受性降低,其生活史特征产生明显改变,轮虫繁殖潜力下降,种群增长受抑制。
(2) 停止Cu2+暴露2~3个世代后,轮虫的种群繁殖潜力逐渐恢复到正常水平。这表明Cu2+对轮虫的繁殖能力和生活史的不利影响是可逆的。该研究结果也表明了在物种单一、群落结构相对简单的海产养殖水域进行重金属污染的治理和生态修复对受损浮游动物种群的恢复和渔业资源的可持续发展具有重要意义。
| [1] |
Lao Q, Su Q, Liu G, et al. Spatial distribution of and historical changes in heavy metals in the surface seawater and sediments of the Beibu Gulf, China[J]. Marine Pollution Bulletin, 2019, 146: 427-434. DOI:10.1016/j.marpolbul.2019.06.080 (  0) 0) |
| [2] |
He H, Zhang C, Chen X, et al. Ecological risk assessment of trace metals and comprehensive contamination indicators in the coastal waters of Macao South China Sea[J]. Marine Pollution Bulletin, 2020, 154: 110718. DOI:10.1016/j.marpolbul.2019.110718 (  0) 0) |
| [3] |
韩现芹, 陈春秀, 贾磊. 汉沽养殖区海水重金属含量分布特征及潜在生态危险评价[J]. 安徽农业科学, 2016, 44(20): 66-68. Han X Q, Chen C X, Jia L. The distribution and potential ecological risk of heavy metals in seawater from Hangu aquiculture area[J]. Journal of Anhui Agricultural Sciences, 2016, 44(20): 66-68. DOI:10.13989/j.cnki.0517-6611.2016.20.022 (  0) 0) |
| [4] |
国家环境保护局. GB 3097—1997海水水质标准[S]. 北京: 环境科学出版社, 2004.
(  0) 0) |
| [5] |
Siregar T H, Priyanto N, Putri A K, et al. Spatial distribution and seasonal variation of the trace hazardous element contamination in Jakarta Bay, Indonesia[J]. Marine Pollution Bulletin, 2016, 110(2): 634-646. DOI:10.1016/j.marpolbul.2016.05.008 (  0) 0) |
| [6] |
Hu C, Shui B, Yang X, et al. Trophic transfer of heavy metals through aquatic food web in a seagrass ecosystem of Swan Lagoon, China[J]. Science of the Total Environment, 2021, 762: 143139. DOI:10.1016/j.scitotenv.2020.143139 (  0) 0) |
| [7] |
Wang W X, Meng J, Weng N. Trace metals in oysters: Molecular and cellular mechanisms and ecotoxicological impacts[J]. Environmental Science-Processes & Impacts, 2018, 20(6): 892-912. (  0) 0) |
| [8] |
Dhont J, Dierckens K, Støttrup J, et al. 5 - Rotifers, Artemia and copepods as live feeds for fish larvae in aquaculture[M/OL]. [2022-01-08]https://doi.org/10.1533/9780857097460.1.157.
(  0) 0) |
| [9] |
Xiong W, Li J, Yang Y, et al. Data collected in an integrated ecological survey of rotifer communities and corresponding environmental variables in the highly polluted Haihe River Basin, China[J]. Data in Brief, 2018, 17: 141-147. DOI:10.1016/j.dib.2017.12.062 (  0) 0) |
| [10] |
王嘉仪, 沙婧婧, 张晖, 等. 石油水溶性成分对褶皱臂尾轮虫(Brachionus plicatilis)生殖、发育及种群动态的影响[J]. 生态毒理学报, 2019, 14(5): 159-167. Wang J Y, Sha J J, Zhang H, et al. Water-accommodated fraction (WAF) of oil exert negative impacts on reproduction, development and population dymanics of marine rotifer Brachionus plicatilis[J]. Asian Journal of Ecotoxicology, 2019, 14(5): 159-167. (  0) 0) |
| [11] |
Guo R, Ren X, Ren H. Effects of dimethoate on rotifer Brachionus calyciflorus using multigeneration toxicity tests[J]. Journal of Environmental Science and Health, Part B, 2012, 47(9): 883-890. DOI:10.1080/03601234.2012.693869 (  0) 0) |
| [12] |
González-Pérez B K, Sarma S S S, Castellanos-Páez M E, et al. Effects of the endocrine disruptor 4-nonylphenol on the demography of rotifers Plationus patulus and Brachionus havanaensis: A multigenerational study[J]. Journal of Environmental Science and Health, Part A, 2021. (  0) 0) |
| [13] |
Martins N, Pradhan A, Pascoal C, et al. Individual and mixed effects of anticancer drugs on freshwater rotifers: A multigenerational approach[J]. Ecotoxicology and Environmental Safety, 2021, 227: 112893. DOI:10.1016/j.ecoenv.2021.112893 (  0) 0) |
| [14] |
Cooper C A, Tait T, Gray H, et al. Influence of salinity and dissolved organic carbon on acute Cu toxicity to the rotifer Brachionus plicatilis[J]. Environmental Science & Technology, 2014, 48(2): 1213-1221. (  0) 0) |
| [15] |
American Society for Testing and Materials. E 1440—91 Standard Guide for Acute Toxicity Test with the Rotifer Brachionus[S]. America: American Society for Testing and Materials, 2021.
(  0) 0) |
| [16] |
Xue Y H, Sun Z X, Feng L S, et al. Algal density affects the influences of polyethylene microplastics on the freshwater rotifer Brachionus calyciflorus[J]. Chemosphere, 2020, 270: 128613. (  0) 0) |
| [17] |
Sarma S S S, Corral-Jácquez Frida Irais, Nandini S, et al. Population level indicators of stress: Effects of two heavy metals (copper and mercury) on the growth of Lecane quadridentata (Ehrenberg, 1830) (Rotifera: Lecanidae)[J]. Journal of Environmental Science and Health, Part A, 2010, 45(1): 32-36. DOI:10.1080/10934520903388632 (  0) 0) |
| [18] |
Pianka E R. Evolutionary Ecology[M]. 5th Edition. New York: Harper Collins College Publishers, 1994.
(  0) 0) |
| [19] |
Stearns S C. The Evolution of Life Histories[M]. London: Oxford University Press, 1992.
(  0) 0) |
| [20] |
Luoma S N, Rainbow P S. Metal contamination in aquatic environments: Science and lateral management[J]. Journal of Fish Biology, 2009, 75(7): 1911-1912. DOI:10.1111/j.1095-8649.2009.02440_4.x (  0) 0) |
| [21] |
Kimberly D A, Salice C J. Multigenerational contaminant exposures produce non-monotonic, transgenerational responses in Daphnia magna[J]. Environmental Pollution, 2015, 207: 176-182. DOI:10.1016/j.envpol.2015.09.020 (  0) 0) |
| [22] |
Li H, Shi L, Wang D, et al. Impacts of mercury exposure on life history traits of Tigriopus japonicus: Multigeneration effects and recovery from pollution[J]. Aquatic Toxicology, 2015, 166: 42-49. DOI:10.1016/j.aquatox.2015.06.015 (  0) 0) |
| [23] |
Xu X, Shi L, Wang M. Comparative quantitative proteomics unveils putative mechanisms involved into mercury toxicity and tolerance in Tigriopus japonicas under multigenerational exposure scenario[J]. Environmental Pollution, 2016, 218: 1287-1297. DOI:10.1016/j.envpol.2016.08.087 (  0) 0) |
| [24] |
Wamucho A, Heffley A, Tsyusko O V. Epigenetic effects induced by silver nanoparticles in Caenorhabditis elegans after multigenerational exposure[J]. Science of the Total Environment, 2020, 725: 138523. DOI:10.1016/j.scitotenv.2020.138523 (  0) 0) |
| [25] |
Wamucho A, Unrine J M, Kieran T J, et al. Genomic mutations after multigenerational exposure of Caenorhabditis elegans to pristine and sulfidized silver nanoparticles[J]. Environmental Pollution, 2019, 254: 113078. DOI:10.1016/j.envpol.2019.113078 (  0) 0) |
| [26] |
Yoon D S, Lee Y, Park J C, et al. Alleviation of tributyltin-induced toxicity by diet and microplastics in the marine rotifer Brachionus koreanus[J]. Journal of Hazardous Materials, 2021, 402: 123739. DOI:10.1016/j.jhazmat.2020.123739 (  0) 0) |
| [27] |
Aránguiz-Acuña A, Pérez-Portilla P. Metal stress in zooplankton diapause production: Post-hatching response[J]. Ecotoxicology, 2017, 26: 329-339. DOI:10.1007/s10646-017-1766-7 (  0) 0) |
| [28] |
Fernández-González M A, González-Barrientos J, Carter M J, et al. Parent-to-offspring transfer of sublethal effects of copper exposure: Metabolic rate and life-history traits of Daphnia[J]. Revista Chilena de Historia Natural, 2011, 84: 195-201. (  0) 0) |
| [29] |
Cao S, Liu Z, Zhou B, et al. Post-ecological effect and risk assessment of using modified clay in harmful algal bloom mitigation: An attempt based on the responses of zooplankton Brachionus plicatilis and bivalve Mytilus edulis[J]. Ecotoxicology and Environmental Safety, 2022, 230: 113134. DOI:10.1016/j.ecoenv.2021.113134 (  0) 0) |
| [30] |
Liu J, Cao L, Dou S. Trophic transfer, biomagnification and risk assessments of four common heavy metals in the food web of Laizhou Bay, the Bohai Sea[J]. Science of the Total Environment, 2019, 670: 508-522. DOI:10.1016/j.scitotenv.2019.03.140 (  0) 0) |
| [31] |
Kim H Y, Jeon J, Hollender J, et al. Aqueous and dietary bioaccumulation of antibiotic tetracycline in D. magna and its multigenerational transfer[J]. Journal of Hazardous Materials, 2014, 279: 428-435. DOI:10.1016/j.jhazmat.2014.07.031 (  0) 0) |
| [32] |
Wang M, Zhang C, Lee J S. Quantitative shotgun proteomics associates molecular-level cadmium toxicity responses with compromised growth and reproduction in a marine copepod under multigenerational exposure[J]. Environmental Science & Technology, 2018, 52(3): 1612-1623. (  0) 0) |
| [33] |
Amorim M J B, Pereira C, Soares A M V M, et al. Does long term low impact stress cause population extinction?[J]. Environmental Pollution, 2017, 220(Part B): 1014-1023. (  0) 0) |
2. Functional Laboratory of Marine Ecology and Environmental Science, Piloe National Laboratory of Marine Science and Technology(Qingdao), Qingdao 266071, China
 2023, Vol. 53
2023, Vol. 53


