2. 天津市动物疫病预防控制中心,天津 300000
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾,是世界范围内最具经济价值的虾类养殖品种之一,具有生长速度快、适应能力强等优点[1],其可生存的盐度范围为0.5~45[2]。与海水环境相比,内陆淡水的离子比例失衡,部分离子缺乏甚至严重缺乏,因此在内陆淡水对虾养殖区,需要调节水体离子浓度及比例以满足对虾生长的需要[3-4]。在不同的养殖环境中如池塘和河口等,水体离子浓度会因气候和季节的变化受到影响,换水也会导致水体离子浓度的波动[5]。研究表明,水体中Ca2+、Mg2+的含量与对虾的蜕皮、生长和生理代谢联系紧密[6-9]。在淡水中,Ca2+、Mg2+等离子含量较低,凡纳滨对虾难以通过主动调节吸收足够的Ca2+、Mg2+维持正常的生理功能,从而影响其生长,只有水体中Ca2+、Mg2+浓度在凡纳滨对虾生长的适合范围内,对虾正常的生理功能得以维持[10-11]。因此,了解咸淡水中凡纳滨对虾在周期性Ca2+、Mg2+浓度波动条件下生长的变化,对指导内陆地区对虾养殖具有重要意义。
能量代谢组学作为代谢组学的一个分支,可对三羧酸循环、糖酵解途径和氧化磷酸化过程中的重要代谢物进行系统研究。具有高特异性的选择性反应/多反应监测(SRM/MRM)技术,不仅能够进行针对性检测与分析,并可获得能量代谢物的相对定量结果。本研究采用SRM/MRM技术,结合生物信息学分析,对周期性Ca2+、Mg2+浓度波动的低盐水养殖的凡纳滨对虾鳃中能量代谢物质进行分析,为阐明离子浓度变化对凡纳滨对虾生长的影响提供理论依据。
1 材料与方法 1.1 实验虾来源和管理实验于2017年7—9月于天津农学院天津市水产生态及养殖重点实验室进行。实验用凡纳滨对虾苗(2 cm左右)购自天津市宝坻区渔翁水产科技发展有限公司(水体盐度2~3),对虾运回实验室后,暂养于室内玻璃钢水槽中。暂养期间水温(24.0±1.0) ℃,光照周期14L:10D,连续充气。每天7:00、14:00和21:00定时投喂人工配合饲料,每次投喂2 h后除去粪便并收集残饵,残饵于60 ℃烘干称重。每天换水1/2以保持良好水质,暂养7 d后挑选体色透明、健康活泼的个体用于实验。
1.2 实验设计实验用水盐度为2~3,基础离子浓度见表 1。实验过程中,Ca2+/Mg2+ 保持在1:3左右。以恒定Ca2+浓度150 mg/L、Mg2+浓度450 mg/L为对照组(CC0组);以4 d为波动周期,通过添加分析纯CaCl2、MgCl2或换水的方式调节实验用水的Ca2+、Mg2+浓度,水体离子浓度分别波动至Ca2+浓度100 mg/L、Mg2+浓度300 mg/L(CCM1组)和Ca2+浓度45 mg/L、Mg2+浓度135 mg/L为处理组(CCM2组),4 d后恢复为Ca2+浓度150 mg/L、Mg2+浓度450 mg/L,4 d后再进行波动,依此类推。每组设4个重复,每个重复10尾对虾。实验在室内玻璃水族箱(50 cm×40 cm×30 cm)中进行,实验周期为30 d。实验期间的水温、光照周期和投喂管理与暂养相同。每天统计发生蜕皮的对虾数目。
|
|
表 1 实验用水的主要离子浓度 Table 1 Main ions concentrations of the experimental water |
实验结束时,实验对虾停止投喂24 h后进行样品采集。样品采集时,将对虾放于冰盘上迅速解剖,取其鳃组织,放入1.5 mL离心管(Axygen, RNase free)中,立即置于液氮环境中速冻,而后转入-80 ℃保存待测。
1.4 基于SRM/MRM技术的能量代谢物分析 1.4.1 样品处理每份样本称取约55 mg,加入200 μL超纯水MP匀浆,加入800 μL预冷甲醇/乙腈(1:1,v/v),涡旋混匀,低温超声30 min,-20 ℃孵育1 h沉淀蛋白,11 574 r/min 4 ℃离心20 min,取上清,真空干燥。质谱检测时加入100 μL乙腈-水溶液(1:1, v/v)复溶,11 574 r/min 4 ℃离心15 min,取上清,进样分析。
1.4.2 色谱-质谱分析(1) 高效液相色谱条件。样品采用Agilent 1290 Infi-nity LC超高效液相色谱系统进行分离。流动相:A液为15 mmol/L乙酸铵水溶液,B液为乙腈。样品置于4 ℃自动进样器中,柱温45 ℃,流速为300 μL/min,进样量4 μL。相关液相梯度如下:0~18.0 min,B液从90%线性变化到40%;18.0~18.1 min,B液从40%线性变化至90%;18.1~23.0 min,B液维持在90%。样本队列中每间隔一定数量的实验样本设置一个QC样本,用于检测和评价系统的稳定性及重复性;样本队列的设置能量代谢物质的标准品混合物,用于色谱保留时间的矫正。
(2) 质谱分析。采用5500 QTRAP质谱仪(AB SCIEX)在负离子模式下进行质谱分析。5500 QTRAP ESI源条件如下:source temperature 450 ℃,ion Source Gas1(Gas1):45,Ion Source Gas2 (Gas2):45,Curtain gas(CUR):30,ion Sapary Voltage Floating(ISVF)-4500 V;采用MRM模式检测待测离子对。
1.5 数据计算与分析相对增重率(WG,%)=100(Wt-W0)/W0;
蜕皮率(MF,%·d-1)=100Nm/(Ns×T);
特定生长率(SGR,%·d-1)=100(lnWt-lnW0)/T;
摄食率(FI,%·d-1)=100F/[T×(Wt+W0)/2];
食物转化效率(FCE,%)=100(Wt-W0)/F2。
式中:Wt,W0是结束和初始时对虾的湿重;T为实验持续的时间;F为摄食量(干重),Nm为蜕皮次数,Ns为每箱养虾数。
实验中,实验各数据均以平均值±标准误(Mean±S.E.)表示。利用SPSS 20.0软件对凡纳滨对虾生长数据进行单因子方差分析(ANOVA)和Duncan多重比较分析,以P<0.05作为差异显著水平。采用Multiquant软件提取色谱峰面积及保留时间。采用能量代谢物质的标准品矫正保留时间,进行代谢物鉴定。
2 结果与分析 2.1 周期性Ca2+、Mg2+浓度波动对凡纳滨对虾存活、摄食和生长的影响周期性Ca2+、Mg2+浓度波动条件下凡纳滨对虾存活、摄食和生长如表 2所示,各组均有个体出现死亡,但各组存活率间无显著性差异(P>0.05)。
|
|
表 2 周期性Ca2+、Mg2+浓度波动下凡纳滨对虾存活、摄食和生长(n=10) Table 2 Survival, molting frequency, feeding and growth of Litopenaeus vannamei under different concentrations of Ca2+, Mg2+ fluctuation amplitudes (n=10) |
从表 2中可以看出,3组对虾FI差异不显著(P>0.05)。各组间FCE差异均达到显著水平,表现为CCM1>CC0>CCM2(P<0.05)。
实验结束时,各组对虾WG和SGR差异均达到显著水平(P<0.05),按大小排序为:CCM1>CC0>CCM2。
2.2 周期性Ca2+、Mg2+浓度波动对凡纳滨对虾鳃中能量代谢物质的影响采用SRM/MRM技术,有针对性地选择能量代谢物质的数据进行质谱信号采集,对符合规则的离子对进行信号记录,去除不符合规则离子信号的干扰。在定量分析过程中,筛选目标代谢物特异性的母离子,然后选择性地对这些母离子进行碰撞诱导,去除其他离子的干扰,只对选定的MS/MS2离子进行质谱信号的采集,最终检测出周期性Ca2+、Mg2+浓度波动对凡纳滨对虾有重要作用的21种能量代谢物(见表 3)。
|
|
表 3 周期性Ca2+、Mg2+浓度波动下凡纳滨对虾鳃中能量代谢物质表达量分析 Table 3 Expression analysis of energy metabolites in gill of Litopenaeus vannamei under different concentrations of Ca2+, Mg2+ fluctuation amplitudes |
随着养殖水体Ca2+、Mg2+浓度的周期性变化,凡纳滨对虾体内的能量代谢物质含量也发生改变。图 1中,热图中不同的颜色代表不同的能量代谢物质含量水平:红色表示能量代谢物质含量相对高,绿色表示能量代谢物质含量相对低。为了更直观地表示各个能量代谢物质的含量变化,利用归一化面积进行箱式图分析(见图 2)。在检测出的21种能量代谢物质中,丙酮酸等3种和草酰乙酸等4种能量代谢物含量随水体Ca2+、Mg2+浓度波动幅度的升高而降低,分别在CC0组和CCM1组达到最高;而NAD+等14种能量代谢物含量随水体Ca2+、Mg2+浓度波动幅度的升高而升高。
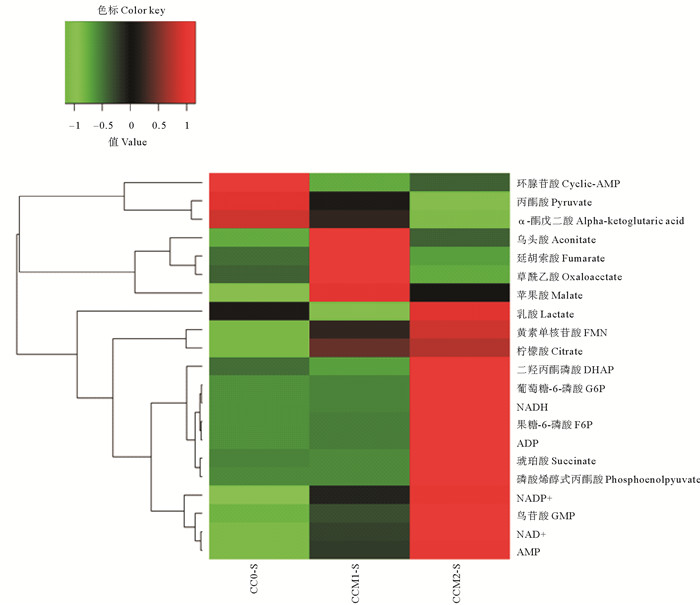
|
(横坐标依次为CC0、CCM1和CCM2组,每组取各尾对虾的平均值;纵坐标为能量代谢物质。The horizontal coordinates was the samples divided into three groups (CC0、CCM1 and CCM2), each group adopted the mean value of the shrimp; vertical coordinates was the energy metabolites. ) 图 1 周期性Ca2+、Mg2+浓度波动下凡纳滨对虾鳃中能量代谢物质的热图 Fig. 1 Heat-map of energy metabolites in gills of Litopenaeus vannamei in response to different concentrations of Ca2+, Mg2+ fluctuation amplitudes |
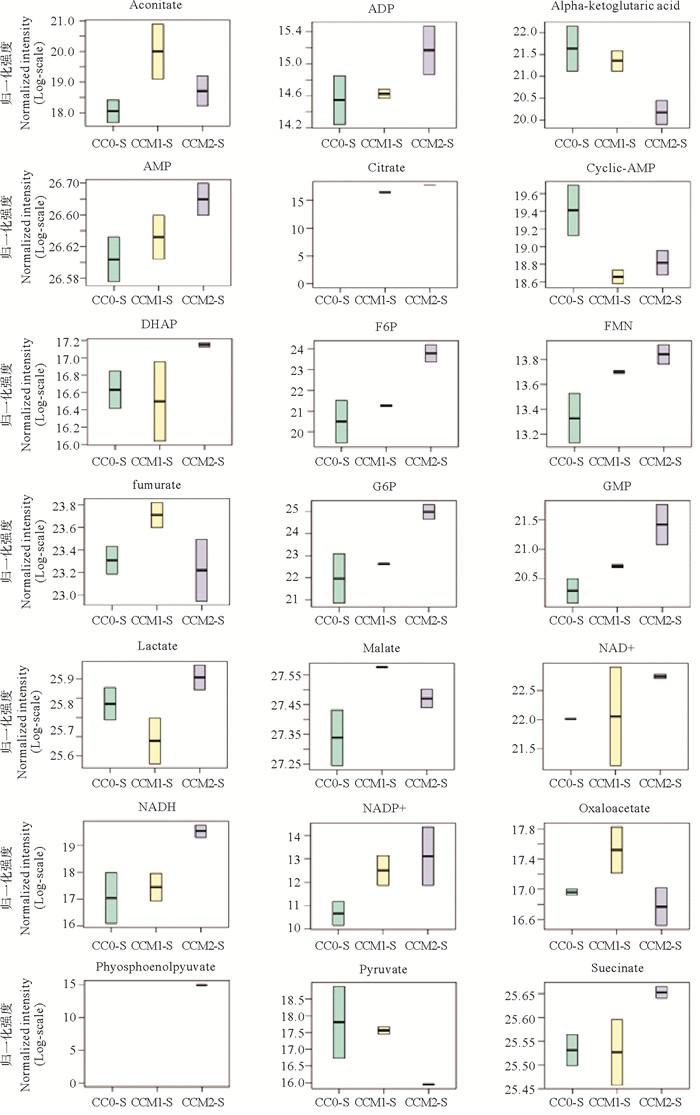
|
(分图按顺序代表的能量代谢物质分别为:乌头酸、ADP、α-酮戊二酸、AMP、柠檬酸、环腺苷酸、二羟丙酮磷酸、果糖-6-磷酸、黄素单核苷酸、延胡索酸、葡萄糖-6-磷酸、鸟苷酸、乳酸、苹果酸、NAD+、NADH、NADP+、草酰乙酸、磷酸烯醇式丙酮酸、丙酮酸、琥珀酸。横坐标依次为CC0、CCM1和CCM2组;纵坐标为归一化强度。The energy metabolites represented by the sub-graphs in sequence are as follows: aconitate、ADP、alpha-ketoglutaric acid、AMP、citrate、cyclic-AMP、DHAP、F6P、FMN、fumarate、G6P、GMP、lactate、malate、NAD+、NADH、NADP+、oxaloacetate、phosphoenolpyuvate、pyruvate、succinate. The horizontal coordinates was the samples divided into three groups (CC0、CCM1 and CCM2); vertical coordinates was the normalized intensity. ) 图 2 周期性Ca2+、Mg2+浓度波动下凡纳滨对虾鳃中能量代谢物质的箱形图 Fig. 2 Box-plots of energy metabolites in gills of Litopenaeus vannamei in response to different concentrations of Ca2+, Mg2+ fluctuation amplitudes |
随着内陆对虾养殖业的迅速发展,水中离子浓度的变化对对虾生长存活影响的研究就越来越受重视。Ca2+、Mg2+对于动物生理作用具有相互关联性,研究发现,水中Ca2+/Mg2+比值为1:3时,凡纳滨对虾的生长和存活情况较好[12]。此外,适宜的节律性地添加钙能促进对虾的蜕皮和生长[13]。本研究模仿自然环境中养殖水体离子浓度的周期性变化,设置水中Ca2+/Mg2+比值约为1:3,但Ca2+、Mg2+浓度波动幅度不同,实验结果表明,各组对虾的存活率、蜕皮率未出现显著差异,然而,不同Ca2+、Mg2+浓度波动幅度对凡纳滨对虾的生长产生了显著的影响,其中,Ca2+、Mg2+浓度在适宜范围内波动(CCM1组),对虾FCE最高,生长最好。
能量流动伴随动物体内物质循环的进行,是机体代谢的核心。当环境条件发生变化时,动物机体会产生适应性生理响应,而体内充足的能量供给是完成这些生理活动的基础。因此,能量平衡是动物对变化环境耐受性的重要衡量指标之一[14-15]。已有研究表明,动物在等渗环境下用于渗透调节的能量消耗最少,此时用于生长的能量比例较低渗和高渗条件下更高,因而更有利于生长[16-17]。然而,也有研究发现,一些甲壳动物,如Farfantepenaeus brasiliensis和Penaeus escultentus在非等渗环境下生长更好[18-19]。这些研究结果表明,在不同离子浓度的水体环境中,动物体内能量的分配直接影响其生长水平,但机体内能量代谢的适应性调节能力可能存在物种差异。在生物体内,能量主要产生于三条途径:糖酵解、三羧酸循环(TCA循环)和氧化磷酸化作用,本研究检测了周期性Ca2+、Mg2+浓度变化条件下凡纳滨对虾稚虾鳃组织中能量代谢主要途径中的关键物质的含量。结果发现,蜕皮和生长较好的CCM1组和恒定Ca2+、Mg2+浓度的CC0组对虾鳃中能量代谢物质含量较低,而Ca2+、Mg2+浓度波动幅度较大的CCM2组对虾鳃中能量代谢物质含量普遍较高,推测CC2组对虾需要更多的能量用于渗透调节,从而重新建立体内能量平衡,导致对虾生长速度较慢。
4 结语凡纳滨对虾稚虾在适宜的Ca2+、Mg2+浓度波动范围内(CCM1组),蜕皮最快,生长最好。利用SRM/MRM技术,共检测获得21种能量代谢物质,其中NADP+、环腺苷酸、丙酮酸和α-酮戊二酸的含量随Ca2+、Mg2+浓度波动幅度的变化达到显著差异。周期性Ca2+、Mg2+浓度波动条件下,凡纳滨对虾具有生长差异,且表现为能量代谢过程的积极响应。
| [1] |
Menz A, Blake B. Experiments on the growth of Penaeus vannamei Boone[J]. Journal of Experimental Marine Biology and Ecology, 1980, 48(2): 99-111. DOI:10.1016/0022-0981(80)90010-6
(  0) 0) |
| [2] |
Araneda M, Pérez E P, Gasca-Leyva E. White shrimp Penaeus vannamei culture in freshwater at three densities:Condition state based on length and weight[J]. Aquaculture, 2008, 283(1): 13-18.
(  0) 0) |
| [3] |
Boyd C E. Inland shrimp farming and the environment[J]. World Aquaculture, 2001, 32(1): 10-12.
(  0) 0) |
| [4] |
朱长波, 董双林. 对虾内陆养殖的现状、存在的问题及其展望[J]. 南方水产科学, 2005, 1(5): 63-69. Zhu C B, Dong S L. Advances, problems and prospect of inland shrimp farming[J]. South China Fisheries Science, 2005, 1(5): 63-69. (  0) 0) |
| [5] |
侯纯强.水中钙浓度对凡纳滨对虾(Litopenaeus vannamei)蜕皮和生长的影响及生理生态学机制[D].青岛: 中国海洋大学, 2011. Hou C Q.Effects and Mechanism of Ca2+ Concentration on the Molting and Growth of Juvenile Litopenaeus vannamei[D].Qingdao: Ocean University of China, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011231267.htm (  0) 0) |
| [6] |
Cheng W, Liu C H, Yan D F, et al. Hemolymph oxyhemocyanin, protein, osmolality and electrolyte levels of whiteleg shrimp Litopenaeusvannamei in relation to size and molt stage[J]. Aquaculture, 2002, 211(1): 325-339.
(  0) 0) |
| [7] |
Kim H S, Kim J E, Son H, et al. Roles of three Fusarium graminearum membrane Ca2+ channels in the formation of Ca2+ signatures, growth, development, pathogenicity and mycotoxin production[J]. Fungal Genetics & Biology, 2018, 111: 30-46.
(  0) 0) |
| [8] |
Tantulo U, Fotedar R. Physiological performance and serum Na+, K+, Ca2+ and Mg2+ regulation of black tiger prawn (Penaeus monodon Fabricius 1798) reared in varying Na+/K+ ratios of inland saline water[J]. Aquaculture, 2017, 479: 52-59. DOI:10.1016/j.aquaculture.2017.05.023
(  0) 0) |
| [9] |
张立田, 戴习林, 臧维玲. Ca2+、Mg2+及盐度对凡纳滨对虾体内代谢酶的影响[J]. 海洋科学, 2013, 37(7): 63-71. Zhang T L, Dai X L, Zang W L. Effect of Ca2+, Mg2+ and salinity on metabolic enzymes of Litopenaeusvannamei[J]. Marine Sciences, 2013, 37(7): 63-71. (  0) 0) |
| [10] |
Noor A F, Soo T, Ghani F M, et al. Dystrophin gene expression and intracellular calcium changes in the giant freshwater prawn, Macrobrachiumrosenbergii, in response to white spot symptom disease infection[J]. Heliyon, 2017, 3(12): 446.
(  0) 0) |
| [11] |
Nadukuru N, Yallapragada P R. In vitro and in vivo inhibition of Ca2+-Mg2+-ATPase activity by cadmium in post larvae of Penaeus monodon[J]. Chemistry and Ecology, 2015, 31(5): 446-454. DOI:10.1080/02757540.2015.1051040
(  0) 0) |
| [12] |
刘存歧, 刘丽静, 张亚娟, 等. 基于卤水的养殖用水中Ca2+/Mg2+对凡纳滨对虾生长及体内SOD和AKP的影响[J]. 水产科学, 2007, 26(2): 67-69. Liu C Q, Liu L J, Zhang Y J, et al. Effects of Ca2+/Mg2+ in brine water from salt works on growth and activities of AKP and SOD in white legged shrimp[J]. Fisheries Science, 2007, 26(2): 67-69. (  0) 0) |
| [13] |
侯纯强, 王芳, 董双林. 低钙浓度波动对凡纳滨对虾稚虾蜕皮、生长及能量收支的影响[J]. 中国水产科学, 2010, 17(3): 536-542. Hou C Q, Wang F, Dong S L. Effects of low Ca2+ concentration fluctuation on molting, growth and energy budget of juvenile Litopenaeusvannamei[J]. Journal of Fishery Sciences of China, 2010, 17(3): 536-542. (  0) 0) |
| [14] |
Rodrigues A P, Oliveira P C, Guilhermino L, et al. Effects of salinity stress on neurotransmission, energy metabolism, and anti-oxidant biomarkers of Carcinusmaenas from two estuaries of the NW Iberian Peninsula[J]. Marine biology, 2012, 159(9): 2061-2074. DOI:10.1007/s00227-012-1992-8
(  0) 0) |
| [15] |
Giacomin M, Jorge M B, Bianchini A. Effects of copper exposure on the energy metabolism in juveniles of the marine clam Mesodesmamactroides[J]. Aquatic Toxicology, 2014, 152: 30-37. DOI:10.1016/j.aquatox.2014.03.025
(  0) 0) |
| [16] |
Swanson C. Interactive effects of salinity on metabolic rate, activity, growth and osmoregulation in the euryhaline milkfish (Chanoschanos)[J]. Journal of Experimental Biology, 1998, 201(24): 3355-3366.
(  0) 0) |
| [17] |
Boeuf G, Payan P. How should salinity influence fish growth?[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2001, 130(4): 411-423.
(  0) 0) |
| [18] |
Brito R, Chimal M E, Rosas C. Effect of salinity in survival, growth, and osmotic capacity of early juveniles of Farfantepenaeusbrasiliensis (Decapoda:Penaeidae)[J]. Journal of Experimental Marine Biology and Ecology, 2000, 244(2): 253-263. DOI:10.1016/S0022-0981(99)00142-2
(  0) 0) |
| [19] |
O′brien C J. The effects of temperature and salinity on growth and survival of juvenile tiger prawns Penaeus esculentus (Haswell)[J]. Journal of Experimental Marine Biology and Ecology, 1994, 183(1): 133-145. DOI:10.1016/0022-0981(94)90161-9
(  0) 0) |
2. Tianjin Center for Control and Prevention of Animal Infectious Disease, Tianjin 300000, China
 2020, Vol. 50
2020, Vol. 50


