TBBPA(Tetrabromobisphenol A,TBBPA)是目前全球应用最广泛、使用量最高的溴系阻燃剂(Brominated Flame Retardant,BFRs)之一。TBBPA具有半挥发性,会从产品释放到环境中,并利用高亲脂性在生物体内蓄积,随着TBBPA在生活生产过程中的广泛使用,其在各类环境介质和生物体中的含量不断增加[1],在空气、土壤、底泥和水生生物体内均已检测出TBBPA,甚至在人体血液和母乳中也有检出报道[2-4]。而且近些年来TBBPA被认为是八溴联苯醚和五溴联苯醚的替代品,其使用量仍在持续增长[5]。TBBPA的大量使用,带来了相应的环境问题,因此近年来国内外研究者越来越重视对TBBPA生态毒理效应的研究。
桡足类(Copepoda)隶属于节肢动物门(Arthropoda)、甲壳亚门(Crustacea),是一类种类多、数量庞大且分布广泛的小型低等甲壳动物[6],既是浮游植物的摄食者,又是鱼类的饵料基础,在海洋生态系统的物质循环和能量流动中有不可替代的作用。日本虎斑猛水蚤具有世代周期短,繁殖力强,且易于在实验室培养的特点,被国内外广泛应用于毒性污染物(如内分泌干扰物、以及金属污染物)的检测[7-8],是开展生态毒理学试验的理想生物[9]。
污染物不同的暴露方式是影响污染物在生物体内积累的关键因素[10-11],目前桡足类毒理学研究多以水体暴露的方式进行,通过饵料暴露的慢毒性研究鲜少涉及。自然环境中污染物不仅可以直接对动物产生毒性效应,还可以通过食物链进入捕食者体内进而产生影响,因而单独的水体暴露并不能完全说明污染物对实验动物的影响。
本研究以日本虎斑猛水蚤作为实验对象,研究水体暴露和饵料暴露两种方式下,TBBPA对日本虎斑猛水蚤繁殖和发育的影响,加入饵料暴露可以使实验条件更加接近于自然状态,更加全面地反映TBBPA的潜在危害。本研究可为评估TBBPA对海洋无脊椎动物的影响提供资料与方法,对TBBPA的监控和治理具有重要意义。
1 材料与方法[12-14] 1.1 实验材料 1.1.1 受试生物采集与培养日本虎斑猛水蚤采自青岛汇泉湾附近海域,已在实验室连续培养多代,室内培养条件为温度(20±1)℃,盐度(30±1),光周期12 h L:12 h D。培养所用的海水经0.45 μm孔径的滤膜过滤,充分曝气24 h后使用。实验饵料为6.3× 104 cells/mL青岛大扁藻(Platymonas helgolandica)。
1.1.2 实验药品实验使用的TBBPA固体和二甲基亚砜(DMSO)均为分析纯,分别购自J & K化学试剂有限公司和国药集团化学试剂有限公司,TBBPA纯度>98%。
1.2 试验方法 1.2.1 急性毒性实验实验设定空白对照组、溶剂对照组D(助溶剂为二甲亚砜DMSO)、1.06、1.6、2.4、3.6、5.4、8.1 mg·L-1 TBBPA共8组。每组有三个平行,每个平行组挑选20只健康活泼的日本虎斑猛水蚤。培养条件同上,每隔24 h观察并记录日本虎斑猛水蚤的死亡情况,并更换50%的对应溶液。
1.2.2 慢性毒性实验有实验表明[15],藻细胞在96 h时达到最大富集量和最大富集系数,,因此根据96h-LC50本实验将扁藻提前放入1/10 96h-LC50即0.31 mg/L的TBBPA中进行96 h染毒。
实验分为溶剂对照组、饵料暴露组和水体暴露组三组。溶剂对照组,海水中TBBPA浓度为0 mg·L-1,投喂未经染毒的青岛大扁藻;水体暴露组,海水中TBBPA浓度为0.31 mg·L-1,投喂未经染毒的饵料;饵料暴露组,海水中TBBPA浓度为0 mg·L-1,投喂在0.31 mg·L-1的TBBPA中染毒96 h的青岛大扁藻。各组均有3个平行,每个平行挑选24只无节幼虫至24孔板进行单只培养并记录发育时间、首次挂卵雌体出现时间和产卵量等指标。
1.3 数据分析实验所有数据使用SPSS 19.0软件分析处理。
2 结果 2.1 急性毒性影响急性毒性实验中,对照组及溶剂对照组中日本虎斑猛水蚤未观察到死亡现象,这表明实验中没有溶剂效应;实验组日本虎斑猛水蚤存活率随着TBBPA浓度的升高而逐渐下降,96 h时8.1 mg/LTBBPA组死亡率达到100%(见图 1)。运用软件SPSS 19.0分析求出TBBPA暴露下日本虎斑猛水蚤的96 h-LC50为3.1 mg/L,其95%可信区间为2.841~3.311 mg·L-1,做回归曲线拟合得出TBBPA浓度与日本虎斑猛水蚤96 h存活率的二次曲线方程为y=105.63+1.3x-1.99x2,二次曲线模型拟合度为0.95,P<0.01(见表 1)。
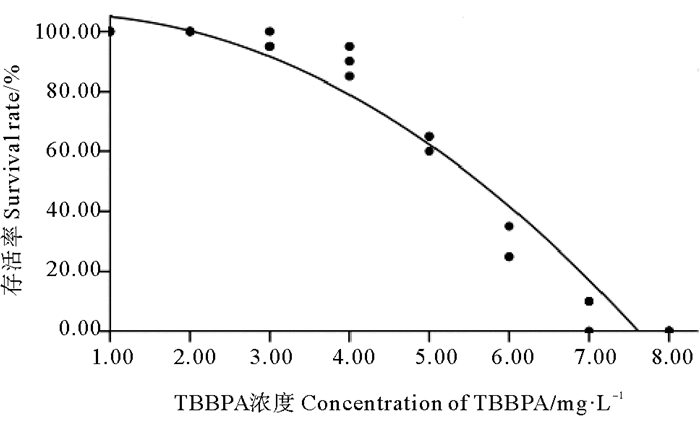
|
图 1 TBBPA暴露下日本虎斑猛水蚤96 h的存活率 Fig. 1 The survival rate of T. japonicus exposed to TBBPA in 96 h |
|
|
表 1 TBBPA对日本虎斑猛水蚤96 h的急性毒性 Table 1 Acute toxicity of TBBPA to T. japonicus in 96 h |
2种暴露方式下TBBPA未对日本虎斑猛水蚤的发育率产生显著影响(见图 2)。对照组、饵料暴露组和水体暴露组日本虎斑猛水蚤无节幼虫发育成功率均在90%以上,分别为98.77%、91.03%和96.94%。与其他两组相比,饵料暴露组发育成功率略低,但各组间无显著差异(P>0.05)。
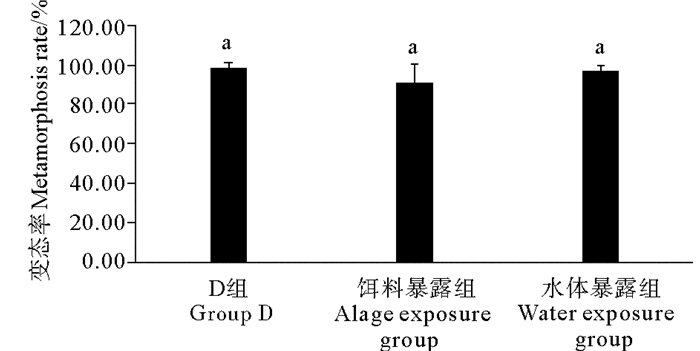
|
( D组为DMSO对照组;不同字母P<0.05;相同字母P>0.05。The solvent control group is abbreviated as D; Different letters P < 0.05; Same letters P > 0.05. ) 图 2 不同暴露方式下TBBPA对日本虎斑猛水蚤无节幼虫变态率的影响 Fig. 2 Effects of TBBPA on metamorphsis rate of T. japonicus in different exposure modes |
对照组、水体暴露组和饵料暴露组中日本虎斑猛水蚤无节幼虫发育至桡足幼体的时间分别为4.76、4.87和4.69 d,各组间无显著差异(P>0.05)(见图 3)。与对照组相比,水体暴露组桡足幼体发育至成熟个体的时间有所延长,但与对照组间没有显著差异(P>0.05);饵料暴露明显缩短了桡足幼体发育至成熟个体的时间,与对照组和水体暴露组均有显著差异(P<0.05)。
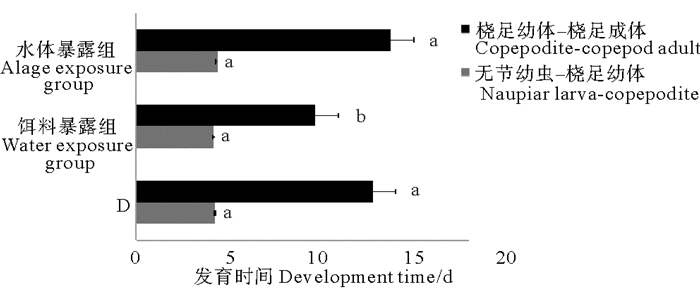
|
( D组为DMSO对照组;不同字母P<0.05;相同字母P>0.05。The solvent control group is abbreviated as D; Different letters P < 0.05; Same letters P > 0.05. ) 图 3 不同暴露方式下TBBPA对日本虎斑猛水蚤发育时间的影响 Fig. 3 Effects of TBBPA on development time of T. japonicus in different exposure modes |
2种暴露方式下TBBPA均缩短了日本虎斑猛水蚤首只挂卵雌体出现的时间(见图 4)。对照组、饵料暴露组和水体暴露日本虎斑猛水蚤第一只挂卵雌体出现的时间分别为16.67、13.33和14.33 d。数据分析显示仅饵料暴露组与对照组间有显著性差异(P<0.05)。
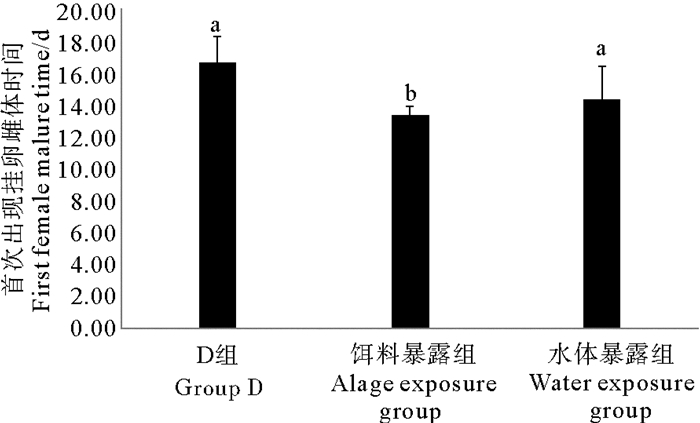
|
( D组为DMSO对照组;不同字母P<0.05;相同字母P>0.05。The solvent control group is abbreviated as D; Different letters P < 0.05; Same letters P > 0.05. ) 图 4 不同暴露方式下TBBPA对日本虎斑猛水蚤首只挂卵雌体出现时间的影响 Fig. 4 Effects of TBBPA on the fist female mature time of T. japonicus in different exposure modes |
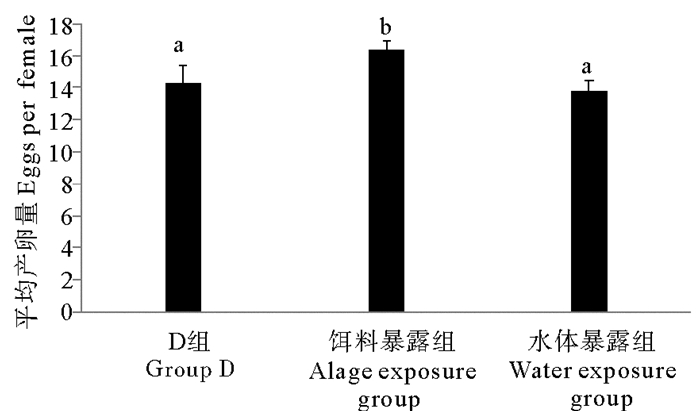
两种暴露方式下TBBPA对日本虎斑猛水蚤的平均产卵量产生了不同的影响(见图 5)。平均产卵量水体暴露组<对照组<饵料暴露组。与对照组相比,水体暴露组雌体平均产卵量略微减少(P>0.05);饵料暴露组产卵量与对照组相比增加显著(P<0.05),与水体暴露组相比增加极显著(P<0.01)。
|
( D组为DMSO对照组;不同字母P<0.05;相同字母P>0.05。The solvent control group is abbreviated as D; Different letters P < 0.05; Same letters P > 0.05. ) 图 5 不同暴露方式下TBBPA对日本虎斑猛水蚤平均产卵量的影响 Fig. 5 Effects of TBBPA on eggs female of T. japonicus in different exposure modes |
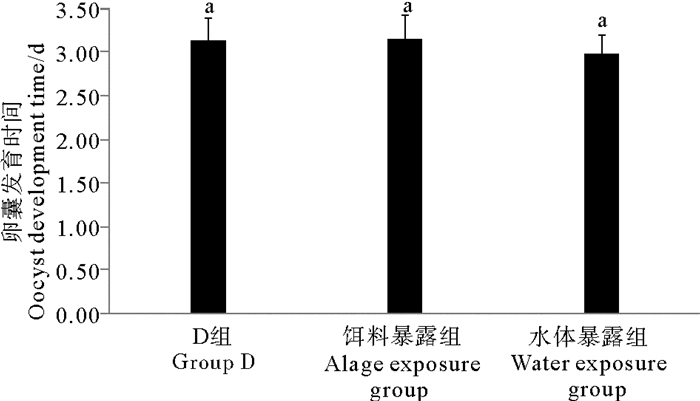
对照组,水体暴露组和饵料暴露组日本虎斑猛水蚤的产卵间隔分别为3.14、2.97和3.15 d(见图 6),各组间均无明显差异(P>0.05)。
|
( D组为DMSO对照组;不同字母P<0.05;相同字母P>0.05。The solvent control group is abbreviated as D; Different letters P < 0.05; Same letters P > 0.05. ) 图 6 不同暴露方式下TBBPA对日本虎斑猛水蚤卵囊发育时间的影响 Fig. 6 Effects of TBBPA on oocyst development time of T.japonicus in different exposure modes |
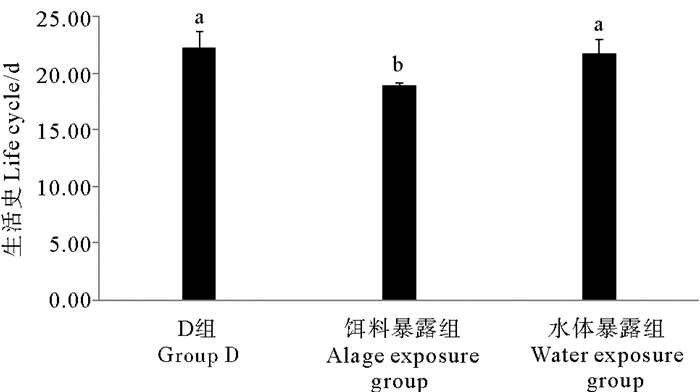
如图 7所示,对照组、饵料暴露组和水体暴露组日本虎斑猛水蚤完成一次生活史所需的时间分别为22.20、18.93和21.69 d。与对照组比,水体暴露组无显著差异(P>0.05);饵料暴露组明显缩短了日本虎斑猛水蚤的生活史周期(P<0.01)。
|
( D组为DMSO对照组;不同字母P<0.05;相同字母P>0.05。The solvent control group is abbreviated as D; Different letters P < 0.05; Same letters P > 0.05. ) 图 7 不同暴露方式下TBBPA对日本虎斑猛水蚤完成一次生活史所需的影响 Fig. 7 Effects of TBBPA on life cycle of T. japonicus in different exposure modes |
TBBPA是一种持久性有机污染物(POPs)和潜在的内分泌干扰物(Endocrine Disrupting Chemicals,EDCs),有研究显示,与五溴联苯醚(BDE)和六溴环十二烷(HBCD)等溴代物相比,其具有甲状腺干扰性、免疫和细胞毒性、神经毒性以及雌激素干扰性等毒性效应,对生物的毒性更高[1, 16]。急性毒性实验结果表明,与哺乳动物相比,TBBPA对水生生物毒性更高[17],如海洋藻类、水蚤、糠虾及鱼类对TBBPA均比较敏感。国际化学品安全规划署(IPCS,International Program on Chemical Safety)公布的TBBPA对虹鳟鱼(Salmo gairdneri)、蓝鳃太阳鱼(Lepomis macrochirus)和黑头软口鲦(Pimephales promelas)的96h-LC50分别为0.4、0.51和0.54 mg·L-1,对糠虾(Mysidopsis bahia)和大型溞(Paphnia magna)的LC50接近1 mg/L(IPCS,1995)[18]。根据《新化学物质危害评估导则(HJ/T154-2004)》的毒性评定标准,TBBPA对多数水生生物的急性毒性均在高毒性甚至极高毒性水平[19]。
本研究测得TBBPA对日本虎斑猛水蚤的96 h-LC50为3.1 mg·L-1。之前的研究结果显示,TBBPA对中华哲水蚤[12](Calanus sinicus)和太平洋真宽水蚤[13](Eurytemora pacifica)的96 h-LC50分为427.6和178 μg·L-1,对拟长腹剑水蚤[20](Oithona similis)48 h-LC50为3.106 mg·L-1。这表明,不同桡足类对TBBPA的耐受能力存在差异,日本虎斑猛水蚤对TBBPA的耐受性相对较高。徐风风[21]在研究四溴联苯醚(BDE-47)对桡足类的急性毒性试验中也发现污染物对不同桡足类的急性毒性存在差异,BDE-47对日本虎斑猛水蚤的96 h-LC50约为太平洋真宽水蚤的15倍。Rajendran和Venugopalan[22]的研究中DDT对桡足类真哲水蚤(Eucalanus sp.)和纺锤水蚤(Acartia sp.)的24 h-LC50也差异显著分别为12和28 μg·L-1。综上所述,桡足类对有机污染物的敏感性具有物种差异性。
本实验中,饵料暴露组明显缩短日本虎斑猛水蚤幼体发育至成体的时间和生活史,这是因为桡足类在各发育期的发育时间受生理制约和外界压力的共同影响[23],而暴露于TBBPA后日本虎斑猛水蚤的摄食率和代谢速率会发生变化,进而影响其生长发育。之前就有研究发现较低浓度的污染物可促进桡足类摄食、加快代谢速度和缩短生活史周期[24]。韩萃等[20]发现,低浓度的TBBPA(0.031 mg·L-1)可促进了拟长腹剑水蚤的发育。王晓敏等[25]的研究同样发现低浓度的污染物可以缩短桡足类发育至成熟个体的时间。巩文静[26]等发现TBBPA暴露能诱导加快拟长腹剑水蚤的摄食速率。徐风风等[21]的研究中同样发现BDE-47能促进太平洋真宽水蚤的摄食率和滤水率,会增加日本虎斑猛水蚤的摄食率、滤水率、耗氧率和排氨率。综上,推测TBBPA可以通过影响日本虎斑猛水蚤的代谢速率进而影响其在日本虎斑猛水蚤体内的积累,最终导致发育时间以及生活史周期的变化。实验中无节幼体变态时间并没有受到TBBPA的毒性影响,可能是因为日本虎斑猛水蚤无节幼虫期对青岛大扁藻的摄食量较低,体内蓄积的TBBPA不足以产生毒性效应。郑重等[27]就曾指出桡足类无节幼虫期可分为六期,前三期依靠卵黄为生,第Ⅳ期才开始进行摄食。另外,还有研究表明,污染物会干扰桡足类蜕皮激素的调节,导致蜕皮过程的紊乱,进而影响桡足类的发育时间[28-29]。在之后的研究中,探究TBBPA对桡足类蜕皮激素的影响,有利于我们更好的了解TBBPA的毒性作用机制。
相比对照组,饵料暴露组日本虎斑猛水蚤第一只挂卵雌体出现的时间明显缩短。这是因为TBBPA具有弱的雌激素效应[30],在一定浓度范围内会促进日本虎斑猛水蚤水蚤卵巢的成熟。Andersen等[31]也发现低浓度的双酚A(20 μg·L-1)能刺激汤氏纺锤水蚤(Acartia tonsa)卵巢的成熟。饵料暴露组日本虎斑猛水蚤卵囊发育时间的略微缩短和产卵量的显著增加,表明在一定的污染物浓度范围内,面对胁迫桡足类倾向于分配更多的能量用于个体的繁殖。Walthall W K和Michalek-Wagner K等[32-33]研究也发现,逆境条件下生物体会进行能量重新分配,通过增加生殖量来掩盖死亡率的上升,以维持种群稳定。Andersen H R和季更生等[31, 34]也发现,一定浓度的污染物的刺激可引起桡足类产卵率增高。Siu等[35]的研究中0.2 μg·L-1多氯联苯提高了火腿伪镖水蚤的产卵率。此外,一定污染物浓度范围内,污染物可刺激桡足类摄食增加、代谢速度加快[24],进而引起产卵率增高[31]。另外,本研究只观察了TBBPA对日本虎斑猛水蚤单世代生殖力的变化,TBBPA的多世代暴露下桡足类的生殖策略是否会发生改变需要进一步的探究。
两种暴露方式下,仅饵料暴露组对日本虎斑猛水蚤的发育、繁殖产生了影响,这表明暴露方式会影响TBBPA在日本虎斑猛水蚤体内的蓄积。之前也有研究发现,污染物在生物体内的蓄积受多种因素的影响,如:污染物的理化性质、生物体自身的代谢能力、年龄、性别以及污染物暴露浓度、方式和环境因素等,其中污染物不同的暴露方式是影响污染物在生物体内积累的关键因素[10-11]。TBBPA水体暴露未对日本虎斑猛水蚤发育、繁殖产生影响,可能是因为日本虎斑猛水蚤体表有几丁质外壳的保护,可以有效地阻止污染物的渗入,水体中仅有极少量的TBBPA可以进入日本虎斑猛水蚤体内。Mauchline[36]也曾报道桡足类很少或几乎不能通过体表吸收海水中的污染物。而饵料暴露组中扁藻蓄积的TBBPA通过食物链直接传至日本虎斑猛水蚤并在其体内进行较为快速地蓄积。Wallberg等[37]就曾指出营养转移是疏水性有机污染物沿浮游生物群落转移的一个重要途径。Zhang Q等[38]发现摄食积累是海洋桡足类和鱼类中二噁英积累的主要途径。Magnusson, K等[39]的研究证明食物摄取是EDCs营养转移的关键途径。另外,在研究重金属对桡足类的的毒性影响时也发现了暴露方式会影响毒物在桡足类体内的蓄积。王文雄等[40]发现海洋动物(包括无脊椎动物和鱼类)中富集重金属的主要途径是食物暴露。Hook SE等[41-42]的研究显示藻类暴露于远低于安全浓度以下的重金属后被桡足类摄食,会导致桡足类的正常繁殖活动受抑,饵料暴露会使桡足类体内重金属负荷成倍增加。此外,Gretchen等[43]研究中也发现了同样的现象,汤氏纺锤水蚤直接暴露于水体低浓度重金属未产生毒性效应,一旦以提前暴露的浮游植物作为桡足类的饵料,其繁殖则受到显著影响。虽然环境胁迫不尽相同,但上述结果与本研究的结果基本一致。
综上所述,TBBPA会对日本虎斑猛水蚤的生殖发育产生影响,发育时间和繁殖力对毒物的敏感性较高,具有在低浓度下可检测的特点。TBBPA饵料暴露对日本虎斑猛水蚤的影响更大,暴露方式会影响TBBPA在日本虎斑猛水蚤体内的积累速率。
| [1] |
晋艺聪, 刘丽华, 罗贤丽, 等. 四溴双酚A的降解性和毒性研究进展[J]. 中央民族大学学报(自然科学版), 2010, 19(2): 5-10. Jin Y C, Liu L H, Luo X L, et al. Research progress on the degradability and toxicity of tetrabromobisphenol-A[J]. Journal of MUC(Natural Sciences Edition), 2010, 19(2): 5-10. DOI:10.3969/j.issn.1005-8036.2010.02.001 (  0) 0) |
| [2] |
Jakobsson K, Thuresso K, Rylander L, et al. Exposureto polybrominated diphenyl ethers and tetrabromobis-phenol A among computer technicians[J]. Chemosphere, 2002, 46(5): 709-716. DOI:10.1016/S0045-6535(01)00235-1
(  0) 0) |
| [3] |
Morris S, Allchin C R, Zegers B N, et al. Distribution and fate of HBCD and TBBPA brominated flame retardants in North Sea estuaries and aquatic food webs[J]. Environmental Science & Technology, 2004, 38(21): 5497-504.
(  0) 0) |
| [4] |
薛银刚, 王晓蓉, 顾雪元, 等. 四溴双酚A对赤子爱胜蚓的急性毒性及抗氧化防御系统酶的影响[J]. 生态毒理学报, 2009, 4(1): 93-100. Xue Y G, Wang X R, Gu X Y, et al. Acute toxicity of tetrabromobisphenol-A to Earthworms Eisenia fetida and its effects on antioxidant defense system enzymes[J]. Asian Journal of Ecotoxicology, 2009, 4(1): 93-100. (  0) 0) |
| [5] |
杜苗苗, 张娴, 颜昌宙. 溴系阻燃剂的毒理学研究进展[J]. 生态毒理学报, 2012, 7(6): 575-584. Du M M, Zhang X, Yan C Y. Advance in researches on toxicology of brominated flame retardants[J]. Asian Journal of Ecotoxicology, 2012, 7(6): 575-584. (  0) 0) |
| [6] |
郑重, 李少菁, 许振祖. 海洋浮游生物学[M]. 北京: 海洋出版社, 1984. Zhang Z, Li S Z, Xu Z Z. Marine Planktology[M]. Beijing: China Ocean Press, 1984. (  0) 0) |
| [7] |
Kwok K W H, Leung K M Y. Toxicity of antifouling biocides to the intertidal harpacticoid copepod Tigriopus japonicus, (Crustacea, Copepoda): Effects of temperature and salinity[J]. Marine Pollution Bulletin, 2005, 51(8-12): 830-837. DOI:10.1016/j.marpolbul.2005.02.036
(  0) 0) |
| [8] |
Li L, Guo D H, Zhu X M. Study on acute toxicity of triazophos and acephate on marine copepods[J]. Journal of Xiamen University, 2008.
(  0) 0) |
| [9] |
Raisuddin S, Kwok K W H, Leung K M Y, et al. The copepod Tigriopus: A promising marine model organism for ecotoxicology andenvironmental genomics[J]. Aquatic Toxicology, 2007, 83(3): 161-173. DOI:10.1016/j.aquatox.2007.04.005
(  0) 0) |
| [10] |
Andersson P L, Berg A H, Bjerselius R, et al. Bioaccumulation of selected PCBs in zebrafish, three-spined stickleback, and arctic char after three different routes of exposure[J]. Archives of Environmental Contamination & Toxicology, 2001, 40(4): 519-30.
(  0) 0) |
| [11] |
Zhou H Y, Cheung R Y H, Wong M H. Bioaccumulation of organochlorines in freshwater fish with different feeding modes cultured in treated wastewater[J]. Water Research, 1999, 33(12): 2747-2756. DOI:10.1016/S0043-1354(98)00506-5
(  0) 0) |
| [12] |
刘树苗.四溴双酚A对中华哲水蚤(Calanus sinicus)摄食、代谢及抗氧化防御系统的影响[D].青岛: 中国海洋大学, 2012: 17-18. Liu S M. The Effects of Tetrabromobisphenol-A on Ingest-Ion, Metabolism and Antioxidant Defense System of Calanus sinicus[D]. Qingdao: Ocean University of China, 2012: 17-18. (  0) 0) |
| [13] |
巩文静, 朱丽岩, 郝雅, 等. 四溴双酚A对太平洋真宽水蚤的急性毒性及氧化胁迫[J]. 生态毒理学报, 2016(4): 232-238. Gong W J, Zhu L Y, Hao Y, et al. Acute toxicity and oxidative stress of tetrabromobis-phenol A to Eurytemora pacifica[J]. Asian Journal of Ecotoxicology, 2016(4): 232-238. (  0) 0) |
| [14] |
Kwok K W H., Leung K M Y. Toxicity of antifouling biocides to the intertidal harpacticoid copepod Tigriopus japonicus (Crustacea, Copepoda): Effects of temperature and salinity[J]. Marine Pollution Bulletin, 2005, 51(8): 830-837.
(  0) 0) |
| [15] |
梁永莉, 季宏兵, 朱毅. 莱茵衣藻的双酚A毒性效应及生物富集和降解作用研究[J]. 环境科学与技术, 2014, 37(6): 25-31, 96. Liang Y L, Ji H B, Zhu Y. Toxic effect for bisphenol A to Chlamydomonas reinhardtii and its bioaccumulation and biodegradation[J]. Environmental Science & Technology, 2014, 37(6): 25-31, 96. (  0) 0) |
| [16] |
张普青.巢湖鱼体内四溴双酚A与多溴二苯醚暴露水平的研究[D].哈尔滨: 东北林业大学, 2011. Zhang P Q. The Research of Exposure Level of Tetrabromobisphenol-A and Polybrominated Diphenyl Ethers in the Chaohu Lake Fish[D]. Haerbin: Northeast Forestry University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10225-1011146895.htm (  0) 0) |
| [17] |
Shi H, Wang X, Yi L, et al. Electron paramagnetic resonance evidence of hydroxyl radical generation and oxidative damage induced by tetrabromobisphenol-A in Carassius auratus[J]. Aquatic Toxicology, 2005, 74(4): 365-371. DOI:10.1016/j.aquatox.2005.06.009
(  0) 0) |
| [18] |
WHO. Environmental Health Criteria 172: Tetrabromobisphenol A and Derivatives[S]. Geneva, Switzerland: International Programme on Chemical Safety, 1995, 172: 25-47.
(  0) 0) |
| [19] |
国家环境保护总局. HJ/T153-2004新化学物质危害评估导则[S].北京: 中华人民共和国环境保护部, 2004. State Environmental Protection Administration. HJ/T153-2004 New Chemical Hazard Assessment Guidelines[S]. Beijing: Ministry of Ecology and Environment of the People's Republic of China, 2004 (  0) 0) |
| [20] |
韩萃, 朱丽岩, 江田田, 等. 不同温度盐度下TBBPA对拟长腹剑水蚤的毒性效应[J]. 中国海洋大学学报(自然科学版), 2018, 48(1): 49-56. HAN C, ZHU L Y, JIANU T T, et al. The effect of TBBPA on copepod(Oithona similis) under different salinity and temperature[J]. Periodical of Ocean University of China, 2018, 48(1): 49-56. (  0) 0) |
| [21] |
徐风风, 朱丽岩, 巩文静, 等. 四溴联苯醚(BDE- 47)对两种海洋桡足类动物的毒性效应[J]. 生态毒理学报, 2013, 8(5): 737-747. Xu F F, Zhu L Y, Gong W J, et al. Toxic effects of BDE-47 on two marine copepods[J]. Asian Journal of Ecotoxicology, 2013, 8(5): 737-747. (  0) 0) |
| [22] |
Rajendran N, Venugopalan V K. Toxicity of organochlorine pesticides to zooplankton of Vellar Estuary[J]. Indian Journal of Marine Science, 1988, 17(2): 168-169.
(  0) 0) |
| [23] |
Peterson W T. Patterns in stage duration and development among marine and freshwater calanoid and cyclopoid copepods: A review of rules, physiological constraints, and evolutionary significance[J]. Hydrobiologia, 2001, 453-454(1): 91-105.
(  0) 0) |
| [24] |
林汝榕, 李少菁. 铜、镉对中华哲水蚤氨基酸含量影响的实验研究[J]. 海洋与湖沼, 1991, 22(3): 242-248. Lin R R, Li S J. Effects of copper and cadmium on amino acids in Calanus sinicus[J]. Chinese Journal of Oceanology and Limnology, 1991, 22(3): 242-248. (  0) 0) |
| [25] |
王晓敏, 朱丽岩, 陈学超, 等. 六溴环十二烷对拟长腹剑水蚤的急性毒性和生殖发育毒性效应[J]. 中国海洋大学学报(自然科学版), 2017, 47(1): 82-88. Wang X M, Zhu L Y, Chen X C, et al. Toxic Effect of HBCD on the acute toxicity, development and reproduction of Oithona Similes[J]. Periodical of Ocean University of China, 2017, 47(1): 82-88. (  0) 0) |
| [26] |
巩文静.四溴双酚A(TBBPA)对河口常见桡足类的毒性效应及其在中国北方海域的污染分布状况[D].青岛: 中国海洋大学, 2016. Gong W J. Toxic Effects of Tetrabromobisphenol A (TBBPA) on Copepods in the Estuary and Its Pollution Distribution in Northern China[D]. Qingdao: Ocean University of China, 2016. (  0) 0) |
| [27] |
郑重. 浮游生物学概论[M]. 北京: 科学出版社, 1965. Zheng Z. Essential of Planktology[M]. Beijing: Science Press, 1965. (  0) 0) |
| [28] |
Davies R, Zou E. Polybrominated diphenyl ethers disrupt molting in neonatal Daphnia magna[J]. Ecotoxicology, 2012, 21(5): 137-138.
(  0) 0) |
| [29] |
Wollenberger L, Dinan L, Breitholtz M. Brominated flame retardants: Activities in a crustacean development test and in an ecdysteroid screening assay[J]. Environmental Toxicology and Chemistry, 2005, 24(2): 400-407. DOI:10.1897/03-629.1
(  0) 0) |
| [30] |
Nakajima A, Saigusa D, Tetsu N, et al. Neurobehavioral effects of tetrabromobisphenol A, a brominated flame retardant, in mice[J]. Toxicology Letters, 2009, 189(1): 78-83. DOI:10.1016/j.toxlet.2009.05.003
(  0) 0) |
| [31] |
Andesen H R, Hailing Sorensen B, Kusk K O. A parameter for detecting estrogenic exposure in the copepod Acartia tonsa[J]. Ecotoxicology and Encironmental Safety, 1999, 44: 56-61. DOI:10.1006/eesa.1999.1800
(  0) 0) |
| [32] |
Walthall W K, Stark J D. A comparison of acute mortality and population growth rate as endpoints of toxicological effect[J]. Ecotoxicol Environ Saf, 1997, 37(1): 45-52. DOI:10.1006/eesa.1997.1521
(  0) 0) |
| [33] |
Michalek-Wagner K, Willis B L. Impacts of bleaching on the soft coral Lobophytum compactum. Ⅰ. Fecundity, fertilization and offspring viability[J]. Coral Reefs, 2001, 19(3): 231-239. DOI:10.1007/s003380170003
(  0) 0) |
| [34] |
季更生, 钱海丰, 刘光兴. 铜离子对克氏纺锤水蚤影响的初步研究[J]. 海洋通报, 2001, 20(1): 92-96. Ji G S, Qian H F, Liu G X. Effect of copper ions on Daphnia magna[J]. Marine Science Bulletin, 2001, 20(1): 92-96. DOI:10.3969/j.issn.1001-6392.2001.01.015 (  0) 0) |
| [35] |
Siu W H, Hung C L, Wong H L, et al. Exposure and time dependent DNA strand breakage in hepatopancreas of green-lipped mussels (Perna viridis) exposed to Aroclor 1254, and mixtures of B[J]. Marine Pollution Bulletin, 2003, 46(10): 1285-1293. DOI:10.1016/S0025-326X(03)00234-0
(  0) 0) |
| [36] |
Mauchline J. The Biology of Calanoid Copepodes[M]. Beaconvale, Parow: Adv Mar Biol, 1998: 33.
(  0) 0) |
| [37] |
Wallberg P, Jonsson P R, Andersson A. Trophic transfer and passive uptake of a polychlorinatedbiphenyl in experimental marine microbial communities[J]. Environmental and Chemistry, 2001, 20(10): 2158-2164. DOI:10.1002/etc.5620201004
(  0) 0) |
| [38] |
Zhang Q, Yang L, Wang W X. Bioaccumulation and trophic transfer of dioxins in marine copepods and fish[J]. Environmental Pollution, 2011, 159(12): 3390-3397. DOI:10.1016/j.envpol.2011.08.031
(  0) 0) |
| [39] |
Magnusson K, Magnusson M, Ostberg P, et al. Bioaccumulation of 14C-PCB 101 and 14C-PBDE 99 in the marine planktonic copepod Calanus finmarchicus under different food regimes[J]. Marine Environmental Research, 2007, 63(1): 67-81. DOI:10.1016/j.marenvres.2006.07.001
(  0) 0) |
| [40] |
王文雄, 潘进芬. 重金属在海洋食物链中的传递[J]. 生态学报, 2004, 24(3): 599-604. Wang W X, Pan F J. The transfer of metals in marine food chains: A review[J]. Acta Ecologica Sinica, 2004, 24(3): 599-604. DOI:10.3321/j.issn:1000-0933.2004.03.030 (  0) 0) |
| [41] |
Hook S E, Fisher N S. Reproductive toxicity of metals in calanoid copepods[J]. Marine Biology, 2001, 138: 1131-1140. DOI:10.1007/s002270000533
(  0) 0) |
| [42] |
Hook S E, Fisher N S. Sublethal effects of silver in zooplankton: Importance of exposure pathways and implications for toxicity testing[J]. Environmental Toxicology and Chemistry, 2001, 20(3): 568-574. DOI:10.1002/etc.5620200316
(  0) 0) |
| [43] |
Gretchen K, Bielmyer, Martin Grosell, et al. Toxicity of silver, zinc, copper and nickel to the copepod acartia tonsa exposed via a phytoplankton diet[J]. Environmental Science & Technology, 2006, 40(6): 2063-2068.
(  0) 0) |
 2019, Vol. 49
2019, Vol. 49


