2. 青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237;
3. 东营市三角洲养殖繁育有限公司,山东 东营 257000
CO2是导致全球变暖的主要温室气体,《2021年全球气候状况》报告指出,2021年全球气温平均值已经比工业化前(1850—1900年)高出(1.11±0.13) ℃,2015—2021年是人类有气温记录以来最热的7年[1]。全球变暖及其引发的负面影响严重威胁着人类的生存,制约着人类社会进步与发展[2-3]。为控制CO2温室气体的排放,减缓全球气候变暖的进程,中国提出了碳达峰、碳中和的目标。在此背景下,不同类型生态系统在碳循环中的作用已成为研究热点。
水生生态系统在为人类提供资源以及影响大气CO2含量方面发挥着重要作用[4]。在过去的几十年里,研究人员对不同类型水生态系统CO2通量进行了相关研究,其中最关注的是自然水生生态系统,如沿岸海域[5-6]、河流[7-8]、淡水湖泊[9-10]和水库[11-12]。总体而言,海洋是大气CO2的汇,内陆水体表现为大气CO2的源[13]。近年来,一些学者开展了人工水体系统如养殖池塘的水-气界面CO2通量的研究[14-16],但目前养殖池塘水-气界面CO2通量实测数据还相对较少。因此,有必要开展不同类型池塘系统水-气界面CO2通量研究。
本研究以凡纳滨对虾(Litopenaeus vannamei)池塘单养系统(L)、凡纳滨对虾-硬壳蛤(Mercenaria mercenaria)池塘综合养殖系统(LM-L、LM-M、LM-H)为研究对象,利用静态箱-气相色谱法逐月测定了养殖期间(5—9月)池塘水-气界面CO2通量,分析了CO2通量与环境因子的关系,研究结果有助于了解海水池塘养殖系统碳源/汇功能,为双碳政策制定提供参考。
1 材料与方法 1.1 实验地点与养殖管理实验在山东省东营市黄河三角洲养殖繁育有限公司开展,选择4口面积均为0.2 hm2、水深1.2 m的池塘。共设置4种养殖模式,具体放养情况见表 1。其中,凡纳滨对虾放养时平均体长(1.60±0.21) cm,平均体质量(0.02±0.01) g;硬壳蛤放养时平均壳长(1.79±0.18) cm,平均壳高(0.83±0.07) cm,平均体质量(1.44±0.35) g。养殖期间不换水,每个池塘配备2个增氧机,每天运行2次,分别于06:00和18:00投喂一次对虾配合饲料,日投喂量为对虾体质量的3%~5%。养殖时间为2021年5—9月。
|
|
表 1 养殖生物放养情况(n=30; x±SD) Table 1 1 Stocking of culture species(n=30; x±SD) |
于2021年5—9月,逐月采集并测定养殖池塘水环境因子和水-气界面CO2通量。每个池塘沿对角线设置3个采样点,同时采集气体样品和原位水质样品。
使用便携式风速仪测定(AVM-03) 风速(水面以上3 m)和气温,使用WS30手持气象仪测定气压,使用海水温度计测定水温,使用便携式pH计测定pH,使用便携式盐度计测定盐度,使用塞式透明度盘测定透明度,用黑白瓶法测定水体初级生产力和呼吸量[17]。参考《海洋监测规范》(GB17378.4—2007)测定氨氮、硝酸氮、亚硝酸氮、磷酸盐、总氮、总磷、叶绿素a和溶解氧[18]。
利用静态箱-气相色谱法对水-气界面CO2气体进行采集和测定。静态箱设计、气体采集和检测方法参考Chen等[14]和张东旭等[15]。具体方法如下:实验所用静态箱为一无底面透明的有机玻璃圆筒(内直径30 cm,高50 cm),箱体外层贴有锡箔胶带,防止阳光直射导致箱内温度过高。箱顶部有一直径为1 cm左右的小孔,分别用于固定检测箱内温度的温度计、平衡箱体内外气压的细玻璃管和收集箱内气体的玻璃导管,其中玻璃导管通过乳胶导管、三通阀和100 mL的医用注射器相连接,采样箱内部倒置一4.5 V的小风扇,以充分混合箱内气体。采样时间控制在上午09:00—12:00。采样时,将静态箱固定在由充气内胎构成的漂浮装置上,箱体没入水体的深度约为5 cm。采集气体前,先用注射器反复抽取箱内气体使其充分混合,之后每隔10 min采集一次,在30 min内共采集4次。将收集的气体注入真空袋中带回实验室,用日本岛津公司生产的GC-2010气相色谱仪测定。进样单元为MGS-4型六通阀装置,气体在柱温为40 ℃的GDX-502不锈钢柱(60~80目)中分离,分离出的CO2经过MTN-1型甲烷转化炉(375 ℃)被转化为CH4后,在FID检测器(氢离子火焰检测器)中检测出峰,其中检测器和WBI进样口温度分别为220和200 ℃。为确保仪器的稳定性和测量精度,每4个气体样品间测定一个标准气体样品。标准气体样品由国家标准物质中心生产,其CO2的浓度为4.80×10-4。CO2通量根据静态箱中CO2气体浓度随时间线性变化的斜率计算,计算公式如下:
| $ F=\frac{M}{V_0} \frac{P}{P_0} \frac{T_0}{T} H \frac{\mathrm{d} c}{\mathrm{~d} t} $ |
式中:F为单位时间单位面积内CO2气体的交换通量,单位为mg·m-2·h-1;V0为目标气体标准状态下的摩尔体积,即22.41 L·mol-1;M为摩尔质量;T0和P0为标准状态下理想气体的气温和空气压强(分别为273.15 K和1 013.25 hPa);H为采样箱内气室高度;T和P为采样箱内的气温和实际气压,T由静态箱体内部温度计测定,P通过WS30手持式气象仪测定;dc/dt为箱内测定气体浓度随时间变化的线性回归直线斜率。CO2通量值为正表示系统向大气排放CO2,为负则表示系统从大气中吸收CO2。
1.3 数据处理采用SPSS 25.0对数据进行统计分析,用ANOVA对不同养殖系统CO2通量和环境因子的差异进行分析,用Pearson双变量相关性分析水-气界面CO2通量与环境因子的关系,利用逐步多元回归法建立CO2通量和环境因子的最优回归方程。采用Origin2019完成图形绘制。
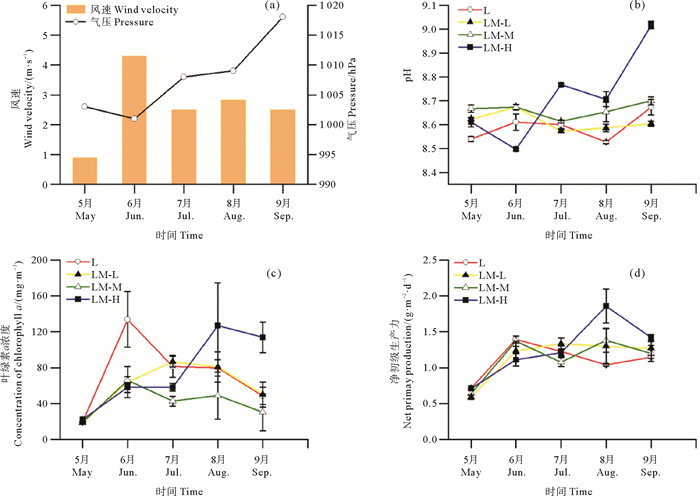
2 结果 2.1 气象因子和水体理化因子养殖期间气压和风速的变化趋势如图 1(a)所示。其中,风速变化范围为0.9~4.3 m·s-1,平均为2.6 m·s-1;气压变化范围为1 001~1 018 hPa,平均为1 007.8 hPa。
|
图 1 养殖期间风速(a)、气压(a)、pH(b)、叶绿素a(Chl-a)浓度(c)和净初级生产力(NPP)(d)的变化 Fig. 1 Variations in wind velocity and pressure(a), water pH (b), chlorophyll-a (Chl-a) concentration (c) and net primary production (NPP) (d) during the culture period |
养殖期间的水质变化见表 2。其中,水温变化范围为19.14~31.21 ℃,呈先升高后降低的变化趋势,平均水温(25.29±3.04) ℃;盐度变化范围为29.53~32.24,整体较稳定;溶解氧变化范围为4.65~9.43 mg·L-1,最高出现在8月((9.04±0.34) mg·L-1);透明度变化范围为15~93 cm,最高出现在5月((92±1) cm)。4种养殖系统中水温、盐度、透明度和溶解氧均无显著性差异(P>0.05)。水体硝态氮浓度变化范围为0.20~0.51 mg·L-1,氨氮浓度变化范围为0.10~0.56 mg·L-1,磷酸盐浓度变化范围为0.001~0.099 mg·L-1,总氮浓度变化范围为2.13~9.52 mg·L-1,总磷浓度变化范围为0.04~0.70 mg·L-1,4种养殖系统间差异均不显著(P>0.05)。
|
|
表 2 不同养殖系统的水质指标(n=60; x±SD) Table 2 Water quality factors of different aquaculture systems(n=60; x±SD) |
养殖期间水体pH、叶绿素a浓度(Chl-a)、净初级生产力(NPP)的变化如图 1所示。pH变化范围为8.49~9.03,L、LM-L、LM-M、LM-H的pH平均值分别为8.59、8.61、8.66、8.72,LM-H的pH显著高于L(P < 0.05);叶绿素a浓度的变化范围为17.7~181.5 mg·m-3,平均叶绿素a浓度分别为72.6、59.9、50.1、75.8 mg·m-3,LM-M叶绿素a浓度显著低于其余三组(P < 0.05);净初级生产力变化范围为0.56~2.13 g·m-2·d-2,L、LM-L、LM-M、LM-H的平均净初级生产力分别为1.10、1.14、1.13、1.26 g·m-2·d-2,L组水体净初级生产力显著低于其余三组(P < 0.05)。
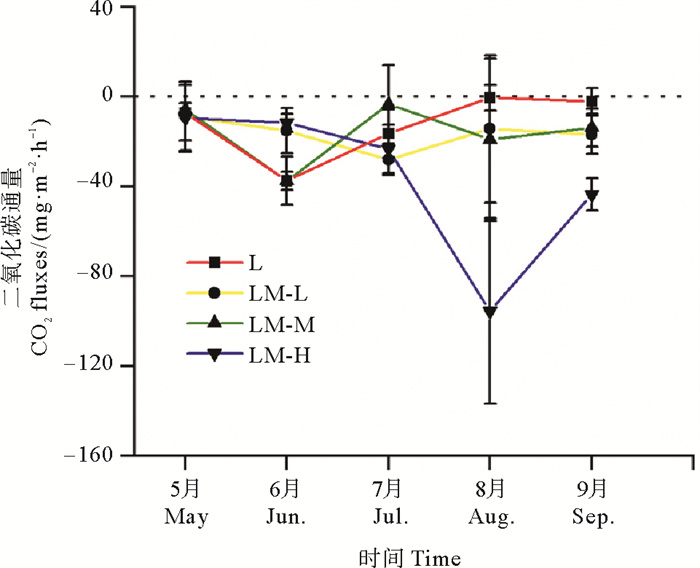
2.2 水-气界面CO2通量4种养殖系统5—9月养殖期间静态箱的T值分别为296.65、302.65、305.15、302.15和297.15 K,水-气界面CO2浓度线性回归斜率dc/dt如表 3所示,水-气界面CO2通量随养殖时间的变化如图 2所示。养殖期间,单养系统L水-气界面CO2通量变化范围为-42.05~7.01 mg·m-2·h-1(平均值-12.66 mg·m-2·h-1),在养殖期间均表现为碳汇;三种综合养殖系统LM-L、LM-M、LM-H的水-气界面CO2通量均为负值,变化范围分别为-50.13~14.32 mg·m-2·h-1(平均值-16.02 mg·m-2·h-1)、-57.29~14.32 mg·m-2·h-1(平均值-16.48 mg·m-2·h-1)和-143.23~7.01 mg·m-2·h-1(平均值-36.70 mg·m-2·h-1),在养殖期间均表现为碳汇。方差分析显示,LM-H的通量值显著低于L、LM-L和LM-M的通量值(P < 0.05)。
|
|
表 3 不同养殖系统的CO2浓度线性回归斜率dc/dt Table 3 Linear regression slope of CO2 concentration of different aquaculture systems dc/dt |
|
图 2 不同养殖系统水-气界面CO2通量随养殖时间的变化 Fig. 2 Changes of CO2 flux on water-air interface in different aquaculture systems with culture period |
由表 4可知,L的通量值与水温相关性不显著,与DO、Chl-a和NPP均呈显著负相关关系(P < 0.01);LM-L的通量值与DO、Chl-a和NPP呈显著负相关关系(P < 0.01);LM-M的通量值与Chl-a和NPP呈显著负相关关系(P < 0.01);LM-H的通量值与DO、Chl-a和NPP呈显著负相关关系(P < 0.01)。随着硬壳蛤放养密度的增加,三种对虾综合养殖系统的CO2通量值与水体Chl-a和NPP的负相关关系增强。
|
|
表 4 CO2通量与环境因子的相关性 Table 4 Correlation between CO2 flux and environmental factors |
养殖系统水-气界面CO2通量与水质因子的逐步多元回归分析结果如表 5所示。由表 5可以看出,对虾单养系统水-气界面CO2通量主要受水体净初级生产力的影响,其次是透明度。对虾综合养殖系统水-气界面CO2通量主要受净初级生产力的影响,其次受透明度和溶解氧浓度的影响。因此,水体净初级生产力是影响对虾养殖系统水-气界面CO2通量的重要因子。
|
|
表 5 CO2通量与环境因子的多元线性回归方程 Table 5 Multiple linear regression equation between CO2 flux and environmental factors |
本研究中,凡纳滨对虾池塘单养系统水-气界面CO2通量平均为-12.66 mg·m-2·h-1,凡纳滨对虾-硬壳蛤池塘综合养殖系统CO2通量平均为-23.74 mg·m-2·h-1,均低于湖泊[9, 19]、水库[20-21]和河流[22-23]等自然生态系统的通量值,也低于团头鲂(Megalobrama amblycephala)[24]、草鱼(Ctenopharyngodon idella)[25]、草鱼-凡纳滨对虾[26]淡水池塘养殖系统的通量值,接近于日本对虾(Marsupenaeus japonicus)-刺参(Apostichopus japonicus)[14]、日本对虾-三疣梭子蟹(Portunus trituberculatus)[16]、日本对虾-三疣梭子蟹-缢蛏(Sinonovacula constricta)[16]和脊尾白虾(Exopalaemon carinicauda)-三疣梭子蟹[27]海水池塘综合养殖系统的通量值(见表 6)。
从表 6可以看出,淡水鱼类投饲养殖系统水-气界面一般表现为大气CO2的源,海水虾蟹投饲养殖系统一般表现为大气CO2的汇,本研究中4种凡纳滨对虾投饲养殖系统也表现为大气CO2的汇。两类养殖系统表现不同的原因可能是:(1)养殖生物生长方式不同,鱼类为连续性生长,而虾蟹为非连续性生长,在生长过程中需要经过多次蜕壳;(2)在虾蟹投饲养殖池塘中一般混养滤食性贝类,贝类通过滤食浮游植物、颗粒有机碳和外壳钙化等途径,直接或间接的促进了碳汇功能的发挥[28-29]。
|
|
表 6 不同生态系统水-气界面CO2通量的比较 Table 6 Comparisons of CO2 fluxes across the water-air interface in different ecosystems |
本研究中,三种凡纳滨对虾池塘综合养殖系统水-气界面CO2通量整体呈先下降后上升的趋势,对于同一个养殖系统,贝类的放养密度是固定的,随着养殖的进行,不同月份的CO2通量并不相同,在整个养殖期间整体上呈先下降后上升的趋势,表明相同密度的贝类在不同的生长阶段产生了不同的生态效应。对于相同的月份(如图 1中的8、9月),随着贝类放养密度的增加,LM-L,LM-M,LM-H的碳汇能力逐渐增强,均高于对虾单养模式L(分别比单养系统提高了26.54%、30.17%和189.89%),这表明随着硬壳蛤密度的增加,碳汇能力逐渐增强。
三种综合系统的CO2通量和水质因子(pH、Chl-a、NPP)间存在显著差异,CO2通量的差异与Chl-a、NPP水质因子的差异相似(见图 1和图 2),随硬壳蛤放养密度的增加,CO2通量与水体Chl-a和NPP的负相关关系增强(见表 4)。这表明不同放养密度的硬壳蛤对养殖系统产生不同的生态效应,从而影响了水体的水质因子,并最终影响了水体的CO2通量。滤食性贝类是养殖生态系统中重要的生态类群,通过摄食、钙化、呼吸、排粪等生理活动影响着水生生态系统间生物的相互作用和生物地球化学循环过程[29]。滤食性贝类排泄的氨氮营养盐对浮游植物具有促进作用,产生“上行”效应,但同时贝类对浮游植物的滤食又会产生“下行”效应。在贝类放养密度较低时,其“上行”效应高于“下行”效应,能刺激浮游植物生长,提高系统的初级生产力[30-31]。相反,过高放养密度则会使“下行”效应高于“上行”效应,而降低系统的初级生产力[32-34]。本研究中,在养殖前、中期(5—8月),硬壳蛤相对较小,我们推测其可能通过“上行”效应促进了浮游植物的生长,提高了系统对CO2的吸收速率,使得水体碳汇能力增强。到养殖后期(8—9月),随着硬壳蛤的生长,其对浮游植物的“下行”效应增强,降低了系统的初级生产力,导致水体碳汇能力减弱。张东旭等[16]的研究也表明,适宜的缢蛏放养密度可提高日本对虾-三疣梭子蟹养殖系统水-气界面CO2汇能力,但过高的缢蛏放养密度会低系统CO2汇能力。
3.2 影响CO2通量的关键驱动因子研究发现,水温影响CO2的产生和消耗,是影响CO2通量的重要因素之一[21]。然而,水温对CO2产生和消耗过程的影响是不成比例的,因为这些过程具有不同的最佳反应条件[16], 而不同过程引起的CO2浓度变化是可以相互抵消的,这可能是本研究中水温与CO2通量相关性不明显的原因。因此,认为水温不是影响影响系统CO2通量的主要因子。
溶解氧浓度在一定程度上反映了水体中的光合作用和呼吸作用的相对强度,较高的溶解氧浓度表明水中浮游植物的光合作用占据了主导地位。在水生生态系统中,溶解氧浓度通常与CO2通量呈负相关关系[35-36],本研究中,溶解氧浓度在整个养殖周期中均保持了较高水平,三种养殖系统的溶解氧浓度与CO2通量均呈显著负相关(见表 4),因此,认为溶解氧浓度是影响系统CO2通量的主要因子。
通常认为,水体pH增加可促进CO2和HCO3-向CO32-的解离转化,导致水中CO2含量下降,进而从大气中吸收更多的CO2[37-38],因此,CO2通量与水体pH有较强的相关性[15, 39]。在本研究中,三种对虾综合养殖系统的CO2通量与pH呈显著负相关(P<0.05),而单养系统的CO2通量与pH相关性不明显(P>0.05),原因有待进一步分析。
在水生生态系统中,浮游植物的光合作用是调控系统水-气界面CO2通量的内动力,可以吸收水体中的CO2并转化为有机碳[39-40]。本研究中,养殖系统CO2通量与水体净初级生产力和叶绿素a浓度均呈显著负相关关系(见表 4),逐步回归方程结果也表明,水体净初级生产力是影响系统水-气界面CO2通量的主要因子(见表 5),这也与Bogard等和张东旭等的研究结果相一致[41-42]。因此,认为水体净初级生产力是影响对虾养殖系统水-气界面CO2通量的关键驱动因子。
水体的初级生产力通常表现为有规律的日变化,并且在调节水生生态系统中的CO2通量方面起着重要作用,因此,水体的CO2通量通常表现出与初级生产力的变化相对应的日变化规律。Anderson和Davies等的研究表明,09:00—12:00之间的水体初级生产量是替代总生产量的最佳短期指标[43-44]。因此,目前关于池塘生态系统水-气界面CO2通量的研究多将白天的测量值作为日平均CO2通量[14-16]。在未来的研究中,应该包括对池塘水-气界面CO2通量的日变化的测量。此外还应测定另外两种重要的温室气体(CH4和N2O),以确定的水产养殖池塘的整体温室气体排放。
4 结语本文通过养殖实验,探究了不同养殖系统下,水-气界面CO2通量及其主要驱动因子,研究得到的主要结论如下:
(1) 对虾单养系统L养殖期间水-气界面平均CO2通量为-12.66 mg·m-2·h-1;综合养殖系统LM-L、LM-M和LM-H养殖期间水-气界面平均CO2通量分别为-16.02、-16.48和-36.70 mg·m-2·h-1,单养系统和综合养殖系统整体均表现为CO2的汇。
(2) 4种养殖系统的CO2通量与水体叶绿素a浓度和净初级生产力均呈负相关关系,影响系统CO2通量的关键驱动因子是水体净初级生产力。
(3) 随着硬壳蛤放养密度的增加,三种综合养殖系统的碳汇能力逐渐增强(分别比单养系统提高了26.54%、30.17%和189.89%)。以三种综合养殖系统平均CO2通量为基准,推算出在养殖期间每公顷该系统可以吸收626.75 kg CO2。
| [1] |
World Meteorological Association. State of the Global Climate 2021[R]. [S. l. ]: World Meteorological Organization Publication Board, 2022: 1-53.
(  0) 0) |
| [2] |
Stott P. How climate change affects extreme weather events[J]. Science, 2016, 352(6293): 1517-1518. DOI:10.1126/science.aaf7271 (  0) 0) |
| [3] |
Otto F E L, Skeie R B, Fuglestvedt J S, et al. Assigning historic responsibility for extreme weather events[J]. Nature Climate Change, 2017, 7: 757-759. DOI:10.1038/nclimate3419 (  0) 0) |
| [4] |
Duarte C M, Prairie Y T. Prevalence of heterotrophy and atmospheric CO2 emissions from aquatic ecosystems[J]. Ecosystems, 2005, 8: 862-870. DOI:10.1007/s10021-005-0177-4 (  0) 0) |
| [5] |
Friederich G E, Ledesma J, Ulloa O, et al. Air-sea carbon dioxide fluxes in the coastal southeastern tropical Pacific[J]. Progress in Oceanography, 2008, 79(2-4): 156-166. DOI:10.1016/j.pocean.2008.10.001 (  0) 0) |
| [6] |
Jiang L Q, Cai W J, Wanninkhof R, et al. Air-sea CO2 fluxes on the US South Atlantic Bight: Spatial and seasonal variability[J]. Journal of Geophysical Research: Oceans, 2008, 113: 1-17. (  0) 0) |
| [7] |
Wang F S, Wang Y, Zhang J, et al. Human impact on the historical change of CO2 degassing flux in River Changjiang[J]. Geochemical Transactions, 2007, 8(7): 1-10. (  0) 0) |
| [8] |
Sun Q Q, Shi K, Damerell P, et al. Carbon dioxide and methane fluxes: seasonal dynamics from inland riparian ecosystems, northeast China[J]. Science of the Total Environment, 2013, 465: 48-55. DOI:10.1016/j.scitotenv.2013.01.036 (  0) 0) |
| [9] |
Xing Y, Xie P, Yang H, et al. Methane and carbon dioxide fluxes from a shallow hypereutrophic subtropical lake in China[J]. Atmospheric Environment, 2005, 39(30): 5532-5540. DOI:10.1016/j.atmosenv.2005.06.010 (  0) 0) |
| [10] |
嵇晓燕, 崔广柏, 杨龙元, 等. 太湖水-气界面CO2交换通量观测研究[J]. 环境科学, 2006, 27(8): 1479-1486. Ji X Y, Cui G B, Yang L Y, et al. MeasuremIent of the CO2 flux on the water-air interface of Taihu Lake[J]. Environmental Science, 2006, 27(8): 1479-1486. (  0) 0) |
| [11] |
Soumis N, Duchemin É, Canuel R, et al. Greenhouse gas emissions from reservoirs of the western United States[J]. Global Biogeochemical Cycles, 2004, 18(3): 1-11. (  0) 0) |
| [12] |
Abril G, Guérin F, Richard S, et al. Carbon dioxide and methane emissions and the carbon budget of a 10-year old tropical reservoir (Petit Saut, French Guiana)[J]. Global Biogeochemical Cycles, 2005, 19(4): 1-16. (  0) 0) |
| [13] |
Cole J J, Prairie Y T, Caraco N F, et al. Plumbing the global carbon cycle: Integrating inland waters into the terrestrial carbon budget[J]. Ecosystems, 2007, 10: 172-185. DOI:10.1007/s10021-006-9013-8 (  0) 0) |
| [14] |
Chen Y, Dong S, Wang F, et al. Carbon dioxide and methane fluxes from feeding and no-feeding mariculture ponds[J]. Environmental Pollution, 2016, 212: 489-497. DOI:10.1016/j.envpol.2016.02.039 (  0) 0) |
| [15] |
Zhang D X, Tian X L, Dong S L, et al. Carbon dioxide fluxes from two typical mariculture polyculture systems in coastal China[J]. Aquaculture, 2020, 521: 735041. DOI:10.1016/j.aquaculture.2020.735041 (  0) 0) |
| [16] |
Zhang D X, Xu W J, Wang F, et al. Carbon dioxide fluxes from mariculture ponds with swimming crabs and shrimps in eastern China: The effect of adding razor clams[J]. Aquaculture Reports, 2022, 22: 100917. DOI:10.1016/j.aqrep.2021.100917 (  0) 0) |
| [17] |
赵文, 董双林, 张兆琪, 等. 盐碱池塘浮游植物初级生产力日变化的研究[J]. 应用生态学报, 2003, 14(2): 234-236. Zhao W, Dong S L, Zhang Z Q, et al. Daily change of primary productivity of phytoplankton in saline-alkaline ponds[J]. Chinese Journal of Applied Ecology, 2003, 14(2): 234-236. DOI:10.13287/j.1001-9332.2003.0053 (  0) 0) |
| [18] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 中华人民共和国国家标准: 海洋监测规范第4部分: 海水分析: GB17378.4—2007[S]. 北京: 中国标准出版社, 2007: 99-121. General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, Stan-Dardization Administration of the People′s Republic of China. National Standard of the People′s Republic of China: The specification for marine monitoring-Part4: Seawater analysis: GB17378.4—2007[S]. Beijing: Standards Press of China, 2007: 99-121. (  0) 0) |
| [19] |
Gerardo-Nieto O, Astorga-España M S, Mansilla A, et al. Initial report on methane and carbon dioxide emission dynamics from sub-Antarctic freshwater ecosystems: A seasonal study of a lake and a reservoir[J]. Science of the Total Environment, 2017(593-594): 144-154. (  0) 0) |
| [20] |
Xiao S B, Wang Y C, Liu D F, et al. Diel and seasonal variation of methane and carbon dioxide fluxes at Site Guojiaba, the Three Gorges Reservoir[J]. Journal of Environmental Sciences, 2013, 25(10): 2065-2071. DOI:10.1016/S1001-0742(12)60269-1 (  0) 0) |
| [21] |
张永领, 杨小林, 张东. 小浪底水库影响下的黄河花园口站和小浪底站pCO2特征及扩散通量[J]. 环境科学, 2015, 36(1): 40-48. Zhang Y L, Yang X L, Zhang D. Partial pressure of CO2 and CO2 degassing fluxes of Huayuankou and Xiaolangdi station affected by Xiaolangdi reservoir[J]. Environmental Science, 2015, 36(1): 40-48. (  0) 0) |
| [22] |
李凌宇, 于瑞宏, 田明扬, 等. 黄河二氧化碳逸出时空变化及其影响因素——以头道拐水文站为例[J]. 生态学报, 2017, 37(22): 7636-7646. Li L Y, Yu R H, Tian M Y, et al. Spatial-temporal variations and influencing factors of carbon dioxide evasion from the Yellow River: An example of the Toudaoguai gauging station[J]. Acta Ecologica Sinica, 2017, 37(22): 7636-7646. (  0) 0) |
| [23] |
Alin S R, Rasera M F F L, Salimon C I, et al. Physical controls on carbon dioxide transfer velocity and flux in low-gradient river systems and implications for regional carbon budgets[J]. Journal of Geophysical Research: Biogeosciences, 2011, 116: 1-17. (  0) 0) |
| [24] |
Zhu L, Che X, Liu H, et al. Greenhouse gas emissions and comprehensive greenhouse effect potential of Megalobrama amblycephala culture pond ecosystems in a 3-month growing season[J]. Aquaculture International, 2016, 24(4): 893-902. DOI:10.1007/s10499-015-9959-7 (  0) 0) |
| [25] |
Chen Y, Dong S L, Wang Z N, et al. Variations in CO2 fluxes from grass carp Ctenopharyngodon idella aquaculture polyculture ponds[J]. Aquaculture Environment Interactions, 2015, 8: 31-40. DOI:10.3354/aei00149 (  0) 0) |
| [26] |
杨平, 仝川, 何清华, 等. 闽江口鱼虾混养塘水-气界面温室气体通量及主要影响因子[J]. 环境科学学报, 2013, 33(5): 1493-1503. Yang P, Tong C, He Q H, et al. Greenhouse gases fluxes at water-air interface of aquaculture ponds and influencing factors in the Min River estuary[J]. Acta Scientiae Circumstantiae, 2013, 33(5): 1493-1503. DOI:10.13671/j.hjkxxb.2013.05.018 (  0) 0) |
| [27] |
Zhang D X, He J, Xu W J, et al. Carbon dioxide and methane fluxes from mariculture ponds: The potential of sediment improvers to reduce carbon emissions[J]. Science of The Total Environment, 2022, 829: 154610. DOI:10.1016/j.scitotenv.2022.154610 (  0) 0) |
| [28] |
唐启升, 蒋增杰, 毛玉泽. 渔业碳汇与碳汇渔业定义及其相关问题的辨析[J]. 渔业科学进展, 2022, 43(5): 1-7. Tang Q S, Jiang Z J, Mao Y Z. Clarification on the definitions and its relevant issues of fisheries carbon sink and carbon sink fisheries[J]. Progress in Fishery Sciences, 2022, 43(5): 1-7. (  0) 0) |
| [29] |
蒋增杰, 方建光, 毛玉泽, 等. 滤食性贝类养殖碳汇功能研究进展及未来值得关注的科学问题[J]. 渔业科学进展, 2022, 43(5): 106-114. Jiang Z J, Fang J G, Mao Y Z, et al. Research progress on the carbon sink function of filter-feeding shellfish mariculture and future scientific issues[J]. Progress in Fishery Sciences, 2022, 43(5): 106-114. (  0) 0) |
| [30] |
Ogilvie S C, Ross A H, Schiel D R. Phytoplankton biomass associated with mussel farms in Beatrix Bay, New Zealand[J]. Aquaculture, 2000, 181(1-2): 71-80. DOI:10.1016/S0044-8486(99)00219-7 (  0) 0) |
| [31] |
Froján M, Arbones B, Zúñiga D, et al. Microbial plankton community in the Ría de Vigo (NW Iberian upwelling system): Impact of the culture of Mytilus galloprovincialis[J]. Marine Ecology Progress Series, 2014, 498: 43-54. DOI:10.3354/meps10612 (  0) 0) |
| [32] |
Newell R I E. Ecosystem influences of natural and cultivated populations of suspension-feeding bivalve molluscs: A review[J]. Journal of Shellfish Research, 2004, 23(1): 51-62. (  0) 0) |
| [33] |
McKindsey C W, Archambault P, Callier M D, et al. Influence of suspended and off-bottom mussel culture on the sea bottom and benthic habitats: A review[J]. Canadian Journal of Zoology, 2011, 89(7): 622-646. DOI:10.1139/z11-037 (  0) 0) |
| [34] |
Rice M A. Environmental effects of shellfish aquaculture in the northeast[J]. Northeastern Regional Aquaculture Center Publication, 2008, 105: 1-6. (  0) 0) |
| [35] |
Macklin P A, Suryaputra I, Maher D T, et al. Carbon dioxide dynamics in a lake and a reservoir on a tropical island (Bali, Indonesia)[J]. PLoS One, 2018, 13(6). (  0) 0) |
| [36] |
汪国骏, 胡明明, 王雨春, 等. 蓄水初期三峡水库草堂河水-气界面CO2和CH4通量日变化特征及其影响因素[J]. 湖泊科学, 2017, 29(3): 696-704. Wang G J, Hu M M, Wang Y C, et al. Diurnal variation and influencing factors of carbon dioxide and methane emissions at water-air interface of Caotang River, Three Gorges Reservoir in the initial impoundment period[J]. Journal of Lake Sciences, 2017, 29(3): 696-704. (  0) 0) |
| [37] |
Schrier-Uijl A P, Veraart A J, Leffelaar P A, et al. Release of CO2 and CH4 from lakes and drainage ditches in temperate wetlands[J]. Biogeochemistry, 2011, 102: 265-279. DOI:10.1007/s10533-010-9440-7 (  0) 0) |
| [38] |
Yang P, He Q H, Huang J F, et al. Fluxes of greenhouse gases at two different aquaculture ponds in the coastal zone of southeastern China[J]. Atmospheric Environment, 2015, 115: 269-277. DOI:10.1016/j.atmosenv.2015.05.067 (  0) 0) |
| [39] |
Trolle D, Staehr P A, Davidson T A, et al. Seasonal dynamics of CO2 flux across the surface of shallow temperate lakes[J]. Ecosystems, 2012, 15: 336-347. DOI:10.1007/s10021-011-9513-z (  0) 0) |
| [40] |
Li S Y, Zhang Q F, Bush R T, et al. Methane and CO2 emissions from China's hydroelectric reservoirs: a new quantitative synthesis[J]. Environmental Science and Pollution Research, 2015, 22: 5325-5339. DOI:10.1007/s11356-015-4083-9 (  0) 0) |
| [41] |
Bogard M J, del Giorgio P A. The role of metabolism in modulating CO2 fluxes in boreal lakes[J]. Global Biogeochemical Cycles, 2016, 30(10): 1509-1525. DOI:10.1002/2016GB005463 (  0) 0) |
| [42] |
张东旭, 田相利, 董双林, 等. 不同许氏平鮋与栉孔扇贝养殖系统水-气界面CO2通量及其主要影响因子[J]. 应用生态学报, 2019, 30(7): 2447-2456. Zhang D X, Tian X L, Dong S L, et al. Carbon dioxide fluxes at the water-air interface and the main influencing factors from different aquaculture systems of Sebastes schlegelii and Chlamys farreri[J]. Chinese Journal of Applied Ecology, 2019, 30(7): 2447-2456. (  0) 0) |
| [43] |
Anderson R S. Diurnal primary production patterns in seven lakes and ponds in Alberta (Canada)[J]. Oecologia, 1974, 14(1): 1-17. (  0) 0) |
| [44] |
Silva E I L, Davies R W. Primary productivity and related parameters in three different types of inland waters in Sri Lanka[J]. Hydrobiologia, 1986, 137(3): 239-249. DOI:10.1007/BF00004237 (  0) 0) |
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. The Dongying Delta Farming Company Limited, Dongying 257000, China
 2023, Vol. 53
2023, Vol. 53


