2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;
3. 国家海洋局第一海洋研究所海洋气候研究中心,山东 青岛 266061
浮游植物是海洋生态系统中重要的初级生产者,在海洋物质循环和能量传递过程中起着重要的作用。浮游动物是海洋中重要的次级生产者,其种类组成、丰度分布以及群落结构变化直接或间接地影响海洋生态系统的稳定。因此,浮游生物是海洋环境评价的重要参数之一。
关于北黄海浮游生物的调查研究始于1953年[1],之后学者们开展了大量关于北黄海浮游生物的调查研究[2-6]。在黄渤海海域,针对莱州湾[7-8]、桑沟湾[9-11]以及黄河口[12]等小尺度区域浮游生物有过研究报道,但小尺度范围海域浮游生物的研究相对较少。浮游生物群落结构在小尺度范围内可能存在较大差异,小范围海域环境变化对浮游生物群落结构的影响相对大尺度范围海域往往更加显著[13],因此在特定环境对浮游生物群落结构影响研究中,小尺度范围上的研究更加重要。
刘公岛位于山东半岛东端,黄海之滨的威海湾内,其南部沿海一带为著名景区。随着风化、海蚀、地表径流切割、主体滑坡、风暴潮等自然灾害以及近年来威海湾沿岸开发的人为影响,海岛岛体面积逐年减小,南部沿岸沙滩严重流失[14]。本文于2014年4月在威海刘公岛南部毗邻海域开展生物环境调查,研究了刘公岛南侧小范围海域内浮游生物的种类组成、丰度分布等特征,并分析其与环境因子间的关系。本研究可为评价刘公岛海域的生态环境状况提供重要的基础数据。
1 材料与方法 1.1 调查站位2014年4月23日在威海刘公岛南部毗邻海域开展生物环境调查,共设置12个站位,调查区域和站位分布详见图 1。
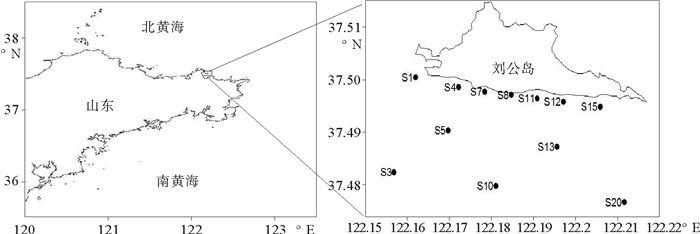
|
图 1 2014年4月刘公岛海域调查区域和站位 Fig. 1 Investigation area and sampling stations in the south of Liugong Island in Apr. 2014 |
在各站位采集表层和底层海水各500 mL,经GF/F滤膜(Whatman)过滤后用铝箔包裹,立即放入液氮保存,实验室内用90%的丙酮在4 ℃条件下萃取24 h后,用分光光度计(F-4500,HITACHI,日本)测量水样叶绿素a浓度(μg/L)。浮游植物和浮游动物样品分别采用浅水Ⅲ型(网口内径37 cm,筛绢孔径0.076 mm)和浅水Ⅰ型(网口内径50 cm,筛绢孔径0.505 mm)浮游生物网自海底至海表垂直拖曳采集,样品立即用福尔马林溶液固定保存(终浓度分别为2%和5%),在实验室内静置和浓缩后分别使用倒置显微镜(Nikon Eclipse TS100)和体视显微镜(Leica S8APO)鉴定计数。温度和盐度采用随船CTD(RBR 620 CTD)现场测定。海上采样、样品处理和室内分析等均严格按照《海洋调查规范第6部分海洋生物调查》(GB/T 12763.6—2007)执行。
1.3 数据处理浮游植物与浮游动物丰度(Abundance)根据采样时的滤水体积,以每立方米水体中的细胞数或个体数(cells/m3,ind/m3)表示。
浮游植物与浮游动物优势种根据每个种的优势度值(Y)来确定:
| $ Y = \frac{{{n_i}}}{N}\cdot{f_i}。$ |
式中:ni第i种的丰度; N为所有种类总丰度; fi为第i种出现频率。Y值大于0.02的种类为优势种[15]。
生物多样性采用香农-威纳指数(Shannon-Weaner index)(H′)和均匀度指数(Pielou index)(J)进行分析。
香农-威纳指数的计算公式为:
| $ H' = - \sum\limits_{i = 1}^S {{P_i}{\rm{lo}}{{\rm{g}}_2}{P_i}}。$ |
均匀度的计算公式为:
| $ J = H'/{\rm{lo}}{{\rm{g}}_2}S。$ |
式中:Pi为样品中第i种的个体数与总个体数的比值;S为各站水柱平均种类数。
2 结果 2.1 水文环境刘公岛南部海域表层温度分布趋势为由近岸向远离海岸方向降低,东部海域水温比西部偏高;表层盐度值分布趋势为由东南向西北方向逐渐降低。调查区域表层海水温度平均值为13.8 ℃,最高值出现在调查区域近岸东部的S15站(15.2 ℃),最低值分别位于S1、S4和S13站(13.0 ℃);盐度平均值为26.9,最大和最小值分别位于南部中间的S10站(28.4)和近岸东部的S15站(24.8)(见图 2)。
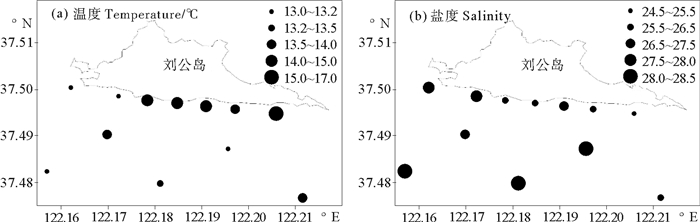
|
图 2 2014年4月刘公岛南部海域表层温度和盐度 Fig. 2 Distribution of temperature and salinity of the surface seawater in the south of Liugong Island in Apr. 2014 |
研究海域表层叶绿素a浓度呈现由近岸向外海增加的趋势。表层叶绿素a浓度平均值为9.51 μg/L,最高值出现在南部的S10站(11.69 μg/L),最低值出现在西南部的S20站(8.37 μg/L)。底层叶绿素a浓度的平均值为8.97 μg/L,最高值和最低值分别位于S1站(15.31 μg/L)和S20站(5.20 μg/L)。研究海域各站位水柱叶绿素a浓度平均值为9.25 μg/L,最高值出现在S1站(12.50 μg/L),最低值出现在S12站(7.47 μg/L)(见图 3)。
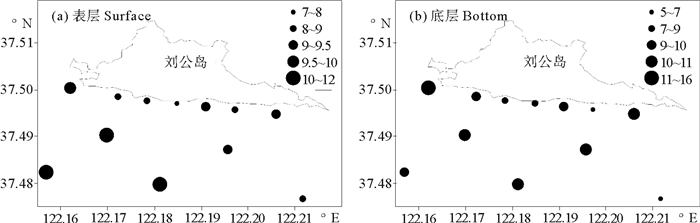
|
图 3 2014年4月刘公岛南部海域叶绿素a分布(μg/L) Fig. 3 Distribution of chlorophyll a concentration in the south of Liugong Island in Apr. 2014(μg/L) |
研究海域共鉴定出浮游植物25属41种。其中,硅藻21属36种,占浮游植物总种数的87.8%;甲藻4属5种,占总种数的12.2%。硅藻在物种数上占显著优势。研究海域共记录到各类浮游动物18种、浮游幼虫7类,合计种类25种(见表 1)。其中浮游动物成体隶属于刺胞动物(3种)、甲壳动物(桡足类9种,端足类3种、糠虾1种)和毛颚动物(2种)。
|
|
表 1 刘公岛南部海域浮游生物种类组成 Table 1 Species composition of plankton in investigation area |
调查海域浮游植物平均丰度为3.67×105 cells·m-3,丰度最大值(9.91×105 cells·m-3)出现在S20站,最小值(0.84 cells·m-3)出现在S8站(见图 4)。硅藻平均丰度为3.16×105 cells·m-3,占浮游植物总丰度的85.9%;甲藻平均丰度为0.52×105 cells·m-3,占总丰度的14.1%。本次调查硅藻分布趋势与浮游植物总丰度一致,甲藻丰度分布表现为东南部较高、西南部较低的特征。
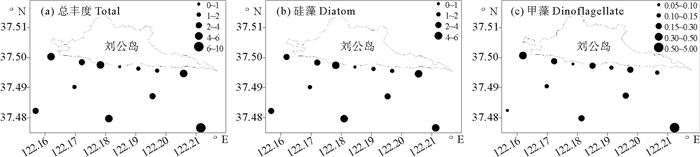
|
图 4 2014年4月刘公岛南部海域浮游植物丰度值平面分布(×105 cells·m-3) Fig. 4 Abundance distribution of phytoplankton in the south of Liugong Island in Apr. 2014 (×105 cells·m-3) |
浮游动物总丰度的平均值为127.9 ind·m-3,最高值(267.2 ind·m-3)出现在S1站,最低值(1.7 ind·m-3)出现在S4站。桡足类平均丰度为107.8 ind·m-3,占浮游动物总丰度的40.3%,最大值(240.8 ind·m-3)位于西北部的S1站,最小值(0.8 ind·m-3)位于S4站(见图 5)。
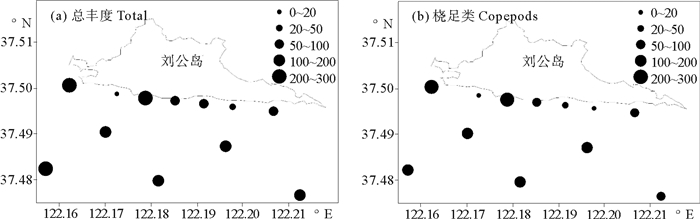
|
(a.总丰度;b.桡足类。a.Total;b.Copepods ) 图 5 2014年4月刘公岛南部海域浮游动物丰度值平面分布(ind/m3) Fig. 5 Abundance distribution of zooplankton in the south of Liugong Island in Apr. 2014(ind/m3) |
本次调查浮游植物优势种有6种,分别为威氏圆筛藻(Coscinodiscus wailesii)、丹麦细柱藻(Leptocylindrus danicus)、新月筒柱藻(Cylindrotheca closterium)、长菱形藻(Nizschia. longissima)、柔弱几内亚藻(Guinardia delicatula)和夜光藻(Noctiluca scientillans)(见表 2)。研究海域威氏圆筛藻平均丰度为0.31×105 cells·m-3,最高值(1.38×105 cells·m-3)位于调查区域西北端的S1站。丹麦细柱藻平均丰度为1.37×105 cells·m-3,在该调查海域浮游植物中占绝对优势,其分布趋势与调查海域浮游植物总丰度趋势相一致。新月菱形藻平均丰度为0.44×105 cells·m-3,最高值(0.33×105 cells·m-3)位于调查区域东北部的S15站。夜光藻平均丰度0.50×105 cells·m-3,最大值为4.32×105 cells·m-3(S20站),最小值为0.05×105 cells·m-3(S5站)。长菱形藻和柔弱几内亚藻平均丰度分别为0.28×105和0.33×105 cells·m-3。
|
|
表 2 2014年4月刘公岛南部海域浮游植物优势种及其优势度 Table 2 Dominant species and their dominance in the south of Liugong Island in Apr. 2014 |
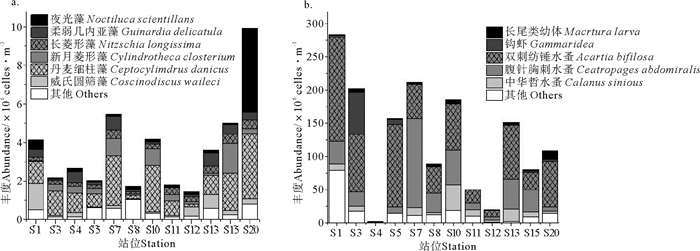
|
(a.浮游植物;b.浮游动物。a. Phytoplankton; b. Zooplankton ) 图 6 2014年4月刘公岛南部海域浮游生物优势种丰度 Fig. 6 Abundance distributions of dominant species in the south of Liugong Island in Apr. 2014 |
研究海域浮游动物优势种共5种,分别为中华哲水蚤(Calanus sinicus)、腹针胸刺水蚤(Centropages abdominalis)、双毛纺锤水蚤(Acartia bifilosa)、钩虾(Gammaridea)和长尾类幼体(Macrura larva)(见表 3)。双毛纺锤水蚤平均丰度最高,为61.0 ind·m-3,占浮游动物总丰度的47.7%,在调查海域浮游动物中占绝对优势,最高值(156.8 ind·m-3)位于调查海域西北部的S1站,最低值(8.6 ind·m-3)在S12站。其次为腹针胸刺水蚤,平均丰度为31.7 ind·m-3,最高值(134.3 ind·m3)出现在调查海域中部近岸的S7站,而在S4站则没有分布。
|
|
表 3 浮游动物优势种及其优势度 Table 3 Dominant species and their dominance of zooplankton in Apr. 2014 |
研究海域浮游植物群落香农-威纳指数和均匀度的分布趋势基本一致,即由近岸海域向外逐渐减小。H′平均值为1.86,J的平均值为0.66;两种生物多样性指数(H′和J)最低值(1.45;0.51)均在S10站,香农-威纳指数最高值(2.23)位于S4站,均匀度最高值(0.79)同时出现在S8、S12和S13站(见图 7a、b)。
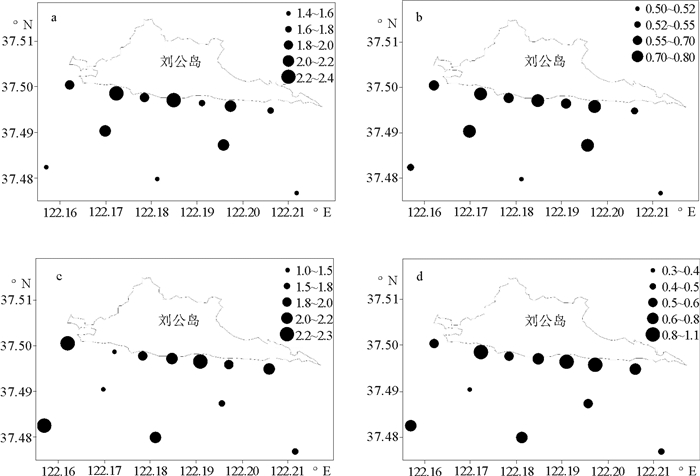
|
(a.浮游植物香农-威纳指数;b.浮游植物均匀度;c.浮游动物香农-威纳指数; d.浮游动物均匀度。a, c: H'; b, d:J; a, b:Phytoplankton; c, d:Zooplankton ) 图 7 2014年4月浮游生物生物多样性指数分布 Fig. 7 Distributions of plankton biodiversity indices in Apr. 2014 |
各站位浮游动物的群落香农-威纳指数和均匀度的分布也基本一致,即近岸海域向外逐渐减小。H′平均值为1.90,J的平均值为0.66;2种生物多样性指数(H′和J)最低值(1.00;0.37)分别位于S4站和S5站,香农-威纳指数最高值(2.29)位于S11站,均匀度最高值(1.00)位于S4站(见图 7c、d)。
2.4 相关性分析浮游动物丰度与浮游植物丰度以及温盐之间无明显相关性;浮游植物丰度与叶绿素浓度呈负相关关系,与环境因子无显著相关性;叶绿素a浓度与温盐亦无显著相关性(见表 4)。
|
|
表 4 2014年4月浮游生物丰度、叶绿素a浓度与环境因子间相关性分析 Table 4 Correlation analysis between abundance of plankton, concentration of chlorophyll a and environmental variables in Apr. 2014 |
历史研究表明,北黄海海域硅藻占据浮游植物群落绝对优势地位[5]。本次调查中硅藻占总种数和总丰度的比例分别为87.8%和85.9%,其丰度分布在很大程度上影响着浮游植物总丰度的分布趋势。本次调查共鉴定出浮游植物25属41种,平均丰度为3.67×105 cells/m3,与同季节北黄海海域历史资料相比[3],本研究海域浮游植物丰度较大,群落结构相差较大。该航次共记录浮游动物25种,种类组成以近岸低盐类群(海洋伪镖水蚤和太平洋真宽水蚤等)和广温广盐类群(中华哲水蚤,小拟哲水蚤等)为代表。本次调查各站位浮游动物在种类组成、丰度分布、以及种群结构等方面差异较大,浮游动物丰度的差异可直接受某一物种的影响(如S1站,双毛纺锤水蚤大量出现,浮游动物总丰度较高)。本次调查区域范围小,水深较浅,浮游生物的总取样量少,与黄渤海以及其他海湾相比[16]种类数偏少。桑沟湾4个季节(2003年8月—2005年5月)共检出浮游植物32属72种,其中硅藻29属60种,占83.3%,甲藻3属12种,占16.7%,明显高于本研究[9]。对渤黄海浮游动物调查中,秋季记录到47种浮游动物,春季仅有27种[17],浮游动物种类随季节变化明显。与以往调查结果对比表明,小尺度范围研究海域浮游生物丰度和群落结构在时间和空间尺度上均变化较大,在受人为活动影响显著的沿岸小尺度范围海域,环境的多变性更易引起浮游生物群落的剧烈变化[9, 18-19],因此在小尺度范围海域开展浮游生物的长期监测,对于了解环境变化对浮游生物群落演替影响的机制,有着重要的意义。
研究海域浮游植物优势种有6种,其中丹麦细柱藻和夜光藻优势度较高。丹麦细柱藻为广温广盐性种类,在北黄海海域以及小尺度的海湾常成为优势种[19-20]。本次调查中丹麦细柱藻的分布与该海域的温度和盐度无显著相关性,有研究表明丹麦细柱藻的丰度与溶解性无机磷含量呈指数性正相关[21],刘公岛南部海域受人类活动影响显著,营养盐浓度较高[22],这可能使得该区域丹麦细柱藻迅速生长增殖。夜光藻最适生长温度是16~24 ℃[23],最适盐度为25.0~30.0[24],加之该海域较高的浮游植物丰度为夜光藻的生长提供了充足食物来源,因此夜光藻在本次浮游植物调查中占优势地位。新月菱形藻的最适生长温度为20 ℃左右[25],研究海域各站位温度均低于20 ℃,但在温度最高(15.2 ℃)的S15站位,新月菱形藻丰度值也最高,低温可能是本次调查中限制新月菱形藻生长的重要因素。
桡足类在浮游动物中占主导地位。其中双毛纺锤水蚤优势度最高,其次为腹针胸刺水蚤。双毛纺锤水蚤和腹针胸刺水蚤均属于近岸低盐性种,腹针胸刺水蚤在春季常成为黄渤海海域优势种[16]。双毛纺锤水蚤分布广泛,在波罗的海、地中海、黄渤海等近岸海域均有记录[26-29]。黄渤海双毛纺锤水蚤在5月丰度达到最高[28, 30],本研究结果中双毛纺锤水蚤大量出现也与之相符。中华哲水蚤常成为黄渤海海湾浮游动物优势种,在桑沟湾、荣成湾以及莱州湾等海域广泛分布[31-32],适温范围大致为5~23 ℃[28],黄渤海地区在5、6月份可达到丰度高峰。
Telesh指出物种多样性与海域的营养水平存在密切的关系,因此浮游生物群落的结构和功能指数(如H′)的变化能够作为生态系统在环境压力下发生改变的指标[33]。研究海域浮游植物与浮游动物多样性指数分布趋势相似。个别站位如S3站、S10站和S20站等浮游植物多样性较低,这些站位均远离岸边,受沿岸环境和人类活动影响相比近岸海域较小,某些物种(如S20站位的夜光藻和丹麦细柱藻)占据的绝对优势也可能导致这些站位生物多样性较低。
相关性分析结果显示,浮游动物与浮游植物丰度表现为正相关关系,浮游动物与浮游植物之间的摄食关系使得二者分布趋势相一致。本研究中浮游植物丰度与叶绿素a浓度相关性并不显著。夜光藻对浮游植物丰度贡献最大,但其细胞体内不含叶绿素a;其次,研究表明,夜光藻的大量繁殖和摄食可能对浮游植物生长产生一定压力,使得海域叶绿素a浓度和生产力下降[34-35];此外,本次调查中浮游植物采用孔径76 μm浮游生物网采集,而通过采水测得的叶绿素a浓度是水体中0.7~200 μm粒径浮游植物的叶绿素a浓度,这种差异也可能是导致浮游植物丰度与叶绿素a浓度相关性不显著的原因之一。
| [1] |
朱树屏, 郭玉洁. 烟台、威海鲐鱼渔场及其附件海区角毛藻属的研究: Ⅰ.分类的研究[J]. 海洋与湖沼, 1957, 1(1): 27-94. ZHU Shu-Ping, GUO Yu-Jie. Studies on the genus chaetoceros ehrenberg from the fishing ground of the mackerel, Pneumatophorus japonicus (Houttuyn), off the Shantung Coast from Chefoo to Weihai. Part Ⅰ: A Systematic Study[J]. Oceanologia et Limnologia Sinica, 1957, 1(1): 27-94. (  0) 0) |
| [2] |
郑重, 郑执中, 王荣, 等. 烟、威鲐鱼渔埸及邻近水域浮游动物生态的初步研究[J]. 海洋与湖沼, 1965, 7(4): 329-354. ZHENG Zhong, ZHENG Zhi-Zhong, WANG Rong, et al. Ecological investigations on the zooplankton of the mackerel fishing off Yantai-Weihai and adjacent waters[J]. Oceanologia et Limnologia Sinica, 1965, 7(4): 329-354. (  0) 0) |
| [3] |
王俊. 黄海春季浮游植物的调查研究[J]. 海洋水产研究, 2001, 22(1): 56-61. WANG Jun. Study on phytoplankton in the Yellow Sea in spring[J]. Marine Fisheries Research, 2001, 22(1): 56-61. (  0) 0) |
| [4] |
杜秀宁, 刘光兴. 2006年冬季北黄海网采浮游植物群落结构[J]. 海洋学报, 2009, 31(5): 132-147. DU Xiu-Ning, LIU Guang-Xing. Community structure of net-phytoplankton in the northern Huanghai Sea in the winter of 2006[J]. Acta Oceanologica Sinica, 2009, 31(5): 132-147. (  0) 0) |
| [5] |
刘述锡, 樊景凤, 王真良. 北黄海浮游植物群落季节变化[J]. 生态环境学报, 2013, 22(7): 1173-1181. LIU Shu-Xi, FAN Jing-Feng, WANG Zhen-Liang. The seasonal changes of phytoplankton community in North Yellow Sea, China[J]. Ecology and Environmental Sciences, 2013, 22(7): 1173-1181. DOI:10.3969/j.issn.1674-5906.2013.07.014 (  0) 0) |
| [6] |
Liu X, Chiang K P, Liu S M, et al. Influence of the Yellow Sea warm current on phytoplankton community in the central Yellow Sea[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2015, 106: 17-29. DOI:10.1016/j.dsr.2015.09.008
(  0) 0) |
| [7] |
李广楼, 陈碧鹃, 崔毅, 等. 莱州湾浮游植物的生态特征[J]. 中国水产科学, 2006, 13(2): 292-299. LI Guang-Lou, CHEN Bi-Juan, CUI Yi, et al. Ecological characteristics of phytoplankton in the Laizhou Bay[J]. Journal of Fishery Sciences of China, 2006, 13(2): 292-299. DOI:10.3321/j.issn:1005-8737.2006.02.020 (  0) 0) |
| [8] |
宋洪军, 张朝晖, 刘萍, 等. 莱州湾海洋浮游和底栖生物多样性分析[J]. 海洋环境科学, 2015, 34(6): 844-851. SONG Hong-Jun, ZHANG Chao-Hui, LIU Ping, et al. Analysis of marine plankton and benthos diversity in the Laizhou Bay[J]. Marine Environmental Science, 2015, 34(6): 844-851. (  0) 0) |
| [9] |
慕建东, 董玮, 陈碧鹃, 等. 桑沟湾浮游植物生态特征[J]. 渔业科学进展, 2009, 30(3): 91-96. MU Jian-Dong, DONG Wei, CHEN Bi-Juan, et al. Ecological characteristics of phytoplankton in Sanggou Bay[J]. Progress in Fishery Sciences, 2009, 30(3): 91-96. DOI:10.3969/j.issn.1000-7075.2009.03.016 (  0) 0) |
| [10] |
Mu J D, Dong W, Chen B J, et al. Ecological characteristics of phytoplankton in Sanggou Bay[J]. Progress in Fishery Sciences, 2009, 30(3): 91-96.
(  0) 0) |
| [11] |
Yuan M, Zhang C, Jiang Z, et al. Seasonal variations in phytoplankton community structure in the Sanggou, Ailian, and Lidao Bays[J]. Journal of Ocean University of China, 2014, 13(6): 1012-1024. DOI:10.1007/s11802-014-2305-2
(  0) 0) |
| [12] |
苏芝娟, 王玉珏, 董志军, 等. 调水调沙后黄河口邻近海域浮游植物群落响应特征[J]. 海洋学报, 2015, 37(4): 62-75. SU Zhi-Juan, WANG Yu-Jue, DONG Zhi-Jun, et al. Response of phytoplankton assemblages to the water-sediment regulation in the adjacent sea of the Yellow River Mouth[J]. Acta Oceanologica Sinica, 2015, 37(4): 62-75. DOI:10.3969/j.issn.0253-4193.2015.04.006 (  0) 0) |
| [13] |
Cowles T, Desiderio R, Carr M E. Small-scale planktonic structure: Persistence and trophic consequences[J]. Oceanography, 1998, 11(1): 4-9. DOI:10.5670/oceanog
(  0) 0) |
| [14] |
邱照宇, 安伟, 赵宇鹏. 刘公岛岸滩整治方案数值模拟[J]. 船海工程, 2014, 43(5): 103-107. QIU Zhao-Yu, AN Wei, ZHAO Yu-Peng. Numerical simulation of regulation scheme of Liugong Island beach[J]. Ship&Ocean Engineering, 2014, 43(5): 103-107. DOI:10.3963/j.issn.1671-7953.2014.05.028 (  0) 0) |
| [15] |
徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15. XU Zhao-Li, CHEN Ya-Qu. Aggregated intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea[J]. Chinese Journal of Ecology, 1989, 8(4): 13-15. (  0) 0) |
| [16] |
毕洪生, 孙松. 渤海浮游动物群落生态特点Ⅰ.种类组成与群落结构[J]. 生态学报, 2000, 20(5): 715-721. BI Hong-Sheng, SUN Song. The ecological characteristics zooplakton community in the Bohai Sea[J]. Species Composition and Community Structure. Acta Ecologica Sinica, 2000, 20(5): 715-721. DOI:10.3321/j.issn:1000-0933.2000.05.001 (  0) 0) |
| [17] |
张武昌, 王克, 高尚武, 等. 渤海春季和秋季的浮游动物[J]. 海洋与湖沼, 2002, 33(6): 630-639. ZHANG Wu-Chang, WANG Ke, GAO Shang-Wu, et al. Zooplankton in the Bohai Sea in spring and autumn[J]. Oceanologia et Limnologia Sinica, 2002, 33(6): 630-639. DOI:10.3321/j.issn:0029-814X.2002.06.009 (  0) 0) |
| [18] |
郝彦菊, 王宗灵, 朱明远, 等. 莱州湾营养盐与浮游植物多样性调查与评价研究[J]. 海洋科学进展, 2005, 23(2): 197-204. HAO Yan-Ju, WANG Zong-Ling, ZHU Ming-Yuan, et al. Investigation and assessment of nutrients and phytoplankton diversity in the Laizhou Bay[J]. Advanced in Marine Science, 2005, 23(2): 197-204. DOI:10.3969/j.issn.1671-6647.2005.02.011 (  0) 0) |
| [19] |
宁璇璇, 纪灵, 王刚, 等. 2009年莱州湾近岸海域浮游植物群落的结构特征[J].海洋湖沼通报, 2011(3): 97-104. NING Xuan-Xuan, JI Ling, WANG Gang, XIA Bing-Xun. Phytoplankton community in the nearshore waters of Laizhou Bay in 2009[J]. Transactions of Oceanology and Limnology, 2011(3): 97-104. http://www.cnki.com.cn/Article/CJFDTotal-HYFB201103015.htm (  0) 0) |
| [20] |
王年斌, 周遵春, 马志强, 等. 大连湾丹麦细柱藻赤潮的主成分分析[J]. 水产科学, 2004, 23(7): 9-11. WANG Nian-Bin, ZHOU Zun-Chun, MA Zhi-Qiang, et al. The principal components analysis of blooming caused by Leptocylindrus danicus in Dalian Bay[J]. Fisheris Science, 2004, 23(7): 9-11. DOI:10.3969/j.issn.1003-1111.2004.07.003 (  0) 0) |
| [21] |
陈玮. 大鹏湾丹麦细柱藻(Leptocylindrus danicus)的生态与赤潮[J]. 海洋通报, 1993, 12(2): 39-45. CHEN Wei. Population ecology of Leptocylindurs danicus in Dapeng Bay, north of South China Sea[J]. Marine Science Bulletin, 1993, 12(2): 39-45. (  0) 0) |
| [22] |
柴心玉, 高尚德. 刘公岛海域内叶绿素-a含量和初级生产力[J]. 青岛海洋大学学报(自然科学版), 1996, 26(2): 203-211. CHAI Xin-Yu, GAO Shang-De. Concentration of chlorophyll-a and primary productivity in the Liugong Island waters[J]. Journal of Ocean University of Qingdao, 1996, 26(2): 203-211. (  0) 0) |
| [23] |
Uhlig G, Sahling G. Blooming and red tied phenomenon in Noctiluca scintillans[C]//Bulletin of Marine Science. 4600 Rickenbacker Causeway, Miami, FL 33149: Rosenstiel Schmaratmos SCI, 1985, 37(2): 779-780.
(  0) 0) |
| [24] |
陆斗定, 张志道, 朱根海, 等. 浙江近海夜光藻的分布及其生态学特点[J]. 东海海洋, 1994, 12(3): 62-69. LU Dou-Ding, ZHANG Zhi-Dao, ZHU Gen-Hai, et al. Distributive pattern of Noctiluca scintillans in the Zhejiang Coastal waters area[J]. Donghai Marine Science, 1994, 12(3): 62-69. (  0) 0) |
| [25] |
周洪琪, Renaud S M, Parry D L, 等. 温度对新月菱形藻, 铲状菱形藻和杷夫藻的生长, 总脂肪含量以及脂肪酸组成的影响[J]. 水产学报, 1996, 20(3): 235-240. ZHOU Hong-Qi, Renaud S M, Parry D L, et al. Effect of temperature on growth, total lipid content and fatty acid composition of the Microalgae, N. closterium, N. pleacea and Pavlova sp.[J]. Journal of Fisheries of China, 1996, 20(3): 235-240. (  0) 0) |
| [26] |
Viitasalo M. Calanoid resting eggs in the Baltic Sea: Implications for the population dynamics of Acartia bifilosa (Copepoda)[J]. Marine Biology, 1992, 114(3): 397-405. DOI:10.1007/BF00350030
(  0) 0) |
| [27] |
Castro-Longoria E, Williams J A. The production of subitaneous and diapause eggs: A reproductive strategy for Acartia bifilosa (Copepods: Calanoida) in Southampton Water, UK[J]. Journal of Plankton Research, 1999, 21(1): 65-84. DOI:10.1093/plankt/21.1.65
(  0) 0) |
| [28] |
王荣, 张鸿雁, 王克, 等. 小型桡足类在海洋生态系统中的功能作用[J]. 海洋与湖沼, 2002, 33(5): 453-460. WANG Rong, ZHANG Hong-Yan, WANG Ke, et al. Function performed by small copepods in marine ecosystem[J]. Oceanologia et Limnologia Sinica, 2002, 33(5): 453-460. DOI:10.3321/j.issn:0029-814X.2002.05.001 (  0) 0) |
| [29] |
Chinnery F E., Williams J A. Photoperiod and temperature regulation of diapause egg production in Acartia bifilosa from Southampton Water[J]. Marine Ecology Progress Series, 2003, 263: 149-157. DOI:10.3354/meps263149
(  0) 0) |
| [30] |
孙松, 周克, 杨波, 等. 胶州湾浮游动物生态学研究Ⅰ.种类组成[J]. 海洋与湖沼, 2008, 39(1): 1-7. SUN Song, ZHOU Ke, YANG Bo, et al. Ecology of zooplankton in the Jianzhou BayⅠ. species composition[J]. Oceanologia et Limnologia Sinica, 2008, 39(1): 1-7. DOI:10.3321/j.issn:0029-814X.2008.01.001 (  0) 0) |
| [31] |
毕晓欣, 毕立海, 刘冲, 等. 山东省近岸海域浮游动物的生态特征分析[J]. 安徽农业科学, 2016(4): 136-141. BI Xiao-Xin, BI Li-Hai, LIU Chong, et al. Ecological characteristics of zooplankton of inshore areas in Shandong province[J]. Journal of Anhui Agricultual Sciences, 2016(4): 136-141. DOI:10.3969/j.issn.0517-6611.2016.04.045 (  0) 0) |
| [32] |
刘萍.山东近岸典型海湾浮游动物群落时空分布和长期变化特征[D].青岛: 中国海洋大学, 2015. LIU Ping. Spatial Distribution and Long-Term Change of Zooplankton Community in Typical Bay in Shandong Province[D]. Qingdao: Ocean University of China, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10423-1015714639.htm (  0) 0) |
| [33] |
Telesh I V. Plankton of the baltic estuarine ecosystems with emphasis on Neva Estuary: A review of present knowledge and research perspectives[J]. Marine Pollution Bulletin, 2004, 49: 206-219. DOI:10.1016/j.marpolbul.2004.02.009
(  0) 0) |
| [34] |
黄长江, 齐雨藻, 杞桑, 等. 大鹏湾夜光藻种群的季节变化和分布特征[J]. 海洋与湖沼, 1996, 27(5): 493-498. HUANG Chang-Jiang, QI Yu-Zao, QI Sang, et al. Seasonal and geographical distribution of Noctiluca scintillans in Dapeng Bay, the south of China[J]. Oceanologia et Limnologia Sinica, 1996, 27(5): 493-498. DOI:10.3321/j.issn:0029-814X.1996.05.007 (  0) 0) |
| [35] |
陈汉辉, 杞桑. 夜光藻摄食和营养繁殖的昼夜节律[J]. 暨南大学学报, 1991, 12(3): 104-107. CHEN Han-Hui, QI Sang. The feeding and vegetative reproduction diurnal rhythms of Noctiluca scintillans[J]. Journal of Jinan University, 1991, 12(3): 104-107. (  0) 0) |
2. 2 Key Laboratory of Marine Environment and Ecology (Ocean University of China), Ministry of Education, Qingdao 266100, China;
3. Center for Ocean and Climate Research, First Institute of Oceanography, State Oceanic Administration, Qingdao 266061, China
 2019, Vol. 49
2019, Vol. 49


