营养学研究发现,在动物快速生长期,氨基酸对机体饲料利用、蛋白质沉积、组织功能完整性和免疫功能有着重要作用[1]。氨基酸是生物体合成蛋白质的前体物质,且具有许多重要的生理功能。目前已有许多研究报道了饲料氨基酸添加剂对于鱼类生理功能的影响[2-4],其在水产养殖业中具有广阔的应用前景。其中,亮氨酸(Leu)是一种鱼体不能自身合成的必需氨基酸,也是二十种氨基酸中唯一的生酮氨基酸[5]。Leu是激活雷帕霉素靶蛋白(TOR)信号通路效果最好的氨基酸,有着起始蛋白质翻译过程的功能;Leu缺乏会减缓蛋白质合成,并引起脂肪代谢紊乱的问题[6]。当饲料配方中鱼粉被其他蛋白源替代时,鱼类对Leu的利用率通常较低[7],因此需要添加晶体Leu以满足其营养需求。有报道称,饲料中适宜水平的Leu可以提高鱼类的生长性能和免疫力[8-9]。谷氨酰胺(Gln)是动物体内含量最多的游离氨基酸,也是一种条件性必需氨基酸。Gln是鱼类组织的主要代谢燃料,在蛋白质合成和抗氧化反应中发挥着重要作用[10]。有研究表明,饲料中添加Gln能够改善鱼类的生长性能、免疫力和肠道健康[11-13]。目前含有高水平植物蛋白源的饲料通常会诱发鱼类的炎症性肠病[14-15],因此,鱼类对饲料中营养物质的利用率与鱼类肠道健康的关系受到广泛关注。
在动物体内,不同氨基酸之间存在相互协同或拮抗的作用,这种氨基酸的交互作用受到多种因素的影响,包括氨基酸本身的性质、动物的生理状态和种类等[16]。目前在鱼类上关于氨基酸交互作用的研究较少。在哺乳动物上的研究表明,通过双向转运机制,Gln可以促进Leu的吸收,因此Gln浓度能够限制Leu生长因子激活TOR信号通路,从而限制蛋白质合成和细胞增殖[17]。此外,叶元土等在草鱼肠道离体灌注模型上的研究表明,Gln能够显著增加草鱼肠道对Leu的吸收量和肠道组织内的游离Leu含量,且能够显著增加草鱼肠道的蛋白质合成代谢[18]。因此,在饲料中联合添加Leu和Gln可能提高鱼类的氨基酸的利用率和生长性能,从而取得更好的养殖生产效果。虽然大量研究表明在鱼类饲料中单独添加Leu、Gln、Met等氨基酸具有促进生长、提高免疫力的作用[8-9, 11-13],但未见有鱼类饲料中联合添加Leu和Gln的报道。
需要注意的是,动物摄食的蛋白质被消化后会以氨基酸或小肽的形式被动物吸收,而肠道小肽转运载体的转运效率远高于氨基酸转运载体。有研究推测大菱鲆(Scophthalmus maximus L.)偏好以小肽的形式吸收蛋白质[19]。此外,硬骨鱼可以有效地利用小肽进行发育、生长和新陈代谢[20]。同时,由于晶体氨基酸的稳定较差,因此在饲料生产中,常用二肽替代晶体氨基酸。例如用于替代饲料中晶体Gln的Ala-Gln和Gln-Gln,在被动物摄取后能够快速水解释放单体Gln,以更高效地发挥调节营养代谢的作用[21]。基于此,本实验补充设计了添加Leu-Gln二肽的处理组,来观察不同氨基酸添加模式(晶体或小肽)对鱼类生理状态的调节效果。
大菱鲆是着国重要的海水养殖鱼类,本研究以大菱鲆为研究对象,旨在探究复合植物蛋白源替代部分鱼粉后,饲料中单独或共同添加Leu与Gln及其不同联合添加模式(晶体氨基酸或小肽)对大菱鲆幼鱼的生长性能、血浆代谢指标、肠道健康和免疫力的影响,进而揭示Leu和Gln在鱼类饲料中的最佳组合模式。本研究的成果能够为饲料配方设计和生产中氨基酸的添加提供理论依据与应用指导,同时也能为氨基酸型饲料添加剂的开发提供新的思路和参考。
1 材料与方法 1.1 实验饲料配方设计与制作设计6组等氮等能饲料,以鱼粉、豆粕、花生粕、谷朊粉为主要蛋白源,以鱼油为主要脂肪源。主要蛋白源仅鱼粉的饲料为全鱼粉组(FM),以复合植物蛋白替代40%鱼粉的饲料为阴性对照组(Con),在Con组的基础上分别添加0.2%的晶体Leu、晶体Gln、晶体Leu和晶体Gln的混合物(Leu∶Gln=0.095%∶0.105%)、Leu-Gln二肽,形成四个处理组(分别记为L、G、L+G、L-G组)。添加晶体氨基酸(Met、Lys和Gly)以维持这6组实验饲料的氮平衡,配制颗粒饲料的方法参照文献[22],制粒前调节饲料pH至中性,实验饲料配方及近似组成如表 1所示。
|
|
表 1 饲料配方及干物质中组成成分 Table 1 Feed formula and the components of dry matter |
养殖实验开始前,选取健康的大菱鲆幼鱼(购自当地养殖场),在室内循环水养殖系统中(黄海水产公司养殖基地,山东海阳)投喂商业饲料暂养2周,驯化以适应养殖环境。养殖实验开始前,取6尾大菱鲆用于测定初始全鱼体组成成分,保存于-20 ℃冰箱中。挑选规格均一、体格健壮的大菱鲆幼鱼((8.14±0.03) g),随机分到18个养殖桶中,每桶30尾鱼,每个处理3个重复桶,每天7:00和19:00表观饱食投喂2次实验饲料,进行为期8周的养殖实验。养殖所用海水为浅井海水,经过二级沉淀、砂滤后,以约1.5 L/min的流速进入养殖桶中。养殖实验期间,维持水温17~19 ℃,盐度27~30,溶解氧≥7 mg/L,pH为7.5~8.0,氨氮和亚硝酸盐≤0.1 mg/L。
养殖周期结束时,所有实验鱼禁食以使代谢状态达到一致。在禁食24 h时称重并计数,用于计算生长指标和存活率;在禁食48 h时再饱食投喂相应的各组实验饲料。每个处理组随机取6尾全鱼用于体组成分析,保存于-20 ℃冰箱中待用;每个处理组另取6尾鱼的完整肠道用于组织切片分析,使用生理盐水漂洗后置于Bouin′s固定液中待用。在复投喂后8 h随机取6尾鱼的血浆样品用于血浆生理指标分析,离心后取上清保存于-20 ℃冰箱中待用;同时取肠道组织用于实时荧光定量PCR分析(qRT-PCR),在液氮中速冻后保存于-80 ℃冰箱中待用。
1.3 体组成成分分析全鱼体组成成分分析方法参见文献[23]。简而言之,将大菱鲆全鱼放置于105 ℃烘箱中烘干24 h至恒重并称量,计算全鱼水分含量;使用全自动凯氏定氮仪(Kjeltec 8400,FOSS)测定大菱鲆全鱼粗蛋白,用索氏抽提法(以石油醚为溶剂)测定全鱼粗脂肪;使用550 ℃马弗炉高温灼烧样品,称重并计算全鱼灰分含量。
1.4 血清生理生化及免疫指标分析使用全自动生化分析仪(Biomix-800,Sysmex)检测并分析大菱鲆幼鱼的血清葡萄糖、总胆固醇、甘油三酯以及血浆总蛋白的含量,检测所需试剂购自Sysmex公司。依据制造商的说明书,使用南京建成试剂盒检测大菱鲆的血清溶菌酶活性。
1.5 肠道组织形态将固定好的大菱鲆幼鱼肠道组织取出,选取每尾鱼的相同部位,经过乙醇脱水后置于二甲苯中,然后用融化的石蜡包埋肠道组织,冷却后切片。使用全自动染色机进行HE染色后,封片并拍摄显微镜下观察到的肠道形态,使用ImageJ软件定量分析肠绒毛高度及肠道杯状细胞数目。
1.6 实时荧光定量PCR使用TRIzol试剂(#15596026,Invitrogen)裂解大菱鲆肠道组织,依照制造商的说明书提取组织RNA,通过1%琼脂糖凝胶电泳检测RNA质量,使用微量分光光度计(NanoDrop2000,Thermo Fisher Scientific)检测RNA的质量及浓度。使用反转录试剂盒PrimeScrip RT reagent Kit with gDNA Eraser(#RR047,TaKaRa)合成大菱鲆肠道组织的cDNA;使用实时荧光定量PCR仪(CFX96,Bio-Rad)对大菱鲆肠道分化相关基因hes1、notch1的mRNA相对表达量进行测定和分析,以EF1α作为内参基因。本研究中实时荧光定量PCR(RT-PCR)所使用的引物见表 2。
|
|
表 2 RT-PCR所用引物序列 Table 2 Primers used for RT-PCR |
采用SPSS 25.0版软件对所得数据进行数据统计和分析,先对数据作单因素方差分析(One-way ANOVA),若处理间有显著差异,再使用Tukey法进行多重比较,P < 0.05表示差异性显著。实验数据用平均值±标准差(Mean ± SD)表示。
本研究所使用的计算公式如下:
特定生长率(Specific growth rate,SGR)=(ln终末体质量(g)-ln初始体质量(g))÷养殖天数(d)×100%;
摄食率(Feed intake,FI)=总摄食量(g)÷((终末体质量(g)+初始体质量(g))÷2)÷养殖天数(d)×100%;
存活率(Survival rate, SR)=终末尾数÷初始尾数×100%;
饲料系数(Feed coefficient ratio,FCR)=总摄食量(g)÷总增加质量(g);
蛋白质效率(Protein efficiency ratio,PER)=鱼体增加质量(g)÷蛋白质摄入量(g);
蛋白质沉积率(Protein retention,PR)=鱼体蛋白质增加质量(g)÷蛋白质摄入量(g) ×100%;
脂肪沉积率(Fat retention,FR)=鱼体脂肪增加质量(g)÷脂肪摄入量(g) ×100%;
肥满度(Condition factor,CF)=鱼体质量(g)÷(鱼体长度(cm))3×100%;
脏体比(Hepatosomatic index,HSI)=内脏团质量(g)÷全鱼质量(g)×100%;
肝体比(Viscerosomatic index,VSI)=肝脏质量(g)÷全鱼质量(g)×100%。
2 结果 2.1 生长性能与饲料利用饲料中单独或协同添加Leu、Gln对大菱鲆幼鱼生长性能和饲料利用的影响如表 3所示。相比FM组,Con组大菱鲆幼鱼的FBW和SGR均显著降低(P < 0.05),L+G组和L-G组的FBW和SGR显著高于Con组(P < 0.05),且与FM组无显著差异(P>0.05)。各组间FI和SR的差异不显著(P>0.05)。
|
|
表 3 饲料中添加Leu和Gln对大菱鲆生长性能和饲料利用的影响 Table 3 Effects of dietary leucine and glutamine supplementation on growth performance and feed utilization of turbot |
Con、L、G组的FCR显著高于FM组(P < 0.05),L+G和L-G组的FCR则与Con和FM组的差异均不显著(P>0.05)。Con组大菱鲆幼鱼的PER和PR显著低于FM组(P < 0.05);L+G和L-G组的PER和PR高于单独添加Leu或Gln组,且与FM组差异不显著(P>0.05)。Con组的FR显著低于FM组(P < 0.05);添加晶体氨基酸或二肽组的FR均高于Con组,且与FM组差异不显著(P>0.05)。
2.2 形体指标和全鱼体组成成分各组大菱鲆幼鱼形体指标分析结果见表 4,各组之间的肥满度、脏体比和肝体比无显著差异(P>0.05)。
|
|
表 4 饲料中添加Leu和Gln对大菱鲆形体指标的影响 Table 4 Effects of dietary leucine and glutamine supplementation on physical indicators of turbot |
各组大菱鲆幼鱼体组成成分的分析结果见表 5,各组之间的全鱼水分、粗蛋白、粗脂肪和灰分均无显著差异(P>0.05)。
|
|
表 5 饲料中添加Leu和Gln对大菱鲆体组成成分的影响 Table 5 Effects of dietary leucine and glutamine supplementation on body composition of turbot |
各组大菱鲆幼鱼的血清代谢指标见表 6。各组间的血清葡萄糖和总蛋白含量无显著差异(P>0.05)。相比FM组,Con组的血清总胆固醇(TCHO)和甘油三酯(TG)含量显著下降(P < 0.05)。L组和L-G组的血清TCHO含量均高于Con组,且与FM组无显著差异(P>0.05)。FM组的血清TG水平显著高于其余各组(P < 0.05)。
|
|
表 6 饲料中添加Leu和Gln对大菱鲆血浆代谢指标的影响 Table 6 Effects of dietary leucine and glutamine supplementation on plasma metabolic index of turbot |
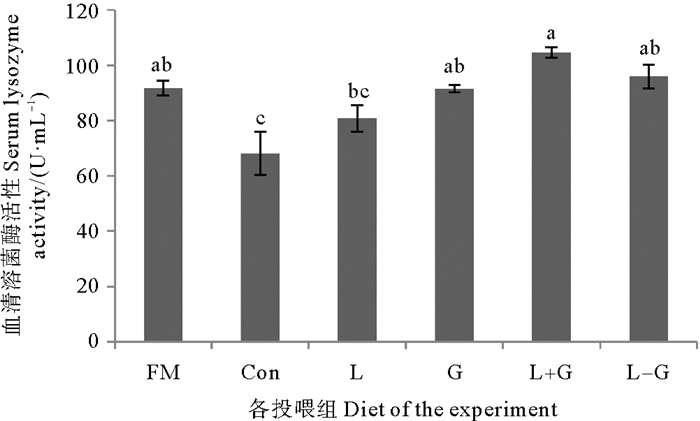
如图 1所示,Con组血清溶菌酶活性显著低于FM组(P < 0.05),G、L+G、L-G组的血清溶菌酶活性高于Con组(P < 0.05),且与FM组差异不显著(P>0.05)。
|
( 数据表示为平均值±标准差(Mean±SD),n=3。不同组之间上标字母不同表示差异显著(P < 0.05)。The data were expressed as Mean±SD, n=3. The difference in superscript letters between different groups indicated a significant difference (P < 0.05). ) 图 1 饲料中添加Leu和Gln对大菱鲆血清溶菌酶活性的影响 Fig. 1 Effects of dietary leucine and glutamine supplementation on serum lysozyme activity of turbot |
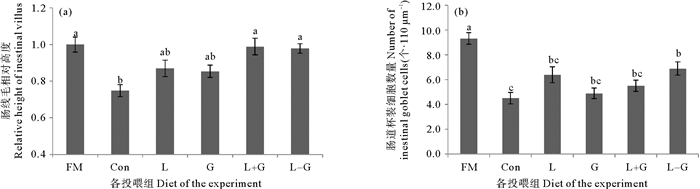
如图 2(a)所示,相比FM组,Con组的肠绒毛高度显著降低(P < 0.05),添加晶体氨基酸或二肽的4个组肠绒毛高度增加,且L+G、L-G组的肠绒毛高度与FM组无显著差异(P>0.05)。如图 2(b)所示,与FM组相比,其余各组的肠道杯状细胞数量显著降低(P < 0.05),仅L-G组的肠道杯状细胞数目显著高于Con组(P < 0.05)。
|
( 图 2(a)和2(b)分别表示了大菱鲆幼鱼肠绒毛相对高度和肠道杯状细胞数量。数据表示为平均值±标准差(Mean±SD),n=3。不同组之间上标字母不同表示差异显著(P < 0.05)。The relative height of the intestinal villus and the number of intestinal goblet cells in each group were shown in Fig. 2(a) and Fig. 2(b). The data were expressed as Mean±SD, n=3. The difference in superscript letters between different groups indicated a significant difference (P < 0.05). ) 图 2 饲料中添加Leu和Gln对大菱鲆肠道组织形态的影响 Fig. 2 Effects of dietary leucine and glutamine supplementation on intestinal morphology of turbot |
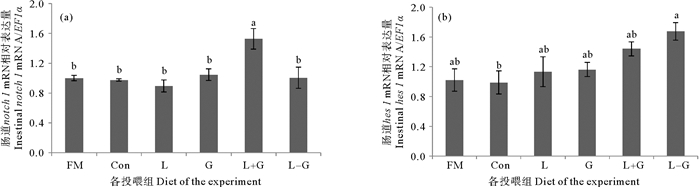
如图 3(a)所示,L+G组的肠道notch1基因表达量显著高于其余各组(P < 0.05)。如图 3(b)所示,L-G组的肠道hes1基因表达量显著高于Con组(P < 0.05),并与其余各组无显著差异(P>0.05)。
|
( 图 3(a)和3(b)分别表示各组大菱鲆肠道notch1和hes1的基因相对表达量。数据表示为平均值±标准差(Mean±SD),n=3。不同组之间上标字母不同表示差异显著(P < 0.05)。Fig. 3(a) and (b) show the relative gene expression levels of notch1 and hes1 in the turbot intestinal in each group, respectively. The data were expressed as Mean±SD, n=3. The difference in superscript letters between different groups indicated a significant difference (P < 0.05). ) 图 3 饲料中添加Leu和Gln对大菱鲆肠道分化相关基因表达的影响 Fig. 3 Effects of dietary leucine and glutamine supplementation on the expression of intestinal differentiation-related genes in turbot |
本研究显示,植物蛋白替代鱼粉的饲料中添加Leu或Gln能够改善大菱鲆的生长性能,并对其饲料利用有着积极影响。在其他物种上,单独添加Leu或Gln的相关研究中也有类似的结果,例如在半滑舌鳎(Cynoglossus semilaevis)、大眼利齿脂鲤(Hoplias macrophthalmus)和黄颡鱼(Pelteobagrus fulvidraco)饲料中添加Gln能够提高鱼体的生长性能,这被认为与抗氧化能力的增加和肠道功能的改善有关[24-26]。另外,对异育银鲫(Carassius auratus gibelio)、卵形鲳鲹(Trachinotus ovatus)和团头鲂(Megalobrama amblycephala)上的研究表明,饲料中添加适宜含量的Leu也能够提高生长性能,这与Leu激活TOR信号通路从而调节蛋白质合成的功能相关[27-29]。
在本研究中,Leu和Gln联合添加比单独添加可以更好地改善鱼类的生长性能和饲料利用效率,且与FM组无显著差异。这与一些相关研究的结果类似,某些氨基酸联合添加时存在协同作用[30-31]。但其他几项研究中氨基酸联合添加却会引发拮抗作用,例如在饲料中添加高含量的Leu和缬氨酸(Val)会对牙鲆(Paralichthys olivaceus)的生长性能产生不良影响[32]。推测氨基酸交互作用的相关研究结果存在差异的原因至少包括四个方面:第一,不同种类氨基酸本身的性质各异,不同添加量下不同氨基酸组合的交互作用存在复杂的多样性;第二,氨基酸的应答机制存在种间差异;第三,研究对象的生理状态可能会对氨基酸交互作用的效果产生影响,这受到研究对象生长阶段、水环境因子和饲料组成等多种因素的共同影响;第四,饲料的组成成分(原料来源、营养素比例和抗营养因子含量等)可能会影响氨基酸之间的交互作用。但目前氨基酸协同作用的相关研究较少,且未见有鱼类饲料中Leu和Gln联合添加的报道,难以进一步类比推理。
过往的研究表明,鱼类摄食高水平植物蛋白替代鱼粉饲料后,其肠道组织形态普遍会发生不良变化,且氨基酸吸收能力往往会降低[14-15]。已有很多研究证实了Gln和Leu对肠道健康的重要作用,包括增加肠道长度和肠绒毛高度[13, 25, 28, 33]。而肠绒毛高度的增加意味着肠道吸收表面积的增加和小肠吸收功能的改善。本研究进一步发现,相比于饲料中单独添加Leu或Gln,二者联合添加能够更显著地提高大菱鲆幼鱼肠绒毛高度,这与在斑马鱼(Danio rerio)饲料中添加二肽的研究结果类似[34]。已有研究表明二肽型Leu比游离型Leu的氨基酸利用率更高[35],这可能是因为二肽能够上调肠道小肽转运载体PepT1的mRNA表达[4, 30],进而提高其吸收效率。另外,硬骨鱼类对二肽的吸收速率较高,并能够很好地利用二肽[19-20],有研究推测,相比氨基酸而言,鱼类可能更偏好利用二肽。以上研究表明,Leu和Gln共同添加有利于维持鱼体的肠道健康,且可能通过改善肠道的吸收能力来提升对饲料氨基酸的利用率。本研究中Leu-Gln二肽还可以显著增加大菱鲆肠道杯状细胞的数量,这可能有助于肠道黏膜屏障的修复和保护。
由于肠上皮细胞的寿命较短,通常需要肠道干细胞不断增殖分化实现自我更新,以维持上皮完整性。为解释在Leu和Gln共同添加时观察到的肠道健康状况的改善,我们检测了肠道分化相关的基因表达。Notch-Hes通路的活性对于肠道干细胞的自我更新至关重要,其信号传导由细胞间接触介导。Notch通过调控下游Hes的蛋白表达来控制肠道干细胞的命运[36]。本研究中,L+G组的notch1基因表达量显著高于其余各组。事实上,在小鼠和鱼类中的研究都证实了,TOR信号通过调控notch1的表达和及其活性来调节小鼠肠道内稳态,TOR信号的抑制会引起notch1和hes1的表达下调,从而增加分泌性肠细胞(包括杯状细胞)的分化,同时减少吸收性肠细胞的分化[36-38]。Leu和Gln会激活TOR信号通路[17, 27-29],理论上能够上调notch1和hes1的基因表达,从而使肠道杯状细胞数量下调。但在本研究中,饲料中添加晶体氨基酸或二肽后,大菱鲆幼鱼肠道杯状细胞数量却是增加的。这可能是因为不同研究条件下信号通路的调控存在差异,且Notch信号其他下游靶基因的表达对肠内干细胞的增殖和分化也起到重要作用[36]。另外,Gln及其代谢产物(如谷胱甘肽)还可以通过其他通路在维持肠道正常功能方面发挥重要作用[2]。目前氨基酸调控鱼类肠道健康的机制尚不明确,需要更多的研究来阐明氨基酸是如何通过Notch信号及其他信号机制来影响鱼类肠道细胞分化命运的选择。
在本研究中,Leu和Gln共同添加时,大菱鲆幼鱼的体蛋白沉积高于单独添加Leu或Gln组,且与FM组差异不显著。这可能与前文所述的肠道健康改善有关,鱼体对营养物质吸收效率增加,从而提高了饲料中营养物质的利用率。除此之外,推测其他原因有如下四点:第一,Gln能够以不同于Leu的方式激活mTOR信号通路(分别依赖Arf1 GTPase或Rag GTPase),还能够影响丝裂原活化蛋白激酶(MAPK)通路[39];第二,Gln和Leu存在代谢和转运的关联,Gln能够通过双向转运机制促进Leu在肠道中的吸收和转运[17],同时,大部分鱼类摄食的Gln在肠道中用于氧化供能,只有少部分进入门静脉,而Leu能够在肝脏代谢生成Gln[10];第三,Gln能够为肠道供能,从而减少Leu的氧化分解,使更多的Leu进入体内的氨基酸库中[31];第四,氨基酸能够通过代谢产物对激素分泌起到调节作用,在哺乳动物上的研究表明,Leu通过激活谷氨酰胺酶和谷氨酸脱氢酶(GDH)促进Gln分解,从而诱导胰岛素分泌[40]。此外,Gln能够转化成为Glu,Glu也是γ-氨基丁酸(GABA)合成的前体物质,而GABA能够调控生长激素的分泌[10]。Leu和Gln可能通过以上营养生理功能,以较低的剂量发挥协同作用,优化鱼类的饲料利用,改善蛋白质平衡,表观体现为蛋白质水解减少、体蛋白合成与沉积增加,使养殖鱼类取得更好的生长性能。但也有一项体外研究报道表明,Leu和Gln对C2C12肌原细胞中的mTOR通路存在拮抗作用[41],这可能与其实验条件和实验对象的差异有关。目前关于Leu和Gln交互作用的研究报道较少,其对生物体蛋白质利用的调控机制有待进一步探究。
本研究发现,所有组的大菱鲆幼鱼的形体指标和体组成成分均无显著差异,这与其他氨基酸型饲料添加剂的相关研究结果类似[16, 42]。其原因可能是在本研究条件下,实验鱼体内蛋白质周转处于稳态;同时,添加氨基酸虽然会促进细胞的增殖和蛋白质沉积,但相对幼鱼整体生长的比例而言是基本恒定的。因此,虽然有的处理组的实验鱼营养物质沉积率提高,但鱼体的形体指标与体组成未发生显著改变。
本研究结果表明,添加Leu或Gln的4个组的均能提高大菱鲆幼鱼的FE,且与FM组无显著差异,这可能与氨基酸激活TOR通路从而调节脂质代谢有关[6]。同时,本研究中观察到G、L+G两组的血清TCHO显著低于FM组。有趣的是,血清TG含量的最低值出现在G组,而L-G组的血清TG含量显著高于G组,这说明晶体Gln对于大菱鲆的脂质代谢可能有着独特的作用。虽然目前尚不清楚Gln是否是鱼类中主要的脂肪生成氨基酸,但Gln能够生成Glu,后者参与水生动物体内调节葡萄糖和脂质稳态的过程,能够促进脂肪生成来提高肝脏对葡萄糖的利用[10]。由于肌肉内脂肪含量是影响肉质的重要因素,在水产养殖中利用氨基酸型饲料添加剂的模式有待进一步探究,以寻求小肽和晶体氨基酸添加的最适比例。
本研究中,G、L+G和L-G组的血清溶菌酶活性显著高于Con组,且L+G组的血清溶菌酶活性高于FM组,说明同时添加晶体Leu和Gln能更好地促进鱼体的非特异性免疫功能,但其机制尚不明确,需要更多的研究加以阐释。
4 结语本研究揭示了以0.2%的水平在饲料(植物蛋白源替代部分鱼粉)中联合添加Leu和Gln能够更有效地促进大菱鲆幼鱼的生长和肠道健康,并能够提高鱼体的免疫力。这是对植物蛋白源替代鱼粉后的鱼类饲料中添加Leu和Gln的协同作用的首次评估,说明了水产动物饲料中协同添加特定氨基酸可能产生更高的应用价值,今后有必要进一步研究以阐述氨基酸交互作用背后的机理,并探索多种氨基酸添加剂相互配合的最佳模式。
| [1] |
Wu G Y, Bazer F W, Dai Z L, et al. Amino acid nutrition in animals: Protein synthesis and beyond[J]. Annual Review of Animal Biosciences, 2014, 2: 387-417. DOI:10.1146/annurev-animal-022513-114113 (  0) 0) |
| [2] |
Li P, Wu G Y. Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth[J]. Amino Acids, 2018, 50(1): 29-38. DOI:10.1007/s00726-017-2490-6 (  0) 0) |
| [3] |
da Cruz T P, Michelato M, Dal-Pai-Silva M, et al. Growth performance, amino acid retention and mRNA levels of mTORC1 signaling pathway genes in Nile tilapia fingerlings fed protein-bound and crystalline amino acids[J]. Aquaculture, 2021, 543: 736953. DOI:10.1016/j.aquaculture.2021.736953 (  0) 0) |
| [4] |
Dabrowski K, Zhang Y F, Kwasek K, et al. Effects of protein-, peptide-and free amino acid-based diets in fish nutrition[J]. Aquaculture Research, 2010, 41(5): 668-683. DOI:10.1111/j.1365-2109.2010.02490.x (  0) 0) |
| [5] |
Ahmad I, Ahmed I, Fatma S, et al. Role of branched-chain amino acids on growth, physiology and metabolism of different fish species: A review[J]. Aquaculture Nutrition, 2021, 27(5): 1270-1289. DOI:10.1111/anu.13267 (  0) 0) |
| [6] |
Duan Y H, Li F N, Li Y H, et al. The role of leucine and its metabolites in protein and energy metabolism[J]. Amino Acids, 2016, 48(1): 41-51. DOI:10.1007/s00726-015-2067-1 (  0) 0) |
| [7] |
McCann K M, Rawles S D, Lochmann R T, et al. Dietary replacement of fishmeal with commercial protein blends designed for aquafeeds in hybrid striped bass (Morone chrysops male×Morone saxatilis female): Digestibility, growth, body composition, and nutrient retention[J]. Aquaculture Reports, 2021, 21: 100903. DOI:10.1016/j.aqrep.2021.100903 (  0) 0) |
| [8] |
Liang H L, Mokrani A, Ji K, et al. Dietary leucine modulates growth performance, Nrf2 antioxidant signaling pathway and immune response of juvenile blunt snout bream (Megalobrama amblycephala)[J]. Fish & Shellfish Immunology, 2018, 73: 57-65. (  0) 0) |
| [9] |
Wu C L, Chen L, Lu Z B, et al. The effects of dietary leucine on the growth performances, body composition, metabolic abilities and innate immune responses in black carp Mylopharyngodon piceus[J]. Fish & Shellfish Immunology, 2017, 67: 419-428. (  0) 0) |
| [10] |
Li X Y, Zheng S X, Wu G Y. Nutrition and metabolism of glutamate and glutamine in fish[J]. Amino Acids, 2020, 52(5): 671-691. DOI:10.1007/s00726-020-02851-2 (  0) 0) |
| [11] |
Zhao Z G, Song F J, Xu Q Y. Effects of glutamine and its precursors on the growth performance and relevant protein synthesis pathway of mirror carp Cyprinus carpio[J]. Fisheries Science, 2017, 83(6): 1019-1026. DOI:10.1007/s12562-017-1124-y (  0) 0) |
| [12] |
张杰, 陈海敏, 周歧存, 等. 谷氨酰胺对黄颡鱼幼鱼抗氧化能力和非特异性免疫力的影响[J]. 动物营养学报, 2016, 28(3): 759-765. Zhang J, Chen H M, Zhou Q C, et al. Effects of glutamine on antioxidant capacity and non-specific immunity of juvenile yellow catfish (Pelteoobagrus fulvidraco)[J]. Chinese Journal of Animal Nutrition, 2016, 28(3): 759-765. DOI:10.3969/j.issn.1006-267x.2016.03.016 (  0) 0) |
| [13] |
Gu M, Pan S H, Li Q, et al. Protective effects of glutamine against soy saponins-induced enteritis, tight junction disruption, oxidative damage and autophagy in the intestine of Scophthalmus maximus L[J]. Fish & Shellfish Immunology, 2021, 114: 49-57. (  0) 0) |
| [14] |
Chen Z C, Liu Y, Li Y X, et al. Dietary arginine supplementation mitigates the soybean meal induced enteropathy in juvenile turbot, Scophthalmus maximus L[J]. Aquaculture Research, 2018, 49(4): 1535-1545. DOI:10.1111/are.13608 (  0) 0) |
| [15] |
Zhang Y L, Duan X D, Jiang W D, et al. Soybean glycinin decreased growth performance, impaired intestinal health, and amino acid absorption capacity of juvenile grass carp (Ctenopharyngodon idella)[J]. Fish Physiology and Biochemistry, 2019, 45(5): 1589-1602. DOI:10.1007/s10695-019-00648-z (  0) 0) |
| [16] |
韩雨哲, 高乔, 崔培, 等. 水产动物饲料中氨基酸交互作用的研究[J]. 天津农学院学报, 2015, 22(1): 45-49. Han Y Z, Gao Q, Cui P, et al. Interactive effects of amino acids in aquatic animal feed[J]. Journal of Tianjin Agricultural University, 2015, 22(1): 45-49. DOI:10.3969/j.issn.1008-5394.2015.01.012 (  0) 0) |
| [17] |
Nicklin P, Bergman P, Zhang B L, et al. Bidirectional transport of amino acids regulates mTOR and autophagy[J]. Cell, 2009, 136(3): 521-534. DOI:10.1016/j.cell.2008.11.044 (  0) 0) |
| [18] |
叶元土, 王永玲, 蔡春芳, 等. 谷氨酰胺对草鱼肠道L-亮氨酸、L-脯氨酸吸收及肠道蛋白质合成的影响[J]. 动物营养学报, 2007, 19(1): 28-32. Ye Y T, Wang Y L, Cai C F, et al. Effects of the L-glutamine on the absorption of L-leucine, L-proline and the protein synthesis in intestine of grass carp (Ctenopharyngodon idellus) in vitro[J]. Chinese Journal of Animal Nutrition, 2007, 19(1): 28-32. DOI:10.3969/j.issn.1006-267X.2007.01.005 (  0) 0) |
| [19] |
Xu D D, He G, Mai K S, et al. Expression pattern of peptide and amino acid genes in digestive tract of transporter juvenile turbot (Scophthalmus maximus L.)[J]. Journal of Ocean University of China, 2016, 15(2): 334-340. DOI:10.1007/s11802-016-2768-4 (  0) 0) |
| [20] |
Verri T, Terova G, Dabrowski K, et al. Peptide transport and animal growth: The fish paradigm[J]. Biology Letters, 2011, 7(4): 597-600. DOI:10.1098/rsbl.2010.1164 (  0) 0) |
| [21] |
贺光祖. 谷氨酰胺二肽对猪肠上皮细胞更新和蛋白质代谢的调控研究[D]. 长沙: 湖南农业大学, 2015. He G Z. Studies of the Regulation of Glutamine Dipeptide on Cell Renewal and Protein Metabolism in Porcine Intestinal Epithelial Cell[D]. Changsha: Hunan Agricultural University, 2015. (  0) 0) |
| [22] |
Bian F Y, Jiang H W, Man M S, et al. Dietary gossypol suppressed postprandial TOR signaling and elevated ER stress pathways in turbot (Scophthalmus maximus L.)[J]. American Journal of Physiology-Endocrinology and Metabolism, 2017, 312(1): 37-47. DOI:10.1152/ajpendo.00285.2016 (  0) 0) |
| [23] |
Liu Y Z, He G, Wang Q C, et al. Hydroxyproline supplementation on the performances of high plant protein source based diets in turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2014, 433: 476-480. DOI:10.1016/j.aquaculture.2014.07.002 (  0) 0) |
| [24] |
Liu J W, Mai K S, Xu W, et al. Effects of dietary glutamine on survival, growth performance, activities of digestive enzyme, antioxidant status and hypoxia stress resistance of half-smooth tongue sole (Cynoglossus semilaevis Gunther) post larvae[J]. Aquaculture, 2015, 446: 48-56. DOI:10.1016/j.aquaculture.2015.04.012 (  0) 0) |
| [25] |
Ramos A R P, Campelo D A V, Carneiro C L d S, et al. Optimal dietary L-glutamine level improves growth performance and intestinal histomorphometry of juvenile giant trahira (Hoplias lacerdae), a Neotropical carnivorous fish species[J]. Aquaculture, 2022, 547: 737469. DOI:10.1016/j.aquaculture.2021.737469 (  0) 0) |
| [26] |
Jiao C R, Zou J H, Chen Z W, et al. Dietary glutamine inclusion regulates immune and antioxidant system, as well as programmed cell death in fish to protect against Flavobacterium columnare infection[J]. Antioxidants, 2021, 11(1): 44. DOI:10.3390/antiox11010044 (  0) 0) |
| [27] |
Zou T, Cao S P, Xu W J, et al. Effects of dietary leucine levels on growth, tissue protein content and relative expression of genes related to protein synthesis in juvenile gibel carp (Carassius auratus gibelio var. CAS Ⅲ)[J]. Aquaculture Research, 2018, 49(6): 2240-2248. DOI:10.1111/are.13682 (  0) 0) |
| [28] |
Tan X H, Lin H Z, Huang Z, et al. Effects of dietary leucine on growth performance, feed utilization, non-specific immune responses and gut morphology of juvenile golden pompano Trachinotus ovatus[J]. Aquaculture, 2016, 465: 100-107. DOI:10.1016/j.aquaculture.2016.08.034 (  0) 0) |
| [29] |
Ren M C, Habte-Tsion H M, Liu B, et al. Dietary leucine level affects growth performance, whole body composition, plasma parameters and relative expression of TOR and TNF-alpha in juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2015, 448: 162-168. DOI:10.1016/j.aquaculture.2015.06.008 (  0) 0) |
| [30] |
Wei Y L, Li B X, Xu H G, et al. Effects of lysine and leucine in free and different dipeptide forms on the growth, amino acid profile and transcription of intestinal peptide, and amino acid transporters in turbot (Scophthalmus maximus)[J]. Fish Physiology and Biochemistry, 2020, 46(5): 1795-1807. DOI:10.1007/s10695-020-00828-2 (  0) 0) |
| [31] |
Obeid O A, Bittar S T, Hwalla N, et al. Effect of diet supplementation with glutamine, dihydroxyacetone, and leucine on food intake, weight gain, and postprandial glycogen metabolism of rats[J]. Nutrition, 2005, 21(2): 224-229. DOI:10.1016/j.nut.2004.03.026 (  0) 0) |
| [32] |
Han Y Z, Han R Z, Koshio S, et al. Interactive effects of dietary valine and leucine on two sizes of Japanese flounder Paralichthys olivaceus[J]. Aquaculture, 2014, 432: 130-138. DOI:10.1016/j.aquaculture.2014.05.004 (  0) 0) |
| [33] |
Lin Y, Zhou X Q. Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. Aquaculture, 2006, 456(1-4): 389-394. (  0) 0) |
| [34] |
Molinari G S, Wojno M, McCracken V J, et al. The use of dipeptide supplementation as a means of mitigating the negative effects of dietary soybean meal on zebrafish Danio rerio[J]. Comparative Biochemistry and Physiology a-Molecular & Integrative Physiology, 2021, 257: 110958. (  0) 0) |
| [35] |
Kim S S, Lee K J. Comparison of leucine requirement in olive flounder (Paralichthys olivaceus) by free or synthetic dipeptide forms of leucine[J]. Animal Feed Science and Technology, 2013, 183(3-4): 195-201. DOI:10.1016/j.anifeedsci.2013.05.008 (  0) 0) |
| [36] |
Noah T K, Shroyer N F. Notch in the Intestine: Regulation of Homeostasis and Pathogenesis[M]. Annual Review of Physiology, Palo Alto: Annual Reviews, 2013: 263-288.
(  0) 0) |
| [37] |
Wang Q C, He G, Mai K S, et al. Chronic rapamycin treatment on the nutrient utilization and metabolism of juvenile turbot (Psetta maxima)[J]. Scientific Reports, 2016, 6: 28068. DOI:10.1038/srep28068 (  0) 0) |
| [38] |
Zhou Y, Rychahou P, Wang Q, et al. TSC2/mTORC1 signaling controls Paneth and goblet cell differentiation in the intestinal epithelium[J]. Cell Death & Disease, 2015, 6(2): 1631. (  0) 0) |
| [39] |
Jewell J L, Kim Y C, Russell R C, et al. Differential regulation of mTORC1 by leucine and glutamine[J]. Science, 2015, 347(6218): 194-198. DOI:10.1126/science.1259472 (  0) 0) |
| [40] |
Li C H, Najafi H, Daikhin Y, et al. Regulation of leucine-stimulated insulin secretion and glutamine metabolism in isolated rat islets[J]. Journal of Biological Chemistry, 2003, 278(5): 2853-2858. DOI:10.1074/jbc.M210577200 (  0) 0) |
| [41] |
Deldicque L, Canedo C S, Horman S, et al. Antagonistic effects of leucine and glutamine on the mTOR pathway in myogenic C2C12 cells[J]. Amino Acids, 2008, 35(1): 147-155. DOI:10.1007/s00726-007-0607-z (  0) 0) |
| [42] |
Pereira R T, Rosa P V, Gatlin III D M. Glutamine and arginine in diets for Nile tilapia: Effects on growth, innate immune responses, plasma amino profiles and whole-body composition[J]. Aquaculture, 2017, 473: 135-144. DOI:10.1016/j.aquaculture.2017.01.033 (  0) 0) |
 2023, Vol. 53
2023, Vol. 53


