2. 中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003
囊舌目(Sacoglossa)属于软体动物门腹足纲,其部分类群可通过摄食将特定藻类的叶绿体完整保留到消化道上皮细胞中作为内共生体(Endosymbiont)行使功能[1-3],因而受到广泛的关注,这种现象被称为盗食质体(Kleptoplasty)[4]。目前,海天牛科的Elysia timida[5]、E. diomedea及E. chlorotica[6]等已被证实具备此能力。有报道指出,棍螺科指状棍螺(Placida dendritica)[7]同样具有盗食质体的能力。
指状棍螺是黄、渤海潮间带常见的囊舌目棍螺科棍螺属动物,它以藓羽藻(Bryopsis hypnoides)为食,身体呈淡绿色,背部前侧可见半透明围心腔,背部两侧有纺锤形次生鳃突起,腹足平滑,尾部细长。其生殖方式为雌雄同体但异体受精[8]。关于指状棍螺的研究主要聚焦于其形态描述[9]和天然产物分离[10-11],有关胚胎发育过程的研究尚未见报道,且其盗食质体的细胞学机制也尚未明确。
本文研究了青岛近岸指状棍螺的胚胎早期发育过程,系统记录和描述了各个发育阶段的形态特征及生长数据。并利用透射电子显微镜观察了指状棍螺成体消化道上皮细胞吞噬叶绿体的亚显微结构变化。研究结果将为研究指状棍螺室内人工繁育提供技术参数,并为研究内吞的叶绿体在指状棍螺细胞内的代谢过程及其与宿主细胞的相互关系奠定基础。
1 材料与方法 1.1 实验动物采集与暂养指状棍螺亲本于2021年7月采自山东青岛栈桥海域。指状棍螺常附着于藓羽藻上,其体色与藻色相近。采集时,通过收集藓羽藻将指状棍螺一并获取,并转移至已消毒的玻璃缸中。玻璃缸规格为45 cm×30 cm×20 cm,提前注入盐度约为30的过滤海水20 L,每缸放入指状棍螺15~20只,使其自由运动、摄食及交配。室温保持在20 ℃,并保持充氧状态。每天上午9:00,投喂新鲜藓羽藻,并将前一天投喂的海藻及粪便进行清理,然后换水(换水量为原水量的40%~60%)。每两周对玻璃缸及海水进行彻底更换,以确保水质清洁。
1.2 胚胎培养及观察亲本交配后,产出由多个受精卵聚集形成的卵块。将卵块用过滤海水清洗,去除表面附着的杂藻及杂质,移入500目筛绢制成的培育篮中,然后将放有卵块的培育篮放入暂养缸中进行孵化。孵化水温保持在18~20 ℃,盐度约为30,每天换水(换水量为原水量的40%~60%)。在卵块孵化过程中,对受精卵进行连续取样,观察各个时期胚胎发育的变化并记录时间节点。每个时期均选取20个胚胎进行观察测量。当孵化破膜后,指状棍螺幼虫漂浮在培育篮的水面上,此时需将已孵化的指状棍螺幼虫转移至规格为39 cm×28 cm×14 cm的透明箱中,加入过滤海水10 L,保持盐度约30,水温18 ℃,并每日换水(换水量为原水量的40%~60%)。
1.3 胚胎染色及观察用4%多聚甲醛溶液对不同发育阶段胚胎固定20 min后,用PBS缓冲液洗涤,再用鬼笔环肽(Phalloidin)及4′,6-二脒基-2-苯基吲哚(DAPI)染色后封片,并进行荧光观察。记录胚胎发育阶段,测量相关数据,并整理发育图谱。
1.4 胚胎发育动态观察用镊子去除卵块表面附着的动物粪便及藓羽藻,将卵块分离成若干小块。使用200 μL移液枪反复吹打卵块,使受精卵相互分离。使用倒置显微镜观察受精卵,对其发育动态过程进行拍照记录。
1.5 次生鳃冷冻切片制备用4%多聚甲醛溶液对指状棍螺次生鳃进行固定,20 min后,用30%的蔗糖-海水溶液对样品进行脱水沉降。沉降完成后,吸干样品表面蔗糖溶液,并将其置于最佳切割温度(Optimal cutting temperature, OCT)包埋胶水中,再放入液氮中凝固。样品于冷冻切片机中平衡0.5 h后开始切片,切片厚度为10 μm。
1.6 次生鳃染色及观察使用4%多聚甲醛溶液对指状棍螺次生鳃固定约20 min后,使用PBS缓冲液进行洗涤,随后进行Phalloidin染色。最后封片观察次生鳃的结构和形态。
1.7 电镜样品制备分别提取正常喂食、饥饿1 d、饥饿3 d、饥饿5 d和饥饿7 d后仍存活的指状棍螺背侧消化道密集的组织作为样本。使用2.5%的戊二醛-海水溶液固定样本,并于4 ℃条件下保存。之后,样本送至青岛大学医学院电镜中心制备成半薄切片和超薄切片样本,并进行拍摄观察。
2 结果 2.1 卵块形态描述指状棍螺卵块由若干受精卵组成,呈半透明乳白色,其外覆有一层卵膜(见图 1)。自然状态下,指状棍螺卵块通常产在潮间带海藻或礁石上。实验状态下,指状棍螺以玻璃缸壁及藻株作为附着基,卵块呈螺旋状排列在这些附着基上。卵块中的受精卵彼此黏附在一起,随着受精卵的孵化,卵块由乳白色的胶质逐渐变为透明黏液。

|
图 1 指状棍螺受精卵 Fig. 1 Fertilized eggs of P. dendritica |
通过记录胚胎发育时序特征,测量相关数据,整理出发育图谱。在光学显微镜下观察测量胚胎各发育阶段及其形态和大小(见表 1),同时,记录胚胎发育形态(见图 2)。此外,对胚胎进行免疫荧光染色,胚胎发育形态如图 3所示。
|
|
表 1 指状棍螺胚胎早期发育的不同时期 Table 1 Stages of embryonic development of P. dendritica |
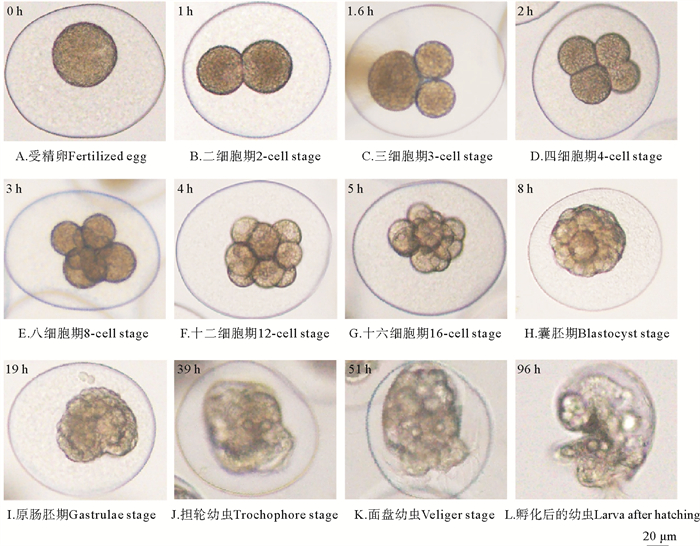
|
图 2 指状棍螺的胚胎发育 Fig. 2 Morphology of P. dendritica embryos at different stages |
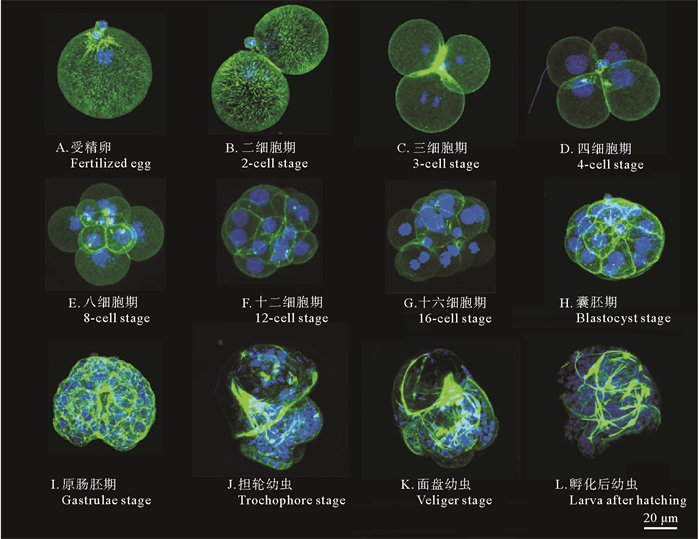
|
( 绿色为Phalloidin标记的微丝,蓝色为DAPI标记的细胞核。The green represents actin filaments labeled with Phalloidin, while the blue represents cell nuclei labeled with DAPI. ) 图 3 指状棍螺胚胎早期发育的免疫荧光染色 Fig. 3 Immunofluorescence staining embryos at different developmental stages of P. dendritica |
(1) 受精卵:每枚受精卵外有一层透明的卵膜包被,在受精卵和卵膜间,存在两枚极体。受精卵呈球形,内部充满卵黄,直径为(43.85±2.08) μm。刚产出的受精卵中卵黄均匀。约30~40 min后,受精卵的一侧逐渐出现一个较透明的圆形区域,预示着即将发生第一次卵裂。
(2) 二细胞期:受精约1 h后,受精卵逐渐变为椭圆形,并发生一次不均等分裂,形成一大一小两个卵裂球。
(3) 三细胞期:受精约1.6 h后,大多数胚胎中,小卵裂球先进行分裂,分裂方向与第一次卵裂垂直。此时,一大两小三个卵裂球呈三角形排列。部分胚胎二细胞期的两个卵裂球几乎同时分裂,直接进入四细胞期。
(4) 四细胞期:受精约2 h后,经过短暂的三细胞期,二细胞期中较大的卵裂球也进行分裂,分裂方向与较小卵裂球平行,因此产生的四个裂球排列在同一平面。
(5) 八细胞期:受精约3 h后,四细胞期的四个裂球发生不均等卵裂,卵裂球分为两层。动物极四个小裂球旋转45°后,位于植物极四个大裂球上层,呈现螺旋状分布。
(6) 十二细胞期:受精约4 h后,植物极的四个大裂球再次分裂为两层,每层各有四个裂球,且这些细胞相差45°排列。而动物极的四个小裂球不分裂。此时,胚胎共分为3个平面,各层卵裂球均呈45°螺旋分布。
(7) 十六细胞期:受精约5 h后,最靠近植物极的四个大裂球再次发生不均等的分裂,产生四个小裂球。这些小细胞分别插入四个大裂球的间隙中。
(8) 桑葚胚期:受精约7 h后,细胞分裂不再同步,而是形成一个细胞团。
(9) 囊胚期:受精约8 h后,胚胎经过多次分裂,形成一个多细胞的胚体,然而并无明显的囊胚腔。
(10) 原肠胚期:受精约19 h后,致密的囊胚细胞开始运动,位于外层的囊胚细胞通过原肠作用进入内部,逐渐形成原口。原口最初为植物极一侧的凹陷,且凹陷逐渐加深。此时胚胎形状逐渐向球形转换,为原口的加深和扩大提供空间。原口周围的一列细胞呈U形排列,且颜色较深。随后,原口的开口处逐渐收拢变小,使胚胎近球形。
(11) 担轮幼虫:受精约39 h后,原肠胚开始在卵室中微微旋转。其原口的对侧逐渐突起变尖,使胚胎形状接近三角形,并出现了贝壳。贝壳口处有大量微丝富集,呈圆环状排列,并出现了纤毛环,幼虫可以借助纤毛的摆动在膜内缓慢运动。
(12) 面盘幼虫:受精约51 h后,随着面盘逐渐形成,面盘幼虫开始运动,此时,面盘中存在大量肌肉,大量微丝束从壳内的一点放射状延伸至面盘中。面盘末端生长有大量纤毛,面盘幼虫依靠纤毛摆动在水中游动。这一阶段持续约2 d,随后孵化出幼虫(幼虫破膜)。
(13) 孵化后的幼虫:在水温18~20 ℃条件下,产卵约4 d后,面盘幼虫孵化出膜,此时卵块周围原本发挥黏着功能的分泌物被逐渐溶解,幼虫进入水中营浮游生活。随着幼虫的发育,纤毛逐渐退化,其运动能力也随之下降,运动范围逐渐缩小。
刚孵化出膜的指状棍螺幼虫前期整体呈帽状结构,有较薄且透明的贝壳、两个较大的圆形面盘以及密集的纤毛,幼虫运动能力较强且速度较快,同时,幼虫背部的透明贝壳逐渐变大,幼虫平均壳长(101.84±8.36) μm。幼虫的面盘与纤毛进行规律的运动:当面盘张开时,纤毛剧烈摆动;当面盘合拢时,纤毛随之收拢。幼虫中期,贝壳逐渐成型,壳口向一侧偏转,当面盘收缩时,贝壳外侧的大部分柔软组织可收缩至壳内。随着幼虫的发育面盘退化,幼虫运动能力减弱,此时平均壳长(115.82±6.41) μm。幼虫后期贝壳发育呈螺旋状,壳体增大且略侧扁,面盘连同纤毛逐渐退化并失去运动能力,软体部分可缩入贝壳。
2.3 叶绿体在指状棍螺体内的组织分布指状棍螺背部前端具围心腔。背部两侧分布若干纺锤形次生鳃,其中可见墨绿色树枝状消化道,消化道分支一直延伸至头部嗅角中。在显微镜下可观察到,指状棍螺摄食所获得的藻类原生质在消化道中流动。正常喂食的指状棍螺体色为绿色,饥饿7 d后,体色转为黄色。将正常喂食的指状棍螺次生鳃制作成横向冷冻切片,并利用共聚焦显微镜观察发现,其消化道中存在明显的叶绿体红色自发荧光信号(见图 4)。
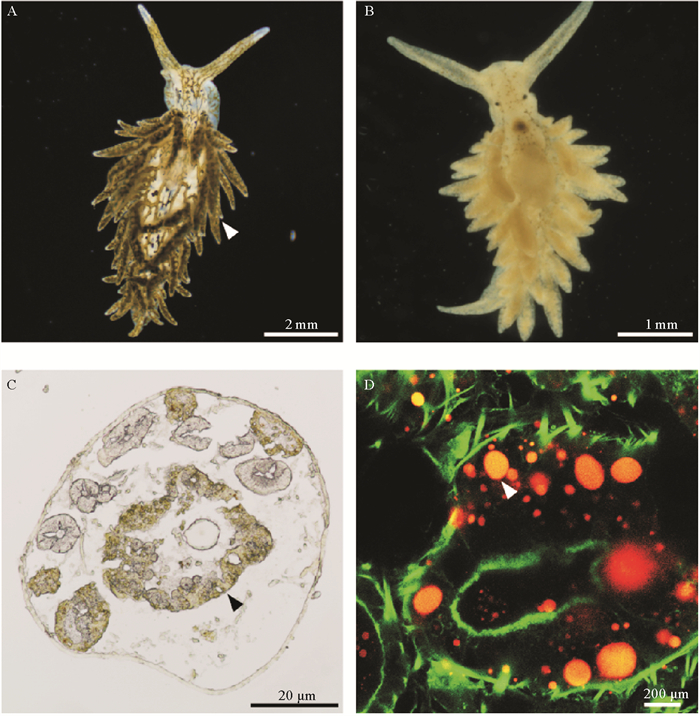
|
( A. 正常喂食条件下的指状棍螺。成体指状棍螺消化道遍布全身,一直延伸至背侧的次生鳃中。白色箭头指示次生鳃。B. 饥饿条件下的指状棍螺。饥饿7 d的成体指状棍螺体色由绿色变为黄色。C. 成体指状棍螺次生鳃的横向冷冻切片。黑色箭头所指为消化道。D. 次生鳃的消化道中显示有叶绿体自发荧光信号。通过共聚焦显微镜观察,绿色为Phalloidin标记的微丝,白色箭头所指为叶绿体的自发红色荧光信号。A. P. dendritica under feeding conditions. The digestive tract of adult P. dendritica extends throughout the body and into the cerata located on the dorsal side. White arrow indicates cerata. B. P. dendritica under starvation conditions. After 7 days for starvation, body color of the adult P. dendritica changes from green to yellow. C. Transverse cryosections of the cerata in adult P. dendritica. Black arrow indicates digestive tract. D. Chloroplast autofluorescence is observed in the digestive tract of cerata, Observation through confocal microscopy, green fluorescence signal showing microfilaments were labeled with phalloidin, white arrow indicates red spontaneous fluorescence signal from chloroplasts. ) 图 4 叶绿体在指状棍螺体内的组织分布 Fig. 4 Spatial distribution of chloroplasts in P. dendritica |
利用透射电子显微镜观察正常喂食的指状棍螺消化道组织(见图 5)。结果显示:消化道上皮细胞结构完好,有明显的细胞边界,并具有微绒毛、绒毛和线粒体等结构;消化道与上皮细胞之间有片层结构紧密的叶绿体。
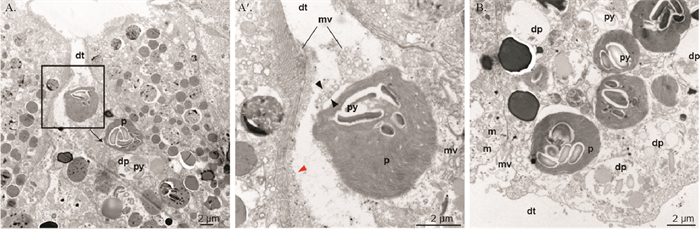
|
( A. 叶绿体进入上皮细胞。叶绿体位于消化道与上皮细胞间,正由消化道进入上皮细胞中。A′. 上皮细胞局部放大图。处于消化道与上皮细胞之间的叶绿体结构完整,具有多个淀粉核。黑色箭头指示叶绿体被单层膜包裹;红色箭头指示周围上皮细胞结构完好。B. 叶绿体完全进入上皮细胞中。上皮细胞中的叶绿体被单层膜包裹。dt: 消化道;dp: 降解的叶绿体;p: 叶绿体;py: 淀粉核;mv: 微绒毛;m: 线粒体。A. Chloroplast entry into the epithelial cells. Chloroplast is located between the digestive tract and the epithelial cells, and is entering the epithelial cells from the digestive tract. A′. Local amplification of epithelial cells. The chloroplast between the digestive tract and epithelial cells have intact structure and have multiple starch nuclei. Black arrows indicate chloroplasts coated with monolayers; red arrows indicate the integrity of surrounding epithelial cells. B. Complete entry of the chloroplasts into the epithelial cells. Chloroplasts in epithelial cells and are coated by a monolayer. dt: Digestive tract; dp: Degraded chloroplasts; p: Chloroplasts; py: Pyrenoid; mv: Microvilli; m: Mitochondria. ) 图 5 指状棍螺消化道上皮细胞的透射电子显微镜图 Fig. 5 TEM images of the digestive epithelial cells of P. dendritica |
|
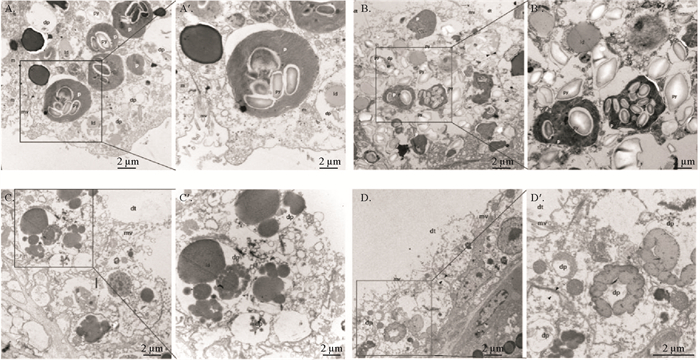
( A. 饥饿1 d时,上皮细胞的亚显微结构。A′. 饥饿1 d时,上皮细胞局部放大图。叶绿体被单层膜包裹,结构完整,具有多个淀粉核。B. 饥饿3 d时,上皮细胞的亚显微结构。B′.饥饿3 d时,上皮细胞局部放大图。多数叶绿体基粒片层结构发生降解,仅保留淀粉核。C. 饥饿5 d时,消化道上皮细胞的亚显微结构。C′. 饥饿5 d时,上皮细胞局部放大图。淀粉核降解形成大小不一的脂滴。D. 饥饿7 d时,上皮细胞的亚显微结构。D′. 饥饿7 d时,上皮细胞局部放大图。如黑色箭头所示,上皮细胞之间的细胞边界存在,但细胞内结构受损。多数叶绿体完全降解,脂滴被保留在上皮细胞当中。dt:消化道;dp:降解的叶绿体;p:叶绿体;py:淀粉核;ld:质滴;mv:微绒毛;v:绒毛;m:线粒体。A. One day after starvation, subcellular structure of epithelial cells. A′. One day of starvation.Magnified view of a local area of epithelial cells. Chloroplasts contained multiple pyrenoid have intact structures, are enveloped by single membrane. B. Three days of starvation, subcellular structure of epithelial cells. B′. Three days of stavation. Magnified view of a local area of epithelial cells. Most thylakoid membrane structures of chloroplasts undergo degradation, leaving the pyrenoids. C. Five days of starvation, subcellular structure of epithelial cells. C′. Five days of starvation. Magnified view of a local area of epithelial cells. The degradation of pyrenoids forms lipid droplets. D. Seven days of starvation, subcellular structure of epithelial cells. D′. Seven days of starvation.Magnified view of a local area of epithelial cells. Black arrow indicates the presence of cell boundaries between the epithelial cells, but the internal structures of the cells are damaged. Most chloroplasts are completely degraded, while lipid droplets are retained in the epithelial cells. dt: Digestive tract; dp: Degraded chloroplasts; p: Chloroplasts; py: Pyrenoid; ld: Lipid droplet; mv: Microvilli; v: Villi; m: Mitochondria. ) 图 6 不同喂食条件下指状棍螺消化道上皮细胞的透射电子显微镜图 Fig. 6 TEM images of the epithelial cells of the digestive tract of P. dendritica under different feeding conditions |
|
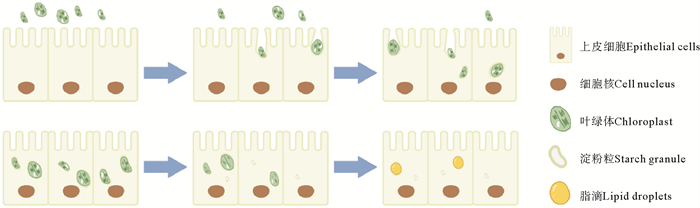
图 7 消化道上皮细胞吞噬(上)、降解(下)叶绿体过程模式图 Fig. 7 Illustrated model patterns of acquisition (upper) and degradation (lower) of chloroplasts by the epithelial cells of the digestive tract |
为观察叶绿体的降解情况,利用透射电子显微镜观察不同饥饿条件下的指状棍螺消化道上皮细胞内叶绿体的亚显微结构变化。饥饿1 d时,上皮细胞与多数叶绿体结构完整,叶绿体被单层膜包裹,上皮细胞中具有微绒毛、核糖体和线粒体等结构,部分叶绿体的片层结构发生降解。饥饿3 d时,多数叶绿体基粒片层结构发生降解,少数叶绿体结构相对完整,包裹叶绿体的膜泡中仅保留淀粉核。饥饿5 d时,上皮细胞中叶绿体的基粒片层结构与淀粉核继续被降解,形成脂滴并聚集在一起。饥饿7 d时,消化道的基底层结构仍保持完整,上皮细胞之间的边界清晰可见,但其细胞内结构已受损,多数叶绿体与淀粉核的降解过程已完成。
3 讨论在青岛海区,指状棍螺通常出现在5—12月的潮间带。成体平均体长约为13 mm,最长可达20 mm。指状棍螺在性成熟后完成受精,产出受精卵,多个受精卵由胶状物质包裹并形成卵块。自然条件下,卵块多附着在藓羽藻或岩石表面,呈螺旋状排列;而在实验室条件下,卵块多附着在藓羽藻上及养殖缸的缸壁上。指状棍螺的交配、产卵及孵化过程受环境影响较大,尤其是水温或盐度,过高和过低均会影响其受精卵的正常发育及孵化。条件恶劣时,卵块质地由胶状转为黏液状,颜色由白色变为黄色,受精卵数目减少且早期分裂速度降低,甚至停止分裂。值得注意的是,同一卵块所包含的所有受精卵发育时间并不完全同步。不同种类的囊舌目动物胚胎发育过程及孵化时间差异较大,如四线海牛(Polycera quadrilineata)和多角海牛(P. aurantiomarginata)的孵化分别发生在产卵后(165±35.5)和(202.4±42) h,孵化时间显著长于指状棍螺[12]。指状棍螺胚胎发育具有一次性产卵数量多、受精卵固定、分裂球大小差异明显和胚胎发育时间较短等优势,使其成为研究胚胎早期细胞极性的理想材料。
自然界中,动物-藻类内共生现象颇为常见,如部分腔肠动物[13]和海绵动物[14]均可与蓝藻共生,利用光合产物来满足自身生理需求。囊舌目动物通过盗食质体获得多种生长发育上的益处:摄食藻株后,动物体色发生改变,使之与环境接近,从而更有利于隐藏自身[1];利用叶绿体为自身生长发育提供能量和碳骨架,提高个体存活率[15];利用叶绿体的代谢产物合成其他化合物[16];在需要磷酸盐和能量时,可以利用叶绿体中富含能量的焦磷酸盐[17]。
Fan等[18]通过透射电子显微镜观察到指状棍螺上皮细胞中存在结构完整叶绿体,但未对其叶绿体来源进行证实。本研究则进一步观察到,叶绿体能够进入指状棍螺消化道上皮细胞,并被单层膜包裹,从而在消化道上皮细胞得以保留。同时,本研究还对叶绿体降解过程进行了观察:饥饿条件下,叶绿体基粒的片层结构首先发生降解;随着饥饿时间延长,越来越多的叶绿体基粒的片层结构降解,直到叶绿体中仅保留淀粉核;最后,叶绿体的淀粉核逐步降解,形成脂滴。
不同种类的囊舌目动物在保留叶绿体时间上存在差异[19-20],并需要通过摄食进行定期补充[21]。实验表明,指状棍螺可保留具有功能的叶绿体约1 d,且在短时间内可以反复获得和代谢叶绿体。此过程对于研究细胞选择性地保留外来物质、细胞器内共生及细胞免疫等问题提供了良好的模型以及新的视角。
| [1] |
Handeler K, Grzymbowski Y P, Krug P J, et al. Functional chloroplasts in metazoan cells—a unique evolutionary strategy in animal life[J]. Frontiers in Zoology, 2009, 6: 28. DOI:10.1186/1742-9994-6-28 (  0) 0) |
| [2] |
Rumpho M E, Pelletreau K N, Moustafa A, et al. The making of a photosynthetic animal[J]. Journal of Experimental Biology, 2011, 214(2): 303-311. DOI:10.1242/jeb.046540 (  0) 0) |
| [3] |
Cartaxana P, Trampe E, Kühl M, et al. Kleptoplast photosynthesis is nutritionally relevant in the sea slug Elysia viridis[J]. Scientific Reports, 2017, 7(1): 1-10. DOI:10.1038/s41598-016-0028-x (  0) 0) |
| [4] |
Maselli M, Anestis K, Klemm K, et al. Retention of prey genetic material by the kleptoplastidic ciliate Strombidium cf. basimorphum[J]. Frontiers in Microbiology, 2021, 12: 694508. DOI:10.3389/fmicb.2021.694508 (  0) 0) |
| [5] |
Rahat M. Direct development and symbiotic chloroplasts in Elysia timida(Mollusca: Opistho branchia)[J]. Israel Journal of Zoology, 1976, 25(4): 186-193. (  0) 0) |
| [6] |
Moreano-Arrobo L, Pérez O D, Brown F D, et al. The "Mexican dancer" in Ecuador: Molecular confirmation, embryology and planktotrophy in the sea slug Elysia diomedea[J]. The International Journal of Developmental Biology, 2020, 65(4-5-6): 323-332. (  0) 0) |
| [7] |
Evertsen J, Johnsen G. In vivo and in vitro differences in chloroplast functionality in the two north Atlantic sacoglossans (Gastropoda, Opisthobranchia) Placida dendritica and Elysia viridis[J]. Marine Biology, 2009, 156(5): 847-859. DOI:10.1007/s00227-009-1128-y (  0) 0) |
| [8] |
尤仲杰, 林光宇. 中国近海棍螺科(后鳃类)的研究[J]. 宁波大学学报(理工版), 2004, 17(4): 373-379. You Z J, Lin G Y. Study on the family Stiligeridae (Opisthobranchia) of China coast[J]. Journal of Ningbo University, 2004, 17(4): 373-379. DOI:10.3969/j.issn.1001-5132.2004.04.001 (  0) 0) |
| [9] |
Trowbridge C D. Dietary induction of opisthobranch morphology: Placida dendritica(Alder & Hancock, 1843) on different green algal hosts[J]. Journal of Molluscan Studies, 1997, 63(1): 29-38. DOI:10.1093/mollus/63.1.29 (  0) 0) |
| [10] |
Cutignano A, Fontana A, Renzulli L, et al. Placidenes C-F, Novel α-pyrone propionates from the Mediterranean Sacoglossan Placida dendritica[J]. Journal of Natural Products, 2003, 66(10): 1399-1401. DOI:10.1021/np0300176 (  0) 0) |
| [11] |
Cutignano A, Cimino G, Villani G, et al. Origin of the C3-unit in placidenes: Further insights into taxa divergence of polypropionate biosynthesis in marine molluscs and fungi[J]. Tetrahedron, 2009, 65(39): 8161-8164. DOI:10.1016/j.tet.2009.07.078 (  0) 0) |
| [12] |
Martínez-Pita I, Sánchez-España A I, García F J. Some aspects of the reproductive biology of two Atlantic species of Polycera(Mollusca: Opisthobranchia)[J]. Journal of the Marine Biological Association of the United Kingdom, 2006, 86(2): 391-399. DOI:10.1017/S0025315406013245 (  0) 0) |
| [13] |
Hu M, Zheng X, Fan C M, et al. Lineage dynamics of the endosymbiotic cell type in the soft coral Xenia[J]. Nature, 2020, 582(7813): 534-538. DOI:10.1038/s41586-020-2385-7 (  0) 0) |
| [14] |
Karimi E, Ramos M, Gonçalves J M, et al. Comparative metagenomics reveals the distinctive adaptive features of the Spongia officinalis endosymbiotic consortium[J]. Frontiers in Microbiology, 2017, 8: 2499. DOI:10.3389/fmicb.2017.02499 (  0) 0) |
| [15] |
Evertsen J, Burghardt I, Johnsen G, et al. Retention of functional chloroplasts in some sacoglossans from the Indo-Pacific and Mediterranean[J]. Marine Biology, 2007, 151(6): 2159-2166. DOI:10.1007/s00227-007-0648-6 (  0) 0) |
| [16] |
Cartaxana P, Rey F, Lekieffre C, et al. Photosynthesis from stolen chloroplasts can support sea slug reproductive fitness[J]. Proceedings of the Royal Society B-Biological Sciences, 2021, 288(1959): 20211779. DOI:10.1098/rspb.2021.1779 (  0) 0) |
| [17] |
Sanz-Luque E, Bhaya D, Grossman A R. Polyphosphate: A Multifunctional Metabolite in Cyanobacteria and Algae[J]. Frontiers in Plant Science, 2020, 11: 938. DOI:10.3389/fpls.2020.00938 (  0) 0) |
| [18] |
Fan X, Qiao H, Xu D, et al. Short-term retention of kleptoplasty from a green alga (Bryopsis) in the sea slug Placida sp. YS001[J]. Biologia, 2014, 69(5): 635-643. DOI:10.2478/s11756-014-0355-y (  0) 0) |
| [19] |
Cruz S, Cartaxana P. Kleptoplasty: Getting away with stolen chloroplasts[J]. PLoS Biology, 2022, 20(11): e3001857. DOI:10.1371/journal.pbio.3001857 (  0) 0) |
| [20] |
Christa G, Handeler K, Schaberle T F, et al. Identification of sequestered chloroplasts in photosynthetic and non-photosynthetic sacoglossan sea slugs(Mollusca, Gastropoda)[J]. Frontiers in Zoology, 2014, 11(1): 15. DOI:10.1186/1742-9994-11-15 (  0) 0) |
| [21] |
Maeda T, Hirose E, Chikaraishi Y, et al. Algivore or phototroph? Plakobranchus ocellatus (Gastropoda) continuously acquires kleptoplasts and nutrition from multiple algal species in nature[J]. PLoS One, 2012, 7(7): e42024. DOI:10.1371/journal.pone.0042024 (  0) 0) |
2. Key Laboratory of Marine Genetics and Breeding, Ministry of Education, Ocean University of China, Qingdao 266003, China
 2025, Vol. 55
2025, Vol. 55


