长牡蛎(Crassostrea gigas)原产于西北太平洋沿岸国家,广泛分布于中国、韩国和日本海域,是中国乃至全球水产养殖业重要的海产贝类[1]。作为重要的水产经济物种,长牡蛎的遗传改良一直受到众多遗传育种学家的重视。目前关于牡蛎的良种选育主要针对的性状是生长、壳色、抗病等[2]。针对生长、壳色、糖原含量等性状的选育,我国科学家已培育出多个长牡蛎新品种,包括“海大1号”(品种登记号:GS-01-005-2013)、“海大2号”(品种登记号:GS-01-007-2016)、“海大3号”(品种登记号:GS-01-007-2018)、“海大4号”(品种登记号:GS-02-005-2022)、“海蛎1号”(品种登记号:GS-01-007-2020)和“鲁益1号”(品种登记号:GS-01-006-2020)等。然而,由于牡蛎高度可塑的外壳,其出肉率性状易受环境影响,难以准确度量,影响育种效率。
壳容积指的是牡蛎左壳和右壳闭紧后两壳之间的空腔的体积,也叫壳腔容积或壳腔体积[3-4]。壳容积是与产肉量显著关联的表型性状。首先,由于壳的三维增大,壳容积相较于壳长、壳高和壳宽等形态性状能更好地反映牡蛎的生长[5]。其次,壳容积不仅可以作为条件指数的参数之一用于衡量环境对双壳贝类肉质和产量的影响[6],还是肉的最大生长空间,对预测最大产肉量具有重要作用。此外,壳容积的测量还可以发挥牡蛎生物监测的作用,例如Higuera等[7]使用体积指数(外部体积/内部体积)评估牡蛎的异常增厚和空腔化进而衡量沿海水域中三丁基锡(Tributyltin,TBT)含量的作用。然而由于壳容积难以在牡蛎活体中测量且测量过程较为复杂,目前对壳容积的研究较少。
通径分析和遗传参数评估是对经济物种的性状进行遗传改良时常用的研究方法。通径分析法将相关系数分解为直接效应和间接效应,可以直接比较自变量对因变量的影响[8]。在贝类遗传育种工作中,通径分析已经取得了广泛应用,在大珠母贝(Pinctada maxima)[9]、合浦珠母贝(P. martemsii)[10]和长牡蛎[11-12]等养殖贝类中,通径分析主要用于探究形态性状对重量性状的影响。关于形态性状对壳容积影响的相关报道只见于近江牡蛎(C. ariakensis)中[13]。此外,遗传力、遗传相关性和表型相关性等遗传参数评估可以为育种计划提供有价值的参考,可以基于此来分析性状通过选育来改良的可行性[14]。多项研究表明长牡蛎的生长、繁殖、抗性等性状可以通过选育进行改良,具有很好的改良潜力,如长牡蛎的生长、壳色[15]、抗病性状[16]、耐热性状[17]和雌性生殖性状(卵径和怀卵量)[18]等。目前,虽然在长牡蛎中已有多项关于表型性状的通径分析和遗传参数评估,但未见关于长牡蛎壳容积的相关报道。
本研究以中国群体、日本群体和韩国群体三个选育群体以及一个野生群体的长牡蛎为研究对象,比较了不同群体间壳型的差异,对每个群体的壳容积进行通径分析和遗传参数评估,旨在为长牡蛎壳容积选育和改良提供理论基础和参考资料。
1 材料与方法 1.1 实验材料实验样品来自于本实验室之前培育的三个选育群体(中国群体(HD)、日本群体(JP)、韩国群体(KR))和一个野生群体(WD)[19]。本研究共构建46个全同胞家系,其中10个中国群体家系,23个日本群体家系,7个韩国群体家系,6个野生群体家系,所有实验样品均在山东莱州利滔育苗场进行繁育,当幼虫壳高达2 mm时,运送至山东荣成的海域进行养成,所有样品均在2020年5月培育,2021年5月采集。
1.2 数据测量本研究从HD、JP、KR和WD四个群体中分别取出113、246、53和79个个体。测量前,去除壳表面的附着物,使用电子游标卡尺(精度:0.01 mm)测量壳高(SH)、壳长(SL)和壳宽(SW)。使用固体填充法[3]测量壳容积(V),填充物为300目石英砂,根据填充石英砂前后质量差除以石英砂密度计算出壳容积。参考文献[11, 20]的研究,使用三个具有几何学意义的指数作为衡量壳型的指标,这三个指数越接近1说明长牡蛎在相应的视角越圆。三个壳型指数的计算公式如下:
| $ I S A=\frac{S W}{S H}, $ | (1) |
| $ I S B=\frac{S L}{S H}, $ | (2) |
| $ I S C=\frac{S W}{S L}。$ | (3) |
式中:ISA为壳型指数A;ISB为壳型指数B;ISC为壳型指数C。
1.3 数据处理 1.3.1 通径分析使用SPSS 27.0对所有数据进行正态性检验和单因素方法分析。通径分析主要参考杜家菊和陈志伟的方法进行[21],使用SPSS 27.0以壳容积为因变量,形态性状为自变量进行通径分析,利用SPSS计算相关系数和直接路径系数(Pi)。间接路径系数(Pij-y)和决定系数(di或dij)的计算方式如下:
| $ P_{i j-y}=r_{i j} P_{j y}, $ | (4) |
| $ d_i=P_i^2, $ | (5) |
| $ d_{i j}=2 r_{i j} P_i P_j \text { 。} $ | (6) |
使用ASReml软件(3.0)[22],参考之前的研究[23], 用动物模型评估出肉率及对相关性状的遗传力(h2),使用双变量模型计算各个性状之间的遗传相关性和表型相关性,计算模型如下:
| $ Y_i=\mu+\alpha_i+d_j+e_i \text { 。} $ | (7) |
式中:Yi表示第i个长牡蛎的性状观测值;μ表示性状的平均值;αi表示第i个长牡蛎的加性遗传方差;dj表示环境效应;ei表示残差。由于dj对所有性状都不显著,故此实际计算中未加入环境效应。
遗传力计算方式如下:
| $ h^2=\frac{\sigma_\alpha^2}{\sigma_\alpha^2+\sigma_e^2}。$ | (8) |
式中:h2表示遗传力;σα2表示加性遗传方差;σe2表示残差方差。
相关性计算方式如下:
| $ r={\frac{\sigma_{x y}}{\sqrt{\sigma_x^2 \sigma_y^2}}}。$ | (9) |
式中:r表示相关性;σxy表示两个性状之间估计的加性遗传或表型协方差;σx表示性状x的加性遗传或表型方差;σy表示性状y的加性遗传或表型方差。
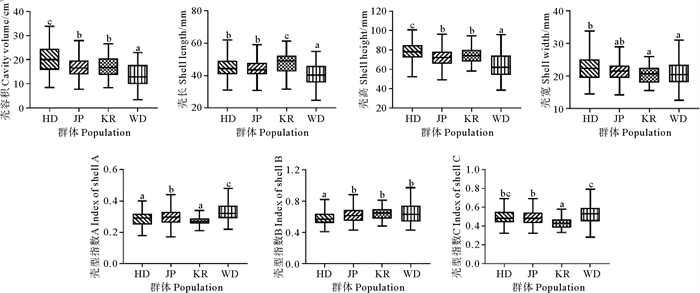
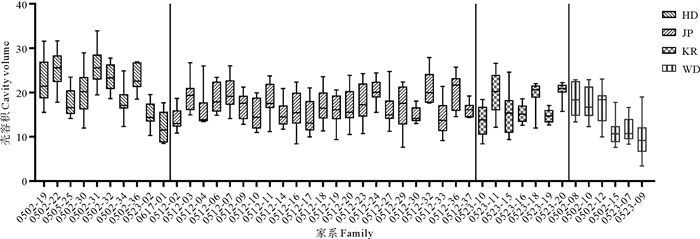
2 结果 2.1 不同群体表型性状的描述性统计及单因素方差分析各群体表型性状测量结果如表 1所示,各性状范围及单因素方差分析结果如图 1所示。在所有生长性状中,壳容积在不同群体均具有最大的变异系数(23.40%~35.29%),其余生长性状和壳型性状的变异系数较小(10.94%~22.34%),表明壳容积具有较大的改良潜力,在所有家系中,平均壳容积最高的为中国群体的0502-31家系,最低的为野生群体的0523-09家系(见图 2)。WD群体各个性状的变异系数明显大于其余选育群体,表明经过选育,各选育群体的性状更加统一。从图 1可知:在壳容积、壳高和壳长方面,HD群体最大,JP和KR群体其次,WD群体最小;就壳宽而言,HD群体改良最为明显;从壳型指数A来看,WD群体最大,其次是JP群体,最后是HD和KR群体;从壳型指数B来看,WD、KR和JP群体较大,HD群体较小;从壳型指数C来看,WD群体最大,HD和JP群体其次,KR群体最小。
|
|
表 1 不同群体长牡蛎各表型性状的描述性统计 Table 1 Descriptive statistics of various phenotypic traits in different populations of Pacific oysters |
|
( 同一图中标准差上方标有不同的英文字母表示差异显著(P<0.05),标有相同的字母表示差异不显著(P>0.05)。The means with different letters within the same column are significantly different at the 0.05 probability level (P < 0.05), while the same letters within the same column are not significantly different(P>0.05). ) 图 1 各个群体表型性状单因素方差分析 Fig. 1 ANOVA for phenotypic traits among different populations |
|
图 2 各家系壳容积分布 Fig. 2 Distribution of shell volume in each family |
不同群体长牡蛎形态与壳容积性状之间的相关系数见表 2,除WD群体外,其余群体所有性状的相关系数均达到极显著水平(P<0.01)。在所有群体中,壳容积与形态性状的相关系数大于形态性状之间的相关系数。除KR群体外,其余群体与壳容积最大的形态性状均为壳高。
|
|
表 2 不同群体长牡蛎各个生长性状之间的相关系数 Table 2 Phenotypic correlation coefficients among different growth traits of Pacific oysters in different populations |
壳长、壳高和壳宽对壳容积的直接影响及间接影响如表 3所示。从直接作用来看,HD、JP和WD群体中对壳容积的直接影响最大的均是壳高,其次是壳宽,最后是壳长,KR群体对壳容积影响最大的首先是壳宽,其次是壳长,最后是壳高。从间接作用来看,在HD群体中,壳宽主要通过影响壳高进而影响壳容积(0.155),JP群体中,壳长主要通过影响壳高进而影响壳容积(0.122),KR群体中,壳高主要通过影响壳宽进而影响壳容积(0.267),WD群体中,壳宽主要通过影响壳高进而影响壳容积(0.302)。
|
|
表 3 不同群体长牡蛎以壳容积为因变量的通径分析 Table 3 Path analysis with shell cavity volume as the dependent variable in different populations of Pacific oysters |
不同群体长牡蛎的决定系数如表 4所示。从单性状决定系数来看,在HD、JP和WD群体中,决定系数最大的均为壳高,其决定系数分别为0.143、0.205和0.345,在KR群体中决定系数最大的是壳宽(0.244)。从两性状决定系数来看,在四个群体中,最大的均为壳高和壳宽组合,分别为0.104、0.070、0.143和0.167。
|
|
表 4 不同群体长牡蛎以壳容积为因变量的决定系数 Table 4 Determination coefficients of phenotypic traits on shell cavity volume in different populations of Pacific oysters |
基于通径分析得到的各个回归系数如表 5所示,根据显著性检验结果,得到了相应的回归方程, R2选择调整后的值,结果如下:HD群体为V=-19.087+0.248SL+0.216SH+0.506SW(R2=0.581),JP群体为V=-15.623+0.179SL+0.195SH+0.493SW(R2=0.557),KR群体为V=-17.359+0.139SL+0.771SH+0.170SW(R2=0.718),WD群体为V=-15.090+0.339SL+0.216SH+0.190SW(R2=0.765)。
|
|
表 5 不同群体长牡蛎出肉率性状的回归系数检验 Table 5 Test of regression coefficients for meat yield traits in different populations of Pacific oysters |
采用动物模型对群体的固定效应进行显著性检验,结果见表 6。如表 6所示,群体对大多数性状有显著影响(P<0.01),因此,对样本来源进行准确的记录对于评估遗传参数至关重要,应考虑群体作为固定效应对结果的影响。
|
|
表 6 群体的显著性检验 Table 6 The test of significance of population |
以群体为固定效应,对壳容积、形态性状和各个壳型指数进行遗传参数评估,结果如表 7所示。从遗传力来看,壳高和壳容积的遗传力属于极高(0.64~0.68),壳长的遗传力属于高等遗传力(0.49),壳宽的遗传力属于中等遗传力(0.24)。从相关性来看,壳容积与其余形态性状的遗传相关属于高度正相关(0.57~0.83),壳容积与壳高的表型相关性为高度正相关(0.66),壳容积与壳长、壳宽的表型相关性为中等水平正相关(0.49~0.54)。形态性状之间的遗传相关性属于中等到高水平正相关(0.49~0.71),表型相关性属于低度正相关(0.26~0.30)。
|
|
表 7 遗传力和遗传参数评估 Table 7 Evaluation of genetic heritability and genetic parameters |
经济动物遗传改良目标一般聚焦于具有重要经济价值的性状[1]。随着长牡蛎产业的不断发展,市场对出肉率及壳型等经济性状提出了更高的需求[24]。壳容积作为重要的表型之一,可以作为预测长牡蛎最大肉产量潜力的关键指标[25]。多项研究表明,牡蛎壳具有极高的可塑性,除了遗传因素之外,环境对壳的生长和形状也有显著影响[24, 26]。因此,本研究均选取在相同环境下进行繁育和养殖的牡蛎,一定程度上减少了环境对牡蛎壳的影响。在本研究中,不同群体长牡蛎壳容积的变异系数均比形态性状更大,在23.40%~35.29%之间,此外,不同家系之间的壳容积也存在明显差异,说明这个性状具有很好的改良潜力[10]。在相关性分析中,壳容积与形态性状的相关系数大于形态性状之间的相关系数,说明壳容积与其余形态性状之间存在良好的相关性,可以更为精确地反映长牡蛎的生长。单因素方差分析结果表明,中国、日本、韩国三个选育群体的形态性状和壳容积相对于野生群体有了明显改良,中国群体的长牡蛎改良效果最明显。本研究的中国群体为中国海洋大学培育的“海大1号”长牡蛎新品种,该品种以生长速度和壳型作为选育目标,平均壳高、总湿重、出肉率和壳型的整齐度明显优于普通商品牡蛎[27],这也和本研究分析结果一致。
3.1 影响不同群体长牡蛎壳容积的主要形态性状通径分析自20世纪20年代初期由Sewall Wright提出以来已经在众多领域中得到了广泛运用。该方法通过深入研究自变量与因变量之间的相关性,揭示了各个自变量对因变量的直接和间接影响[28]。在育种领域中,通径分析可以反映性状之间的直接和间接影响,体现真实的相关性,比仅使用相关系数获得更多信息,可以为育种过程中的性状选择提供参考[29]。相关分析和通径分析结果与群体[10]、物种[30]、性别[31]和年龄[32]等不同因素相关。为更好地探究形态性状对壳容积的影响,本研究分别对不同群体长牡蛎的壳容积进行了通径分析。直接作用分析表明,除KR群体外,其余群体中壳高对壳容积的直接作用值最大(0.378~0.587),且这些直接作用值均大于间接作用值(0.143~0.242)。KR群体中,壳宽对壳容积的直接作用值最大(0.494),且该直接作用值大于间接作用值(0.271)。间接作用表明,HD群体中,壳宽主要通过影响壳高进而影响壳容积(0.155),JP群体中,壳长主要通过影响壳高进而影响壳容积(0.122),KR群体中,壳高主要通过影响壳宽进而影响壳容积(0.267),WD群体中,壳宽主要通过影响壳高进而影响壳容积(0.302),这与之前在近江牡蛎的研究结果一致[13]。此外,决定系数表明,除KR群体为壳宽(0.244)以外,对壳容积影响最大的均为壳高(0.143~0.345)。壳高不仅是对壳容积影响最大的形态性状,之前的研究表明,在壳橙品系长牡蛎中,壳高对软体部重的直接影响也最大[11]。
经过相关分析和多元回归分析,我们建立了各群体牡蛎形态性状和壳容积之间的回归方程,中国、日本、韩国和野生群体的回归方程分别为V=-19.087+0.248SL+0.216SH+0.506SW(R2=0.581)、V=-15.623+0.179SL+0.195SH+0.493SW(R2=0.557)、V=-17.359+0.139SL+0.771SH+0.170SW(R2=0.718)和V=-15.090+0.339SL+0.216SH+0.190SW(R2=0.765)。已有研究表明,当R2≥0.85时,即可确定对因变量有显著影响的自变量[33]。本研究中各回归方程的R2均小于0.85,这说明形态性状不能完全描述壳容积,今后需要考虑更多的性状,以便更准确地研究壳容积。
3.2 长牡蛎壳容积的遗传参数评估结果长牡蛎是优良的育种材料,可通过选育实现有效改良。遗传力是衡量表型由遗传决定程度的指标,具体而言,狭义遗传力决定了性状对选择的预期反应[16]。参考之前的研究,本研究将遗传力分为以下4个等级:低(0.00~0.20)、中(0.20~0.40)、高(0.40~0.60)和极高(>0.60)[18]。在我们的研究中,壳容积、壳高和壳长具有高到极高的遗传力(0.49~0.68),可直接进行选育;而壳宽的遗传力属于中等(0.24),可通过家系选育的方式进行改良。相比于之前对形态性状遗传力的报道[34-35],我们的结果相对较高。这可能是遗传多样性、不同生长阶段以及不同环境条件等因素导致同一性状的遗传力存在差异[2]。这种差异在其他的研究中也有报道,如壳紫品系长牡蛎形态性状的遗传力在不同日龄阶段存在明显差异[36]。
对于不便于直接选育的性状,可根据遗传相关性进行间接选育,同时,遗传相关性还有助于预测对某一性状进行选择可能带来的其他性状变化[29]。根据之前的研究,本研究将相关性分为以下三个等级:低(0~0.45)、中(0.45~0.55)和高(0.55~1)[18]。生长性状之间的高度遗传相关性表明可能有相关基因参与调控了多种性状。在我们的研究中,壳容积与其余性状的遗传相关性属于高度正相关(0.57~0.83),壳容积及相关形态性状可以同时改良。其中,壳高与壳容积的遗传相关性最大,对壳高进行选育能更有效地改良壳容积,这与近江牡蛎壳容积通径分析的结果一致[13]。各个形态性状之间的遗传相关性属于中等到高水平正相关(0.49~0.71),且各个生长性状之间的遗传相关性整体上大于表型相关性,这与之前的研究相符[34-35]。
4 结语本研究对长牡蛎的三个选育群体和一个野生群体的壳型进行了比较,同时对形态性状和壳容积进行通径分析和遗传参数评估。结果表明,三个选育群体的形态性状和壳容积相对于野生群体有了明显改良,其中中国群体的改良效果最明显。通径分析结果表明,在中国、日本和野生群体中对壳容积影响最大的是壳高,而在韩国群体中是壳宽。此外,本研究还建立了四个群体的壳容积逐步回归方程。遗传参数评估结果表明,壳容积具有极高的遗传力,可以通过选育进行改良,且壳容积和形态性状具有较高的相关性,可间接对壳容积进行改良。
| [1] |
Jiang K, Chen C, Jiang G W, et al. Genetic improvement of oysters: Current status, challenges, and prospects[J]. Reviews in Aquaculture, 2024, 16(2): 796-817. DOI:10.1111/raq.12868 (  0) 0) |
| [2] |
Hollenbeck C M, Johnston I A. Genomic tools and selective breeding in molluscs[J]. Frontiers in Genetics, 2018, 9: 253. DOI:10.3389/fgene.2018.00253 (  0) 0) |
| [3] |
杨红伟, 黄宏, 朱静敏, 等. 运用盐充法测量双壳贝类的壳腔体积[J]. 环境科学导刊, 2013, 32(5): 10-13. Yang H W, Huang H, Zhu J M, et al. The measurement of bivalve mollusks' internal shell cavity volume with the salt-displacement method[J]. Environmental Science Survey, 2013, 32(5): 10-13. DOI:10.3969/j.issn.1673-9655.2013.05.003 (  0) 0) |
| [4] |
许飞, 刘晓, 张国范. 牡蛎壳腔容积的两种测量方法比较[J]. 海洋科学, 2007, 31(7): 15-19. Xu F, Liu X, Zhang G F. Comparison of two methods to measure the internal shell cavity volume of oyster[J]. Marine Sciences, 2007, 31(7): 15-19. DOI:10.3969/j.issn.1000-3096.2007.07.004 (  0) 0) |
| [5] |
Zeng Y, Yang H. Review of molluscan bivalve condition index calculations and application in Northern Quahogs Mercenaria mercenaria[J]. Aquaculture Research, 2021, 52(1): 23-36. DOI:10.1111/are.14866 (  0) 0) |
| [6] |
Lawrence D R, Scott G I. The determination and use of condition index of oysters[J]. Estuaries, 1982, 5(1): 23-27. DOI:10.2307/1352213 (  0) 0) |
| [7] |
Higuera-Ruiz R, Elorza J. Shell thickening and chambering in the oyster Crassostrea gigas: Natural and anthropogenic influence of tributyltin contamination[J]. Environmental Technology, 2011, 32(6): 583-591. DOI:10.1080/09593330.2010.506201 (  0) 0) |
| [8] |
Du Y, Du J, Liu X, et al. Multiple-to-multiple path analysis model[J]. PLoS One, 2021, 16(3): e0247722. DOI:10.1371/journal.pone.0247722 (  0) 0) |
| [9] |
张钰伟, 邓正华, 黄星美, 等. 南沙群体大珠母贝表型性状比较及通径分析[J]. 中国渔业质量与标准, 2023, 13(6): 19-25. Zhang Y W, Deng Z H, Huang X M, et al. Comparison and path analysis of phenotypic traits of wild Pinctada maxima in Nansha population[J]. Chinese Fishery Quality and Standards, 2023, 13(6): 19-25. DOI:10.3969/j.issn.2095-1833.2023.06.003 (  0) 0) |
| [10] |
范超, 张学开, 张兴志, 等. 不同群体合浦珠母贝表型性状的相关性与通径分析[J]. 中国海洋大学学报(自然科学版), 2022, 52(S1): 12-19. Fan C, Zhang X K, Zhang Z X, et al. Correlation and path analysis of phenotypic traits among different populations of pearl oyster Pinctada martensii[J]. Periodical of Ocean University of China, 2022, 52(S1): 12-19. (  0) 0) |
| [11] |
韩自强, 李琪. 长牡蛎壳橙品系形态性状与体质量的相关及通径分析[J]. 中国海洋大学学报(自然科学版), 2017, 47(12): 46-52. Han Z Q, Li Q. Multiple regression and path analysis of morphological and weight traits of Pacific oyster (Crassostrea gigas) orange shell strain[J]. Periodical of Ocean University of China, 2017, 47(12): 46-52. (  0) 0) |
| [12] |
褚洪永, 张建柏, 张秀梅, 等. 长牡蛎二倍体与三倍体壳型性状对体质量的影响分析[J]. 海洋科学, 2022, 46(8): 57-64. Chu H Y, Zhang J B, Zhang X M, et al. Correlation and path analysis of quantitative traits of diploid and triploid Crassostrea gigas[J]. Marine Sciences, 2022, 46(8): 57-64. (  0) 0) |
| [13] |
Yang Q, Li A, Wang L, et al. Shell characterization and effects on cavity volume of wild Jinjiang oyster Crassostrea ariakensis in different estuaries of China[J]. Journal of Oceanology Limnology, 2023, 41(5): 2020-2031. DOI:10.1007/s00343-022-2192-0 (  0) 0) |
| [14] |
Evans S, Langdon C. Direct and indirect responses to selection on individual body weight in the Pacific oyster (Crassostrea gigas)[J]. Aquaculture, 2006, 261(2): 546-555. DOI:10.1016/j.aquaculture.2006.07.037 (  0) 0) |
| [15] |
陈雨露, 徐成勋, 刘士凯, 等. 长牡蛎壳橙性状遗传参数评估及与生长性状的关联性[J]. 水产学报, 2024, 48(1): 123-131. Chen Y L, Xu C X, Liu S K, et al. Estimates of genetic parameters for orange shell color and their correlation with growth traits in the improved orange shell line of Pacific oyster (Crassostrea gigas)[J]. Journal of Fisheries of China, 2024, 48(1): 123-131. (  0) 0) |
| [16] |
Wang H, Yang B, Li Q, et al. Low-dose of formalin-inactivated Vibrio alginolyticus protects Crassostrea gigas from secondary infection and confers broad-spectrum Vibrio resistance on offspring[J]. Developmental and Comparative Immunology, 2024, 152: 105122. DOI:10.1016/j.dci.2023.105122 (  0) 0) |
| [17] |
Chi Y, Jiang G, Liang Y, et al. Selective breeding for summer survival in Pacific oyster (Crassostrea gigas): Genetic parameters and response to selection[J]. Aquaculture, 2022, 556: 738271. DOI:10.1016/j.aquaculture.2022.738271 (  0) 0) |
| [18] |
Wu D, Yang B, Li Q, et al. Estimation of genetic parameters for female reproduction traits in the Pacific oyster, Crassostrea gigas[J]. Aquaculture, 2023, 569: 739387. DOI:10.1016/j.aquaculture.2023.739387 (  0) 0) |
| [19] |
Zhang J, Li Q, Xu C, et al. Response to selection for growth in three selected strains of the Pacific oyster Crassostrea gigas[J]. 2019, 503(9): 34-39.
(  0) 0) |
| [20] |
Vu S V, Knibb W, Gondro C, et al. Genomic prediction for whole weight, body shape, meat yield, and color traits in the Portuguese oyster Crassostrea angulata[J]. Frontiers in Genetics, 2021, 12: 661276. DOI:10.3389/fgene.2021.661276 (  0) 0) |
| [21] |
杜家菊, 陈志伟. 使用SPSS线性回归实现通径分析的方法[J]. 生物学通报, 2010, 45(2): 4-6. Du J J, Chen Z W. Implementation of pass-through analysis using SPSS linear regression[J]. Bulletin of Biology, 2010, 45(2): 4-6. (  0) 0) |
| [22] |
Gilmour A R, Gogel B J, Cullis B R, et al. ASReml User Guide Release 3.0[M]. Hemel Hempstead, UK: VSN International Limited Company, 2009.
(  0) 0) |
| [23] |
Wan S, Li Q, Yu H, et al. Estimating heritability for meat composition traits in the golden shell strain of Pacific oyster (Crassostrea gigas)[J]. Aquaculture, 2020, 516: 734532. DOI:10.1016/j.aquaculture.2019.734532 (  0) 0) |
| [24] |
Mizuta D D, Wikfors G H. Seeking the perfect oyster shell: A brief review of current knowledge[J]. Aquaculture, 2019, 11(3): 586-602. DOI:10.1111/raq.12247 (  0) 0) |
| [25] |
张学开, 范超, 霍忠明, 等. 不同群体长牡蛎壳型相关性状的比较分析[J]. 中国海洋大学学报(自然科学版), 2021, 51(S1): 1-9. Zhang X K, Fan C, Huo Z M, et al. A Comparative analysis of shell traits among different populations of Crassostrea gigas[J]. Periodical of Ocean University of China, 2021, 51(S1): 1-9. (  0) 0) |
| [26] |
Trussell G C. Phenotypic clines, plasticity, and morphological trade-offs in an intertidal snail[J]. Evolution, 2000, 54(1): 151-166. (  0) 0) |
| [27] |
孟乾, 李琪, 王许波, 等. 长牡蛎'海大1号'生长及育种性能分析[J]. 中国水产科学, 2018, 25(2): 263-268. Meng Q, Li Q, Wang X B, et al. Analysis of growth performance and breeding value of the Pacific oyster 'Haida No.1'[J]. Journal of Fishery Sciences of China, 2018, 25(2): 263-268. (  0) 0) |
| [28] |
Denis D, Legerski J. Causal modeling and the origins of path analysis[J]. Theory Science, 2006, 7(1): 2-10. (  0) 0) |
| [29] |
Jiang P, Li S, Fan J, et al. A novel morphological index applied to genetic improvement of body shape in grass carp Ctenopharyngodon idella[J]. Aquaculture, 2022, 548: 737687. (  0) 0) |
| [30] |
Zhang A, Wang L, Yang X, et al. Relationship between shell morphological traits and body weight in two estuarine clams, Meretrix meretrix and Cyclina sinensis in shuangtaizi estuary, bohai sea in China[J]. Journal of Shellfish Research, 2018, 37(5): 989-996. (  0) 0) |
| [31] |
Jiang W, Ma H, Ma C, et al. Characteristics of growth traits and their effects on body weight of G[J]. Genetics Molecular Research, 2014, 13(3): 6050-6059. (  0) 0) |
| [32] |
安拉扎, 陈益, 陈彬龙, 等. 美姑山羊母羊不同年龄段形态与体重相关性分析[J]. 黑龙江畜牧兽医, 2024(5): 43-48. An L Z, Chen Y, Chen B L, et al. Correlation analysis between body size and body weight of female Meigu ewes at different ages[J]. Heilongjiang Animal Science and Veterinary Medicine, 2024(5): 43-48. (  0) 0) |
| [33] |
You W, Ke C, Luo X, et al. Genetic correlations to morphological traits of small abalone Haliotis diversicolor[J]. Journal of Shellfish Research, 2010, 29(3): 683-686. (  0) 0) |
| [34] |
Kong N, Li Q, Yu H, et al. Heritability estimates for growth-related traits in the Pacific oyster (Crassostrea gigas) using a molecular pedigree[J]. Aquaculture Research, 2015, 46(2): 499-508. (  0) 0) |
| [35] |
Xu L, Li Q, Yu H, et al. Estimates of heritability for growth and shell color traits and their genetic correlations in the black shell strain of Pacific oyster Crassostrea gigas[J]. Marine Biotechnology, 2017, 19: 421-429. (  0) 0) |
| [36] |
李琳, 徐成勋, 李琪. 壳紫长牡蛎家系生长存活比较及生长性状的遗传参数评估[J]. 中国水产科学, 2023, 30(7): 841-851. Li L, Xu C X, Li Q. Comparison and evaluation of genetic parameters of growth and survival in purple shell families of Pacific oyster(Crassostrea gigas)[J]. Journal of Fishery Sciences of China, 2023, 30(7): 841-851. (  0) 0) |
 2025, Vol. 55
2025, Vol. 55


