2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266237;
3. 中国海洋大学 化学化工学院,山东 青岛 266100;
4. 崂山实验室,海洋观测与探测研究部,山东 青岛 266200;
5. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100;
6. 中国海洋大学环境科学与工程学院, 山东 青岛 266100;
7. 中国海洋大学 海洋生命学院,山东 青岛 266003;
8. 国家自然博物馆,生命科学部, 北京 100050;
9. 自然资源部 第一海洋研究所,山东 青岛 266061;
10. 崂山实验室,山东 青岛 266237
镭(Ra)是一种放射性碱土金属元素,自然界中存在四种天然放射性镭同位素,分别为223Ra(T1/2=11.4 d)、224Ra(T1/2=3.6 d)、226Ra(T1/2=1 600 a)和228Ra(T1/2=5.7 a),它们是研究不同时间和空间尺度海洋学过程的强有力的示踪工具。其中,226Ra是海洋中丰度最高、研究最早的镭同位素,常用于示踪热盐环流、海底地下水排放(Submarine groundwater discharge,简称SGD)、沉积物地球化学等海洋学过程[1-5]。
大量研究表明[6-9],海洋中镭的来源主要包括沉积物扩散、河流输送、颗粒物解吸、SGD和热液输入等,而主要的汇包括镭自身的衰变、与外海水的交换以及颗粒物清除(Particle scavenging)等。然而在目前关于镭同位素的示踪研究中,颗粒物清除项的重要性常常被忽视[10-11]。早在二十世纪50年代,Koczy发现表层海水中226Ra的损失通量高于核素衰变量,推测表层海水中可能有大量的226Ra被生物颗粒清除[12]。此后,陆续有研究指出藻类初级生产来源的颗粒物可能对226Ra有清除作用[13-17]。但由于缺乏对其重要性的认识,颗粒物清除对226Ra的汇贡献在随后二三十年的研究中并未得到重视。
甲藻是重要的海洋初级生产者。Fisher等研究了海洋浮游植物对于钡的积累,发现甲藻对钡的清除作用比硅藻更强[18]。钡与镭为同一主族碱土金属元素,它们在海洋中有着相似的生物地球化学行为,因此甲藻对于镭可能亦存在一定的清除作用。近年来,以甲藻为优势种的赤潮灾害频繁发生,对近岸海域生态环境健康产生重要影响[19]。甲藻的暴发性繁殖对水体中226Ra的清除可能具有重要贡献,对以之为示踪工具的研究结果的准确性产生显著影响,但相关研究尚鲜见报道。
东海原甲藻(Prorocentrum donghaiense)是中国沿海的优势藻种,也是常见的赤潮藻种。近年来,东海原甲藻在我国近海造成了大面积的赤潮,并显著影响着各种物质和元素的海洋生物地球化学循环[20-21]。本文以东海原甲藻为研究对象,通过室内培养实验定量分析其对海水中226Ra的清除效率,评估其对海底地下水排放(SGD)通量量化研究的影响。
1 材料与方法 1.1 藻种培养实验所用东海原甲藻取自中国海洋大学海洋环境与生态教育部重点实验室藻种室。实验用海水为天然海水,盐度约为32,pH为7.2~7.5。使用孔径为0.45 μm醋酸纤维膜对海水进行过滤,除去海水中的颗粒物等杂质,随后使用锰纤维除去海水中的镭同位素[22],得到无镭海水。在120 ℃条件下灭菌120 min,冷却后加入培养基接种培养。
实验使用500 mL塑料瓶对东海原甲藻进行培养,按照L1培养基添加方法配置培养液。培养时,将培养瓶放置于光照培养箱中,设置培养温度为(20±1) ℃。培养光照采用白色冷光源,模拟天然海域光照情况,调整光暗比为12 h∶12 h。
1.2 东海原甲藻对海水中不同浓度226Ra的清除实验将东海原甲藻接入具有不同226Ra浓度的样品瓶中进行室内培养实验。为防止藻体附壁生长或者下沉,每天定时摇动藻液3次,所有实验操作均在超净工作台上的无菌环境中进行。平行地配置5个初始藻细胞密度为105个/L的培养液,加入不同浓度的226Ra标准溶液,制备5个藻液中的初始226Ra浓度分别为83.3、133.3、166.6、499.9和833.3 Bq/m3的平行样品。置于恒温光照培养箱中培养21天至藻类生长平台期,即藻细胞密度为3×107个/L左右时,按照藻细胞丰度计数法计数。随后取400 mL滤液以0.45 μm的聚醚砜膜过滤,保存滤膜。滤液在塑料瓶中密封10天,用脉冲电离室(PIC)测氡仪测试滤液中的226Ra活度。
1.3 脉冲电离室(PIC)测氡仪测试水体中226Ra活度本实验使用实验室自研仪器脉冲电离室(PIC)测氡仪测试水体中的226Ra活度[23]。其中通过测定水样的子体222Rn的活度来间接测定母体226Ra的活度,实验装置如图 1所示。将装有滤液的样品瓶连入实验气路中,打开全部阀门保持气路通畅。首先打开气阀使样品瓶中出现细密的气泡,鼓气时间为3 h;鼓气结束后,关闭气泵和PIC两端的阀门,将样品瓶移出实验气路;等待5 min后操作软件使其重新计数,设置计数时间为3 h,计数间隔为10 min,得到222Rn的测试数据,计数结束后对数据进行处理从而得到226Ra测试活度。与样品体积为500 mL时该仪器检出限为11.8 Bq/m3,精密度为6%,具体实验操作方法详见Song等的研究[23]。
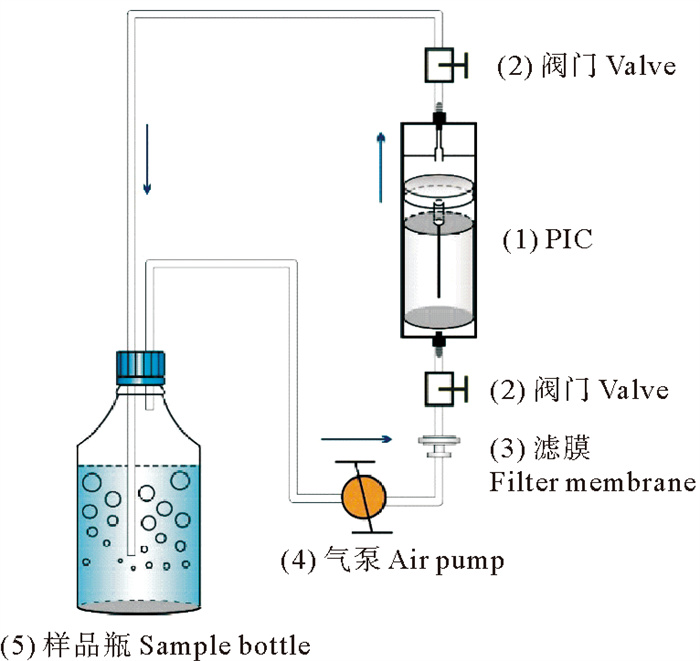
|
图 1 使用脉冲电离室(PIC)测氡仪测量水样中226Ra的装置示意图 Fig. 1 Schematic diagram of a device for measuring 226Ra in water samples using a Pulsed Ionization Chamber (PIC) radon meter |
取东海原甲藻置于1 000 mL广口瓶中,加入培养液配制15个初始细胞密度为105个/L的平行样品。向各样品中加入226Ra标液,配制培养液中的226Ra浓度为499.9 Bq/m3。东海原甲藻生长周期为35天左右,在生长初期每72 h取样一次,生长指数期每48 h取样一次,生长平台期每72 h取样一次,而后对各个样品进行细胞丰度计数、藻液经过滤处理后对滤液中的226Ra浓度进行分析,绘制东海原甲藻生长曲线及对应水体中剩余226Ra浓度曲线。
1.5 藻细胞中的颗粒有机碳(POC)含量测试为定量表征单位质量东海原甲藻对226Ra的清除作用,本研究利用元素分析仪测定滤膜样品中东海原甲藻藻体的颗粒有机碳(Particulate organic carbon,POC)含量。首先,取100 mL处于生长平台期的甲藻藻液过滤到GF/F膜(Whatman)上,另取GF/F膜过滤同样体积的培养液(不含藻)作为空白。GF/F膜预先经过马弗炉灼烧处理(450 ℃,2 h),并用分析天平测定其重量。将过滤完毕的滤膜迅速用煅烧过的铝箔包裹,并置于-20 ℃冰箱中冷冻保存。在进行样品测定之前,将样品从冰箱中取出并置于冻干机中进行24 h的冷冻干燥处理,然后使用浓盐酸酸熏48 h以清除无机碳。最后,将样品装入锡杯并用模具压实,使用元素分析仪测量样品中的POC含量。
2 结果与讨论 2.1 不同226Ra浓度下东海原甲藻对水体中226Ra的清除比例东海原甲藻对不同镭浓度的水体中226Ra的清除比例数据如表 1所示。清除比例是指由于东海原甲藻的生长导致的水体中溶解态226Ra浓度下降值占初始226Ra浓度值的比例。由表 1可见,东海原甲藻对水体中226Ra具有明显的清除作用,清除比例随着初始226Ra浓度的增加呈现下降趋势。例如,当226Ra浓度为83.3 Bq/m3时,东海原甲藻对水体中226Ra清除比例为32.3%;而当226Ra浓度为833.3 Bq/m3时,清除比例下降为15.8%。
|
|
表 1 东海原甲藻对不同镭活度水体中226Ra的清除作用 Table 1 Removal of 226Ra from water bodies with different radium activity by Prorocentrum donghaiense |
藻细胞丰度是用来表征藻体生长状态的重要参数之一,颗粒有机碳(POC)是浮游植物生物量的良好指标。通过测试不同细胞丰度的各个东海原甲藻样品中细胞丰度与POC含量并进行作图发现,东海原甲藻细胞丰度与POC呈显著线性正相关关系(见图 2),其关系式为y=1.49×10-7x+0.84(R2=0.91, n=6, P<0.05),故本研究使用POC含量来表示藻类生物量。
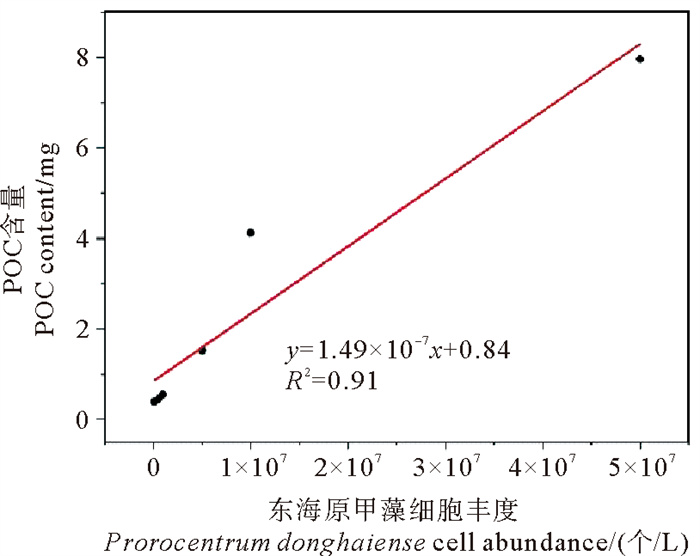
|
图 2 东海原甲藻细胞丰度与POC浓度的关系 Fig. 2 The relationship between cell abundance of Prorocentrum donghaiense and POC concentration |
考虑到天然海水中藻类在不同生长阶段的不同状态,本研究进一步根据藻类的不同生长阶段,对226Ra的清除效率进行区分,从而更精确地评估藻类对于海水中226Ra的清除效率。以226Ra活度为0.50 Bq/L为例,本研究定量分析了东海原甲藻不同生长阶段的藻体POC含量与水体中剩余226Ra浓度的对应关系。如图 3所示。由图可见,在东海原甲藻的不同生长阶段,藻体对于水体中226Ra的清除效率不同。在生长初期到生长中期的过程中,藻细胞丰度逐渐增加,POC含量也相应增加,此时滤液中的226Ra浓度逐渐下降,即对于水体中226Ra的清除比例逐渐增加。培养的前21天,POC浓度由1.78×10-3 g/L增长到3.96×10-3 g/L,滤液中的226Ra浓度由1 426.6 Bq/m3下降到1 331.6 Bq/m3,水体中226Ra的清除比例由9.0%增长到16.6%,增长了7.6%;第21—38天为快速增值期,POC浓度由5.33×10-3 g/L增长到2.18 ×10-2 g/L,滤液中的226Ra浓度由1 331.6 Bq/m3下降到1 125 Bq/m3,水体中226Ra的清除比例由16.6%增长到28.1%,增长了11.5%。
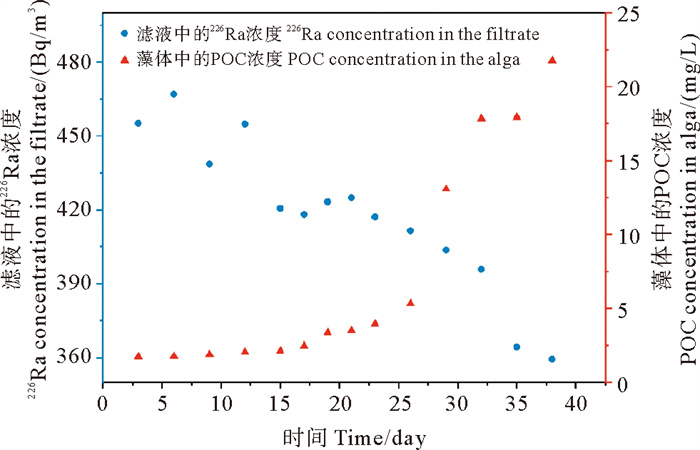
|
图 3 东海原甲藻滤液中的226Ra浓度与藻体中POC浓度随时间的变化 Fig. 3 The change of 226Ra concentration in the filtrate of Prorocentrum donghaiense and POC concentration in the algal body over time |
由图 3可以看出,东海原甲藻对于水体中226Ra的清除过程并非一成不变,而是随着藻类的生长阶段和水体环境的变化呈现出明显的阶段性特征。以藻体POC含量及藻体上清除226Ra含量的对应关系来看,其清除过程大致可以分为两个阶段(见图 4)。第一阶段为东海原甲藻的生长初期和指数期,这一阶段大约持续21天。在此期间,藻类经历了从初始的适应期到快速繁殖的过程。由于环境中营养物质丰富,东海原甲藻迅速吸收利用这些营养物质,同时高效地清除水体中的226Ra。由图 4a可以看出,在POC浓度较低的情况下,东海原甲藻对226Ra的吸收总量相对较小,但其吸收效率却相对较高,藻体中的POC含量与226Ra吸收量的比值约为17.6 Bq/g(回归线性关系的斜率值)。随着藻类的快速生长,其单位质量POC对水体中226Ra的清除量逐渐减低且变化迅速,但在第一阶段单位质量甲藻对于226Ra的清除效率整体较高,其范围为16.6~38.3 Bq/g(见图 4b)。当POC含量超过0.003 5 g/L时,东海原甲藻对226Ra的清除过程进入了第二阶段。这一阶段主要处于藻类生长的平台期,大约从第22天开始,一直持续到第38天左右。在这一阶段,由于水体中的营养物质逐渐减少,藻类的生长速度也开始减缓。因此,东海原甲藻对水体中营养物质和226Ra的清除速率也相应降低。与此同时,单位质量藻体上的镭吸收量也大幅下降至2.9 Bq/g,相较于第一阶段减少了80%以上(见图 4a)。这表明在第二阶段,东海原甲藻对226Ra的清除效率显著降低。在该阶段,单位质量POC对水体中226Ra的清除量较低,其范围基本处于5.0~16.6 Bq/g之间(见图 4b)。
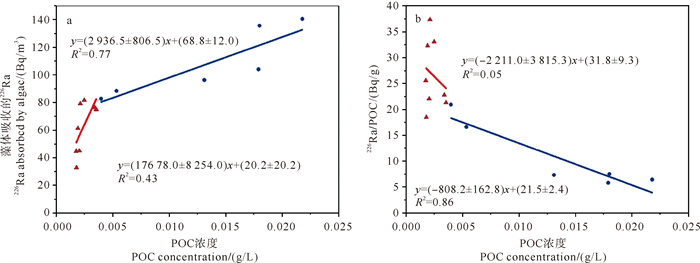
|
( a.东海原甲藻内的226Ra与POC浓度之间的关系;b.东海原甲藻藻体中的226Ra/POC比值与藻体中POC浓度的关系。a. The relationship between 226Ra and POC concentration in the Prorocentrum donghaiense: b. The relationship between the 226Ra/POC ratio and POC concentration in the Prorocentrum donghaiense. ) 图 4 东海原甲藻藻体POC浓度及藻体上清除226Ra含量的对应关系 Fig. 4 The corresponding relationship between the POC concentration of Prorocentrum donghaiense cells and the scavenged 226Ra content on the algal cells |
东海原甲藻在生长初期对水体中的226Ra具有较高的清除效率,但随着藻类的生长和水体环境的变化,其清除效率逐渐降低。其对金属离子的吸附主要是通过其表面所吸附的蛋白质或多糖分子与金属离子(例如Cu2+、Cd2+、Ni2+等)的结合实现的。此外,也可能与藻体颗粒浓度稀释效应有关,即颗粒物越多,单位颗粒物上吸附和吸收的物质量越少。因此,在研究甲藻对水体中226Ra的清除作用时,需要充分考虑其生长阶段和水体环境的变化对清除效果的影响。
研究表明,藻类对环境中金属离子和其他污染物的清除包括吸附和吸收两个过程[24-25]。藻类能够将金属离子吸附到细胞壁上,随后进一步渗透到藻细胞的细胞质中并在细胞内存储[26-27]。该过程主要分为两个阶段:第一阶段金属离子被吸附到细胞表面为被动的吸附机制,第二阶段被吸收进细胞内则是一个主动的吸收机制,在活细胞中发生且相对较慢[28]。甲藻对金属离子有较强的富集作用,其对于金属离子的吸附是通过表面吸附蛋白质或者多糖来对金属离子(例如Cu2+、Cd2+、Ni2+等)进行结合,并在一段滞后期后被细胞代谢活动所吸收,使其进入细胞内部[29-31]。甲藻细胞外壁主要由多糖组成,作为直接与水体接触的部分,多糖能够与水中金属离子发生直接相互作用。这种相互作用是通过多糖上的基团与金属离子结合实现的,并且其吸收能力和选择性取决于藻类外壁基团的类型。因此,藻体细胞壁上的基团对甲藻表面吸附金属离子的过程起着重要作用[32-33]。此外,甲藻还对许多金属离子具有吸收能力,这些离子通过代谢活动被藻细胞主动吸收,进入到液泡或细胞质等可溶性物质中。然而,过量重金属离子会影响藻细胞生长,因此甲藻会通过防御机制来应对这种情况。例如,在不同细胞器中沉淀被捕获的金属离子并进行生物积累,并产生高亲和力的金属结合蛋白以增强自身抵抗重金属毒性的能力[34]。
在实验过程中,随着东海原甲藻细胞丰度与POC含量的增加,水体中的226Ra活度逐渐降低。甲藻对水体中226Ra的清除过程可能与此类似,其生长过程中同时吸收营养盐和226Ra,并先通过细胞外壁基团对溶解在水体中的226Ra进行吸附,随后将其吸收进细胞内部存在于细胞质或细胞器中。
2.3 226Ra在东海原甲藻上的固液分配系数及其应用为研究226Ra在东海原甲藻上的固液分配系数KPOC及其应用,本研究对东海原甲藻的POC含量和其清除的226Ra活度进行比值计算。选取生长平台期阶段甲藻样品(细胞丰度为3×107个/L),剖析226Ra清除量与对应的POC含量的定量关系。由图 3b可见,生长平台期的藻类对水体中226Ra的清除效率最低,故此时得到的定量关系是甲藻对226Ra颗粒清除能力的保守估计。在226Ra活度为500 Bq/m3时,东海原甲藻的226Ra与POC的比值为0.82 Bq/g。同时,对其他4种226Ra活度83.3、133.3、166.6和833.3 Bq/m3下处于生长平台期的东海原甲藻的226Ra与POC的比值进行了总结,如表 1所示。由表 1可见,在不同的226Ra活度,东海原甲藻对水体中226Ra的清除效率处于40%~71%之间,且随着水体中226Ra的浓度增加而降低。
利用226Ra在甲藻和水体中的固液分配系数(KPOC),进一步定量研究水体中不同226Ra活度下东海原甲藻对于水体中226Ra的清除效率。KPOC值的计算公式如下:
| $ K_{\mathrm{POC}}=\frac{A_{\mathrm{S}} / P O C}{A_{\mathrm{l}}} 。$ | (1) |
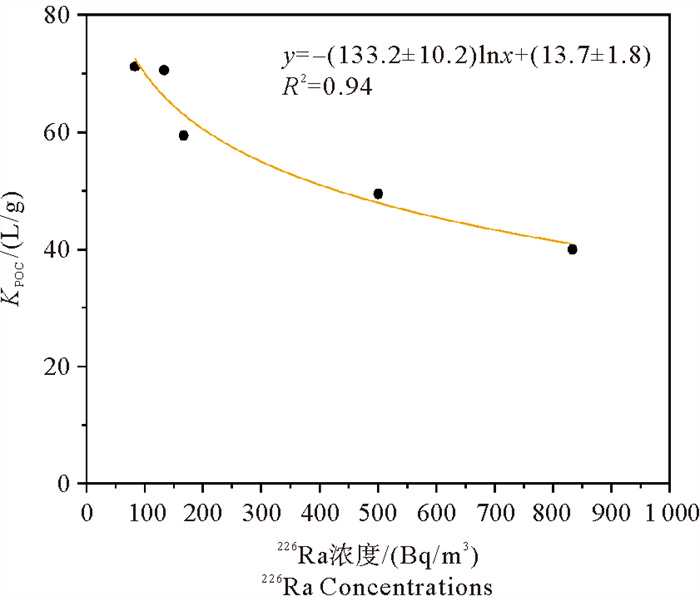
式中:AS表示藻上 226Ra的活度,单位为Bq/m3;POC表示藻上颗粒有机碳的质量,单位为g;Al表示水体中 226Ra的浓度,单位为Bq/m3。使用该公式计算不同226Ra活度下东海原甲藻的KPOC值,并对不同226Ra活度和KPOC值作图(见图 5)。由图可知,对于东海原甲藻,226Ra活度与KPOC值呈现对数关系,即随着226Ra活度的降低,KPOC值逐渐增大,其关系公式为y=-(133.2±10.2)lnx+(13.7±1.8)(R2=0.94)。
|
图 5 东海原甲藻的KPOC值与不同 226Ra浓度的关系 Fig. 5 Relationship between KPOC values and different 226Ra concentrations of the Prorocentrum donghaiense |
该公式可以进一步应用于借助226Ra的收支平衡进行的示踪研究中,例如对海底地下水排放(SGD)通量的量化。SGD中所含的污染物和营养物质可能比地表径流高出数倍[35],在一定程度上,SGD可能会导致海洋环境的恶化,造成沿海水体的高度富营养化和赤潮等。Wang等研究表明,SGD输送的营养物具有较高的DIN/DIP比值,这可能导致近岸海域频繁的有害藻华或者缺氧等环境问题[36]。因此,SGD的研究已经成为了GEOTRACES等国际计划重点关注的热点前沿。然而在赤潮频发的海域,藻类对于以镭为示踪工具建立的SGD通量量化模型的准确性有何影响,相关研究却鲜见报道。
在此之前,一些文献已基于226Ra质量平衡模型对渤海、黄海和东海的SGD通量进行了估算,但并未考虑藻类清除的影响。Liu等基于226Ra的质量平衡模型估算了渤海海域的SGD通量为230×1012 m3/a,由SGD提供的226Ra通量为3.38×1012 Bq/a,其表层水的平均镭活度为(6.6±10.5) Bq/m3[37]。Jiao等估算了渤海的有机碳沉积通量为2.0 Tg·a-1[38]。根据上述东海原甲藻不同 226Ra活度和KPOC关系式(见图 4)可以得到,当226Ra活度为(6.6±10.5) Bq/m3时,226Ra/POC的值为0.78 Bq/g。将上述参数带入式(2)可得,甲藻对 226Ra的清除通量(Fdinoflagellate)为1.5×1012 Bq/a。式(3)为考虑颗粒物清除项后的SGD通量,计算可知FSGD-new为5.3×1012 Bq/a。由Liu等可知SGD端元平均值为19 Bq/m3,带入式(4)重新计算后得到的SGD通量为2.8×1011 m3/a,该值比先前报道的渤海SGD通量增加了约40%。Liu等基于226Ra的质量平衡模型估算了黄海海域的SGD通量为1.4×1012 m3/a,由SGD提供的226Ra通量为8.3× 1012 Bq/a,其表层水的平均镭活度为(5±2.16) Bq/m3[39]。Jiao等估算了黄海的有机碳沉积通量为3.6 Tg· a-1[38]。代入式(1)可以得到,当226Ra活度为(5±2.16) Bq/m3时,226Ra/POC的比值为0.61 Bq/g。以同样的方法计算可知Fdinoflagellate为2.1×1012 Bq/a,则FSGD-new为1.0×1013 Bq/a。由Liu等可知SGD端元平均值为5.59 Bq/m3,带入式(4)重新计算后得到的SGD通量为1.8×1012 m3/a,较先前报道的黄海SGD通量增加了约29%。Wang等基于226Ra的质量平衡模型估算了东海海域的SGD通量为5.4×1011 m3/a,由SGD提供的226Ra通量为8.1×1012 Bq/a,其表层水的平均镭活度为(2±1) Bq/m3[36]。Jiao等估算了东海的有机碳沉积通量为7.4 Tg·a-1[38],代入式(1)可以得到,当226Ra活度为(2±1) Bq/m3时,226Ra/POC的比值为0.28 Bq/g。将上述参数带入式(2)可得,甲藻对 226Ra的清除通量(Fdinoflagellate)为2.1×1012 Bq/a,再带入式(3)计算可知FSGD-new为1.0×1013 Bq/a。由Wang等可知SGD端元平均值为15.1 Bq/m3,重新计算后得到的SGD通量为6.8×1011 m3/a,比先前报道的东海SGD通量增加了约26%。
综上所述,浮游植物对不同海域中226Ra的源汇收支和示踪应用均具有重要的影响。因此,在未来的SGD相关研究中,当利用Ra同位素进行示踪时,必须充分考虑这一汇项的作用。
| $F_{\text { dinoflagellate }}={ }^{226} R a / P O C \times F_{\mathrm{OC}}, $ | (2) |
| $ F_{\text {SGD-new }}=F_{\text { SGD }}+F_{\text { dinoflagellate }}, $ | (3) |
| $ F_{\text { SGD-} \text {new}}={ }^{226} R a_{\text{SGD}} \times Q_{\text {SGD-} \text {new}}。$ | (4) |
式中:Fdinoflagellate为甲藻清除的226Ra通量,Bq/a;226Ra/POC为研究区域表层海水的226Ra和POC的比值;FOC为有机碳沉积通量,Tg/a;FSGD为文献中计算的SGD提供的226Ra通量,Bq/a;FSGD-new为本文计算的考虑颗粒物清除项后SGD提供的226Ra通量,Bq/a;226RaSGD为SGD端元平均值;QSGD-new为考虑颗粒物清除项后的SGD通量,m3/a。
3 结论(1) 实验结果表明,东海原甲藻对于水体中226Ra存在明显的清除作用,其清除比例与水体中226Ra浓度呈负相关,即当226Ra浓度较低时,东海原甲藻对水体中226Ra的清除比例较高。
(2) 随着藻类细胞丰度的增加,东海原甲藻对于水体中226Ra的清除比例逐渐增大。在不同生长阶段,东海原甲藻表现出不同的226Ra清除能力。当水体中226Ra活度为500 Bq/m3时,东海原甲藻的清除比例范围为9%至28%。在生长初期与生长指数期,藻体上的226Ra/POC比值为17.6 Bq/g;而在生长平台期,该比值则降低至2.9 Bq/g。
(3) 东海原甲藻中226Ra的固液分配系数KPOC与水体中226Ra的浓度呈现良好的对数关系,即随着226Ra活度的降低,KPOC值逐渐增大。在考虑颗粒物清除项后,相较于先前文献报道的结果,渤海、黄海、东海海域校正后的SGD通量分别增加了约40%、29%、26%。
| [1] |
Burnett W C, Bokuniewicz H, Huettel M, et al. Groundwater and pore water inputs to the coastal zone[J]. Biogeochemistry, 2003, 66(1/2): 3-33. (  0) 0) |
| [2] |
Gu H, Moore W S, Zhang L, et al. Using radium isotopes to estimate the residence time and the contribution of submarine groundwater discharge (SGD) in the Changjiang effluent plume, East China Sea[J]. Continental Shelf Research, 2012, 35: 95-107. DOI:10.1016/j.csr.2012.01.002 (  0) 0) |
| [3] |
Xu B, Li S, Burnett W C, et al. Radium-226 in the global ocean as a tracer of thermohaline circulation: Synthesizing half a century of observations[J]. Earth-science Reviews, 2022, 226: 1-14. (  0) 0) |
| [4] |
Inoue M, Takehara R, Hanaki S, et al. Distributions of radiocesium and radium isotopes in the western Bering Sea in 2018[J]. Marine Chemistry, 2020, 225: 1-9. (  0) 0) |
| [5] |
Yuan L, Cai P, Jiang X, et al. Precise measurement of 226Ra/230Th disequilibria in deep-sea sediments by high-sensitivity ICP-MS[J]. Chemical Geology, 2023, 620: 1-35. (  0) 0) |
| [6] |
Charette M, Moore W, Burnett W. Uranium-and thorium-series nuclides as tracers of submarine groundwater discharge[J]. Radioactivity in the Environment, 2008, 13: 155-191. (  0) 0) |
| [7] |
Kim G, Ryu J W, Hwang D W. Radium tracing of submarine groundwater discharge (SGD) and associated nutrient fluxes in a highly-permeable bed coastal zone, Korea[J]. Marine Chemistry, 2008, 109(3-4): 307-317. DOI:10.1016/j.marchem.2007.07.002 (  0) 0) |
| [8] |
Beck A J, Rapaglia J P, Cochran J K, et al. Submarine groundwater discharge to Great South Bay, NY, estimated using Ra isotopes[J]. Marine Chemistry, 2008, 109(3-4): 279-291. DOI:10.1016/j.marchem.2007.07.011 (  0) 0) |
| [9] |
Yuan X, Guo Z, Li W, et al. Estimating submarine groundwater discharge in the Jiaozhou Bay using radium isotopes[J]. Indian Journal of Marine Science, 2014, 43(10): 1811-1819. (  0) 0) |
| [10] |
Moore W S. Large groundwater inputs to coastal waters revealed by 226Ra enrichments[J]. Nature, 1996, 380(6575): 612-614. (  0) 0) |
| [11] |
Moore W S. The effect of submarine groundwater discharge on the ocean[J]. Annual Review of Marine Science, 2010, 2: 59-88. (  0) 0) |
| [12] |
Szabo B. Radium content in plankton and sea water in the Bahamas[J]. Geochimica et Cosmochimica Acta, 1967, 31(8): 1321-1331. (  0) 0) |
| [13] |
Chow T J, Goldberg E D. On the marine geochemistry of barium[J]. Geochimica et Cosmochimica Acta, 1960, 20(3-4): 192-198. (  0) 0) |
| [14] |
Broecker W S, Li Y H, Cromwell J. Radium-226 and radon-222: Concentration in Atlantic and Pacific Oceans[J]. Science, 1967, 158(3806): 1307-1310. (  0) 0) |
| [15] |
Wolgemuth K, Broecker W S. Barium in sea water[J]. Earth and Planetary Science Letters, 1970, 8(5): 372-378. (  0) 0) |
| [16] |
Ku T, Li Y, Mathieu G, et al. Radium in the Indian-Antarctic Ocean south of Australia[J]. Journal of Geophysical Research, 1970, 75(27): 5286-5292. (  0) 0) |
| [17] |
Shannon L, Cherry R. Radium-226 in marine phytoplankton[J]. Earth and Planetary Science Letters, 1971, 11(1-5): 339-343. (  0) 0) |
| [18] |
Fisher N S, Guillard R R, Bankston D C. The accumulation of barium by marine phytoplankton grown in culture[J]. Journal of Marine Research, 1991, 49(2): 339-354. (  0) 0) |
| [19] |
陈楠生, 张梦佳, 刘淑雅, 等. 中国海域赤潮物种多样性[J]. 海洋与湖沼, 2023, 54(3): 599-624. Chen N S, Zhang M L, Liu S Y, et al. Diversity of hab species in coastal regions of China[J]. Journal of Oceanology and Limnology, 2023, 54(3): 599-624. (  0) 0) |
| [20] |
Zhou M. Environmental settings and harmful algal blooms in the sea area adjacent to the Changjiang River Estuary[J]. Coastal Environmental and Ecosystem Issues of the East China Sea, 2010, 133-149. (  0) 0) |
| [21] |
Gao Y, Jiang Z, Liu J, et al. Seasonal variations of net-phytoplankton community structure in the southern Yellow Sea[J]. Journal of Ocean University of China, 2013, 12: 557-567. (  0) 0) |
| [22] |
Moore W S, Krishnaswami S. Coral growth rates using 228Ra and 210Pb[J]. Earth & Planetary Science Letters, 1972, 15(2): 187-190. (  0) 0) |
| [23] |
Song L, Liu W, Zhao S, et al. Measuring 222Rn in aquatic environment via Pulsed Ionization Chamber Radon Detector[J]. Acta Oceanologica Sinica, 2023, 42(8): 185-189. (  0) 0) |
| [24] |
Gélabert A, Pokrovsky O S, Reguant C, et al. A surface complexation model for cadmium and lead adsorption onto diatom surface[J]. Journal of Geochemical Exploration, 2006, 88(1-3): 110-113. (  0) 0) |
| [25] |
Gélabert A, Pokrovsky O S, Schott J, et al. Cadmium and lead interaction with diatom surfaces: A combined thermodynamic and kinetic approach[J]. Geochimica et cosmochimica acta, 2007, 71(15): 3698-3716. (  0) 0) |
| [26] |
Priyanarshini E, Priyadarshini S S, Pradhan N. Heavy metal resistance in algae and its application for metal nanoparticle synthesis[J]. Applied Microbiology and Biotechnology, 2019, 103: 3297-3316. (  0) 0) |
| [27] |
Wang W X, Guo L D. Bioavailability of colloid-bound Cd, Cr, and Zn to marine plankton[J]. Marine Ecology Progress, 2000, 202(1): 41-49. (  0) 0) |
| [28] |
Das N, Vimala R, Karthika P. Biosorption of heavy metals-an overview[J]. 2008, 7(2): 159-169.
(  0) 0) |
| [29] |
Hong H S, Wang M H, Huang X G, et al. Effects of macronutrient additions on nickel uptake and distribution in the dinoflagellate Prorocentrum donghaiense Lu[J]. Environmental Pollution, 2009, 157(6): 1933-1938. (  0) 0) |
| [30] |
Huang X G, Li S X, Liu F J, et al. Regulated effects of Prorocentrum donghaiense Lu exudate on nickel bioavailability when cultured with different nitrogen sources[J]. Chemosphere, 2018, 197: 57-64. (  0) 0) |
| [31] |
Xu S J, Wu K C, Lam W, et al. Evaluation of a causative species of harmful algal blooming, Prorocentrum triestinum, as a sustainable source of biosorption on cadmium[J]. Journal of Marine Science and Engineering, 2022, 10(6): 4-10. (  0) 0) |
| [32] |
Pistocchi R, Guerrini F, Balboni V, et al. Copper toxicity and carbohydrate production in the microalgae Cylindrotheca fusiformis and Gymnodinium sp.[J]. European Journal of Phycology, 1997, 32(2): 125-132. (  0) 0) |
| [33] |
Pistocchi R, Mormile M, Guerrini F, et al. Increased production of extra-and intracellular metal-ligands in phytoplankton exposed to copper and cadmium[J]. Journal of Applied Phycology, 2000, 12: 469-477. (  0) 0) |
| [34] |
Walha L D, Hamza A, Keskes F A, et al. Heavy metals accumulation in environmental matrices and their influence on potentially harmful dinoflagellates development in the Gulf of Gabes (Tunisia)[J]. Estuarine, Coastal and Shelf Science, 2021, 254: 1-13. (  0) 0) |
| [35] |
Slomp C P, Van Cappellen P. Nutrient inputs to the coastal ocean through submarine groundwater discharge: Controls and potential impact[J]. Journal of Hydrology, 2004, 295(1-4): 64-86. (  0) 0) |
| [36] |
Wang X, Baskaran M, Su K, et al. The important role of submarine groundwater discharge (SGD) to derive nutrient fluxes into River dominated Ocean Margins—The East China Sea[J]. Marine Chemistry, 2018, 204: 121-132. (  0) 0) |
| [37] |
Liu J, Du J, Yi L. Ra tracer-based study of submarine groundwater discharge and associated nutrient fluxes into the Bohai Sea, China: A highly human-affected marginal sea[J]. Journal of Geophysical Research: Oceans, 2017, 122(11): 8646-8660. (  0) 0) |
| [38] |
Jiao N, Liang Y, Zhang Y, et al. Carbon pools and fluxes in the China Seas and adjacent oceans[J]. Science China Earth Sciences, 2018, 61: 1535-1563. (  0) 0) |
| [39] |
Liu J, Du J, Yu X. Submarine groundwater discharge enhances primary productivity in the Yellow Sea, China: Insight from the separation of fresh and recirculated components[J]. Geoscience Frontiers, 2021, 12(6): 1-40. (  0) 0) |
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China;
4. Laoshan Laboratory, Ocean Obseruation and Detection Research Division, Qingdao 266200, China;
5. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China;
6. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;
7. College of Marine Life Science, Ocean University of China, Qingdao 266003, China;
8. Department of Life Sciences, National Natural History Museum of China, Beijing 100050, China;
9. First Institute of Oceanography, Ministry of Natural Resources, Qingdao 266061, China;
10. Laoshan Laboratory, Qingdao 266237, China
 2025, Vol. 55
2025, Vol. 55


