2. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;
3. 中国海洋大学山东省海洋环境地质工程重点实验室,山东 青岛 266100
受陆海交替作用的影响,滨海盐渍土壤面临盐碱含量高、结构性差以及养分贫瘠的严峻问题,这严重制约着滨海土地资源质量的提升与农业的高效利用,给滨海的发展带来了诸多挑战[1]。滨海盐渍土的形成往往与高浓度的NaCl(引起盐胁迫的主要成分)有关,盐胁迫的次生反应之一氧化胁迫也会干扰植物的营养吸收甚至导致植物细胞中毒[2-3],由此降低了滨海湿地的碳汇能力,并影响其维持生物多样性的功能。氧化胁迫下,植物为了维持体内正常的代谢功能,就需要平衡活性氧自由基(Reactive oxygen species,ROS)的产生与清除之间的平衡[4]。因此,探索有效的方法来提升植物在滨海盐渍土的的抗氧化能力,对增强植物生存能力至关重要。植物在缓解盐胁迫时,抗氧化酶和抗氧化剂在清除ROS中扮演着至关重要的角色[5-6]。这些抗氧化酶和抗氧化剂主要通过抗坏血酸-谷胱甘肽循环来清除植物体内多余的ROS[7-8]。
已有研究表明,生物炭的添加和丛枝菌根真菌(Arbuscular mycorrhizal fungi, AMF)的接种均可有效提升植物的抗氧化水平[9-11]。生物炭通过释放微量元素供植物吸收,能够显著提升植物中的超氧化物歧化酶和过氧化氢酶活性,从而降低丙二醛的含量[12]。AMF可以通过促进植物宿主积累渗透调节物质来降低脂质过氧化水平[13]。同时,AMF会通过共生改变根系分泌物的组成比例,促进共生植物快速吸收微量元素,从而促进还原剂的生成[14]。但是目前对于盐胁迫下生物炭和AMF的联用对植物抗氧化调节的影响路径还不清晰,因此可以通过量化分析,深入探究生物炭和AMF对黑麦草抗氧化代谢的影响。
偏最小二乘路径模型(Partial least squares path modeling,PLS-PM)可以分析多组变量之间的线性统计关系,即使样本量较小,也能定量解释指标和影响路径之间的因果关系和相关性[15]。目前,PLS-PM主要用于研究大量环境因素对群落结构变化的影响,污染物的转移路径等[16]。因此,PLS-PM可用于量化盐胁迫下生物炭和AMF对植物抗氧化代谢的调节路径。
本研究通过水培实验,探究了盐胁迫下植物体抗氧化代谢相关指标的变化,分析并量化了生物炭和AMF对植物抗氧化代谢的影响路径及促生长效果。本研究目的包括:(1)明确在不同盐浓度胁迫下,生物炭和AMF对植物生长是否具有显著的促进作用;(2)揭示生物炭和AMF对植物光合作用、渗透调节机制、抗氧化酶活性及抗氧化剂含量的影响;(3)通过聚类分析和PLS-PM方法,阐明生物炭和AMF调控植物抗氧化代谢的具体作用路径。本研究结果将为滨海盐碱地区的生态修复工作提供理论基础。
1 材料与方法 1.1 实验材料生物炭原材料为浒苔(Enteromorpha prolifera),购自中国海洋大学生物科技有限公司。将浒苔粉置于气氛炉中,在400 ℃下限氧热解2 h,降至室温后,将烧制的浒苔生物炭(记为“BC”)过2 mm筛并保存于密封袋中备用,其基本理化特性如表 1所示。AMF菌剂购自捷克诺曼环境技术股份有限公司。黑麦草种子购自宿迁春满园种业有限公司。
|
|
表 1 浒苔生物炭的理化特性 Table 1 Physicochemical properties of Enteromorpha prolifera biochar |
首先,将黑麦草种子用6%的H2O2灭菌,用蒸馏水清洗3次。然后,在花盆(12 cm×12 cm×15 cm)中加入100 g灭菌蛭石。设置4个处理组,每个处理组3个重复,具体处理过程如下:(1)在对照(记为“CK”)组中,加入10 g高温灭活菌剂。(2)在生物炭(记为“BC”)组中,向其花盆中加入1.5 g生物炭,与蛭石混合均匀,并加入10 g高温灭活菌剂。(3)在AMF处理组中,将10 g AMF菌剂均匀地铺在蛭石表面。(4)在联合(记为“BA”)处理组中,加入1.5 g生物炭和10 g AMF菌剂。最后,将50粒种子均匀撒在基质表面,再用10 g蛭石盖住种子,用蒸馏水浇透基质。将盆栽放置在黑暗培养箱中,一半以上种子萌发的条件为30 ℃和16 h/d光照。培养期间,每天浇灌1/2强度的Hoagland营养液(其中NaCl浓度分别为0‰、10‰和20‰)30 mL。即本研究共涉及4个处理组,每个处理组包含3个NaCl浓度水平,每个浓度水平又设置了3组平行实验以确保结果的可靠性,共需要36个花盆来容纳所有的实验单元。为避免NaCl冲击,20‰NaCl浓度组的NaCl浓度每天增加4.0‰,5 d后NaCl浓度升至20‰。生长50 d后,收获不同NaCl浓度下4个处理组的植株,并测定各项植物指标。
1.3 分析测定方法 1.3.1 植物生长指标的测定每盆选取3株植物幼苗进行收获。首先将收获后的幼苗冲洗干净并拭干表面水分;其次用直尺测量植物从茎基部到植株顶部和主根末端分别测株高和根长;然后称质量,并将该质量作为植物鲜质量;最后将植物在60 ℃的烘箱中干燥72 h,直至质量恒定,所得的质量作为植物的干质量。
1.3.2 植物生理生化指标的测定(1) 植物光合色素含量的测定。准确称取0.20 g叶片样品,并浸泡在20 mL 80%丙酮溶液(作为浸提试剂)中。在黑暗条件下提取72 h后,分别在663、646和470 nm波长下比色,测定叶绿素a、叶绿素b和类胡萝卜素的含量[17]。
(2) 植物渗透调节物质含量的测定。可溶性糖含量测定采用了硫酸-蒽酮比色法[18]。可溶性蛋白含量测定采用了考马斯亮蓝染色法[19]。
(3) 植物抗氧化酶活性和抗氧化剂含量的测定。抗氧化酶包含超氧化物歧化酶、过氧化氢酶、谷胱甘肽还原酶、脱氢抗坏血酸还原酶、单脱氢抗坏血酸还原酶以及抗坏血酸过氧化物酶等。抗氧化剂包括谷胱甘肽和抗坏血酸。抗坏血酸酶、单脱氢抗坏血酸还原酶和抗坏血酸过氧化物酶活性的测定参照青岛凯泰克工贸提供的标准试剂盒的使用方法。谷胱甘肽还原酶活性的测定采用苏州格锐思生物科技提供的标准试剂盒方法。谷胱甘肽含量和抗坏血酸含量的测定采用南京建成提供的标准试剂盒方法。过氧化氢酶活性的测定借鉴了Chen等[20]的方法,并稍有改进,具体步骤如下:称取0.20 g植物组织,将其置于含有0.5 mmol/L EDTA、2%(w / v)可溶性聚乙烯吡咯烷酮和0.5%(v / v)TritonX-100的5 mL 50 mmol/L Tris-NaOH缓冲液(pH=8.0)中,在4 ℃下2 200 r/min离心10 min;向100 μL清液中加入1 mL 100 mmol/L磷酸钾缓冲液(pH=7.0)和400 μL 200 mmol/L H2O2,充分混合后反应5 min;在240 nm波长下测定吸光度。超氧化物歧化酶活性的测定借鉴了Cunha等[21]的方法,并稍有改进,具体步骤如下:取0.5 g植物组织于预冷的研钵中,加入1 mL磷酸缓冲液,在冰浴下研磨成浆,加缓冲液使最终体积为5 mL;取2 mL研磨液于3 000 r/min下离心20 min,取上清液备用;取6支试管,其中3支作为测定管,另外3支作为对照管;在测定管中均依次加入1.5 mL的磷酸缓冲液、0.3 mL的130 mmol/L甲硫氨酸溶液、750 μmol/L氮蓝四唑溶液、100 μmol/L EDTA-Na2溶液和20 μmol/L核黄素溶液,再加入0.1 mL组织上清液和0.5 mL蒸馏水;对照组不添加组织上清液,改加0.6 mL蒸馏水;全部试剂加完后摇匀,反应20 min后,在560 nm下测定反应液吸光度。
1.4 数据处理与分析实验结果以平均值±标准差(Mean±SD)表示。实验数据采用SPSS 22.0软件进行单因素方差分析(One-way ANOVA),不同处理组之间的显著差异采用Duncan多重范围检验进行比较。使用R语言进行聚类分析,采用Smart PLS 3.0软件进行PLS-PM分析,以描述生物炭和AMF调节黑麦草抗氧化代谢的作用路径。使用Origin 2022b软件进行绘图。
2 结果与分析 2.1 生物炭和AMF对黑麦草生长的促进作用在盐胁迫下,生物炭和AMF对黑麦草株高、根长、鲜质量和干质量的影响如图 1所示。BA对黑麦草株高和鲜质量促进效果明显,AMF对植物鲜质量和干质量促进效果最佳。在10‰NaCl浓度下,BA使株高和根长分别增加了39.77%和95.63%。AMF使黑麦草鲜质量和干质量分别增加了21.79%和42.46%。
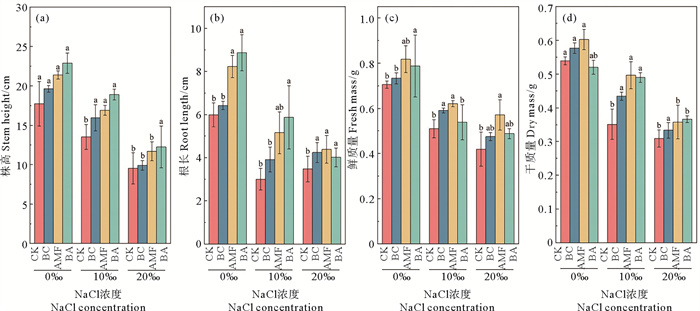
|
图 1 盐胁迫下生物炭和AMF对黑麦草株高(a)、根长(b)、鲜质量(c)和干质量(d)的影响 Fig. 1 Effects of biochar and AMF on ryegrass stem height (a), root length (b), fresh mass (c) and dry mass (d) under saline stress |
随着NaCl浓度的升高,黑麦草的光合色素展现出不同的变化趋势(见图 2)。AMF的接种可以显著增加叶绿素的含量。具体而言,在NaCl浓度分别为0‰、10‰和20‰时,相较于CK组,AMF使得叶绿素a含量分别增加了33.42%、42.07%和30.11%,使得叶绿素b含量分别增加了5.62%、16.32%和35.28%。对于类胡萝卜素来说,在10‰和20‰的NaCl浓度下,BA使得类胡萝卜素含量分别增加了39.12%和36.20%。
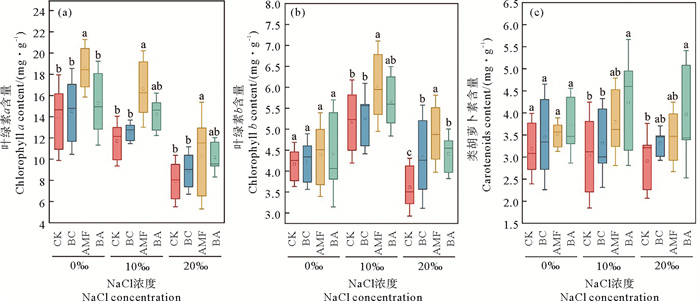
|
图 2 盐胁迫下生物炭和AMF对黑麦草叶绿素a (a)、叶绿素b (b)和类胡萝卜素(c)含量的影响 Fig. 2 Effects of biochar and AMF on ryegrass Chlorophyll a (a), Chlorophyll b (b), and carotenoids (c) contents under saline stress |
随着NaCl浓度的升高,黑麦草体内渗透调节物质(可溶糖和可溶蛋白)的含量也随之上升(见图 3)。生物炭和AMF也可以提高渗透调节物质的含量,其中BA的促进效果最显著。当NaCl浓度为0‰、10‰和20‰时,BA的添加使得可溶糖含量分别增加了27.39%、21.55%和36.92%,使得可溶蛋白的含量分别增加了81.44%、36.60%和24.71%。
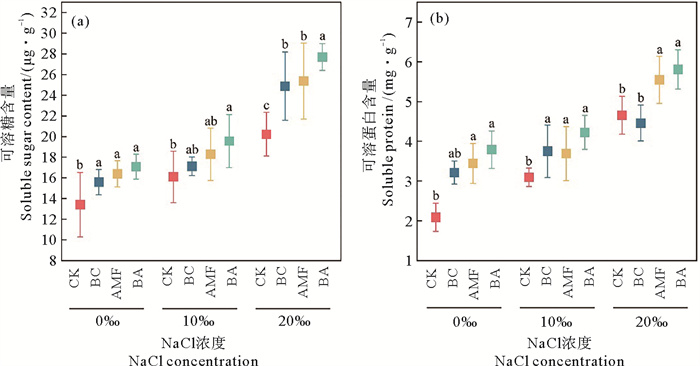
|
图 3 盐胁迫下生物炭和AMF对黑麦草可溶糖(a)和可溶蛋白(b)含量的影响 Fig. 3 Effect of biochar and AMF on ryegrass soluble sugars (a) and soluble proteins (b) contents under saline stress |
生物炭和AMF对盐胁迫下的黑麦草抗氧化酶活性有不同的影响(见图 4)。相比对照组,AMF在NaCl浓度为0‰、10‰和20‰时,过氧化氢酶活性分别提升了31.83%、36.80%和60.99%,使谷胱甘肽还原酶活性分别提升了47.73%、69.28%和88.25%。BA使得抗坏血酸过氧化物酶的活性分别增加了69.14%、43.93%和55.50%,使超氧化物歧化酶活性分别提升了28.26%、14.12%和20.26%。BC使得脱氢抗坏血酸还原酶活性分别增加了40.20%、39.53%和27.75%,在NaCl浓度为10‰和20‰时,使得单脱氢抗坏血酸还原酶的活性分别提升了43.41%和16.44%。
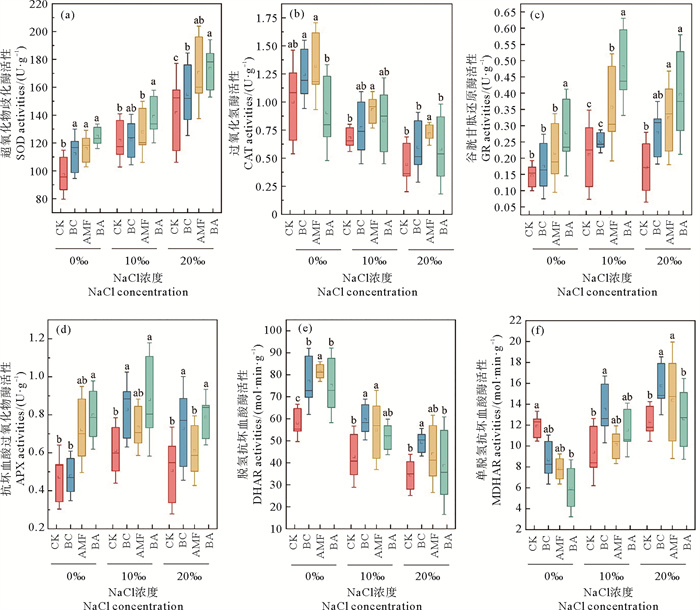
|
图 4 盐胁迫下生物炭和AMF对黑麦草超氧化物歧化酶(a)、过氧化氢酶(b)、谷胱甘肽还原酶(c)、抗坏血酸过氧化物酶(d)、脱氢抗坏血酸还原酶(e)和单脱氢抗坏血酸还原酶(f)活性的影响 Fig. 4 Effects of biochar and AMF on ryegrass SOD (a), CAT (b), GR (c), APX (d), DHAR (e) and MDHAR (f) activities under saline stress |
在盐胁迫下,生物炭和AMF均可以促进抗氧化剂含量的提升(见图 5)。在0‰、10‰和20‰的NaCl浓度下,AMF使得还原型谷胱甘肽含量分别提升了25.37%、16.05%和11.97%,使得氧化型谷胱甘肽含量分别提升了106.22%、40.47%和38.52%。BC使得还原型抗坏血酸含量分别提升了41.26%、80.30%和27.00%,使得氧化型抗坏血酸含量分别提升了11.49%、13.90%和20.00%。
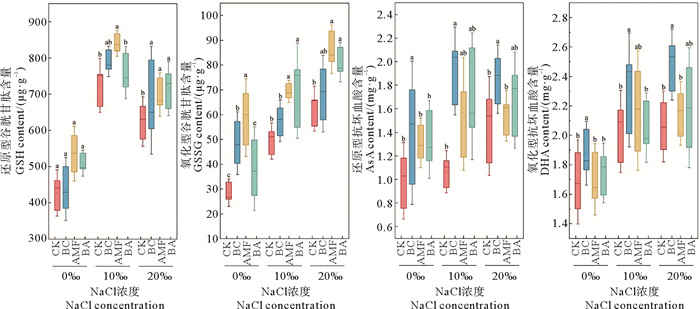
|
图 5 不同盐度下生物炭和AMF对黑麦草还原型谷胱甘肽(a)、氧化型谷胱甘肽(b)还原性抗坏血酸(c)和氧化型抗坏血酸(d)含量的影响 Fig. 5 Effects of biochar and AMF on ryegrass GSH (a), GSSG (b), AsA (c) and DHA (d) contents at different salinities |
过高的盐分会抑制黑麦草正常的生长,然而生物炭和AMF的加入能缓解盐分胁迫,进而促进黑麦草的生长[22]。AMF与黑麦草根部形成的共生体扩大了黑麦草的养分吸收范围,显著促进了黑麦草的根系发育[23-25]。由于生物炭在水培环境中浸出的部分营养元素被AMF用于自身的生长发育,故生物炭和AMF联用在增加黑麦草鲜质量及干质量方面效果最佳[26-27]。在无盐胁迫(NaCl浓度为0‰)时,生物炭和AMF虽都有促生作用,但是这两种处理间的差异不明显。20‰的NaCl浓度处理超出了黑麦草的耐受范围,且过量盐分可能会促使生物炭中有害物质浸出,进而损伤AMF孢子,使得生物炭和AMF的联合作用效果不再显著[28]。这说明生物炭和AMF联合作用只能在一定的盐度范围内对黑麦草起积极的调节作用。鉴于黑麦草的生长与抗氧化调节密切相关,故阐明生物炭和AMF在10‰NaCl浓度下对黑麦草抗氧化代谢的路径对促进其生长尤为重要。
3.2 生物炭和AMF对黑麦草抗氧化代谢的调节路径盐胁迫会促进植物体内ROS的生成,进而直接或间接地对细胞膜功能产生负面影响[29]。过量ROS会损坏蛋白质、核酸和脂质等生物大分子,影响细胞正常的生理和生化功能,最终导致细胞损伤和死亡[30]。本文通过聚类分析,探究了不同盐度下生物炭和AMF联合处理后黑麦草的生长生理指标之间的相关性(见图 6)。在NaCl浓度为0‰时,生物炭和AMF分别单独添加对黑麦草生长的促进效果较好,且两者联合对黑麦草根长、鲜质量、干质量的提升效果最佳。为应对盐胁迫,植物会通过一系列清除ROS的机制来维持体内的氧化还原稳态,其中最重要的环节是抗坏血酸-谷胱甘肽循环[31]。在NaCl浓度为10‰时,生物炭处理增加了抗坏血酸的含量,提升了抗坏血酸过氧化物酶的活性。在抗坏血酸过氧化物酶的催化作用下,还原型抗坏血酸可以直接与ROS反应,在被氧化成氧化型抗坏血酸的同时,将H2O2还原为H2O,缓解了黑麦草所受的氧化胁迫[32-33]。有研究表明,生物炭通过向植物提供矿质养分,提升了植物抗坏血酸过氧化物酶的活性,降低细胞膜ROS的损伤[34]。而AMF处理则增加了谷胱甘肽含量和光合色素含量,提升了谷胱甘肽还原酶活性。谷胱甘肽是有效的抗氧化剂,可以有效清除叶绿体中的H2O2,促进植物光合作用。同时有研究表明AMF的侵染可增加抗坏血酸过氧化物酶活性,清除植物叶绿体和胞浆中的H2O2 [35]。在NaCl浓度为20‰时,生物炭和AMF只能稍微缓解盐分对植物生长的抑制,但效果并不显著。生物炭处理显著提升了抗坏血酸含量以及单脱氢抗坏血酸还原酶活性,AMF显著提升了谷胱甘肽的含量,这与10‰的NaCl浓度处理趋势相似。不同之处在于20‰的NaCl浓度下,生物炭和AMF联合作用显著增加了黑麦草渗透调节物质的含量,这可能是因为过高的盐度使得黑麦草渗透胁迫和氧化胁迫程度加剧,生物炭和AMF会通过促进黑麦草生成和吸收可溶糖来维持渗透平衡。
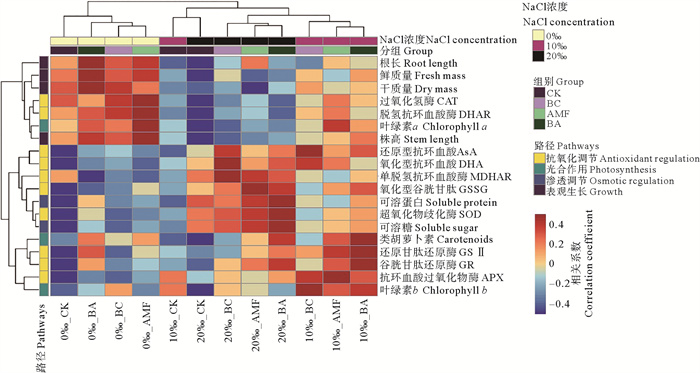
|
图 6 盐胁迫下生物炭和AMF作用与植物指标的聚类分析 Fig. 6 Cluster analysis of biochar and AMF effects with plant indicators under saline stress |
本文采用PLS-PM量化了10‰NaCl浓度下生物炭和AMF对黑麦草的抗氧化调节路径(见图 7)。椭圆之间箭头所示的路径系数代表了潜变量的总效应,其数值大小反映了指标之间影响的强度。从结果可以看出,生物炭和AMF侧重不同的抗氧化调节路径。生物炭对抗坏血酸相关酶的活性的影响(路径系数为0.861)最大,生物炭通过向植物提供矿质养分,提升了抗坏血酸还原酶等酶活性,从而增加了抗坏血酸含量(路径系数为0.823)。抗坏血酸作为还原剂,平衡了黑麦草的ROS稳态,消除了多余的ROS,最终促进了黑麦草的生长。AMF与生物炭的调节路径有所不同,AMF主要提升了谷胱甘肽还原酶活性((路径系数为0.807)。谷胱甘肽还原酶可以促进谷胱甘肽的还原,有助于清除叶绿体及其他细胞器中多余的H2O2,从而优化黑麦草的光合作用效率,促进植物生长。该模型结果阐明了生物炭和AMF在10‰NaCl浓度胁迫下,调节黑麦草抗氧化代谢的不同路径。
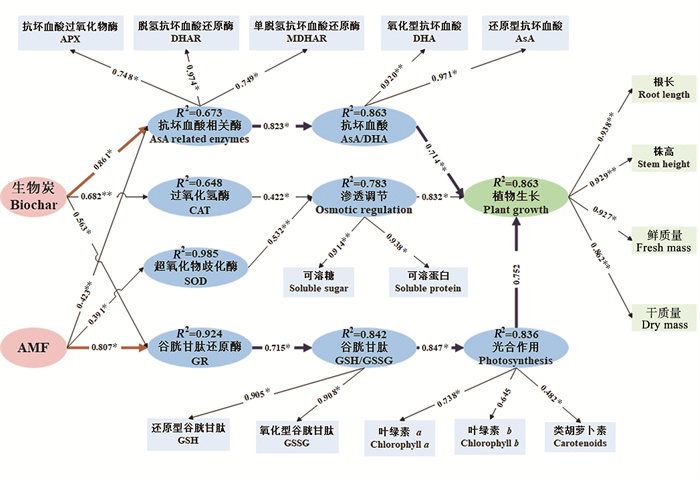
|
( *代表P<0.05;**代表P<0.01; ***代表P<0.001。*stands for P < 0.05; **stands for P < 0.01; ***stands for P < 0.001. ) 图 7 PLS-PM量化的生物炭和AMF调节黑麦草抗氧化代谢路径 Fig. 7 Pathways of biochar and AMF to regulate ryegrass antioxidant metabolism under PLS-PM quantification |
在盐胁迫下,生物炭和AMF均增加了黑麦草的生物量,促进了黑麦草光合作用及渗透物质积累,提高了黑麦草的抗氧化能力。但是生物炭和AMF在调节植物抗氧化代谢方面存在差异。具体来说,在10‰的NaCl浓度下,生物炭主要通过促进抗坏血酸的还原来实现抗坏血酸的积累,从而促进了植物的生长。而AMF主要作用于谷胱甘肽还原过程,通过促进谷胱甘肽的合成,使得黑麦草的光合作用得以增强,最终增加了黑麦草的生物量。值得注意的是,生物炭和AMF的共同添加,在黑麦草的生长、光合作用、渗透调节及抗氧化代谢方面均发挥了显著的促进作用,这为两者联合应用于修复滨海湿地提供了理论依据。
| [1] |
Haj-Amor Z, Araya T, Kim D G, et al. Soil salinity and its associated effects on soil microorganisms, greenhouse gas emissions, crop yield, biodiversity and desertification: A review[J]. Science of The Total Environment, 2022, 843: 156946. DOI:10.1016/j.scitotenv.2022.156946 (  0) 0) |
| [2] |
Sahab S, Suhani I, Srivastava V, et al. Potential risk assessment of soil salinity to agroecosystem sustainability: Current status and management strategies[J]. Science of the Total Environment, 2021, 764: 144164. DOI:10.1016/j.scitotenv.2020.144164 (  0) 0) |
| [3] |
Tiwari S, Sharma B, Bisht N, et al. Role of beneficial microbial gene pool in mitigating salt/nutrient stress of plants in saline soil through underground phytostimulating signalling molecules: A review[J]. Pedosphere, 2023, 33(1): 153-171. DOI:10.1016/j.pedsph.2022.06.029 (  0) 0) |
| [4] |
赵晶晶, 詹万龙, 周浓. 非生物胁迫下植物体内活性氧和丙酮醛代谢的研究进展[J]. 南方农业学报, 2022, 53(8): 2099-2113. Zhao J J, Zhan W L, Zhou N. Advances in the metabolism of reactive oxygen species and pyruvate aldehyde in plants under abiotic stress[J]. Journal of Southern Agriculture, 2022, 53(8): 2099-2113. (  0) 0) |
| [5] |
Choudhary A, Kumar A, Kaur N. ROS and oxidative burst: Roots in plant development[J]. Plant Diversity, 2020, 42(1): 33-43. DOI:10.1016/j.pld.2019.10.002 (  0) 0) |
| [6] |
Bela K, Horváth E, Gallé á, et al. Plant glutathione peroxidases: Emerging role of the antioxidant enzymes in plant development and stress responses[J]. Journal of Plant Physiology, 2015, 176: 192-201. DOI:10.1016/j.jplph.2014.12.014 (  0) 0) |
| [7] |
Kaya C, Ashraf M. Sodium hydrosulfite together with silicon detoxifies arsenic toxicity in tomato plants by modulating the AsA-GSH cycle[J]. Environmental Pollution, 2022, 294: 118608. DOI:10.1016/j.envpol.2021.118608 (  0) 0) |
| [8] |
Wang J, Zeng Q, Zhu J, et al. Dissimilarity of ascorbate-glutathione (AsA-GSH) cycle mechanism in two rice (Oryza sativa L.) cultivars under experimental free-air ozone exposure[J]. Agriculture, Ecosystems & Environment, 2013, 165: 39-49. (  0) 0) |
| [9] |
Ghassemi-Golezani K, Farhangi-Abriz S. Biochar related treatments improved physiological performance, growth and productivity of Mentha crispa L. plants under fluoride and cadmium toxicities[J]. Industrial Crops and Products, 2023, 194: 116287. DOI:10.1016/j.indcrop.2023.116287 (  0) 0) |
| [10] |
Wei H, Li X, He W, et al. Arbuscular mycorrhizal symbiosis enhances perennial ryegrass growth during temperature stress through the modulation of antioxidant defense and hormone levels[J]. Industrial Crops and Products, 2023, 195: 116412. DOI:10.1016/j.indcrop.2023.116412 (  0) 0) |
| [11] |
El-Sawah A M, Abdel-Fattah G G, Holford P, et al. Funneliformis constrictum modulates polyamine metabolism to enhance tolerance of Zea mays L. to salinity[J]. Microbiological Research, 2023, 266: 127254. DOI:10.1016/j.micres.2022.127254 (  0) 0) |
| [12] |
Turan V. Potential of pistachio shell biochar and dicalcium phosphate combination to reduce Pb speciation in spinach, improved soil enzymatic activities, plant nutritional quality, and antioxidant defense system[J]. Chemosphere, 2020, 245: 125611. DOI:10.1016/j.chemosphere.2019.125611 (  0) 0) |
| [13] |
Liu X, Cheng S, Aroca R, et al. Arbuscular mycorrhizal fungi induce flavonoid synthesis for mitigating oxidative damage of trifoliate orange under water stress[J]. Environmental and Experimental Botany, 2022, 204: 105089. DOI:10.1016/j.envexpbot.2022.105089 (  0) 0) |
| [14] |
孙思淼, 常伟, 宋福强. 丛枝菌根真菌提高盐胁迫植物抗氧化机制的研究进展[J]. 应用生态学报, 2020, 31(10): 3589-3596. Sun S M, Chang W, Song F Q. Mechanism of arbuscular mycorrhizal fungi improve the oxidative stress to the host plants under salt stress: A review[J]. Chinese Journal of Applied Ecology, 2020, 31(10): 3589-3596. (  0) 0) |
| [15] |
Dai L, Chen Y, Liu L, et al. Effect of biochar on the uptake, translocation and phytotoxicity of chromium in a soil-barley pot system[J]. Science of the Total Environment, 2022, 826: 153905. DOI:10.1016/j.scitotenv.2022.153905 (  0) 0) |
| [16] |
Leng T, Li F, Chen Y, et al. Fast quantification of total volatile basic nitrogen (TVB-N) content in beef and pork by near-infrared spectroscopy: Comparison of SVR and PLS model[J]. Meat Science, 2021, 180: 108559. DOI:10.1016/j.meatsci.2021.108559 (  0) 0) |
| [17] |
Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254. (  0) 0) |
| [18] |
Hase S, Ikenaka K, Mikoshiba K, et al. Analysis of tissue glycoprotein sugar chains by two-dimensional high-performance liquid chromatographic mapping[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1988, 434(1): 51-60. DOI:10.1016/0378-4347(88)80061-6 (  0) 0) |
| [19] |
Wang Y, Kim W, Naik R R, et al. Chapter 5—Functionality of plant-based proteins[M]//Prakash S, Bhandari B R, Gaiani C. Engineering Plant-Based Food Systems. Cambridge: Academic Press, 2023.
(  0) 0) |
| [20] |
Farhangi-Abriz S, Ghassemi-Golezani K. Improving electrochemical characteristics of plant roots by biochar is an efficient mechanism in increasing cations uptake by plants[J]. Chemosphere, 2023, 313: 137365. DOI:10.1016/j.chemosphere.2022.137365 (  0) 0) |
| [21] |
Chen H, Lee J, Lee J, et al. MSD2, an apoplastic Mn-SOD, contributes to root skotomorphogenic growth by modulating ROS distribution in Arabidopsis[J]. Plant Science, 2022, 317: 111192. (  0) 0) |
| [22] |
Cunha J R, Carvalho F E L, Lima-Neto M C, et al. Proteomic and physiological approaches reveal new insights for uncover the role of rice thylakoidal APX in response to drought stress[J]. Journal of Proteomics, 2019, 192: 125-136. DOI:10.1016/j.jprot.2018.08.014 (  0) 0) |
| [23] |
杨怡森, 袁小会, 廖国婷, 等. 菌根共生条件下施加生物炭对玉米根系及生长的影响[J]. 江苏农业科学, 2022, 50(17): 90-94. Yang Y S, Yuan X H, Liao G T, et al. Effect of biochar application on root system and growth of maize under mycorrhizal symbiosis[J]. Jiangsu Agricultural Sciences, 2022, 50(17): 90-94. (  0) 0) |
| [24] |
Bisht A, Garg N. AMF modulated rhizospheric microbial enzyme activities and their impact on sulphur assimilation along with thiol metabolism in pigeonpea under Cd stress[J]. Rhizosphere, 2022, 21: 100478. DOI:10.1016/j.rhisph.2022.100478 (  0) 0) |
| [25] |
Frosi G, Barros V A, Oliveira M T, et al. Symbiosis with AMF and leaf Pi supply increases water deficit tolerance of woody species from seasonal dry tropical forest[J]. Journal of Plant Physiology, 2016, 207: 84-93. (  0) 0) |
| [26] |
张哲超, 杨久扬, 郝百惠, 等. 微生物群落驱动AM真菌、生物炭及联合改良沙化土壤作用潜力[J]. 环境科学, 2021, 42(4): 2066-2079. Zhang Z C, Yang J Y, Hao B H, et al. Potential of arbuscular mycorrhizal fungi, biochar, and combined amendment on sandy soil improvement driven by microbial community[J]. Environmental Science, 2021, 42(4): 2066-2079. (  0) 0) |
| [27] |
Hou J, Pugazhendhi A, Sindhu R, et al. An assessment of biochar as a potential amendment to enhance plant nutrient uptake[J]. Environmental Research, 2022, 214: 113909. (  0) 0) |
| [28] |
Cao H, Ding R, Kang S, et al. Chapter Three—Drought, salt, and combined stresses in plants: Effects, tolerance mechanisms, and strategies[M]//Sparks D L. Advances in Agronomy. Cambridge: Academic Press, 2023.
(  0) 0) |
| [29] |
Baba S A, Jain D, Abbas N, et al. Overexpression of Crocus carotenoid cleavage dioxygenase, CsCCD4b, in Arabidopsis imparts tolerance to dehydration, salt and oxidative stresses by modulating ROS machinery[J]. Journal of Plant Physiology, 2015, 189: 114-125. (  0) 0) |
| [30] |
Franklin-Tong N, Bosch M. Plant biology: Stigmatic ROS decide whether pollen is accepted or rejected[J]. Current Biology, 2021, 31(14): 904-906. (  0) 0) |
| [31] |
Mullineaux P M, Exposito-Rodriguez M, Laissue P P, et al. ROS-dependent signalling pathways in plants and algae exposed to high light: Comparisons with other eukaryotes[J]. Free Radical Biology and Medicine, 2018, 122: 52-64. (  0) 0) |
| [32] |
Xiao R, Liu X, Ali A, et al. Bioremediation of Cd-spiked soil using earthworms (Eisenia fetida): Enhancement with biochar and Bacillus megatherium application[J]. Chemosphere, 2021, 264: 128517. (  0) 0) |
| [33] |
Espinosa F, Garrido I, Alvarez-Tinaut M C. Reflexions on some aspects of the interactions among ROS, RNS, and Ca2+ in response to a mycorrhizal or a pathogenic fungus[J]. Plant Signal & Behavior, 2015, 10(9): e1049789. (  0) 0) |
| [34] |
张功臣, 秦玉红, 王波, 等. 生物炭对盐胁迫下黄瓜叶片抗氧化酶活性和矿质元素累积的影响[J]. 土壤通报, 2022, 53(4): 931-938. Zhang G C, Qin Y H, Wang B, et al. Effect of biochar on the activity of antioxidant enzymes and accumulation of mineral elements in cucumber leaves under salt stress[J]. Chinese Journal of Soil Science, 2022, 53(4): 931-938. (  0) 0) |
| [35] |
Saroy K, Garg N. Relative effectiveness of arbuscular mycorrhiza and polyamines in modulating ROS generation and ascorbate-glutathione cycle in Cajanus cajan under nickel stress[J]. Environmental Science and Pollution Research, 2021, 28(35): 48872-48889. (  0) 0) |
2. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China;
3. Shandong Provincial Key Laboratory of Marine Environment and Geological Engineering, Ocean University of China, Qingdao 266100, China
 2025, Vol. 55
2025, Vol. 55


