2. 中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003
目前,全球范围内海藻病害频发,严重威胁了海藻的生存及海藻养殖业的发展[1-3]。研究表明,大多数海藻病害的致病菌是条件致病菌[4]。条件致病菌是指存在于健康藻体的附生细菌,当海藻生存环境恶化(如温度升高、光强变化和酸碱度变化等)或海藻自身免疫能力下降时,这些细菌会转变为致病菌,导致海藻病害的爆发[1, 5-9]。
迄今为止,澳大利亚学者已运用传统微生物分离培养方法,对野生Delisea pulchra白化病的条件致病菌进行了系统地研究。D. pulchra白化病的爆发与其生存环境温度的升高以及藻体化学防御能力的下降密切相关[10-11]。自然条件下,D. pulchra具有化学防御反应的能力,可通过分泌卤代呋喃酮来抑制微生物在其表面的定殖[11-13]。在夏季,D. pulchra生长的环境温度范围为19~24 ℃。当海水温度达到24 ℃且藻体不分泌卤代呋喃酮时,存在于健康D. pulchra上的菌株Ruegeria sp. R11可在藻体上大量繁殖,导致白化病的爆发[11]。这说明Ruegeria sp. R11是导致D. pulchra白化病的条件致病菌。此外,Phaeobacter sp. LSS9、Alteromonas sp. BL110、Aquimarina sp. AD1、Aquimarina sp. BL5和Agarivorans sp. BL7也是D. pulchra白化病的条件致病菌[7, 14-15]。
对于养殖海藻条件致病菌,中国学者提出褐藻酸降解菌是海带(Saccharina japonica)病害的条件致病菌[6]。褐藻酸降解菌能够降解海带细胞壁主要成份——褐藻酸。正常条件下,褐藻酸降解菌存在于健康藻体表面,但当养殖环境恶化(如温度升高、光强变化和酸碱度变化等)以及海带自身免疫能力下降时,褐藻酸降解菌大量繁殖,转变为致病菌,导致海带病害的爆发[6, 16-21]。尽管国内、外学者已运用传统微生物分离培养的方法分离鉴定了大量褐藻酸降解菌(主要隶属于弧菌属(Vibrio)[20, 22]、假单胞菌属(Pseudomonas)[17]、交替单胞菌属(Alteromonas)[23-25]、微球菌属(Micrococcus)[26]、假交替单胞菌属(Pseudoalteromonas)[27]和盐单胞菌属(Halomonas)[20]等),但这些褐藻酸降解菌均未通过实验证明其存在于健康海带表面,因此不能将这些菌株定义为海带条件致病菌。海带致病菌多分离自有病害的藻体。例如,Sawabe等[28]从红斑病海带上分离出致病菌Pseudoalteromonas bacteriolytica;韩宜晓[29]从脱苗病海带上分离出致病菌海床动性微菌LJ2-4(Planomicrobium okeanokoite LJ2-4);Zhang等[21]从白化病海带上分离出致病菌杀鱼假交替单胞菌X-8(Pseudoalteromonas piscicida X-8)。截至目前,只有Yang等[4]从健康海带藻体表面分离出一株条件致病菌铜绿假单胞菌MSLj6-25(Pseudomonas aeruginosa MSLj6-25)。实验室条件下,该菌株可引起海带绿烂的病症,侵染24 h的致病率高达85.6%[4]。另外,Largo等[30]发现,当养殖长心卡帕藻(Kappaphycus alvarezii)遭受环境逆境时(如盐度或光照强度降低),存在于健康养殖长心卡帕藻藻体上的Vibrio sp. P11和Cytophage sp. P25可导致冰样白化病的爆发。随后,Largo等[31]提出条件致病菌是导致养殖长心卡帕藻冰样白化病的主要致病菌,并将Vibrio sp. P11定义为养殖长心卡帕藻冰样白化病的条件致病菌。因此,目前养殖海藻条件致病菌的分离与分类学鉴定相关研究仍处于起步阶段,亟需分离鉴定养殖海藻的条件致病菌,以丰富海藻条件致病菌的菌种资源库。
海带是中国重要的经济养殖海藻,2021年中国海带总产量达到174万t,占中国海水养殖藻类总产量的64.2%[32]。然而,在海带育苗以及养殖过程中,各种病害频频爆发,严重时可减产25%~30%[6, 33]。基于海带病害致病菌多为条件致病菌,本研究结合传统微生物分离培养方法与细菌-海带侵染实验体系,旨在分离鉴定健康海带表面潜在的条件致病菌。研究结果将不仅丰富海带条件致病菌的菌种资源,从而有助于进一步探究条件致病菌致病的机理,还可为海带病害的病因诊断以及病害防控技术的研发奠定重要的前期工作基础。
1 材料与方法 1.1 海带附生细菌的采集2019年8月8日,在山东省荣成市青鱼滩海带育苗场(37°10′2.19″N, 122°34′54.8″E)采集海带成熟孢子体,低温避光,于4 h内运输至实验室。到达实验室后,立即用无菌海水冲洗3次,以去除表面杂质。选取靠近海带生长点三分之一处的50 cm2区域,使用无菌棉签刮取3个重复样品,放置于50 mL的无菌离心管中,保存备用。
1.2 海带附生细菌的分离和纯化为了分离和纯化海带的附生细菌,采用传统的微生物分离培养方法。具体步骤如下:向装有采样棉签的50 mL离心管中加入20粒直径为2.5 mm的无菌玻璃珠和20 mL无菌海水,使用漩涡混合器(VORTEX-6,海门市其林贝尔仪器制造有限公司,中国)震荡5 min后,收集悬液;利用10倍稀释法,取10-1~10-7不同稀释梯度的40 μL菌悬液涂布于改良ZoBell 2216E固体培养基上,该培养基的成分包括胰蛋白胨5 g、酵母提取物1 g、磷酸高铁0.1 g、琼脂15 g和过滤后的海水1 L,将这些成分充分混合后,在121 ℃灭菌30 min;将涂布好的培养基置于25 ℃恒温培养24~ 72 h,定期观察菌落生长情况;选取适当梯度,采用平板三区划线的方法分离和纯化附生细菌,直至分离出单个菌落;将纯化后的菌株接种于改良ZoBell 2216E液体培养基(除不添加琼脂,配方同ZoBell 2216E固体培养基)中,于25 ℃、120 r/min震荡培养24 h后,将其与60%(v/v)无菌甘油按照体积比1∶1保存于2 mL的离心管,放置于-80 ℃冰箱保存备用。
1.3 侵染实验 1.3.1 菌株活化在筛选致病菌之前,按照以下步骤活化保存于-80 ℃冰箱的菌株。
(1) 第一次活化:从-80 ℃冰箱取出菌株,解冻成菌液后,取0.5 mL菌液接种于5 mL改良ZoBell 2216E液体培养基中,于25 ℃、120 r/min振荡培养24 h。
(2) 第二次活化:取步骤(1)中菌液0.5 mL接种于50 mL新鲜的改良ZoBell 2216E液体培养基中,于25 ℃、120 r/min振荡培养24 h。
(3) 第三次活化:取步骤(2)中菌液0.5 mL接种于50 mL新鲜的改良ZoBell 2216E液体培养基中,于25 ℃、120 r/min振荡培养,直至菌液600 nm处的吸光度(OD600)达到0.5。
1.3.2 海带幼孢子体的采集2022年12月1日,在山东省荣成市威海长青海洋科技有限公司采集健康的海带幼孢子体(长度为30~40 cm)(见图 1),经低温避光4 h内运输至实验室后,立即用无菌海水冲洗3次,以去除藻体表面杂质。加入无菌海水,于10 ℃、光照周期12 h∶12 h(光∶暗)恒温培养,并每天更换新鲜的无菌海水。

|
( 虚线为切割线。The dashed line is the cut line. ) 图 1 健康幼孢子体以及1.0 cm×1.0 cm组织块示意图 Fig. 1 Schematic diagram of healthy juvenile sporophytes and 1.0 cm×1.0 cm of tissue pieces |
利用细菌-海带侵染实验体系进行侵染实验。如图 1所示,取生长状况良好的幼孢子体,使用无菌手术刀沿叶状体中部,将其两侧切割成1.0 cm×1.0 cm的组织块,并将这些组织块放入无菌海水中备用。将处理好的海带组织块随机放入24孔板中,每孔放置1个海带组织块。向24孔板每个孔中加入1.5 mL活化好的菌液作为侵染组,同时,以无菌液体培养基作为对照组。使对照组和侵染组均包含30个海带组织块,并设置3个独立重复试验。于10 ℃、光照周期12 h∶12 h(光∶暗)条件下恒温培养,观察并记录对照组及侵染组海带组织块出现的病害症状。
1.4 生长曲线与OD600-CFU(Colony forming unit)相关性曲线的测定根据不同时间点测定的OD600绘制生长曲线。将活化的菌液(OD600≈0.5)0.5 mL接种到新鲜的200 mL改良ZoBell 2216E液体培养基中,于25 ℃、120 r/min振荡培养。然后,每2 h测量一次OD600,直至细菌生长达到稳定期。以OD600为纵坐标,培养时间为横坐标,绘制生长曲线。
参照李亭玉等[34]的方法绘制OD600-CFU相关性曲线。取活化的菌液(OD600≈1.0),使用新鲜的ZoBell 2216E液体培养基将其稀释2、4、6、8和10倍,并测量各稀释液的OD600;同时,运用平板稀释涂布的方法,将稀释2、4、6、8和10倍的菌液均稀释至10-1、10-2、10-3、10-4、10-5、10-6和10-7不同梯度,每个稀释梯度取40 μL菌悬液涂布于改良ZoBell 2216E固体培养基(每个稀释度3个重复)上,于25 ℃培养24 h,选取合适的稀释梯度,计算菌落形成单位。根据测定的OD600及平板统计的菌落形成单位(CFU),绘制OD600-CFU相关性曲线。
1.5 致病菌的形态学观察在TCBS琼脂培养基上观察致病菌的菌落形态。另外,为观察菌体细胞的形态,本研究利用了透射电镜的负染色和超薄切片技术。将致病菌接种于改良ZoBell 2216E液体培养基,活化至生长对数期,参考Zhang等[21]的方法,利用该时期的菌体分别进行负染色和超薄切片处理,具体步骤如下:
(1) 菌体负染色处理及观察。取10 mL活化至生长对数期的菌液,3 000 r/min离心10 min,弃上清,获得菌体沉淀;使用3%戊二醛(Sigma-Aldrich,美国)重悬菌体沉淀,并固定10 min;取一滴固定后的样品滴在碳膜铜网上,并在室温下干燥5 min;使用1%的磷钨酸(Sigma-Aldrich,美国)对干燥后的细菌样品进行负染,并在室温下干燥15 min;使用透射电子显微镜(JEM-1200EX,JEOL,日本)观察样品。
(2) 菌体超薄切片处理及观察。取10 mL活化至生长对数期的菌液,3 000 r/min离心10 min,弃上清液,获得菌体沉淀;使用2.5%戊二醛(Sigma-Aldrich,美国)重悬菌体沉淀,并固定4 h;取固定后的样品,使用磷酸盐缓冲液(PBS)(Solarbio Life Sciences,美国)冲洗3次,每次15 min;使用1%的四氧化锇(OsO4)(青岛医学院电子显微镜中心提供)固定1.5 h;使用PBS缓冲液再次冲洗样品;经过不同浓度(30%、50%、70%、90%和100%)的乙醇(国药集团化学试剂有限公司,中国)梯度脱水,每次10 min,其中用100 %乙醇脱水2次;使用Epon812环氧树脂(Ted Pella,美国)包埋样品,并依次在37、45和65 ℃的温度下聚合,每个温度24 h;使用Ultracut E超薄切片机(Reichert-Jung,德国)制备超薄切片;使用醋酸双氧铀硝酸铅(青岛医学院电子显微镜中心提供)对切片后的菌体染色;使用透射电子显微镜观察样品。
1.6 菌株生理生化特征分析使用Biolog Gen Ⅲ MocroPlate(Hayward,美国)分析致病菌的生理生化特征,测试内容涵盖菌株对碳源的利用以及化学衍生物的敏感性。具体步骤如下:将致病菌株接种至改良ZoBell 2216E固体培养基上,于25 ℃培养12 h;使用无菌棉签挑取平板上的致病菌落,接种至接种液B(Hayward,美国)中,制备成菌悬液;使用浊度计(Hayward,USA)测量透光率,确保达到95%~96%的标准;将该菌悬液加入Gen Ⅲ孔板中,每孔接种100 μL,于25 ℃孵育24 h;利用酶标仪(Synergy LX,BioTek,美国)测量吸光度,设置波长为590 nm,并根据制造商的说明书进行分析。
1.7 菌株的分子鉴定和系统发育分析运用PCR方法扩增致病菌的16S rRNA基因,并测序。具体步骤如下:使用Ezup柱式细菌基因组DNA抽提试剂盒(B518255-0050,生工生物,上海),按照说明书提取菌株的总DNA;使用引物27 F/1492 R(见表 1)扩增致病菌的16S rRNA基因序列,具体流程参考Zhang等[21]的方法;PCR扩增产物送至生工生物工程(上海)股份有限公司青岛分公司测序;将测序得到的菌株16S rRNA基因序列与EziBioCloud基因数据库比对,获得相关菌株的信息;利用Molecular Evolutionary Genetics Analysis(MEGA)X软件,按照Neighbour-Joining方法构建系统发育树。
|
|
表 1 扩增16S rRNA基因的引物序列 Table 1 Primer sequences of 16S rRNA gene |
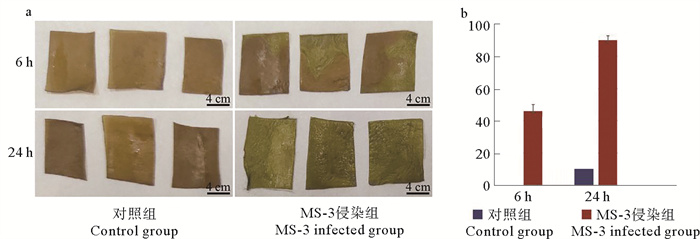
本研究中共分离出45株菌株,经侵染实验初筛发现,有9株菌株表现出致病性。其中,菌株MS-3具有较强的致病性,可在侵染6 h内引起海带组织产生绿烂的病症(见图 2)。与对照组相比,MS-3在侵染海带组织块6 h时,其边缘开始出现绿烂的病症(见图 2a),而在侵染24 h时,海带组织块已完全绿烂(见图 2a)。具体而言,菌株MS-3侵染海带6和24 h时,出现绿烂组织块的比例分别为(45.5±4.2)%和(90.0±2.7)%(见图 2b),而对照组中,在侵染24 h时,仅有少数海带组织块边缘部位出现绿烂,比例为(8.9±1.5)%,绿烂程度轻微(见图 2b)。
|
( a:侵染6和24 h时,对照组和MS-3侵染组海带组织块的图像;b:侵染6和24 h时,对照组和MS-3侵染组中绿烂海带组织块的比例。a: Tissue pieces images of S. japonica in the control and MS-3 infected group at 6 and 24 h, respectively; b: Proportion of green-rotten diseased tissue pieces of S. japonica in the control and MS-3 infected group at 6 and 24 h. ) 图 2 菌株MS-3致病性的验证 Fig. 2 Verification of pathogenicity of MS-3 |
MS-3侵染后,海带组织细胞的显微结构变化如图 3所示。与对照组中健康的海带组织细胞相比,MS-3侵染6 h时,海带组织细胞开始变绿(见图 3);侵染24 h时,海带组织细胞的色素体明显聚集在细胞壁周围(见图 3)。

|
图 3 菌株MS-3诱导海带组织绿烂病症的显微图片 Fig. 3 Microscopic images of green-rotten disease of S. japonica tissues caused by MS-3 |
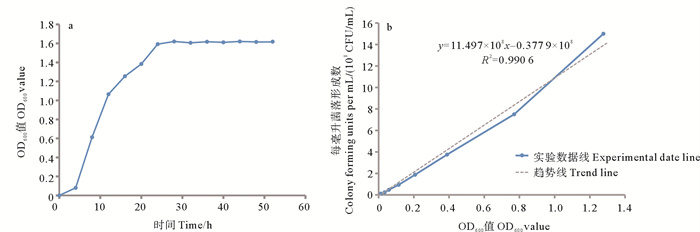
如图 4菌株MS-3的生长曲线显示:在前4 h内,菌株MS-3生长缓慢(见图 4a),利用图 4a和b中的数据并结合Yang等[4]的生长速度计算方法得出,生长速度仅有1.35×107 CFU/(mL·h);在4 ~24 h内,菌株MS-3进入对数期(见图 4a),结合Yang等[4]的生长速度计算方法得出,最大生长速度约为1.53×108 CFU/(mL·h)(见图 4a和b);24 h后,菌株MS-3数量增长仅有小幅波动,进入稳定期,稳定期的OD600约为1.615(见图 4a)。
|
( a:菌株MS-3的生长曲线;b:菌株MS-3的OD600-CFU相关性曲线。R2 = 0.990 6。a: The growth curve of MS-3; b: OD600-CFU correlation curve of MS-3, R2 = 0.990 6. ) 图 4 菌株MS-3的生长曲线和OD600-CFU相关性曲线 Fig. 4 The growth curve of MS-3 and OD600-CFU correlation curve |
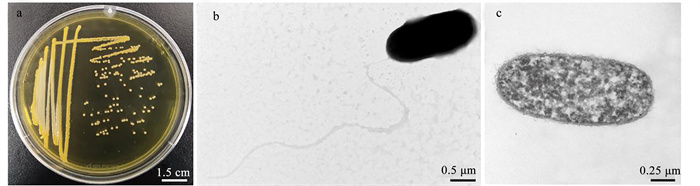
菌株MS-3在TCBS培养基上呈现出亮黄色的圆形菌落,直径约为1~2 mm(见图 5a)。通过菌体负染色和超薄切片的透射电镜图片可以观察到,菌株MS-3的菌体呈棒状,细菌细胞的长度约为1.7~2.3 μm,宽度约为0.6~0.8 μm,具有单根极生鞭毛(见图 5b和c)。
|
( a:菌株MS-3在TCBs培养基上的菌落图片;b:菌株MS-3细胞的负染色透射电镜图片;c:MS-3细胞的超薄切片透射电镜图片。a: Image of colonies of strain MS-3 growing on TCBS agar medium; b: Negative staining TEM image of MS-3 cell; c: Ultrathin section TEM image of the MS-3 cell. ) 图 5 菌株MS-3的形态观察 Fig. 5 Morphological observation of MS-3 |
本研究中,使用Biolog Gen Ⅲ MicroPlate微生物鉴定系统对菌株MS-3的生理生化特性进行研究。菌株MS-3对碳水化合物、氨基酸和其他化学衍生物的代谢图谱如表 2、3所示。其中:菌株MS-3可代谢的碳水化合物包括糊精、D-麦芽糖、D-纤维二糖、龙胆二糖、β-甲酰-D-葡糖苷、D-水杨苷、N-乙酰-D-葡糖胺、α-D-葡糖和D-甘露醇等(见表 2),这与标准菌株新喀里多尼亚弧菌NC470可代谢的碳水化合物的种类相似;菌株MS-3可代谢的氨基酸包括L-天冬氨酸和L-谷氨酸(见表 2);另外,菌株MS-3对一些化学衍生物敏感,例如,梭链孢酸、利福霉素SV、硫酸四癸钠、万古霉素、四唑紫和四唑紫蓝,且可在pH = 6.0的条件下生长,但不能在pH = 5.0的条件下生长(见表 3)。
|
|
表 2 菌株MS-3的碳源利用测试 Table 2 Assay of carbon source utilization of MS-3 |
|
|
表 3 菌株MS-3的化学敏感性测试 Table 3 Assay of chemical sensitivity of MS-3 |
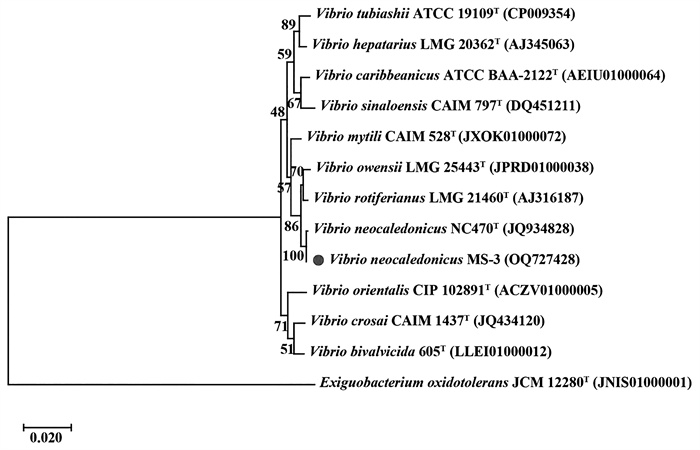
经过16s rRNA基因序列比对发现,菌株MS-3与标准菌株新喀里多尼亚弧菌NC470(Vibrio neocaledonicus NC470T)的序列相似度为99.7%。基于菌株MS-3的16s rRNA基因序列,以Exiguobacterium oxidotolerans JCM 12280T为外群菌株构建系统发育树(见图 6)。在系统发育树中,菌株MS-3与新喀里多尼亚弧菌NC470聚类(见图 6)。根据菌株MS-3与标准菌株的相似度,可将其鉴定为新喀里多尼亚弧菌MS-3(Vibrio neocaledonicus MS-3)。本研究首次从健康海带表面分离出可导致海带绿烂症状的弧菌属条件致病菌。菌株MS-3的16s rRNA基因序列已上传至NCBI数据库,登录号为OQ727428。
|
( 括号内的序号为菌株NCBI序列编号;分支点上数字为自展值(基于1 000次重复);标尺表示核苷酸替换率为0.020。以Exiguobacterium oxidotolerans JCM 12280T作为外群菌株。NCBI accession numbers were listed in parentheses; numbers at nodes indicate percentage levels of bootstrap (1 000 replicates); Scale indicates 0.020 substitutions per nucleotide position. Exiguobacterium oxidotolerans JCM 12280T was used as an out group. ) 图 6 菌株MS-3的系统发育树 Fig. 6 Neighbour-joining phylogenetic tree of MS-3 |
本研究中,我们从健康海带成熟孢子体表面分离鉴定出一株条件致病菌MS-3。在实验室条件下,菌株MS-3侵染健康海带幼孢子体6 h,可导致其发生绿烂。16s rRNA基因序列比对结果显示,MS-3与新喀里多尼亚弧菌NC470的相似度为99.7%,且MS-3的特征符合弧菌的形态特征及生理生化特性。因此,将MS-3鉴定为新喀里多尼亚弧菌MS-3。
新喀里多尼亚弧菌属于弧菌属,最初是由Chalkiadakis等[35]在新喀里多尼亚海洋潮间带地区的海参纲的无脊椎动物的生物膜上分离获得。多项研究揭示,新喀里多尼亚弧菌是许多海洋生物的致病菌。例如:分离自螠虫动物单环刺螠(Urechis unicinctus)肠道内的新喀里多尼亚弧菌SX-1(Vibrio neocaledonicus SX-1),经人工回接感染实验后,可导致单环刺螠体表变红、腹部鼓起及肠道坏死[36];2021年,王印庚等[37]报道了新喀里多尼亚弧菌是凡纳滨对虾(Litopenaeus vannamei)虾苗细菌性玻化症的潜在致病菌;另外,分离自虾夷扇贝(Patinopecten yessoensis)闭壳肌上的新喀里多尼亚弧菌M-08(Vibrio neocaledonicus M-08),经回归感染实验,证实了其对虾夷扇贝具有致病性,具体表现为闭壳肌出现脓胞和黏液[38]。另外,新喀里多尼亚弧菌也是野生及养殖海藻的致病菌。侯明磊等[39]发现,分离自野生真江蓠藻体上的新喀里多尼亚弧菌菌株Nt11-3和Ht12-1可导致真江蓠藻枝体尖端发生白化病。近期,Ahmad[40]从患有绿烂病的海带藻体上分离的新喀里多尼亚弧菌Lj-8(Vibrio neocaledonicus Lj-8) 和新喀里多尼亚弧菌Lj-10(Vibrio neocaledonicus Lj-10) 在实验室条件下侵染海带28 h后,均可导致其绿烂。本研究从健康海带藻体上分离鉴定出一株海带条件致病菌新喀里多尼亚弧菌株MS-3。在实验室条件下,该菌株侵染海带6 h可导致海带发生绿烂病症,与先前从绿烂病海带藻体上分离出的新喀里多尼亚弧菌株Lj-8和Lj-10相比,条件致病菌株MS-3具有较强的致病性。
迄今为止,通过传统微生物分离纯化的方法,国内、外学者已经从野生及养殖海藻上分离鉴定出多株条件致病菌[10-11, 14, 30-31]。然而,尽管褐藻酸降解菌是导致养殖海带病害的条件致病菌,但以往的分类学研究只是停留在属水平上,很少深入到种水平进行鉴定。随着分子鉴定技术的发展,结构和功能高度保守的16s rRNA基因序列越来越广泛地应用于细菌种水平的分类学鉴定[41-42]。Yang等[4]首次从健康海带藻体上分离鉴定出可导致海带绿烂病的条件致病菌铜绿假单胞菌MSLj6-25(Pseudomonas aeruginosa MSLj6-25)。而本研究则首次在健康海带上分离出弧菌属的条件致病菌株新喀里多尼亚弧菌MS-3。因此,我们强烈建议采用传统微生物分离培养方法,从健康海带表面分离出鉴定出更多的条件致病菌,以进一步丰富海带条件致病菌的菌种资源库,并为海藻病害的诊断提供理论依据。
4 结语本研究运用传统微生物分离培养方法和细菌——海带侵染实验体系,从健康的海带成熟孢子体上分离出一株条件致病菌MS-3。在实验室条件下,该菌株侵染海带6 h后,可诱导海带绿烂的病症。结合菌株MS-3的16s rRNA基因序列比对结果及生理生化特征,将该菌株鉴定为新喀里多尼亚弧菌MS-3(Vibrio neocaledonicus MS-3)。本研究首次从健康海带上分离出弧菌属的条件致病菌,并将其鉴定到种水平。该菌株的发现不仅丰富了海带绿烂病条件致病菌的菌种资源,有助于未来深入研究条件致病菌的致病机理,而且为海带病害的病因诊断以及病害防控技术的研发提供理论依据。
| [1] |
Egan S, Fernandes N D, Kumar V, et al. Bacterial pathogens, virulence mechanism and host defence in marine macroalgae[J]. Environmental Microbiology, 2014, 16(4): 925-938. DOI:10.1111/1462-2920.12288 (  0) 0) |
| [2] |
Zhang R, Chang L R, Xiao L Y, et al. Diversity of the epiphytic bacterial communities associated with commercially cultivated healthy and diseased Saccharina japonica during the harvest season[J]. Journal of Applied Phycology, 2020, 32(3): 2071-2080. DOI:10.1007/s10811-019-02025-y (  0) 0) |
| [3] |
Li J, Majzoub M E, Marzinelli E M, et al. Bacterial controlled mitigation of dysbiosis in a seaweed disease[J]. The ISME Journal, 2022, 16(2): 378-387. DOI:10.1038/s41396-021-01070-1 (  0) 0) |
| [4] |
Yang Q, Zhuang Y R, Saha M, et al. An opportunistic pathogenic Pseudomonas isolated from healthy brown alga Saccharina japonica[J]. Aquaculture, 2023, 563: 738975. DOI:10.1016/j.aquaculture.2022.738975 (  0) 0) |
| [5] |
Egan S, Harder T, Burke C, et al. The seaweed holobiont: Understanding seaweed-bacteria interactions[J]. FEMS Microbiology Reviews, 2013, 37(3): 462-476. DOI:10.1111/1574-6976.12011 (  0) 0) |
| [6] |
Wang G G, Lu B J, Shuai L M, et al. Microbial diseases of nursery and field-cultivated Saccharina japonica (Phaeophyta) in China[J]. Algological Studies International Journal of Phycological Research, 2014, 145(1): 39-51. (  0) 0) |
| [7] |
Kumar V, Zozaya-Valdés E, Kjelleberg S, et al. Multiple opportunistic pathogens can cause a bleaching disease in the red seaweed Delisea pulchra[J]. Environmental Microbiology, 2016, 18(11): 3962-3975. DOI:10.1111/1462-2920.13403 (  0) 0) |
| [8] |
Singh R P, Reddy C. Seaweed-microbial interactions: Key functions of seaweed-associated bacteria[J]. FEMS Microbiology Ecology, 2014, 88(2): 213-230. DOI:10.1111/1574-6941.12297 (  0) 0) |
| [9] |
Egan S, Gardiner M. Microbial dysbiosis: Rethinking disease in marine ecosystems[J]. Frontiers in Microbiology, 2016, 7: 991. (  0) 0) |
| [10] |
Campbell A H, Harder T, Nielsen S, et al. Climate change and disease: Bleaching of a chemically defended seaweed[J]. Global Change Biology, 2011, 17(9): 2958-2970. DOI:10.1111/j.1365-2486.2011.02456.x (  0) 0) |
| [11] |
Case R J, Longford S R, Campbell A H, et al. Temperature induced bacterial virulence and bleaching disease in a chemically defended marine macroalga[J]. Environmental Microbiology, 2011, 13(2): 529-537. DOI:10.1111/j.1462-2920.2010.02356.x (  0) 0) |
| [12] |
De Nys R, Steinberg P D, Willemsen P, et al. Broad spectrum effects of secondary metabolites from the red alga Delisea pulchra in antifouling assays[J]. Biofouling, 1995, 8(4): 259-271. DOI:10.1080/08927019509378279 (  0) 0) |
| [13] |
Dworjanyn S A, Nys R D, Steinberg P D. Localisation and surface quantification of secondary metabolites in the red alga Delisea pulchra[J]. Marine Biology, 1999, 133(4): 727-736. DOI:10.1007/s002270050514 (  0) 0) |
| [14] |
Fernandes N, Case R J, Longford S R, et al. Genomes and virulence factors of novel bacterial pathogens causing bleaching disease in the marine red alga Delisea pulchra[J]. PLoS One, 2011, 6(12): e27387. DOI:10.1371/journal.pone.0027387 (  0) 0) |
| [15] |
Fernandes N, Steinberg P, Rusch D, et al. Community structure and functional gene profile of bacteria on healthy and diseased thalli of the red seaweed Delisea pulchra[J]. PLoS One, 2012, 7(12): e50854. DOI:10.1371/journal.pone.0050854 (  0) 0) |
| [16] |
陈騳, 林光恒, 沈世泽. 褐藻酸降解菌的研究Ⅰ.褐藻酸降解菌与褐藻酸酶对海带藻体的作用[J]. 海洋与湖沼, 1979, 10(4): 329-333. Chen D, Lin G H, Shen S Z. Studies on alginic acid-decomposing bacteria Ⅰ. Action of alginic-acid decomposing bacteria and alginase on Laminaria japonica[J]. Oceanologia et Limnologia Sinica, 1979, 10(4): 329-333. (  0) 0) |
| [17] |
陈騳, 林光恒, 沈世泽. 褐藻酸降解菌的研究Ⅱ.海带夏苗培育中褐藻酸降解菌与烂苗的关系[J]. 海洋与湖沼, 1981, 12(2): 133-137. Chen D, Lin G H, Shen S Z. Studies on alginic acid-decomposing bacteriaⅡ. Rot disease of Laminaria summer sporelings caused by alginic acid-decomposing bacteria[J]. Oceanologia et Limnologia Sinica, 1981, 12(2): 133-137. (  0) 0) |
| [18] |
陈騳, 刘秀云, 刘秀珍, 等. 褐藻酸降解菌的研究Ⅲ.海带育苗系统中脱苗和烂苗原因分析及其预防措施[J]. 海洋与湖沼, 1984, 15(6): 581-589. Chen D, Liu X Y, Liu X Z, et al. Studies on alginic acid-decomposing bacteriaⅢ. The cause of the rot disease and detaching of Laminaria sporophytes in sporeling culture stations and their preventive measures[J]. Oceanologia et Limnologia Sinica, 1984, 15(6): 581-589. (  0) 0) |
| [19] |
相建海. 海水养殖生物病害的发生与控制[M]. 北京: 海洋出版社, 2001: 67-68. Xiang J H. Disease Occurrence and Control Strategies of Mariculture Organisms[M]. Beijing: China Ocean Press, 2001: 67-68. (  0) 0) |
| [20] |
Wang G G, Shuai L, Li Y, et al. Phylogenetic analysis of epiphytic marine bacteria on the hole-rotten diseased sporophytes of Laminaria japonica[J]. Journal of Applied Phycology, 2008, 20(4): 403-409. DOI:10.1007/s10811-007-9274-4 (  0) 0) |
| [21] |
Zhang X Y, Chen Y, Saha M, et al. Pseudoalteromonas piscicida X-8 causes bleaching disease in farmed Saccharina japonica[J]. Aquaculture, 2022, 546: 737354. DOI:10.1016/j.aquaculture.2021.737354 (  0) 0) |
| [22] |
Ando Y, Inoue K. Decomposition of alginic acid by microorganisms-Ⅳ: On the Vibrio-type bacteria, newly isolated from the decaying laminaria[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1961, 27(4): 339-341. DOI:10.2331/suisan.27.339 (  0) 0) |
| [23] |
刘成圣, 王丽丽, 王蒙, 等. 褐藻酸降解菌对海带感染能力差异性分析[J]. 海洋科学, 2002, 26(6): 44-47. Liu C S, Wang L L, Wang M, et al. Difference analysis of infection activity of alginic acid decomposing bacteria infecting Laminaria japonica[J]. Marine Sciences, 2002, 26(6): 44-47. (  0) 0) |
| [24] |
Wang Y, Tang X X, Yang Z, et al. Effect of alginic acid decomposing bacterium on the growth of Laminaria japonica (Phaeophyceae)[J]. Journal of Environmental Sciences, 2006, 18(3): 543-551. (  0) 0) |
| [25] |
Peng Y T, Li W. A bacterial pathogen infecting gametophytes of Saccharina japonica (Laminariales, Phaeophyceae)[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(2): 366-373. DOI:10.1007/s00343-013-2136-9 (  0) 0) |
| [26] |
Wu C Y. Cultivation of temperate seaweeds in the Asia Pasific region[J]. Regional Workshop on the Culture and Utilization of Seaweeds, 1990, 2: 27-32. (  0) 0) |
| [27] |
Sawabe T, Tanaka R, Iqbal M M, et al. Assignment of Alteromonas elyakovii KMM 162T and five strains isolated from spot-wounded fronds of Laminaria japonica to Pseudoalteromonas elyakovii 105 comb. nov. and the extended description of the species[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1): 265-271. (  0) 0) |
| [28] |
Sawabe T, Makino H, Tatsumi M, et al. Pseudoalteromonas bacteriolytica sp. nov., a marine bacterium that is the causative agent of red spot disease of Laminaria japonica[J]. International Journal of Systematic Bacteriology, 1998, 48(3): 769-774. (  0) 0) |
| [29] |
韩宜晓. 健康与脱苗病海带幼苗表面与养殖水体微生物群落多样性的研究以及致病菌的分离与鉴定[D]. 青岛: 中国海洋大学海洋生命学院, 2021. Han Y X. Diversity of Microbial Communities in Cultivating Seawater and Epiphytic Bacteria Associated with Healthy and Falling-Off Diseased Sporelings of Saccharina japonica and Isolation and Identification of a Pathogenic Bacterium[D]. Qingdao: Ocean University of China College of Marine Life Sciences, 2021. (  0) 0) |
| [30] |
Largo D B, Fukami K, Nishijima T. Occasional pathogenic bacteria promoting ice-ice disease in the carrageenan producing red algae Kappaphycus alvarezii and Eucheuma denticulatum (Solieriaceae, Gigartinales, Rhodophyta)[J]. Journal of Applied Phycology, 1995, 7(6): 545-554. (  0) 0) |
| [31] |
Largo D B, Fukami K, Nishijima T. Time-dependent attachment mechanism of bacterial pathogen during ice-ice infection in Kappaphycus alvarezii (Gigartinales, Rhodophyta)[J]. Journal of Applied Phycology, 1999, 11(1): 129-136. (  0) 0) |
| [32] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022. Ministry of Agriculture and Rural Affairs of the People's Republic of China, National Fisheries Technology Extension Center, China Society of Fisheries. China Fishery Statistical Yearbook[M]. Beijing: China Agriculture Press, 2022. (  0) 0) |
| [33] |
Gachon C M, Sime-Ngando T, Strittmatter M, et al. Algal diseases: Spotlight on a black box[J]. Trends in Plant Science, 2010, 15(11): 633-640. (  0) 0) |
| [34] |
李亭玉, 孔洁, 王元, 等. 大肠杆菌计数方法的比较与相关性分析[J]. 延边大学农学学报, 2019, 41(3): 71-75. Li T Y, Kong J, Wang Y, et al. Comparison of counting methods and correlation analysis of E. coli[J]. Agricultural Science Journal of Yanbian University, 2019, 41(3): 71-75. (  0) 0) |
| [35] |
Chalkiadakis E, Dufourcq R, Schmitt S, et al. Partial characterization of an exopolysaccharide secreted by a marine bacterium, Vibrio neocaledonicus sp. nov., from New Caledonia[J]. Journal of Applied Microbiology, 2013, 114(6): 1702-1712. (  0) 0) |
| [36] |
于士翔, 纪元, 李新, 等. 一株单环刺螠致病弧菌的分离鉴, 生长特性研究及药敏分析[J]. 海洋科学, 2019, 43(7): 112-121. Yu S X, Ji Y, Li X, et al. Isolation, identification, characterization, and sensitivity analysis of gut pathogenic Vibrio of Urechis unicinctus[J]. Marine Sciences, 2019, 43(7): 112-121. (  0) 0) |
| [37] |
王印庚, 于永翔, 刘潇, 等. 凡纳滨对虾虾苗细菌性玻化症(BVS)的病原, 病理分析[J]. 水产学报, 2021, 45(9): 1563-1573. Wang Y G, Yu Y X, Liu X, et al. Pathogens and histopathological characteristics of shrimp postlarvae bacterial vitrified syndrome(BVS) in the Litopenaeus vannamei[J]. Journal of Fisheries of China, 2021, 45(9): 1563-1573. (  0) 0) |
| [38] |
耿真. 新喀里多尼亚弧菌分离鉴定及其对虾夷扇贝的致病性研究[D]. 大连: 大连海洋大学水产与生命学院, 2022. Geng Z. Isolation and Identification of Vibrio neocaledonicus and Its Pathogenicity to Yesso Scallop(Patinopecten yessoensis)[D]. Daling: Dalian Ocean University College of Fisheries and Life Science, 2022. (  0) 0) |
| [39] |
侯明磊, 任艺飞, Düsedau L, 等. 入侵种真江蓠保护性细菌与条件致病菌的分离与鉴定[J]. 中国海洋大学学报(自然科学版), 2024, 54(4): 78-85. Hou M L, RenY F, Düsedau L, et al. Isolation and identification of protective and opportunistic pathogenic bacteria of invasive Gracilaria vermiculophylla[J]. Periodical of Ocean University of China, 2024, 54(4): 78-85. (  0) 0) |
| [40] |
Ahmad R. Isolation and Identification of Pathogenic Bacteria and Screening the Beneficial Bacteria Against Pathogenic Bacteria of Commercially Cultivated Saccharina japonica[D]. Qingdao: Ocean University of China, 2021.
(  0) 0) |
| [41] |
Chun J, Oren A, Ventosa A, et al. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes[J]. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(1): 461-466. (  0) 0) |
| [42] |
汪霞. 栝楼角斑病相关细菌的分离及其分子鉴定[D]. 合肥: 安徽农业大学植物保护学院, 2021. Wang X. Isolation of Bacteria Associated with Leaf Spot of Trichosanthes kirilowii and Molecular Identification[D]. Hefei: Anhui Agricultural University School of Plant Protection, 2021. (  0) 0) |
2. Institute of Evolution & Marine Biodiversity, Ocean University of China, Qingdao 266003, China
 2025, Vol. 55
2025, Vol. 55


