雷帕霉素靶蛋白(Mechanistic target of rapamycin,mTOR)是一种进化上高度保守的丝氨酸/苏氨酸蛋白激酶,属于磷脂酰肌醇-3-激酶相关蛋白激酶(Phosphatidylinositol 3-kinase,PI3K)家族,在生物体内以mTORC1(mTOR Complex1)和mTORC2(mTOR Complex2)两种形式存在[1-2]。其中,mTORC2对雷帕霉素敏感性弱,主要负责调控细胞骨架结构等;相比之下,mTORC1对雷帕霉素敏感较强,并在促进生长、蛋白质合成、脂肪合成等方面发挥重要作用[3]。因此,本文侧重于mTORC1进行研究。
氨基酸是蛋白质最基本的组成部分,具有多种重要的生理功能[4]。研究发现,mTORC1的激活与饮食引起的氨基酸浓度的变化紧密相连[5]。亮氨酸作为水产动物的必需氨基酸之一,同时也是唯一的生酮氨基酸,对水产动物的生长发育等起到非常重要的作用[6]。此外,亮氨酸是目前最有效激活mTORC1的氨基酸,具有促进蛋白合成、提升机体免疫能力等多种功能[7]。而雷帕霉素是已被证实的mTOR信号通路特异性抑制剂,通过抑制该信号通路对动物的生长发育产生影响[8]。
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾,因生长迅速、抗病力强、肉质鲜美且具有较高的营养价值,是我国现阶段养殖面积最大、产量最多的对虾养殖品种[9]。因此,探究mTOR信号通路调控凡纳滨对虾的营养感知及代谢机制,深入了解mTOR信号通路在凡纳滨对虾中的内在机制具有重要意义。到目前为止,mTOR信号通路在水产动物上的研究大多集中于经济鱼类,如大菱鲆(Scophthalmus maximus)、虹鳟(Oncorhynchus mykiss)、罗非鱼(Oreochromis niloticus)等。然而,对于甲壳动物,如凡纳滨对虾的研究,则多集中在mTOR信号通路对其蛋白质代谢和葡萄糖代谢的影响[10],关于mTOR信号通路对凡纳滨对虾生长、抗氧化及非特异性免疫力等研究还相对较少。
因此,本研究将亮氨酸和雷帕霉素分别作为mTOR信号通路的激活剂和抑制剂,来探究mTOR信号通路对凡纳滨对虾生长、抗氧化及非特异性免疫力的影响,有助于加深对甲壳动物mTOR信号通路的认知,以寻求更好地调节饲料利用和提高动物生长性能,该研究将为甲壳水产动物精准营养研究提供的新方向和思路。
1 材料与方法 1.1 饲料制备本实验饲料以鱼粉为主要蛋白源,鱼油和大豆卵磷脂为主要脂肪源,以小麦粉作为主要碳水化合物来源配制3组等氮等能的配合饲料,这3组饲料分别为对照组(Con组)、亮氨酸组(Leu组)和雷帕霉素组(Rap组)。在Con组中添加了1%的丙氨酸(Ala),在Leu组饲料中添加了1%的亮氨酸[11],在Rap组中添加了0.003%的雷帕霉素[12]。将所有饲料原料经粉碎机粉碎,按配方比例准确称量各饲料原料,各饲料组分由小到大逐级定量充分均匀混合后过40目网筛,与大豆油和磷脂油混合,制成直径为1 mm的颗粒饲料,在45 ℃下干燥24 h,然后密封袋装,置-20 ℃冰箱中备用。饲料配方见表 1。
|
|
表 1 实验饲料配方和主要营养成分(干物质) Table 1 Experimental feed formula and main nutrients (dry mater) |
凡纳滨对虾虾苗购自山东省莱州市某养殖场,养殖实验在山东省烟台市福山区国信东方循环水养殖科技有限公司进行。在实验正式开始前,用Con组饲料驯化2周。禁食24 h后,挑选出规格一致(0.70 g±0.01 g)、活力良好的凡纳滨对虾随机分配于养殖桶(250 L)中,每个处理组3个重复,每个重复60尾虾。每天4次(7:00、11:00、15:00和19:00)投喂,养殖周期为56 d。投喂实验期间,水温维持在(25.0±0.5) ℃,盐度26~28,pH 7.9~8.5,溶解氧≥8 mg/L,氨氮≤0.1 mg/L,亚硝酸盐≤0.03 mg/L。
1.3 样品采集本实验的所有步骤都是基于中国海洋大学的实验动物管理规定。养殖实验结束后,进行样品采集。将凡纳滨对虾饥饿24 h,使虾达到机体代谢稳定水平,称重并记录每桶虾的数量和质量,计算其增重率、饲料系数、蛋白质效率和特定生长率等生长指标。每桶随机抽取6尾虾放于-20 ℃冰箱内用于全虾体成分分析。每个处理组随机取10尾虾,对虾进行饱食投喂,分别在摄食后0、1、2和6 h取对虾组织样品。用1 mL注射器预装0.5 mL抗凝剂,从围心腔采血,抽取后的血淋巴离心(4 000 r/min, 10 min)后立即取上清液保存至1.5 mL离心管中,随后投入液氮中速冻。血样采集完毕后,将虾在冰上进行无菌解剖,分离对虾肝胰腺、肌肉组织。将所有样品置入1.5 mL冻存管中,迅速进行液氮速冻,之后,将样品转移到-80 ℃冰箱中保存。
1.4 饲料和虾体组成成分分析实验饲料和全虾水分、粗蛋白、粗脂肪和灰分等生化分析方法详细参照AOAC进行测定[13]。将饲料和全虾置于105 ℃烘箱中烘干24 h至恒重,通过计算烘干前后样品质量的差值,得出水分含量。使用杜马斯定氮仪测定样品中粗蛋白含量,使用索氏抽提仪对样品中粗脂肪进行萃取,通过计算差量值得出样品的粗脂肪含量。用马弗炉高温灼烧样品6~8 h至恒重(560 ℃),计算得出灰分含量,每个样品3个重复。饲料按照国家标准步骤进行样品处理,并使用全自动氨基酸分析仪分析得到饲料的氨基酸组成(见表 2)。
|
|
表 2 饲料氨基酸组成(干物质) Table 2 Amino acid composition of the experiment diets (dry matter) |
称取适量对虾肌肉样品,加入含有蛋白酶和磷酸酶抑制剂(罗氏, 德国)的RIPA裂解液后,冰上匀浆。使用BCA蛋白浓度测定试剂盒(碧云天生物技术公司,中国)测定蛋白质含量,加入5×蛋白加样缓冲液,95 ℃金属浴5 min,离心。将组织蛋白提取液用聚丙烯酰胺凝胶电泳分离,通过转膜移至0.45 μm PVDF膜上,于5%脱脂奶粉TBST缓冲液中室温封闭1 h,在4 ℃中一抗孵育过夜,二抗为室温孵育1 h,用ECL试剂(碧云天生物技术公司,中国)进行显影得到相应条带。使用image J软件对条带进行量化。抗体信息如下:S6 (Cat.no.2217), Phospho-S6 (Ser235/236) (Cat.no.4856)购买于Cell Signaling Technology公司;anti-GAPDH (Cat.no. AB-P-R 01)购买于Goodhere Biotechnology公司。
1.6 抗氧化及非特异性免疫酶活力分析凡纳滨对虾血淋巴用于测定过氧化氢酶(Catalase,CAT)、总抗氧化能力(Total antioxidant capacity,T-AOC)、酸性磷酸酶(Acid phosphatase,ACP)、碱性磷酸酶(Alkaline phosphatase,AKP)、酚氧化酶(Polyphenol oxidase,PPO);肝胰腺用于测定过氧化氢酶(CAT)、总抗氧化能力(T-AOC)、还原性谷胱甘肽(Glutathione,GSH)、丙二醛(Malondialdehyde,MDA)、酚氧化酶(PPO)。上述非特异性免疫指标均采用南京建成生物公司的试剂盒进行测定,实验步骤严格参照说明书进行,所有实验步骤均在冰上进行检测。
1.7 RNA提取和实时定量PCR本实验检测了凡纳滨对虾肝胰腺中免疫基因的表达量,使用碧云天RNAeasyTM动物RNA抽提试剂盒(RNAeasyTM Small RNA Isolation Kit with Spin Column)。采用NanoDrop2000超微量分光光度计(Thermo)测量RNA浓度,以确保后续实验的正常使用。根据反转录试剂盒的操作说明将RNA反转为cDNA,反转后统一用DEPC水将浓度调至200 ng/μL,保存至-80 ℃冰箱备用。引物购自生工生物工程(上海)股份有限公司,序列见表 3。反应体系为20 μL,其中TB Green Premix Ex Taq Ⅱ 10 μL,上下游引物各0.5 μL,2 μL cDNA溶液以及7 μL DEPC水。实时定量PCR仪为Mastercycler ep realplex (Eppendorf,Germany)。扩增程序为95 ℃预变性20 s,39个循环(95 ℃ 15 s; 57~58 ℃ 15 s; 72 ℃ 30 s)。使用2-ΔΔct法计算基因表达量,以β-actin作为内参基因,以Con组为1.0进行归一化处理。
|
|
表 3 实时荧光定量PCR引物序列 Table 3 Primer sequences used for quantitative real-time PCR |
凡纳滨对虾的生长指标和饲料利用指标的计算公式如下:
增重率(Weight gain rate,WGR)=(终末虾体质量-初始虾体质量)/初始体质量×100%;
特定生长率(Specific growth rate,SGR)=(ln终末虾体质量-ln初始虾体质量)/养殖天数×100%;
饲料系数(Feed conversion ratio,FCR)=总摄食量(g)/虾体湿增重(g);
蛋白质效率(Protein efficiency ratio,PER)=虾体湿增重(g)/蛋白质摄入量(g);
存活率(Survival rate,SR)=(终末尾数/初始尾数)×100%。
实验数据用平均值±标准误(mean±SE)表示,使用IBM SPSS Statistics 26软件对所得数据进行单因素方差(ANOVA)检验分析。若处理间有显著差异,再作Tukey’s检验进行多重比较,以P<0.05表示差异性显著,以P<0.01表示差异极显著。
2 结果 2.1 生长性能与饲料利用经过56 d的养殖实验,得到凡纳滨对虾生长性能数据,数据如表 4所示。表 4显示,亮氨酸组对虾存活率(SR)显著高于雷帕霉素组(P < 0.05),但与对照组均无显著差异(P>0.05)。与对照组相比,添加亮氨酸后极显著增加了对虾特定生长率(P < 0.01),而与对照组相比,添加雷帕霉素后极显著降低了其特定生长率(P < 0.01)。亮氨酸组增重率、蛋白质效率均显著高于雷帕霉素组(P < 0.05),饲料系数显著低于雷帕霉素组(P < 0.05),但与对照组差异不显著(P>0.05)。
|
|
表 4 mTOR信号通路对凡纳滨对虾生长性能和饲料利用的影响 Table 4 Effects of mTOR signaling pathway on growth performance and feed utilization of Litopenaeus vannamei |
凡纳滨对虾体组成如表 5所示。饲料中添加亮氨酸和雷帕霉素后虾体水分、灰分各组间无明显差异(P>0.05)。亮氨酸组粗蛋白含量显著高于雷帕霉素组(P < 0.05),但与对照组差异不显著(P>0.05)。亮氨酸组粗脂肪含量显著低于雷帕霉素组(P < 0.05)。
|
|
表 5 mTOR信号通路对凡纳滨对虾体组成的影响 Table 5 Effects of mTOR signaling pathway on body composition of Litopenaeus vannamei |
本研究通过检测凡纳滨对虾摄食后肌肉中S6蛋白的磷酸化水平来监测摄食后mTOR信号通路的活性变化。如图 1所示,对虾肌肉S6蛋白的磷酸化水平在摄食后1 h激活程度最强,2 h激活程度逐渐减弱,6 h信号激活程度最弱。且亮氨酸组在摄食后1 h肌肉S6蛋白的磷酸化水平显著高于对照组,雷帕霉素组在摄食后1 h肌肉S6蛋白的磷酸化水平显著低于对照组(P < 0.05)。
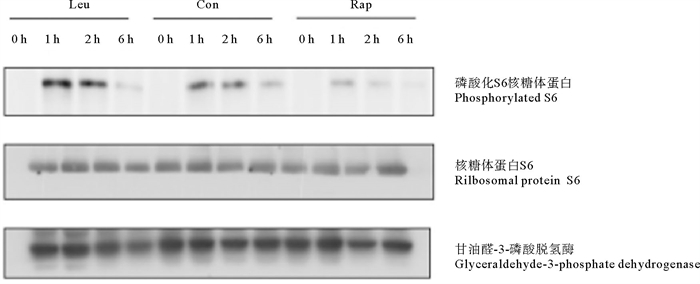
|
图 1 凡纳滨对虾肌肉S6、Phospho-S6相对蛋白水平随时间的变化 Fig. 1 Changes of S6 and Phospho-S6 relative protein levels in muscle of Litopenaeus vannamei over time |
饲料中添加亮氨酸和雷帕霉素对凡纳滨对虾血淋巴抗氧化及非特异性免疫酶活力的影响如表 6所示。其中,亮氨酸组CAT、T-AOC酶活力显著高于雷帕霉素组(P < 0.05),但与对照组差异不显著(P>0.05)。亮氨酸组ACP、PPO酶活力显著高于对照组(P < 0.05),雷帕霉素组ACP、PPO酶活力有降低趋势,但与对照组差异不显著(P>0.05)。雷帕霉素组AKP酶活力显著低于亮氨酸组和对照组(P < 0.05),而亮氨酸组中AKP酶活力虽有上升趋势,但与对照组差异不显著(P>0.05)。
|
|
表 6 mTOR信号通路对凡纳滨对虾血淋巴抗氧化及非特异性免疫酶活力的影响 Table 6 Effects of mTOR signaling pathway on antioxidant and non-specific immunoenzyme activities in hemolymph of Litopenaeus vannamei |
饲料中添加亮氨酸和雷帕霉素对凡纳滨对虾肝胰腺抗氧化及非特异性免疫酶活力的影响如表 7所示。与对照组相比,饲料中添加亮氨酸显著提高了凡纳滨对虾肝胰腺CAT、T-AOC和PPO酶活力(P < 0.05),饲料中添加雷帕霉素后CAT、T-AOC和PPO酶活力呈降低趋势,但与对照组差异不显著(P>0.05)。亮氨酸组MDA含量显著低于雷帕霉素组(P < 0.05)。各组间GSH酶活力无显著差异(P>0.05)。
|
|
表 7 mTOR信号通路对凡纳滨对虾肝胰腺抗氧化及非特异性免疫酶活力的影响 Table 7 Effects of mTOR signaling pathway on antioxidant and non-specific immunoenzyme activities in hepatopancrea of Litopenaeus vannamei |
凡纳滨对虾各组肝胰腺免疫基因Relish、Hsp70、Lysozyme、C-MnSOD、Lectin、CTL、JAK表达水平如图 2所示。图 2显示,饲料中添加亮氨酸后Lysozyme、C-MnSOD、Lectin相对表达量显著高于对照组(P < 0.05),而雷帕霉素组与对照组差异不显著(P>0.05)。亮氨酸组中Relish、Hsp70相对表达量有上升趋势,但与对照组差异不显著(P>0.05),雷帕霉素组Relish、Hsp70相对表达量显著低于对照组(P < 0.05)。亮氨酸组中CTL相对表达量显著高于雷帕霉素组(P < 0.05),但均与对照组差异不显著(P>0.05)。各组间JAK相对表达量无明显差异(P>0.05)。
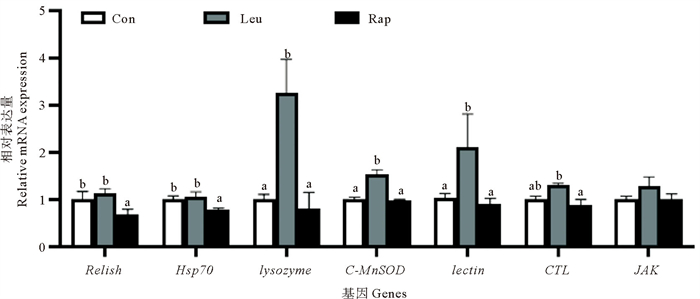
|
(Relish:NF-κB家族的成员基因;Hsp70:热休克70 kDa蛋白基因;Lysozyme:溶菌酶基因;C-MnSOD:胞质型超氧化物歧化酶基因;Lectin:凝集素基因;CTL:多糖结合蛋白C型凝集素基因;JAK:细胞质非受体酪氨酸激酶基因。Relish: A member of the NF-κB family gene; Hsp70: Heat shock 70 kDa protein gene; Lysozyme: Lysozyme gene; C-MnSOD: Cytoplasmic superoxide dismutase gene; Lectin: Lectin gene; CTL: Polysaccharide binding protein C-type lectin gene; JAK: Janus activated kinase gene.) 图 2 mTOR信号通路对凡纳滨对虾肝胰腺免疫相关基因表达量的影响 Fig. 2 Effects of mTOR signaling pathway on hepatopancreas immune-related gene expression in Litopenaeus vannamei |
餐后代谢反应是一个重要的步骤,它确定了如何有效地利用蛋白质[14]。餐后会加快肌肉中蛋白质合成速度。在营养物质的刺激下,细胞内蛋白质合成能力的提高通过营养感知途径调控mRNA的翻译[15],mTOR在这一过程中起到关键作用。mTOR信号通路整合了多种环境信号因子,包括压力、氧含量、生长因子、氨基酸浓度、能量水平等,在生长和代谢过程中发挥核心作用[15]。亮氨酸是有效激活mTORC1的氨基酸之一。S6是mTOR下游的效应分子,其磷酸化水平可以反映mTOR激活情况。在本研究中通过检测凡纳滨对虾摄食后肌肉S6蛋白的磷酸化水平来评估蛋白质合成效果。结果表明,凡纳滨对虾肌肉中mTOR信号通路中S6蛋白的磷酸化水平在摄食后1 h激活程度最强,并且亮氨酸组mTOR信号通路激活程度显著高于雷帕霉素组。上述结果表明,摄食后1 h亮氨酸组凡纳滨对虾肌肉mTOR被有效激活,饲料中添加亮氨酸可提高凡纳滨对虾肌肉S6的磷酸化水平,这与之前的学者在虹鳟上的研究结果一致,即虹鳟摄食高蛋白饲料后其肌肉mTOR信号通路中关键蛋白质的磷酸化程度明显升高[16]。而饲料中添加雷帕霉素起到相反的作用,相似的实验结果在大菱鲆上也已得到验证,即摄食添加雷帕霉素的饲料的大菱鲆,餐后mTOR信号通路激活程度减弱,同时生长性能和饲料效率也得到抑制[17]。上述实验结果表明,饲料中添加亮氨酸后可以有效激活mTOR信号通路,进而提升凡纳滨对虾肌肉蛋白质合成速率,而饲料中添加雷帕霉素后会抑制mTOR信号通路,降低对虾肌肉蛋白质合成速率。
3.2 mTOR信号通路对凡纳滨对虾生长、饲料利用和体组成的影响本实验通过在凡纳滨对虾饲料中添加亮氨酸和雷帕霉素进行了为期56 d的养殖实验。研究结果表明,饲料中添加亮氨酸后,凡纳滨对虾的增长率、存活率、特定生长率等相关生长性能均有所提高。这与之前在半滑舌鳎(Cynoglossus semilaevis)[18]、异育银鲫(Carassius auratus gibelio)[19]、卵形鲳鲹(Trachinotus ovatus)[20]等多种鱼类上的研究结果相似。这一现象的产生可以归因于亮氨酸激活了mTOR信号通路,从而调节了蛋白质的合成功能。而雷帕霉素作为已被证实的mTOR信号通路特异性抑制剂,能够阻断并抑制多种信号转导途径,从而减缓动物生长发育速度[21]。在本研究中也得到了相似的研究结果,雷帕霉素组相对于亮氨酸组显著降低了凡纳滨对虾的生长性能,对虾增重率、存活率、特定生长率等相关生长指标均被抑制。本实验中,饲料中添加亮氨酸后,凡纳滨对虾的饲料系数有所降低,饲料利用率得到提升,同时蛋白质效率也得到有效提高,这与Wei等人在饲料中添加最适浓度的亮氨酸在凡纳滨对虾上的研究结果一致[10]。雷帕霉素组与之均呈现相反的趋势。研究表明,亮氨酸可以通过激活mTOR信号通路有效提升水产动物生长性能,而雷帕霉素通过抑制mTOR信号通路从而对水产动物生长发育过程起到抑制作用。水产动物体组成含量变化在一定程度上映射了动物的生长发育情况,本实验中通过在饲料中添加亮氨酸和雷帕霉素探究对凡纳滨对虾体组成的影响。亮氨酸组虾体的粗蛋白含量虽有所提高,但与对照组相比差异不显著,这与在太平洋白虾上的研究结果相类似[22]。而饲料中添加雷帕霉素后,TOR信号通路被抑制,从而呈现出相反的趋势。此外,在本实验结果显示,亮氨酸组虾体粗脂肪含量显著低于雷帕霉素组,这与López等人用添加亮氨酸饲料喂养泌乳大鼠后得到的结果相类似,即饲料中添加亮氨酸会影响动物的体组成,降低脂肪含量[23]。而雷帕霉素可能会产生脂代谢紊乱等副作用,但本实验结果仅显示雷帕霉素组虾体的脂肪含量升高,并未造成明显的不良影响。
3.3 mTOR信号通路对凡纳滨对虾抗氧化及非特异性酶活力的影响甲壳动物不具有特异性免疫系统,因此必须依靠有效的先天免疫防御来保护它们免受外来入侵者的侵害[24]。研究表明,甲壳动物的非特异免疫是有效抵御病原体的一道重要防线[24]。肝胰腺是甲壳动物体内最主要的器官之一,其功能和生理生化性质受到多种因素影响,具有消化吸收、脂肪贮备、营养物质转化和解毒等重要功能[25]。与此同时,病菌、重金属等众多外界因素也会对这些功能产生影响,如果这些功能不能发挥正常的生理作用,就会引发一系列的病理反应。此外,对虾的血淋巴也是重要的免疫体液[26]。因此,研究凡纳滨对虾血淋巴和肝胰腺中免疫和抗氧化酶活力具有十分重要的研究价值。酸性磷酸酶(ACP)与碱性磷酸酶(AKP)在调节磷酸基团的催化、代谢、水解等过程中起重要作用[27-28],对于评估水产动物的免疫性能具有重要的意义。在本研究中饲料中添加亮氨酸后有效提升凡纳滨对虾血淋巴中ACP、AKP活力,这与之前的学者在凡纳滨对虾饲料中添加适宜浓度的蛋氨酸得到了类似的研究结果[29]。总抗氧化能力(T-AOC)和过氧化氢酶(CAT)是虾类中主要的抗氧化酶,它们在清除体内多余自由基方面发挥着重要的作用,是抗氧化系统的关键组成部分[30]。此外,谷胱甘肽酶系统能够活化多种酶,进而影响糖、脂肪和蛋白质的代谢,从而保护器官和组织免受损伤。PPO是由酚氧化酶原激活系统(proPO system)产生的,其作为一种非自我识别系统,通过血细胞吸引和诱导吞噬、黑化、细胞毒性反应物的产生以及颗粒包被等方式参与先天免疫应答,在甲壳动物防御过程中起到至关重要作用[31-32]。丙二醛(MDA)作为一种间接反应机体氧化损伤的指标,可以评估机体氧化损伤和ROS的生成程度[33]。在本研究中,在饲料中添加1%亮氨酸增强了凡纳滨对虾血淋巴及肝胰腺中T-AOC、CAT等非特异性免疫酶活力,同时降低了丙二醛含量,这在多种鱼类上均得到了相似的研究结果[34-36]。此外,有学者研究发现最佳水平的亮氨酸可以改善梭子蟹(Portunus trituberculatus)的生长性能和抗氧化状态[37],这与Wei等人在凡纳滨对虾上的研究结果一致[10]。因此,本研究表明,在饲料中添加亮氨酸可以有效提高凡纳滨对虾等甲壳水产动物的抗氧化能力和免疫应答水平,这一结果与在鱼类上的研究结果相类似。然而,雷帕霉素组则呈现出相反的趋势。虽然对虾肝胰腺中的丙二醛含量有所提高,但与对照组相比差异不显著。这表明,饲料中添加雷帕霉素虽然降低了凡纳滨对虾的抗氧化能力和非特异性免疫酶活力,但并未导致严重的氧化损伤。
3.4 mTOR信号通路对凡纳滨对虾免疫相关基因表达水平的影响甲壳动物通过先天性免疫系统识别外来物质从而免受外界病原体的侵害[38],其机体中存在着一系列受到外界病原体刺激的防御机制。溶菌酶具有溶解细菌细胞壁的作用,是机体免疫系统中不可缺少的一部分[39],已有学者研究表明可以通过溶菌体膜稳定性和溶菌酶活力来评价对虾的免疫状态[40]。C-MnSOD可以保护机体免受氧化损伤、清除体内自由基,是甲壳动物体内第一道防线[41]。Lectin因其能凝集红血球,得名为凝集素,目前已有多种凝集素被报道在植物中参与免疫反应,有关凝集素参与甲壳动物免疫反应过程还知之甚少[42]。在本研究中,亮氨酸组中凡纳滨对虾肝胰腺Lysozyme、C-MnSOD、Lectin的相对表达量显著高于对照组,这与在饲料中添加蛋氨酸对凡纳滨对虾免疫相关基因表达量的变化相类似[29]。而雷帕霉素组Lysozyme、C-MnSOD、Lectin表达量均呈下降趋势。Hsp70是一种重要的分子伴侣蛋白,它位于分子伴侣网络的中心,与其他分子伴侣协作,共同维护细胞内蛋白稳态,维护机体的正常生理功能[43]。CTL(C-type lectin)作为一类模式受体,其主要功能是与病原体表面碳水化合物结合,从而激活对虾先天免疫反应[44]。核转录因子NF-κB在甲壳动物机体免疫反应中起着关键作用,而Relish是NF-κB的成员。本研究中,亮氨酸组中Relish、Hsp70、CTL基因均有上调趋势,而雷帕霉素组中则呈下降趋势,这在鱼类上也得到了相似的研究结果[45-46]。JAK(Janus kinase)是一类蛋白酪氨酸激酶,该蛋白可以通过与其配体结合而被激活,继而激活“信号传导与转录激活因子”,调控靶基因的表达,具有免疫调节作用。但在本研究中各组JAK表达量无明显差异,这可能是由于养殖环境、饲料配方等条件不同造成的。因此本实验研究结果表明,饲料中添加亮氨酸后可以有效提升凡纳滨对虾免疫相关基因表达水平,调节机体免疫能力,添加雷帕霉素后对凡纳滨对虾免疫能力起到抑制作用。
4 结语饲料中添加亮氨酸可有效激活mTOR信号通路,从而,提高了凡纳滨对虾生长性能,提高了对虾血淋巴和肝胰腺中抗氧化和非特异性免疫酶活力,提高了肝胰腺中免疫相关基因表达水平,且亮氨酸作为化学信使可有效激活mTOR信号通路,从而促进对虾肌肉蛋白质合成。而饲料中添加雷帕霉素则会抑制mTOR,从而对凡纳滨对虾的生长、免疫功能、蛋白质合成起到抑制作用。从分子水平上探索凡纳滨对虾的生长、营养感知及代谢调控机理,可以更好地调节饲料利用和动物生长性能,该研究可为甲壳水产动物精准营养研究提供新的方向和思路。
| [1] |
Guertin D A, Sabatini D M. Defining the role of mTOR in cancer[J]. Cancer Cell, 2007, 12(1): 9-22. (  0) 0) |
| [2] |
Saxton R A, Sabatini D M. mTOR signaling in growth, metabolism, and disease[J]. Cell, 2017, 168(6): 960-976. (  0) 0) |
| [3] |
Kim E, Goraksha-Hicks P, Li L, et al. Regulation of TORC1 by rag GTPases in nutrient response[J]. Nature Cell Biology, 2008, 10(8): 935-945. (  0) 0) |
| [4] |
Wilson R P. Amino acids and proteins[M]//Fish Nutrition. [S. l. ]: Academic Press, 2003: 143-179.
(  0) 0) |
| [5] |
Zhang Y, Wang P, Lin S, et al. mTORC1 signaling-associated protein synthesis in porcine mammary glands was regulated by the local available methionine dependingonmethionine sources[J]. Amino Acids, 2018, 50: 105-115. (  0) 0) |
| [6] |
Ahmad I, Ahmed I, Fatma S, et al. Role of branched-chain amino acids on growth, physiology and metabolism of different fish species: A review[J]. Aquaculture Nutrition, 2021, 27(5): 1270-1289. (  0) 0) |
| [7] |
Zhou Z, Wang X, Wu X, et al. Effects of dietary leucine levels on growth, feed utilization, neuro-endocrine growth axis and TOR-related signaling genes expression of juvenile hybrid grouper (Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂)[J]. Aquaculture, 2019, 504: 172-181. (  0) 0) |
| [8] |
Xia Y, Sun M, Xie Y, et al. mTOR inhibition rejuvenates the aging gingival fibroblasts through alleviating oxidative stress[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017: 6292630. (  0) 0) |
| [9] |
陈永康, 郑朝中, 章双, 等. 黑水虻幼虫粉对凡纳滨对虾生长、免疫和脂质代谢的影响[J]. 水生生物学报, 2023, 47(2): 269-278. Chen Y K, Zheng C Z, Zhang S, et al. Effects of larval meal of Tabanus melanopter on growth, immunity and lipid metabolism of Litopenaeus vannamei[J]. Chinese Journal of Hydrobiology, 2023, 47(2): 269-278. (  0) 0) |
| [10] |
Wei Z L, Zhuang Y T, Liu X T, et al. Leucine promotes protein synthesis of juvenile white shrimp Litopenaeus vannamei through TOR signaling pathway[J]. Aquaculture, 2023(564): 739060. (  0) 0) |
| [11] |
田原, 刘成栋, 王旋, 等. 低蛋白饲料添加亮氨酸、精氨酸对大菱鲆幼鱼生长、消化、免疫及mTOR信号通路的影响[J]. 中国海洋大学学报(自然科学版), 2019, 54(5): 33-43. Tian Y, Liu C D, Wang X, et al. Effects of low protein diet supplemented with leucine and arginine on growth, digestion, immunity and mTOR signaling pathway of juvenile Turbot[J]. Periodical of Ocean University of China, 2019, 54(5): 33-43. (  0) 0) |
| [12] |
Wang Q, He G, Mai K, et al. Chronic rapamycin treatment on the nutrientutilizationand metabolism of juvenile turbot (Psetta maxima)[J]. Scientific Reports, 2016, 6(1): 28068. (  0) 0) |
| [13] |
Cunniff P. Official methods of analysis of AOAC International, method 923.03[J]. Trends in Food Science & Technology, 1995, 6(11): 382. (  0) 0) |
| [14] |
Bos C, Metges C C, Gaudichon C, et al. Postprandial kinetics of dietary amino acds are the main determinant of their metabolism after soy or milk protein ingestion in humans[J]. Journal of Nutrition, 2003, 133(5): 1308-1315. (  0) 0) |
| [15] |
Dickinson J M, Fry C S, Drummond M J, et al. Mammalian target of rapamycin complex 1 activation is required for the stimulation of human skeletal muscle protein synthesis by essential amino acids[J]. Journal of Nutrition, 2011, 141(5): 856-862. (  0) 0) |
| [16] |
Seiliez I, Stéphane P, Lansard M, et al. Dietary carbohydrate-to-protein ratio affects TOR signaling and metabolism-related gene expression in the liver and muscle of rainbow trout after a single meal[J]. AJP Regulatory Integrative and Comparative Physiology, 2011, 300(3): 733-743. DOI:10.1152/ajpregu.00579.2010 (  0) 0) |
| [17] |
Song F, Xu D, Mai K, et al. Comparative study on the cellular and systemicnutrientsensing and intermediary metabolism after partial replacementof fishmeal by meat andbone meal in the diet of turbot (Scophthalmus maximus L.)[J]. PLoS One, 2016, 11(11): e0165708. DOI:10.1371/journal.pone.0165708 (  0) 0) |
| [18] |
Liu J, Mai K, Xu W, et al. Effects of dietary glutamine on survival, growth performance, activities of digestive enzyme, antioxidant status and hypoxia stress resistance of half-smooth tongue sole (Cynoglossus semilaevis Günther) post larvae[J]. Aquaculture, 2015, 446: 48-56. DOI:10.1016/j.aquaculture.2015.04.012 (  0) 0) |
| [19] |
Zou T, Cao S P, Xu W J, et al. Effects of dietary leucine levels on growth, tissue protein content and relative expression of genes related toproteinsynthesis in juvenile gibel carp (Carassius auratus gibelio var. CAS Ⅲ)[J]. Aquaculture Research, 2018, 49(6): 2240-2248. DOI:10.1111/are.13682 (  0) 0) |
| [20] |
Tan X, Lin H, Huang Z, et al. Effects of dietary leucine on growth performance, feed utilization, non-specific immune responses and gut morphology of juvenile golden pompano Trachinotus ovatus[J]. Aquaculture, 2016, 465: 100-107. DOI:10.1016/j.aquaculture.2016.08.034 (  0) 0) |
| [21] |
Kim D H, Sabatini D M. Raptor and mTOR: Subunits of a nutrient-sensitive complex[J]. Current Topics in Microbiology and Immunology, 2004(279): 259-270. (  0) 0) |
| [22] |
Liu F, Liu Y, Tian L, et al. Quantitative dietary isoleucine requirement of juvenile Pacific white shrimp, Litopenaeus vannamei (Boone) reared in low-salinity water[J]. Aquaculture International, 2014, 22(4): 1481-1497. DOI:10.1007/s10499-014-9761-y (  0) 0) |
| [23] |
López N, Sánchez J, Picó C, et al. Dietary l-leucine supplementation of lactating rats results in a tendency to increase lean/fat ratio associated to lower orexigenic neuropeptide expression in hypothalamus[J]. Peptides, 2010, 31(7): 1361-1367. DOI:10.1016/j.peptides.2010.03.028 (  0) 0) |
| [24] |
Zhang Q, Li F, Zhang X, et al. cDNA cloning, characterization and expression analysis of the antioxidant enzyme gene, catalase, of Chinese shrimp Fenneropenaeus chinensis[J]. Fish & Shellfish Immunology, 2008, 24(5): 584-591. (  0) 0) |
| [25] |
Duan Y, Liu P, Li J, et al. Molecular responses of calreticulin gene to Vibrio anguillarum and WSSV challenge in the ridgetail white prawn Exopalaemon carinicauda[J]. Fish & Shellfish Immunology, 2014, 36(1): 164-171. (  0) 0) |
| [26] |
Reddy, Naik M G, Annappaswamy. Evaluation of the dietary essentiality of vitamins for Penaeus monodon[J]. Aquaculture Nutrition, 1999, 5(4): 267-275. (  0) 0) |
| [27] |
尹森. 镜鲤酸性磷酸酶和碱性磷酸酶的QTL分析[D]. 上海: 上海海洋大学, 2012. Yin S. QTL Analysis of Acid Phosphatase and Alkaline Phosphatase in Mirror Carp(Cyprinus carpio)[D]. Shanghai: Shanghai Ocean University, 2012. (  0) 0) |
| [28] |
Song S K, Beck B R, Kim D, et al. Prebiotics as immunostimulants in aquaculture: A review[J]. Fish & Shellfish Immunology, 2014, 40(1): 40-48. (  0) 0) |
| [29] |
Lu J, Zhang X, Zhou Q, et al. Dietary DL-methionyl-DL-methionine supplementation could improve growth performance under low fishmeal strategies by modulating TOR signalling pathway of Litopenaeus vannamei[J]. Aquaculture Nutrition, 2021, 27(6): 1921-1933. DOI:10.1111/anu.13329 (  0) 0) |
| [30] |
Fang Y Z, Yang S, Wu G, et al. Free radicals, antioxidants and nutrition[J]. Nutrition, 2002, 18(10): 872-879. DOI:10.1016/S0899-9007(02)00916-4 (  0) 0) |
| [31] |
Nappi A J, Christensen B M. Melanogenesis and associated cytotoxic reactions: Applications to insect innate immunity[J]. Insect Biochemistry and Molecular Biology, 2005, 35(5): 443-459. (  0) 0) |
| [32] |
Cerenius L, Lee B L, Söderhäll K. The proPO-system: Pros and cons for its role in invertebrate immunity[J]. Trends in Immunology, 2008, 29(6): 263-271. (  0) 0) |
| [33] |
Daniels C L, Merrifield D L, Boothroyd D P, et al. Effect of dietary Bacillus spp. and mannan oligosaccharides (MOS) on European lobster (Homarus gammarus L.) larvae growth performance, gut morphology and gut microbiota[J]. Aquaculture, 2010, 304(1-4): 49-57. (  0) 0) |
| [34] |
Giri S S, Sen S S, Chi C, et al. Effect of dietary leucine on the growth parameters and expression of antioxidant, immune, and inflammatory genes inthe head kidney of Labeo rohita fingerlings[J]. Vet Immunol Immunopathol, 2015, 167(1-2): 36-43. (  0) 0) |
| [35] |
Jiang W D, Deng Y P, Liu Y, et al. Dietary leucine regulates the intestinal immune status, immune-related signalling molecules and tight junctiontranscript abundance ingrass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2015, 444: 134-142. (  0) 0) |
| [36] |
Wu C, Chen L, Lu Z, et al. The effects of dietary leucine on the growthperformances, bodycomposition, metabolic abilities and innate immune responses in black carp Mylopharyngodon piceus[J]. Fish & Shellfish Immunology, 2017, 67: 419-428. (  0) 0) |
| [37] |
Huo Y W, Jin M, Sun P, et al. Effect of dietary leucine on growth performance, hemolymph and hepatopancreas enzyme activities of swimming crab, Portunus trituberculatus[J]. Aquaculture Nutrition, 2017, 23(6): 1341-1350. (  0) 0) |
| [38] |
Johansson M W, Söderhäll K. The prophenoloxidase activating system andassociated proteins in invertebrates[J]. Invertebrate Immunology, 1996, 15: 46-66. (  0) 0) |
| [39] |
Alexander J B, Ingram G A. Noncellular nonspecific defence mechanismsof fish[J]. Annual Review of Fish Diseases, 1992, 2(1): 249-279. (  0) 0) |
| [40] |
Yao C L, Wu C G, Xiang J H, et al. The lysosome and lysozyme response in Chinese shrimp Fenneropenaeus chinensis to Vibrio anguillarum and laminarin stimulation[J]. Journal of Experimental Marine Biology and Ecology, 2008, 363(1-2): 124-129. (  0) 0) |
| [41] |
Fattman C L, Schaefer L M, Oury T D. Extracellular superoxide dismutase in biology and medicine[J]. Free Radical Biology and Medicine, 2003, 35(3): 236-256. (  0) 0) |
| [42] |
Dodd R B, Drickamer K. Lectin-like proteins in model organisms: Implications for evolution of carbohydrate-binding activity[J]. Glycobiology, 2001, 11(5): 71-79. (  0) 0) |
| [43] |
张翔, 王祖峰. 分子伴侣Hsp70变构机制及其在水生动物中的应用研究进展[J]. 大连海洋大学学报, 2022, 37(4): 12. Zhang X, Wang Z F. Research progress on allosteric mechanism of chaperone Hsp70 and its application in aquatic animals[J]. Journal of Dalian Ocean University, 2022, 37(4): 12. (  0) 0) |
| [44] |
Huang Y H, Kumar R, Liu C H, et al. A novel C-type lectin LvCTL 4.2 has antibacterial activity but facilitates WSSV infection in shrimp (Litopenaeus vannamei)[J]. Developmental & Comparative Immunology, 2022, 126: 104239. (  0) 0) |
| [45] |
Liu G Y, Sabatini D M. mTOR at the nexus of nutrition, growth, ageing and disease[J]. Nature Reviews Molecular Cell Biology, 2020, 21(4): 183-203. (  0) 0) |
| [46] |
Seiliez I, Gabillard J C, Skiba-Cassy S, et al. An in vivo and in vitro assessment of TOR signaling cascade in rainbow trout (Oncorhynchus mykiss)[J]. American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2008, 295(1): 329-335. (  0) 0) |
 2025, Vol. 55
2025, Vol. 55


