眼睛的结构复杂且高度特化,是人类不可或缺的视觉器官。光线需穿过角膜、前房、瞳孔、晶状体,最终到达视网膜,由视网膜神经节细胞将视觉信号传递到大脑。这一过程中,多种细胞相互协作并受到严格调控[1]。在致病因子的胁迫下,任何一种细胞出现功能障碍,均可能导致可逆性或不可逆的视力损伤,严重时甚至致盲。据统计,2020年全球有3亿人患有视力障碍甚至失明相关疾病,其中大多数患者的年龄超过50岁[2]。据世界卫生组织报告,导致视力障碍的常见眼部疾病包括年龄相关性黄斑变性(Age-related macular degeneration,AMD)、糖尿病视网膜病变(Diabetic retinopathy,DR)、青光眼、干眼症、白内障和葡萄膜炎等,其病理机制主要涉及氧化损伤、新血管生成、炎症反应和细胞死亡等[3]。鉴于眼部疾病具有高遗传性和多因素诱发的特点,传统的手术治疗存在创伤性,而现有的药物治疗受药源限制,致使眼部疾病的防治仍面临巨大挑战[4-5]。因此,寻找新药源并开发出安全有效的新型药物,对于眼部疾病的临床治疗至关重要。
海洋约占地球生物资源的80%,是一个富含多种生物活性物质的广袤且尚未充分开发的宝库,为应对当前和未来的疾病和亚健康提供新的药源。自1970年以来,在海洋生物中发现了大量具有生物活性的新型化合物,这些化合物展现出作为多种疾病治疗药物的巨大潜力[6]。海洋生物长期生存于低温、高盐、高压及缺氧的特殊环境中,在进化过程中发生了一系列适应性的改变,进化产生了许多结构独特、丰富多样的生物活性物质,被称为海洋天然产物(Marine natural products, MNPs)[6]。MNPs是海洋动物、植物和微生物产生的化合物,可用于癌症、心血管疾病和神经系统等疾病的治疗[7]。近期研究报道证实,MNPs具有抗氧化、抗炎症、抗血管生成和细胞保护等生物学活性,有望在眼科疾病的预防和治疗中发挥出重要作用[8]。本文综合阐述了MNPs的来源及其类别、MNPs的生物学活性、眼部疾病的发病机理以及MNPs在眼部疾病应用中的研究进展,并展望了MNPs作为新型药源在治疗眼部疾病中的应用前景。
1 海洋天然产物的类别及其来源MNPs主要来源于海洋动物、植物和微生物,海洋生物为适应其独特的生存环境,产生了各种各样的初级和次级代谢产物。目前,在海水鱼类、海绵、珊瑚、藻类及海洋微生物中已开发出多种MNPs,包括生物碱、多酚、萜类、多肽、多糖和多不饱和脂肪酸等,并已被证明具有多种生物学活性,如抗癌、抗炎、抗氧化、抗血管生成、抗病毒、镇痛、免疫调节、细胞保护和神经保护等[9]。
海洋生物碱作为一种重要的MNPs,主要包括吲哚类、卤代吲哚类、吡咯类、苯乙胺类和其他生物碱,广泛来源于软体动物、海绵、海鞘、藻类、真菌和放线菌等生物。这些生物碱具有显著的抗炎、抗氧化、抗菌、抗癌和抗疟疾等生物学活性[10]。
海洋多酚主要包括酚酸、类黄酮、单宁、儿茶素、花青素、木质素和没食子酸,主要来源于藻类、海草和红树林等海洋植物中。已有研究表明,多酚化合物具有抗氧化、抗炎、抗癌、抗病毒、抗菌、抑制血小板聚集和金属螯合作用等多种生物学活性,在癌症、冠心病和神经退行性疾病等疾病中发挥重要作用[11-12]。
海洋萜类是含有异戊二烯的烯烃化合物,包括单萜、倍半萜、二萜、三萜、四萜(类胡萝卜素)和多萜,主要存在于软体动物、海绵、珊瑚和藻类中。与陆生萜类化合物不同的是,海洋萜类通常是卤代、含氮或含硫的化合物,这极大地增加了它们的分子多样性,从而也表现出多种多样的生物活性,如抗癌、抗病毒、抗菌、抗氧化、抗炎、免疫调节、抗疟疾、抗寄生虫、保肝和血管保护等。目前,海洋萜类化合物已初步应用于眼部疾病、糖尿病、心血管疾病、口腔癌和结直肠癌等疾病的治疗研究中[13-14]。
海洋多肽包括短线性多肽、长线性多肽、环肽、双环肽、硫肽和四肽等,多来源于鱼类、虾类、软体动物、被囊动物、海绵、藻类和细菌中。海洋生物来源的多肽因其结构多样性而具有多重生物学功能,如抗氧化、抗菌、抗病毒、免疫调节、抗高血压、抗肥胖、抗糖尿病和降胆固醇等[15-16]。
海洋多糖主要来源于藻类,例如褐藻中的海藻酸盐和褐藻糖胶,红藻中的琼脂糖、卡拉胶和其他硫酸化多糖,以及绿藻中的石莼多糖。许多藻类多糖属于硫酸化多糖,如褐藻糖胶和卡拉胶,不同硫酸基团的修饰赋予其结构多样性,因此也表现出了多样的生物学活性,如抗凝血、抗血栓、抗病毒、抗癌、抗糖尿病、免疫调节、抗炎、降血脂和抗氧化等多种生物活性,同时还对对眼睛、皮肤、神经和心血管系统具有保护作用[17-18]。
海洋多不饱和脂肪酸是鱼类和藻类的重要结构成分,也是人体健康的必需脂肪酸。多不饱和脂肪酸(PUFA)主要包括Omega-3和Omega-6两大类。其中对Omega-3的研究较为深入。Omega-3包括二十碳五烯酸(Eicosapentaenoic acid, EPA)和二十二碳六烯酸(Docosahexenoic acid, DHA),是生物膜的基本结构成分,对正常的生长和发育至关重要。现已证明,Omega-3具有抗炎、抗氧化、抗血管生成、免疫调节、细胞保护以及神经保护等多种生物学活性,在预防和治疗心血管疾病、糖尿病、癌症、关节炎和自身免疫性疾病方面均具有显著的疗效。此外,它在保护视力和维护神经正常发育等方面也发挥着重要作用[19]。
2 海洋天然产物的生物学活性及其在眼部疾病中的应用由于海洋生物生存环境的特殊性,MNPs具有独特的不同于陆生天然产物的结构和生物学活性。近年来,国内、外药学家一直致力于MNPs候选药物的研发,越来越多的研究结果显示,MNPs在眼部疾病中也发挥着重要作用(见图 1)。因此,本文旨在对MNPs的抗氧化、抗炎、抗血管生成和细胞保护的生物学活性进行综述,并探讨其在眼部疾病中的作用机制[20]。
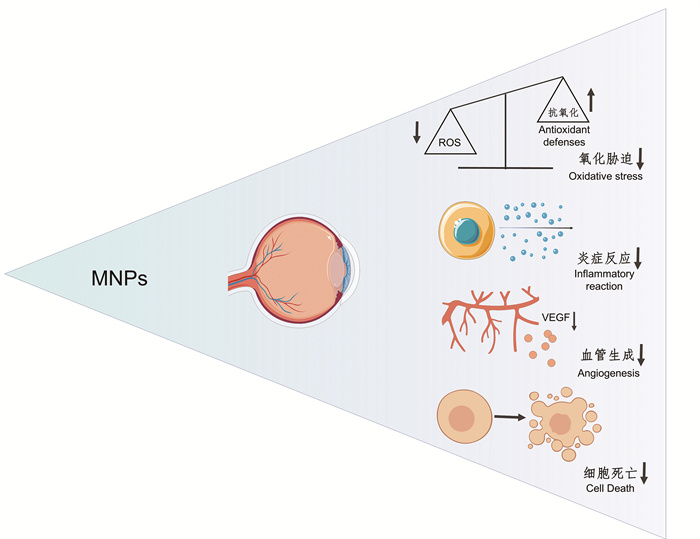
|
( MNPs:海洋天然产物;ROS:活性氧;VEGF:血管内皮生长因子。MNPs: Marine natural products; ROS: Reactive oxygen species; VEGF: Vascular endothelial growth factor. ) 图 1 MNPs在眼部疾病中的作用机制(改自Brillante等[20]) Fig. 1 Mechanism of action of MNPs in ocular diseases (Modified from Brillante et al[20]) |
氧化胁迫是细胞中活性氧(Reactive oxygen species,ROS)水平异常升高所引起的一种应激状态。在正常状态下,氧自由基参与基本的信号传导和免疫防御应答,以助机体对抗病原体的入侵。当氧化水平大于抗氧化水平时,胞内氧化还原失衡便会形成氧化胁迫(见图 1),产生的过量ROS会破坏蛋白质、脂质和DNA,引发自噬、凋亡和坏死,最终导致组织和器官功能障碍。大量研究证实了氧化胁迫是癌症、心血管疾病、神经退行性疾病、糖尿病和眼部疾病的主要诱因[21]。眼睛作为主要的光敏器官,直接受到外界光线的辐射,氧化胁迫产生的过量ROS将会导致细胞损伤和衰老,引起角膜变性、眼压升高(青光眼)、晶状体混浊(白内障)以及各种视网膜疾病(如AMD)等[22]。
鉴于化学抗氧化剂存在一些潜在的健康风险,人们开始在天然产物中寻找无健康风险的天然抗氧化剂,而MNPs因其具有独特的结构和卓越的抗氧化能力而备受关注。研究表明,从鱼类、藻类、海绵和微生物等海洋生物中分离出的MNPs及其代谢物表现出强大的抗氧化活性,其作用机制包括螯合金属离子、清除自由基和抑制脂质过氧化等多个方面[23]。
2.2 抗炎作用炎症是生物体对有害刺激(如过敏原和组织损伤)所做出的一系列复杂的免疫应答反应,对于保护机体免受病原体侵害、修复组织损伤和维持体内氧化还原平衡至关重要。然而,过度或失控的炎症反应可能会损伤宿主细胞和组织,引起许多疾病,如眼部疾病、类风湿性关节炎、哮喘、糖尿病和癌症等[24]。在许多眼部疾病中,细胞内、外的危险信号可破坏胞内稳态,促进炎症因子、趋化因子和基质金属蛋白酶(Matrix metalloproteinase, MMP)的分泌,最终形成慢性炎症和氧化胁迫之间的恶性循环。持续的炎症反应可导致细胞损伤、病理性新生血管形成、眼压升高以及随后的视力障碍[25]。
目前,虽然已有一些抗炎药物获得批准用于治疗相关疾病,但其治疗效果不理想,并常有许多副作用。因此,寻找安全、高效的新型抗炎药物对于眼部炎症及其他炎症相关疾病的临床治疗具有重要意义。有研究表明,从海洋生物中分离出的具有高效抗炎活性的MNPs在预防和治疗眼部疾病、类风湿性关节炎、哮喘、糖尿病和癌症中发挥重要作用,其独特抗炎作用的发挥途径包括调节细胞因子的产生和分泌、调节免疫细胞活化和分化、抑制免疫细胞浸润以及缓解氧化胁迫等[26-27]。这些发现为新型抗炎药物的研发提供了新的思路和方向。
2.3 抗血管生成作用血管生成是从原有血管上生长出新血管的过程,包括细胞外基质重塑、基底膜降解、内皮细胞增殖、细胞迁移和血管形成五个阶段。这一过程可以由生理需求(如伤口愈合、排卵、胚胎发生和胎儿发育等)和病理胁迫(如肿瘤、炎症性眼部疾病、牛皮癣、糖尿病和类风湿性关节炎等)所触发。在病理胁迫过程中,血管生成因子(如血管内皮生长因子(Vascular endothelial growth factor, VEGF))和抗血管生成因子之间的平衡被打破,导致新血管生成[28]。这种异常的血管生成是眼部疾病(如DR和湿性AMD)的主要病理特征之一。高血糖、氧化胁迫和缺氧等病理因素很可能造成眼表损伤,从而引发新血管生成和活化免疫细胞,诱发炎症级联反应,造成新血管生成和炎症反应的恶性循环,最终引起角膜透明度下降和视力丧失[29]。
临床上,针对病理性血管生成的主要治疗策略是使用抗VEGF药物。然而,目前的抗VEGF药物存在降解速率快和靶向性差的缺点,因此需要重复给药才能达到治疗效果。然而,抗VEGF药物的价格非常昂贵,重复注射对正常血管具有副作用,如引起潜在的感染和组织损伤。近年来,从MNPs中筛选出了至少43种具有抗血管生成活性的MNPs及其衍生物,主要靶向VEGF、MMP和细胞骨架相关蛋白来发挥作用[30],为病理性血管生成的治疗提供了新的可能性和希望。
2.4 细胞保护作用细胞死亡分为非程序性细胞死亡和程序性细胞死亡,在免疫、发育和组织稳态等生理过程中起关键作用[31]。其中,程序性细胞死亡的失调可引发多种疾病,如眼部疾病、心脏病、自身免疫性疾病和癌症等。先天免疫系统利用血液-视网膜屏障来维持和控制眼睛稳态和视觉功能,而眼内细胞生长和死亡之间的平衡则有助于维持眼睛稳态。在细胞水平上,视网膜神经节细胞、视网膜色素上皮细胞、视网周细胞、小梁网细胞、角膜上皮细胞、晶状体上皮细胞、视网膜微血管内皮细胞、星形胶质细胞和小胶质细胞的死亡均会引起眼组织损伤,进而导致各种眼部疾病的发生与恶化[32-33]。因此,保护细胞免于死亡也是治疗眼部疾病的重要策略之一。
MNPs通过修饰同细胞凋亡、坏死性凋亡和焦亡相关的一系列关键信号通路蛋白来抑制程序性细胞死亡,展现出对细胞的特殊保护作用,从而对相关疾病的预防和治疗具有潜在价值[34]。目前,尽管靶向细胞死亡的相关抑制剂在眼部疾病的治疗方面尚未进入临床试验,其治疗效果仍需要进一步验证,但MNPs因其特有的安全性和生物学功能,已经引起研发人员的广泛关注。
3 海洋天然产物在眼部疾病防治中的应用国际权威医学期刊《柳叶刀》的调查报告显示,在2020年,全球约有3亿人患有视力障碍性疾病,主要原因包括AMD、青光眼、DR、葡萄膜炎、干眼症和白内障等[35]。眼部疾病直接影响患者的视觉功能,还对其生活质量造成严重影响。因此,研发能够有效治疗眼部疾病的新型药物显得尤为迫切。眼部相关疾病主要是由内源性或外源性损伤引起,其发病机制涉及炎症、氧化胁迫、新生血管形成和细胞死亡等多个方面,而不同来源的MNPs对各种眼部疾病的发病机制展现出多样的调节活性,这为眼科疾病的预防和临床治疗带来了新的希望[5]。现将已应用于眼科疾病的MNPs的主要来源、作用机制及其适应症总结于表 1中。
|
|
表 1 海洋天然产物的主要来源、作用机制及适应症 Table 1 Main sources, mechanism of action and indications of marine natural products |
AMD是一种多因素诱导的慢性视网膜退行性疾病,已成为60岁以上老年人致盲的首要原因,全球AMD患者人数近2亿。AMD的早期阶段主要表现为视网膜色素上皮(视网膜和脉络膜血管之间的细胞层)和玻璃膜疣(视网膜下沉积物)的色素变化。而在晚期,AMD可分为萎缩性(干性)和渗出性(湿性)两类,萎缩性AMD涉及视网膜色素上皮细胞层和光感受器的进一步损伤,导致视力的逐渐丧失;渗出性AMD则由氧化胁迫和炎症反应共同作用导致脉络膜新生血管(CNV)的形成,这些新生血管会生长在视网膜下方或进入视网膜,并伴有脉络膜和视网膜出血,最终导致黄斑水肿和视网膜细胞死亡,严重损伤视力[36]。AMD的核心发病机制包括氧化损伤、炎症反应和新生血管生成,这些过程导致视网膜色素上皮、Bruch膜和脉络膜毛细血管功能障碍[37]。
从铁钉菜(Ishige okamurae)中分离出的二邻羟基香豆酚(Diphlorethohydroxycarmalol, DPHC)是一种褐藻多酚化合物,具有抗氧化和抗凋亡作用,可以保护视网膜色素上皮细胞系ARPE-19细胞免受H2O2诱导的DNA损伤和细胞凋亡。作为ROS清除剂,DPHC对线粒体依赖性凋亡途径具有抑制作用,在AMD的预防和治疗中具有重要的应用价值[38]。
岩藻黄质是一种类胡萝卜素,在羊栖菜(Hijikia fusiformis)中含量丰富,具有显著的抗氧化胁迫能力。有研究显示,岩藻黄质能显著降低ARPE-19细胞中的ROS、DNA损伤蛋白γ-H2AX的表达和衰老相关β-半乳糖苷酶(Senescence associated β-galactosidase, SA-β-Gal)阳性细胞数,这表明其可抑制氧化胁迫引起的脂质和DNA损伤,具有延缓衰老缓解AMD症状的作用[39]。
褐藻糖胶是一种从褐藻和海洋无脊椎动物中提取的硫酸多糖,具有抗氧化、抗炎和抗血管生成活性,在眼部疾病的治疗中起重要作用。褐藻糖胶在体外AMD模型中可显著降低视网膜上皮细胞中VEGF、白细胞介素(IL)家族成员IL-6和IL-8的分泌量,具有抗炎和抗血管生成活性,且不损害视网膜上皮细胞的功能,因此可以作为渗出性AMD治疗的潜在候选药物[40]。另有研究发现,褐藻糖胶还表现出细胞保护作用,可抑制ARPE-19细胞发生死亡[41]。
4-(苯硫基)丁烷-2-酮(4- (phenyl sulfur) butane-2-ketone, 4-PSB-2)是从软珊瑚(Cladiella australis)中衍生的化合物Austrasulfone的合成前体。4-PSB-2可以通过核转录因子-κB(Nuclear factor κB, NF-κB)信号通路下调ARPE-19细胞中的肿瘤坏死因子-α(Tumor necrosis factor α,TNF-α)、环氧化酶-2(Cycloxidase 2, COX-2)和诱导型一氧化氮合酶(Inducible nitric oxide synthase, iNOS)的表达,且不会引起任何显著的细胞毒性或副作用,这表明具有抗炎活性的4-PSB-2有望成为AMD的潜在治疗药物[42]。
从南美白对虾(Litopenaeus vannamei)中分离的类肝素在ARPE-19细胞体外模型和大鼠体内模型中都显示出显著的抗血管生成活性和抗炎活性,其作用机制很可能通过同成纤维细胞生长因子2(Fibroblast growth factor 2,FGF-2)、表皮生长因子(Epidermal growth factor,EGF)和VEGF结合并阻断其发挥作用,进而降低了脉络膜组织中VEGF和转化生长因子-β1(Transforming growth factor β1,TGF-β1)的水平,抑制内皮细胞增殖并减少脉络膜新生血管的形成。由于类肝素对细胞没有毒性作用,因此被视为治疗湿性AMD和其他血管增生性疾病中不可或缺的候选药物[43]。
3.2 海洋天然产物在青光眼中的应用青光眼作为一种多因素诱发的视神经退行性疾病,不仅是全球第二大致盲眼病,更在不可逆致盲眼病中占据首位,全球现有青光眼患者人数已超过7 000万。青光眼可分为急性和慢性两大类,其最主要的临床指标为眼内压升高,其发病机制复杂,涵盖细胞衰老、线粒体功能障碍、氧化胁迫和炎症反应等多个层面。当炎症因子累积超过其代偿能力时,会导致眼内压升高,进而引发视网膜神经节细胞功能障碍乃至死亡,若未能及时干预,最终将恶化为不可逆的视力丧失[44]。最近的研究发现,氧化胁迫、视神经缺血和炎症等均可诱发青光眼病变[45]。目前,降低眼内压已成为治疗青光眼的主流策略。
多不饱和脂肪酸Omega-3是生物膜的基本构成成分,也是多种生物活性物质的前体。长链Omega -3多不饱和脂肪酸主要来源于海洋鱼类,包括EPA、二十二碳五烯酸(Docosapentenoic acid,DPA)和DHA等。研究表明,适量补充Omega-3可以有效降低轻度或中度青光眼患者的眼内压,其作用机制同氧化胁迫、脂质过氧化以及炎症反应有关[46]。这表明Omega-3具有抗炎和抗氧化活性,在青光眼治疗中具有重要的应用价值。
虾青素主要由海洋单细胞生物产生,如金黄色农杆菌(Agrobacterium aurantiacum)、小球藻(Chlorella zofingiensis)和法夫酵母(Xanthophyllomyces dendrorhous)。在急性青光眼小鼠模型中,虾青素可通过激活核因子E2相关因子(Activation of the nuclear factor E2-associated factors, Nrf2)/血红素加氧酶1(Heme oxygenase 1, HO-1)信号通路,减轻视网膜的氧化损伤,从而抑制缺血再灌注诱导的视网膜神经节细胞凋亡,保护视网膜结构的完整性[47]。
3.3 海洋天然产物在DR中的应用DR是糖尿病中最常见的微血管并发症,也是引起糖尿病患者视力障碍的主要原因之一,全球现有DR患者人数约2 100万。DR是由长期慢性高血糖引起的视网膜微血管疾病。早期症状表现为视网膜毛细血管周细胞损伤、微动脉瘤的形成和出血等;晚期则表现为视网膜新生血管形成,从而导致血液-视网膜屏障功能受损,最终引起黄斑水肿[48]。诱发DR疾病的主要因素是高血糖,其发病机制涉及氧化胁迫、炎症的激活、缺血、血管生成、晚期糖基化产物沉积和细胞死亡[49-50]。因此,抗炎和抑制新生血管形成已成为治疗DR疾病的主攻方向。
褐藻糖胶可以通过抑制缺氧诱导因子-1α(Hypoxia-inducible factor-1α, HIF-1α)和VEGF来缓解视网膜病理变化并抑制糖尿病视网膜新生血管形成,为预防和治疗DR提供了潜在的候选药物[51]。
多不饱和脂肪酸Omega-3在DR中展现出显著的抗炎和抗血管生成活性,可延缓DR的进展,特别是在增殖性DR中可以抑制新生血管形成[52]。对于患有Ⅱ型糖尿病的中老年人,补充Omega-3可以降低DR的发生,因此Omega-3有望成为DR治疗的潜在候选药物。
现有研究发现,虾青素在糖尿病大鼠模型中对神经具有保护作用,可通过下调NF-κB的活性来显著降低糖尿病大鼠的视网膜炎症和ROS水平[53],因此也有望用于DR的治疗。
Wondonin是从海绵(Poecillastra wondoensis)中分离出来的咪唑类化合物。研究发现,Wondonin修饰化合物可以降低DR小鼠模型中视网膜细胞血管生成素-2(Angiopoietin-2, ANGPT-2)的表达水平,抑制新生血管形成。这表明Wondonin修饰物具有抗血管生成活性,在DR的治疗中具有潜在的应用价值[54]。
3.4 海洋天然产物在葡萄膜炎中的应用葡萄膜位于眼球的中部,包括脉络膜(营养血管组织)、睫状体和虹膜。葡萄膜炎是虹膜、睫状体和脉络膜炎症的总称,由病毒、细菌感染或颗粒物诱导的非感染性炎症反应所致,其常见症状为眼痛和视力丧失[55]。葡萄膜炎中血液-视网膜屏障的破坏涉及细胞浸润、蛋白质通透性增加、辅助性T细胞(Th细胞)的异常激活以及房水和葡萄膜部位中TNF-α、IL-6、单核细胞趋化蛋白1(Monocyte chemoattractant protein 1, MCP-1)和巨噬细胞炎性蛋白-1(Macrophage inflammatory protein-1, MIP-1)等细胞因子和趋化因子的上调。这些变化所引起的炎症级联反应均同氧化胁迫程度的增大有关[56]。由此可见,研发抗氧化和抗炎症药物可能是防治葡萄膜炎的有效途径。
已有研究结果显示,虾青素可剂量依赖性地抑制葡萄膜炎的恶化,其机制是通过直接阻断一氧化氮合酶(Nitricoxide synthase,NOS)的活性,进而显著抑制一氧化氮(NO)、前列腺素-2(PGE-2)和TNF-α的产生。这表明虾青素通过下调炎症因子和抑制NF-κB依赖性信号通路来发挥其抗炎活性,有望用于葡萄膜炎的临床治疗[57]。
3.5 海洋天然产物在干眼症中的应用干眼症是一种多因素诱发的慢性眼表疾病,其特征是由泪液分泌不足或过多蒸发所致的泪膜不稳定和泪液渗透压异常升高,进而诱发眼部炎症反应、神经传导异常和角膜上皮层损伤。轻者导致眼部异物感、干燥、刺激、流泪、瘙痒、刺痛和视力模糊,重者则可能导致视力障碍甚至失明[58]。干眼症分为缺水性干眼症(泪液产生减少)和蒸发性干眼症(泪液蒸发增加)。蒸发性干眼症通常与睑板腺功能障碍有关,导致所分泌脂质的质和量发生了改变,从而导致泪液蒸发过多和泪膜稳态失衡。缺水性干眼症和蒸发性干眼症都会导致泪液高渗和随后引发炎症和氧化应激级联反应,造成上皮损伤和杯状细胞丢失[59]。因此,抗炎、维持泪液渗透压和泪膜稳定性成为防治干眼症的主要努力方向。
现已证明,Omega-3可以减少炎症标志物IL-17A的水平,降低干眼症患者的泪液渗透压,并增加泪膜稳定性,从而有效改善干眼症的症状,展现出在干眼症的防治中的重要潜在应用价值[60]。
此外,有研究报道,虾青素可通过下调高迁移率族蛋白B1(High-mobility family of protein B1,HMGB1)、促炎性细胞因子TNF-α和IL-1β的表达,抑制角膜上皮细胞中衰老相关氧化胁迫标志物的水平和眼表的炎症反应,从而减轻和缓解干眼症的症状,在防治干眼症中也具有重要的应用前景[61]。
3.6 海洋天然产物在白内障中的应用白内障是以晶状体混浊为显著特征的眼部疾病,位居全球致盲眼病之首,全球白内障患者人数高达2.8亿。晶状体由位于皮质的纤维细胞和位于中央的纤维细胞组成,具有维持透明度和光传输功能。一旦晶状体发生混浊,将影响视力,严重时甚至致盲[62]。根据晶状体混浊的解剖位置,临床上把白内障分为中央型、皮质型、后囊下型和混合型(皮质和中央型)四种形式[63]。尽管手术仍是目前治疗白内障的唯一有效手段,但超声乳化白内障手术会对角膜内皮细胞等造成不可逆的损伤,轻者导致视力模糊,重者则将引发视力下降甚至致盲[64]。因此,筛选和研发出治疗白内障的有效药物可有效避免白内障手术的副作用,对于维护视力健康意义重大。
已有研究表明,氧化应激在白内障的发病过程中起着关键作用。对患有Ⅰ型糖尿病代谢性白内障的大鼠注射虾青素,可以显著降低晚期糖基化终产物的水平,表明虾青素通过抑制氧化胁迫来延缓代谢性白内障的发生和恶化,有望成为白内障治疗的候选药物[65]。
C-藻蓝蛋白是从钝顶螺旋藻(Spirulina platensis)中获得的一种蛋白质色素,具有抗氧化、抗炎和细胞保护作用。在白内障大鼠模型中,C-藻蓝蛋白可显著抑制氧化应激水平和炎症因子的分泌,并通过调控内源性和外源性凋亡相关蛋白的表达来抑制细胞凋亡,这表明C-藻蓝蛋白通过抗氧化、抗炎和抗凋亡作用在白内障中发挥其治疗作用[66]。
4 结语与展望海洋生物凭其高度的物种多样性及其独特的生存环境,孕育出众多具有独特结构和重要生物学活性的MNPs。这些MNPs相较于化学合成药,展现出卓越的生物相容性,成为开发新型、高效和低毒药物的重要源泉。眼部疾病会导致视力损伤甚至是失明,不仅影响患者自身的生活质量,而且也给家庭和社会带来沉重的负担。大多数眼部疾病与年龄有关,随着全球老龄化的日趋加剧,受眼部疾病困扰的人数也在日益增加。因此,研发出安全、有效的眼科药物,对于眼部疾病的治疗至关重要。越来越多的证据表明,MNPs具有抗炎、抗氧化、抗血管生成和细胞保护等生物学活性,在预防和治疗眼部疾病方面具有重要作用,有望成为眼部疾病治疗的新型候选药物。
然而,基于MNPs的新药开发仍面临诸多挑战。首先,由于现有勘探技术的限制,深海生物多样性研究仍处于初级阶段,MNPs的来源比较有限。其次,从海洋生物中分离出的MNPs往往纯度较低且数量有限,难以满足进一步的生物测定和活性物质开发的需求。此外,在新药研发中,体外实验的有效性并不能完全代表体内实验的结果,因此还需根据MNPs的特性和治疗效果来设计和制造出其衍生物,以达到最佳治疗效果。尽管MNPs的开发存在局限性,但目前已经生产出数千种海洋衍生药物,并在临床上发挥出了不可替代的巨大作用。因此,我们有理由相信,在眼部疾病预防和治疗多靶点新药的开发中,MNPs必将展现出重要的应用价值和广阔的应用前景。
| [1] |
DelMonte D W, Kim T. Anatomy and physiology of the cornea[J]. Journal of Cataract and Refractive Surgery, 2011, 37(3): 588-598. DOI:10.1016/j.jcrs.2010.12.037 (  0) 0) |
| [2] |
Bourne R R A, Steinmetz J D, Flaxman S, et al. Trends in prevalence of blindness and distance and near vision impairment over 30 years: An analysis for the global burden of disease study[J]. Lancet Global Health, 2021, 9(2): 130-143. DOI:10.1016/S2214-109X(20)30425-3 (  0) 0) |
| [3] |
Burton M J, Ramke J, Marques A P, et al. The lancet global health commission on global eye health: Vision beyond 2020[J]. Lancet Global Health, 2021, 9(4): 489-551. DOI:10.1016/S2214-109X(20)30488-5 (  0) 0) |
| [4] |
Weng Y H, Liu J, Jin S B, et al. Nanotechnology-based strategies for treatment of ocular disease[J]. Acta Pharmaceutica Sinica B, 2017, 7(3): 281-291. DOI:10.1016/j.apsb.2016.09.001 (  0) 0) |
| [5] |
Whitcher J P, Srinivasan M, Upadhyay M P. Corneal blindness: A global perspective[J]. Bulletin of the World Health Organization, 2001, 79(3): 214-221. (  0) 0) |
| [6] |
Molinski T F, Dalisay D S, Lievens S L, et al. Drug development from marine natural products[J]. Nature Reviews Drug Discovery, 2009, 8(1): 69-85. DOI:10.1038/nrd2487 (  0) 0) |
| [7] |
Carroll A R, Copp B R, Davis R A, et al. Marine natural products[J]. Natural Product Reports, 2021, 38(2): 362-413. DOI:10.1039/D0NP00089B (  0) 0) |
| [8] |
Krueger K, Boehme E, Klettner A K, et al. The potential of marine resources for retinal diseases: A systematic review of the molecular mechanisms[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(27): 7518-7560. DOI:10.1080/10408398.2021.1915242 (  0) 0) |
| [9] |
Lu W Y, Li H J, Li Q Y, et al. Application of marine natural products in drug research[J]. Bioorganic & Medicinal Chemistry, 2021, 35: 116058. (  0) 0) |
| [10] |
Saeed A, Su J Q, Ouyang S Y. Marine-derived drugs: Recent advances in cancer therapy and immune signaling[J]. Biomedicine & Pharmacotherapy, 2021, 134: 111091. (  0) 0) |
| [11] |
Roleira F M F, Tavares-da-Silva E J, Varela C L, et al. Plant derived and dietary phenolic antioxidants: Anticancer properties[J]. Food Chemistry, 2015, 183: 235-258. DOI:10.1016/j.foodchem.2015.03.039 (  0) 0) |
| [12] |
Khalifa S A M, Elias N, Farag M A, et al. Marine natural products: A source of novel anticancer drugs[J]. Marine Drugs, 2019, 17(9): 491. DOI:10.3390/md17090491 (  0) 0) |
| [13] |
Han N N, Li J J, Li X. Natural marine products: Anti-colorectal cancer in vitro and in vivo[J]. Marine Drugs, 2022, 20(6): 349. DOI:10.3390/md20060349 (  0) 0) |
| [14] |
Chen Z H, Guo Y W, Li X W. Recent advances on marine mollusk-derived natural products: Chemistry, chemical ecology and therapeutical potential[J]. Natural Product Reports, 2023, 40(3): 509-556. DOI:10.1039/D2NP00021K (  0) 0) |
| [15] |
Ngo D H, Vo T S, Ngo D N, et al. Biological activities and potential health benefits of bioactive peptides derived from marine organisms[J]. International Journal of Biological Macromolecules, 2012, 51(4): 378-383. DOI:10.1016/j.ijbiomac.2012.06.001 (  0) 0) |
| [16] |
Mayer A M S, Pierce M L, Howe K, et al. Marine pharmacology in 2018: Marine compounds with antibacterial, antidiabetic, antifungal, anti-inflammatory, antiprotozoal, antituberculosis and antiviral activities; affecting the immune and nervous systems, and other miscellaneous mechanisms of action[J]. Pharmacological Research, 2022, 183: 106391. DOI:10.1016/j.phrs.2022.106391 (  0) 0) |
| [17] |
Lee Y E, Kim H, Seo C, et al. Marine polysaccharides: Therapeutic efficacy and biomedical applications[J]. Archives of Pharmacal Research, 2017, 40(9): 1006-1020. DOI:10.1007/s12272-017-0958-2 (  0) 0) |
| [18] |
Raposo M F D, de Morais A M B, de Morais R. Marine polysaccharides from algae with potential biomedical applications[J]. Marine Drugs, 2015, 13(5): 2967-3028. DOI:10.3390/md13052967 (  0) 0) |
| [19] |
Shahidi F, Ambigaipalan P. Omega-3 polyunsaturated fatty acids and their health benefits[J]. Annual Review of Food Science and Technology, 2018, 9: 345-381. DOI:10.1146/annurev-food-111317-095850 (  0) 0) |
| [20] |
Brillante S, Galasso C, Lauritano C, et al. From the sea for the sight: Marine derived products for human vision[J]. Frontiers in Aging Neuroscience, 2022, 14: 892764. DOI:10.3389/fnagi.2022.892764 (  0) 0) |
| [21] |
Valko M, Leibfritz D, Moncol J, et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. International Journal of Biochemistry & Cell Biology, 2007, 39(1): 44-84. (  0) 0) |
| [22] |
Hsueh Y J, Chen Y N, Tsao Y T, et al. The pathomechanism, antioxidant biomarkers, and treatment of oxidative stress-related eye diseases[J]. International Journal of Molecular Sciences, 2022, 23(3): 1255. DOI:10.3390/ijms23031255 (  0) 0) |
| [23] |
Vladkova T, Georgieva N, Staneva A, et al. Recent progress in antioxidant active substances from marine biota[J]. Antioxidants, 2022, 11(3): 439. DOI:10.3390/antiox11030439 (  0) 0) |
| [24] |
Fulop T, Larbi A, Pawelec G, et al. Immunology of aging: The birth of inflammaging[J]. Clinical Reviews in Allergy & Immunology, 2023, 64(2): 109-122. (  0) 0) |
| [25] |
Stepp M A, Menko A S. Immune responses to injury and their links to eye disease[J]. Translational Research, 2021, 236: 52-71. DOI:10.1016/j.trsl.2021.05.005 (  0) 0) |
| [26] |
Ebrahimi B, Baroutian S, Li J Y, et al. Combination of marine bioactive compounds and extracts for the prevention and treatment of chronic diseases[J]. Frontiers in Nutrition, 2023, 9: 1047026. DOI:10.3389/fnut.2022.1047026 (  0) 0) |
| [27] |
Cheung R C F, Ng T B, Wong JH, et al. Marine natural products with anti-inflammatory activity[J]. Applied Microbiology and Biotechnology, 2016, 100(4): 1645-1666. DOI:10.1007/s00253-015-7244-3 (  0) 0) |
| [28] |
Ferrara N, Kerbel R S. Angiogenesis as a therapeutic target[J]. Nature, 2005, 438(7070): 967-974. DOI:10.1038/nature04483 (  0) 0) |
| [29] |
Maddula S, Davis D K, Maddula S, et al. Horizons in therapy for corneal angiogenesis[J]. Ophthalmology, 2011, 118(3): 591-599. DOI:10.1016/j.ophtha.2011.01.041 (  0) 0) |
| [30] |
Wang Y Q, Miao Z H. Marine-derived angiogenesis inhibitors for cancer therapy[J]. Marine Drugs, 2013, 11(3): 903-933. DOI:10.3390/md11030903 (  0) 0) |
| [31] |
Galluzzi L, Vitale I, Aaronson S A, et al. Molecular mechanisms of cell death: Recommendations of the nomenclature committee on cell death 2018[J]. Cell Death and Differentiation, 2018, 25(3): 486-541. DOI:10.1038/s41418-017-0012-4 (  0) 0) |
| [32] |
Tempestini A, Schiavone N, Papucci L, et al. The mechanisms of apoptosis in biology and medicine: A new focus for ophthalmology[J]. European Journal of Ophthalmology, 2003, 13: S11-S18. (  0) 0) |
| [33] |
Dvoriantchikova G, Lypka K R, Adis E V, et al. Multiple types of programmed necrosis such as necroptosis, pyroptosis, oxytosis/ferroptosis, and parthanatos contribute simultaneously to retinal damage after ischemia-reperfusion[J]. Scientific Reports, 2022, 12(1): 17152. DOI:10.1038/s41598-022-22140-0 (  0) 0) |
| [34] |
Choi D Y, Choi H. Natural products from marine organisms with neuroprotective activity in the experimental models of Alzheimer's disease, Parkinson's disease and ischemic brain stroke: Their molecular targets and action mechanisms[J]. Archives of Pharmacal Research, 2015, 38(2): 139-170. DOI:10.1007/s12272-014-0503-5 (  0) 0) |
| [35] |
Steinmetz J D, Bourne R R A, Briant P S, et al. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: The Right to Sight: An analysis for the global burden of disease study[J]. Lancet Global Health, 2021, 9(2): 144-160. DOI:10.1016/S2214-109X(20)30489-7 (  0) 0) |
| [36] |
de Guimaraes T A C, Varela M D, Georgiou M, et al. Treatments for dry age-related macular degeneration: Therapeutic avenues, clinical trials and future directions[J]. British Journal of Ophthalmology, 2022, 106(3): 297-304. DOI:10.1136/bjophthalmol-2020-318452 (  0) 0) |
| [37] |
Apte R S. Age-related macular degeneration[J]. New England Journal of Medicine, 2021, 385(6): 539-547. DOI:10.1056/NEJMcp2102061 (  0) 0) |
| [38] |
Park C, Lee H, Hong S H, et al. Protective effect of diphlorethohydroxycarmalol against oxidative stress-induced DNA damage and apoptosis in retinal pigment epithelial cells[J]. Cutaneous and Ocular Toxicology, 2019, 38(3): 298-308. DOI:10.1080/15569527.2019.1613425 (  0) 0) |
| [39] |
Chen S J, Lin T B, Peng H Y, et al. Cytoprotective potential of fucoxanthin in oxidative stress-induced age-related macular degeneration and retinal pigment epithelial cell senescence in vivo and in vitro[J]. Marine Drugs, 2021, 19(2): 114. DOI:10.3390/md19020114 (  0) 0) |
| [40] |
Doerschmann P, Kopplin G, Roider J, et al. Interaction of high-molecular weight fucoidan from laminaria hyperborea with natural functions of the retinal pigment epithelium[J]. International Journal of Molecular Sciences, 2023, 24(3): 2322. DOI:10.3390/ijms24032322 (  0) 0) |
| [41] |
Dorschmann P, Bittkau K S, Neupane S, et al. Effects of fucoidans from five different brown algae on oxidative stress and VEGF interference in ocular cells[J]. Marine Drugs, 2019, 17(5): 258. DOI:10.3390/md17050258 (  0) 0) |
| [42] |
Varinthra P, Huang S P, Chompoopong S, et al. 4-(phenylsulfanyl) butan-2-one attenuates the inflammatory response induced by amyloid-beta oligomers in retinal pigment epithelium cells[J]. Marine Drugs, 2021, 19(1): 1. (  0) 0) |
| [43] |
Dreyfuss J L, Regatieri C V, Lima M A, et al. A heparin mimetic isolated from a marine shrimp suppresses neovascularization[J]. Journal of Thrombosis and Haemostasis, 2010, 8(8): 1828-1837. DOI:10.1111/j.1538-7836.2010.03916.x (  0) 0) |
| [44] |
Weinreb R N, Aung T, Medeiros F A. The pathophysiology and treatment of glaucoma a review[J]. Jama-Journal of the American Medical Association, 2014, 311(18): 1901-1911. DOI:10.1001/jama.2014.3192 (  0) 0) |
| [45] |
Fleitas M F G, Dorfman D, Rosenstein R E. A novel viewpoint in glaucoma therapeutics: Enriched environment[J]. Neural Regeneration Research, 2022, 17(7): 1431-1439. DOI:10.4103/1673-5374.330594 (  0) 0) |
| [46] |
Villadoniga S R, Garcia E R, Epelde O S, et al. Effects of oral supplementation with docosahexaenoic acid (DHA) plus antioxidants in pseudoexfoliative glaucoma: A 6-month open-label randomized trial[J]. Journal of Ophthalmology, 2018, 2018: 825 9371. (  0) 0) |
| [47] |
Li Y, Wang Q, Chu C Y, et al. Astaxanthin protects retinal ganglion cells from acute glaucoma via the Nrf2/HO-1 pathway[J]. Journal of Chemical Neuroanatomy, 2020, 110: 101876. DOI:10.1016/j.jchemneu.2020.101876 (  0) 0) |
| [48] |
Stitt A W, Curtis T M, Chen M, et al. The progress in understanding and treatment of diabetic retinopathy[J]. Progress in Retinal and Eye Research, 2016, 51: 156-186. DOI:10.1016/j.preteyeres.2015.08.001 (  0) 0) |
| [49] |
Wan T T, Li X F, Sun Y M, et al. Recent advances in understanding the biochemical and molecular mechanism of diabetic retinopathy[J]. Biomedicine & Pharmacotherapy, 2015, 74: 145-147. (  0) 0) |
| [50] |
Lechner J, O'Leary O E, Stitt A W. The pathology associated with diabetic retinopathy[J]. Vision Research, 2017, 139: 7-14. DOI:10.1016/j.visres.2017.04.003 (  0) 0) |
| [51] |
Yang W Z, Yu X F, Zhang Q B, et al. Attenuation of streptozotocin-induced diabetic retinopathy with low molecular weight fucoidan via inhibition of vascular endothelial growth factor[J]. Experimental Eye Research, 2013, 115: 96-105. DOI:10.1016/j.exer.2013.06.011 (  0) 0) |
| [52] |
Sala-Vila A, Diaz-Lopez A, Valls-Pedret C, et al. Dietary marine omega-3 fatty acids and incident sight-threatening retinopathy in middle-aged and older individuals with type 2 diabetes prospective investigation from the PREDIMED trial[J]. Jama Ophthalmology, 2016, 134(10): 1142-1149. DOI:10.1001/jamaophthalmol.2016.2906 (  0) 0) |
| [53] |
Yeh P T, Huang H W, Yang C M, et al. Astaxanthin inhibits expression of retinal oxidative stress and inflammatory mediators in streptozotocin-induced diabetic rats[J]. PLoS One, 2016, 11(1): e0146438. DOI:10.1371/journal.pone.0146438 (  0) 0) |
| [54] |
Kim D, Choi S W, Cho J, et al. Discovery of novel small-molecule antiangiogenesis agents to treat diabetic retinopathy[J]. Journal of Medicinal Chemistry, 2021, 64(9): 5535-5550. DOI:10.1021/acs.jmedchem.0c01965 (  0) 0) |
| [55] |
Forrester J V, Kuffova L, Dick A D. Autoimmunity, autoinflammation, and infection in uveitis[J]. American Journal of Ophthalmology, 2018, 189: 77-85. DOI:10.1016/j.ajo.2018.02.019 (  0) 0) |
| [56] |
Yadav U C S, Kalariya N M, Ramana K V. Emerging role of antioxidants in the protection of uveitis complications[J]. Current Medicinal Chemistry, 2011, 18(6): 931-942. DOI:10.2174/092986711794927694 (  0) 0) |
| [57] |
Suzuki Y, Ohgami K, Shiratori K, et al. Suppressive effects of astaxanthin against rat endotoxin-induced uveitis by inhibiting the NF-kappa B signaling pathway[J]. Experimental Eye Research, 2006, 82(2): 275-281. DOI:10.1016/j.exer.2005.06.023 (  0) 0) |
| [58] |
Tsubota K, Pflugfelder S C, Liu Z G, et al. Defining dry eye from a clinical perspective[J]. International Journal of Molecular Sciences, 2020, 21(23): 9271. DOI:10.3390/ijms21239271 (  0) 0) |
| [59] |
Bron A J, de Paiva C S, Chauhan S K, et al. TFOS DEWSⅡpathophysiology report[J]. Ocular Surface, 2017, 15(3): 438-510. DOI:10.1016/j.jtos.2017.05.011 (  0) 0) |
| [60] |
Deinema L A, Vingrys A J, Wong C Y, et al. A randomized, double-masked, placebo-controlled clinical trial of two forms of omega-3 supplements for treating dry eye disease[J]. Ophthalmology, 2017, 124(1): 43-52. DOI:10.1016/j.ophtha.2016.09.023 (  0) 0) |
| [61] |
Li H, Li J F, Hou C T, et al. The effect of astaxanthin on inflammation in hyperosmolarity of experimental dry eye model in vitro and in vivo[J]. Experimental Eye Research, 2020, 197: 108113. DOI:10.1016/j.exer.2020.108113 (  0) 0) |
| [62] |
Liu Y C, Wilkins M, Kim T, et al. Cataracts[J]. Lancet, 2017, 390(10094): 600-612. DOI:10.1016/S0140-6736(17)30544-5 (  0) 0) |
| [63] |
Braakhuis A J, Donaldson C I, Lim J C, et al. Nutritional strategies to prevent lens cataract: Current status and future strategies[J]. Nutrients, 2019, 11(5): 1186. DOI:10.3390/nu11051186 (  0) 0) |
| [64] |
Mayali H, Baser E F, Kurt E, et al. Corneal endothelial damage in phacoemulsification using an anterior chamber maintainer compared with using an ophthalmic viscosurgical device[J]. Journal of Cataract and Refractive Surgery, 2021, 47(5): 612-617. DOI:10.1097/j.jcrs.0000000000000493 (  0) 0) |
| [65] |
Yang M, Chen Y, Zhao T, et al. Effect of astaxanthin on metabolic cataract in rats with type 1 diabetes mellitus[J]. Experimental and Molecular Pathology, 2020, 113: 104372. DOI:10.1016/j.yexmp.2020.104372 (  0) 0) |
| [66] |
Kumari R P, Ramkumar S, Thankappan B, et al. Transcriptional regulation of crystallin, redox, and apoptotic genes by C-phycocyanin in the selenite-induced cataractogenic rat model[J]. Molecular Vision, 2015, 21: 26-39. (  0) 0) |
 2025, Vol. 55
2025, Vol. 55

