2. 山东省智慧海洋牧场重点实验室(筹),山东 青岛 266104;
3. 青岛市海洋生物种质资源发掘与利用工程实验室,山东 青岛 266104
大菱鲆(Scophthalmus maximus)隶属于硬骨鱼纲(Actinopterygii)鲽形目(Pleuronectiformes)菱鲆科(Scophthalmidae),为冷温性底栖海水鱼类,原产于欧洲大西洋东北部,是世界公认的名贵水产养殖品种之一[1]。自1992年大菱鲆引入我国后,迅速成为了我国鲆鲽类的第一大养殖品种,推动了整个鲆鲽类产业的发展[2]。但近年来,由于引进的大菱鲆原种数量相对较少,导致亲鱼累代繁育现象时有发生,进而造成种质退化严重。外部形态特征是鱼类原种监测及良种选育的重要依据之一。为明确不同群体大菱鲆的形态差异,科学管理大菱鲆种质资源,马爱军等[3]采用传统形态学方法,比较了大菱鲆4个地理群体的外部形态特征,发现丹麦和挪威群体之间及英国和法国群体之间的差异较小,其余两两群体之间形态差异显著;关健等[4]对引进亲鱼和国内累代繁养亲鱼进行了群体形态特征比较,发现引进群体的形态学多样性总体高于累代繁养群体;于飞等[5]对4个引进群体的形态进行了判别分析,得出的综合判别率为62.5%。以上研究为大菱鲆种质管理策略的制定提供了重要的参考价值。然而,大菱鲆传统形态学分析往往仅包含头尾轴和背腹轴之间的可量性状,容易忽视肉眼难以观察的性状[6],这导致对鱼体形态的描述具有一定的局限性,总体判别成功率不高,从而无法实现形态变异可视化。
几何形态测量学方法是20世纪90年代由Bookstein[7]和Rohlf等[8]创立的,该方法应用标点法、半标点法等,通过常规多元统计对物种形态进行相似性比较及差异分析,将形态变异可视化,同时去除非形态信息的干扰,没有余赘信息[9]。目前,该方法被大量运用于鱼类外部形态研究中,Silva等[10]运用多变量度量和几何形态法成功的分析了14个沙丁鱼(Sardina pilchardus)样本的体形差异;Cabuga等[11]应用几何形态学方法成功识别了婆罗叫姑鱼(Johnius borneensis)雌鱼与雄鱼的体形差异;张秀霞等[12]应用几何形态测量方法成功识别了10个唐鱼(Tanichthys albonubes)群体,并发现这些唐鱼群体的形态变异主要表现在眼径和头部形态。为探讨不同引进群体和养殖群体大菱鲆的外部形态变异,高效识别大菱鲆不同群体,实现形态差异的可视化,并精准定位形态变异发生部位,本研究基于大菱鲆体侧扁,卵圆形的形态特点,选取了30个地标点对大菱鲆4个引进群体和2个养殖群体外部形态进行几何形态学分析,旨在探讨不同大菱鲆群体的外部形态差异,为大菱鲆种质资源的合理利用及科学管理提供必要的参考资料。
1 材料与方法 1.1 实验材料4个引进大菱鲆群体分别引自法国、智利、冰岛、丹麦,其中,丹麦群体为2008年由山东龙口市烟台百家水产有限公司自丹麦引进的成鱼,法国、智利、冰岛群体为2014年由威海圣航水产科技有限公司自以上国家引进的成鱼。2个国内养殖群体分别采集于威海、日照养殖场,为国内累代养殖群体。为减少全长差异对形态特征的影响,经二次抽样后,样本全长较为集中,不同群体的平均全长范围为38~42 cm,成鱼年龄均集中在2龄,实验共采集成鱼样品180尾(见表 1)。
|
|
表 1 6个大菱鲆群体的样本信息 Table 1 Sample information of six Scophthalmus maximus populations |
将所取大菱鲆利用MS-222麻醉后,逐条放置在载物台上,整理大菱鲆鱼鳍的形态,让其尽量伸展,利用尼康D4500数码相机进行拍照,拍照时将相机固定在拍摄架上,并在相机和拍摄架上固定水平仪,以保证镜头与拍摄画面完全垂直,从而获取标准图像,用于后续的几何形态学测量分析。在图像采集过程中,标本的摆放位置、拍摄方位以及聚焦部位均需保持一致。将获得的图像利用Photoshop CS软件进行处理,调整底板与大菱鲆的颜色反差,使大菱鲆的轮廓更加清晰。
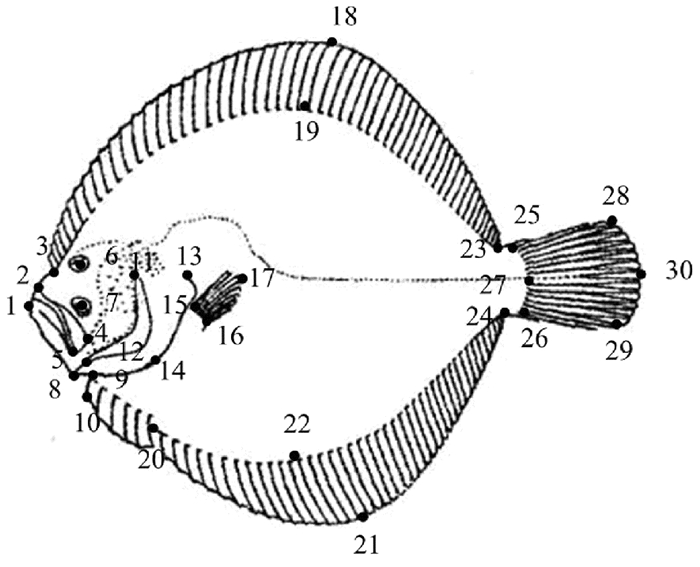
1.3 几何形态学测量分析 1.3.1 地标点的选取与建立地标点在生物学应用上分为3种类型:Ⅰ型、Ⅱ型和Ⅲ型地标点。根据地标点同源性和信息含量的要求,本研究选取了30个地标点,其中3、9、15~16、20、23~26为Ⅰ型地标点,1~2、4~8、10~13、27为Ⅱ型地标点,14、17~19、21~22、28~30为Ⅲ型地标点(见图 1,表 2)。利用tpsUtil软件(网址:tpsutil.updatestar.com),将所需处理的图片创建成一个tps格式文件; 利用tpsDig软件(网址:life.bio.sunysb.edu/morph)对大菱鲆进行标点数据采集,获得相应地标点的x、y坐标值,随后建立坐标点数据文件,确保所有样本的地标点数目和相对顺序保持一致。利用tpsRelw软件(网址:life.bio.sunysb.edu/morph)对所得到的数据进行普氏叠加,通过平移、缩放和旋转去除非形态信息,然后计算出质心距离,评估所有样本每个坐标点的平均坐标,得到大菱鲆的平均形(Mean shape)和重叠形(Overlapping shape),并保存软件生成的相对扭曲指数(Relative warps scores)矩阵和分析报告。
|
图 1 大菱鲆的30个地标点位置 Fig. 1 Position of 30 landmarks of Scophthalmus maximus |
|
|
表 2 地标点类型与定义 Table 2 The landmark types and definition |
利用tpsSmall软件(网址:life.bio.sunysb.edu/morph)进行最小平方和法则(Least-squares criterion)回归分析,检验所有地标点的有效性。将tpsDig软件生成的标点文件导入MorphoJ软件(网址:flywings.org.uk/MorphoJ_page.htm)中,进行普氏印叠(Generalized procrustes analysis,GPA),即对每个样品的地标点进行平移、缩放、旋转等以消除非形变因素,使数据标准化;随后利用MorphoJ软件(网址:flywing.org.uk/MorphoJ_page.htm)对普氏坐标数据进行主成分分析(Principal components analysis,PCA),同时,进行典型变量分析(Canonical variable analysis,CVA),讨论不同大菱鲆群体间的差异,计算马氏距离(Mahalanobis distance)和普氏距离(Procrustes distance),并对其结果进行了基于10 000次重复的P值检验,定量分析不同大菱鲆群体间的形态差异量,本研究的显著性水平为P<0.05。利用各样本的相对扭曲主成分得分(Relative warps scores, RW)进行判别分析,判别方法采用Bayes法,利用SPSS27.0(网址:www.ibm.com/spss)进行统计分析。
2 结果 2.1 6个大菱鲆群体的几何形态学分析利用tpsSmall软件进行的最小平方和法回归分析表明,切空间距离(Distance in tangent space,y轴)与普氏距离(Procrustes distance,x轴)的回归系数为0.999 338,接近1,表明本研究所选取的所有地标点均有效,可用于进一步的地标点形态学分析。
由tpsRelw软件在叠印过程中计算出的平均形和所有地标点矢量化的重叠效果如图 2和图 3所示。30个地标点在相对扭曲主成分分析时的贡献率结果如表 3所示,其中,地标点9的贡献率最大(25.20%),地标点12、8、4、5的贡献率次之,以上地标点主要集中在颌部和鳃峡处,这表明颌和鳃峡等头部性状变异是判断不同大菱鲆群体形态特征差异的重要因素。同时,Ⅰ型、Ⅱ型和Ⅲ型地标点的累计贡献率分别为39.29%、60.11%和0.60%。Ⅰ型和Ⅱ型地标点在6个大菱鲆群体的形态区分中作用较大,Ⅲ型地标点的作用不明显。

|
图 2 大菱鲆6个群体的平均形 Fig. 2 Mean shape of six Scophthalmus maximus populations |

|
图 3 大菱鲆6个群体所有地标点矢量化的重叠效果 Fig. 3 The overlapping effect of vectorization for all landmarks of six Scophthalmus maximus populations |
|
|
表 3 各个地标点的相对扭曲贡献率 Table 3 Relative warp contribution rate of each landmark |
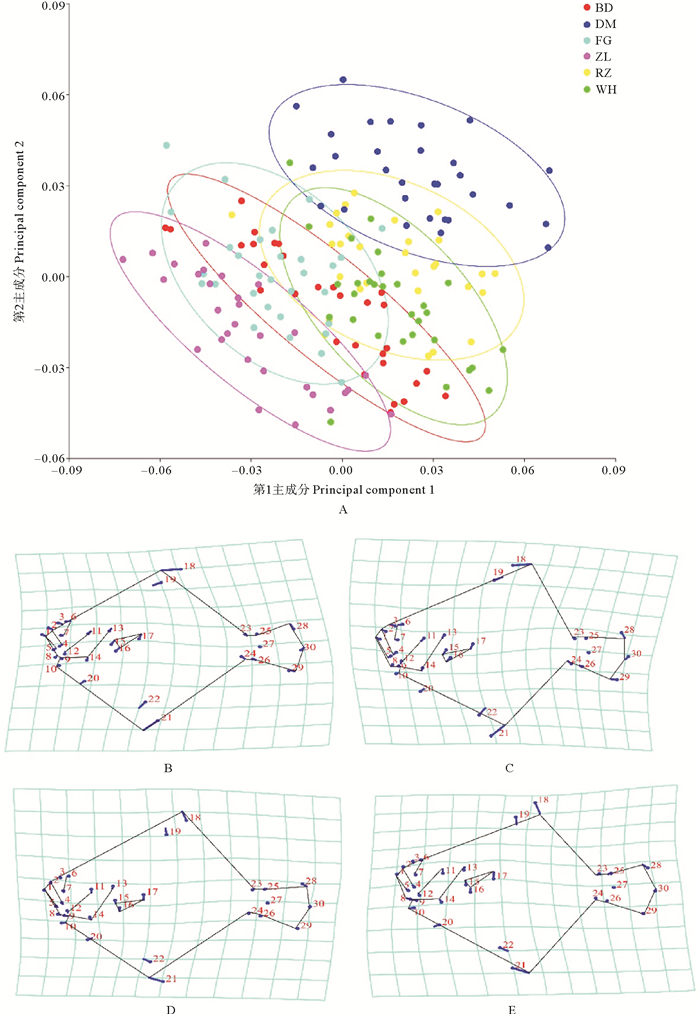
共提取了56个主成分,前3个主成分的贡献率分别为25.59%、16.98%和10.50%。累计贡献率为53.07%。在PCA二维散点图中,大菱鲆不同群体重叠分布,无法从PC1和PC2上区分各大菱鲆群体(见图 4)。网格变形图结果显示,延PC1轴正方向大菱鲆的变化主要表现在颌长变短,头部变小;延PC2轴正方向大菱鲆的变化主要表现在鳃峡与躯干部的缺口变小(见图 4)。
|
( A为第1, 2主成分散点图,B和C分别表示PC1轴值为0.07和-0.07时的大菱鲆平均体形;D和E分别表示PC2轴值为-0.06和0.06时的大菱鲆平均体形。圆圈表示不同群体大菱鲆形态均值的90%置信椭圆。缩写BD、DM、FG、ZL、RZ、WH的含义见表 1。A: Scatter plot of first principal component with respect to the second principal component. Mean shapes of Scophthalmus maximus are shown for sores of 0.07(B)and-0.07(C)in PC1. Mean shapes of Scophthalmus maximus are shown for sores of-0.06(D) and 0.06(E) in PC2. The circle represents 90% confidence ellipses of Scophthalmus maximus in different populations. The meanings of abbreviations BD, DM, FG, ZL, RZ, and WH are detailed in table 1. ) 图 4 6个大菱鲆群体几何形态学特征的主成分分析 Fig. 4 Principal component analysis of geometric morphological characteristics for six Scophthalmus maximus populations |
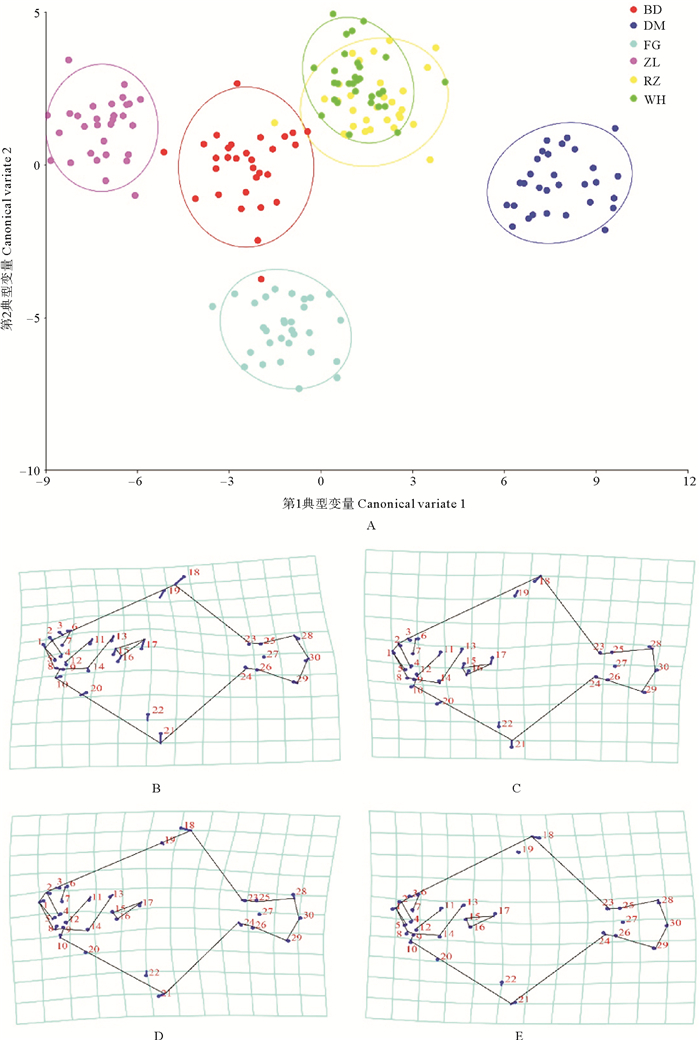
为量化大菱鲆群体间的差异,对不同群体进行了外部形态的典型变量分析,并计算了马氏距离和普氏距离(见表 4和表 5)。典型变量分析共得到5个典型变量,其中,CV1和CV2分别代表总体变异的55.80%和19.20%。在CV1轴和CV2轴上,两个养殖群体均有所重叠,在CV1轴上,冰岛和法国引进群体之间形态差异较小,但在CV2轴上差异较大(见图 5)。由大菱鲆不同群体之间的马氏距离和普氏距离可知,虽然各群体差异显著,但威海养殖群体和日照养殖群体之间的距离均为最短,与典型变量分析的结果类似。网格变形图分析结果显示,延CV1轴正向,不同群体大菱鲆明显的变化表现在头部变小、颌长变短;延CV2轴正向,颌高变窄,鳃峡处向颌部延伸。
|
|
表 4 6个大菱鲆群体外部形态的马氏距离比较 Table 4 Comparison of Mahalanobis distance in external morphology of six Scophthalmus maximus populations |
|
|
表 5 6个大菱鲆群体外部形态的普氏距离比较 Table 5 Comparison of Procrustes distance in external morphology of six Scophthalmus maximus populations |
|
( A:第1和第2典型变量散点图。B和C分别表示CV1轴的值为12和-8时的大菱鲆平均体形;D和E分别表示CV2轴的值为-7和5时的大菱鲆平均体形。圆圈表示不同群体大菱鲆形态均值的90%置信椭圆。缩写BD、DM、FG、ZL、RZ、WH的含义见表 1。A: Scatter plot of first canonical variate with respect to the second canonical variate. Mean shapes of Scophthalmus maximus are shown for sores of 12(B)and-8(C)in CV1. Mean shapes of Scophthalmus maximus are shown for sores of-7(D)and 5(E)in CV2. The circle represents 90% confidence ellipses of Scophthalmus maximus in different populations. The meanings of abbreviations BD, DM, FG, ZL, RZ, and WH are detailed in table 1. ) 图 5 6个大菱鲆群体几何形态学特征的典型变量分析 Fig. 5 Canonical variate analysis of geometric morphological characteristics for Scophthalmus maximus populations |
对6个大菱鲆群体的外部形态进行判别,22个RW被纳入判别分析,判别分析结果显示,丹麦、法国的大菱鲆样品,判别成功率为100%,冰岛群体中1尾判别到法国,智利群体中1尾判别到冰岛,日照群体中5尾判别到威海,威海群体中3尾判别到日照(见表 6)。交互验证分析中,丹麦、法国、智利群体的结果与逐步判别分析结果相同,冰岛、日照、威海群体的结果略低于逐步判别分析结果。逐步判别分析和交互验证分析的总体判别正确率分别为94.4%和91.7%。因此,应用几何形态学对不同大菱鲆群体进行判别的效果较好。
|
|
表 6 6个大菱鲆群体的判别结果 Table 6 Discrimination result of six Scophthalmus maximus population |
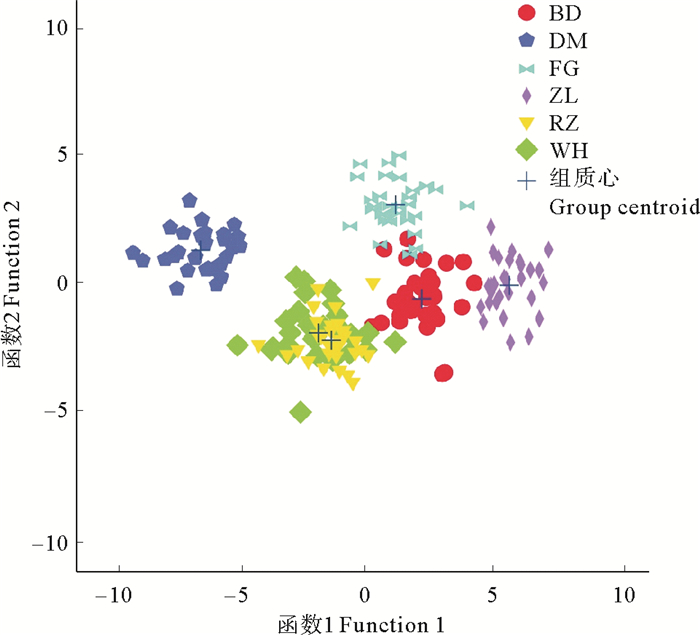
判别分析散点图(见图 6)可更直观地显现出大菱鲆外部形态地标点法的应用结果,由图 6可知,养殖群体和引进群体区分明显,日照养殖群体和威海养殖群体的外部形态有很大程度的重叠,法国引进群体和冰岛引进群体的外部形态有少量重叠。
|
( 缩写BD、DM、FG、ZL、RZ、WH的含义见表 1。The meanings of abbreviations BD, DM, FG, ZL, RZ, and WH are detailed in table 1. ) 图 6 6个大菱鲆群体形态几何形态学特征的判别分析散点示意图 Fig. 6 Scatter diagram of discriminant analysis on geometric morphological characteristics for six Scophthalmus maximus population |
几何形态学为基于笛卡尔地标点的形态统计分析方法,该方法能够较为完整地保留原始样本的形态信息,弥补了传统形态测量法对形态信息的提取能力有限的不足[13]。目前,几何形态测量学中使用最多的方法为地标点法。地标点在生物学上的应用主要分为三种类型[14],Ⅰ型为不同组织间的交接点,可被精准定位;Ⅱ型为形态测量弯曲的极值点,可被明确识别;Ⅲ型为结构的极值点,取点具有主观性。本研究所选取的30个地标点中,地标点9、12、8、4、5的贡献率较大,累计贡献率为70.52%,这些贡献率较高的点均属于Ⅰ型和Ⅱ型,对不同大菱鲆群体的判别准确率在90%以上,这说明所筛选的地标点判别效果较好,可用于有效区分大菱鲆的不同群体。与本研究类似,张秀霞等[12]选取了18个地标点对唐鱼群体进行了几何形态学测量分析,结果显示,Ⅱ型地标点12-15的贡献率较高,总体判别正确率在90%以上;薛竣仁等[15]对阳澄湖原产及“洗澡”中华绒螯蟹(Eriocheir sinensis)背甲进行几何形态分析发现,Ⅱ型地标点贡献率最高,对不同群体的中华绒螯蟹的判别准确率达100%;侯刚等[16]对北部湾4种白姑鱼矢耳石形态进行几何形态学分析发现,贡献率较高的地标点7、6、8、5均为Ⅰ型和Ⅱ型地标点,群体判别成功率在85%以上;许莹等[17]对长江安徽段刀鲚(Coilia nasus)群体矢耳石形态进行几何形态学分析发现,贡献率较高的地标点均为Ⅱ型地标点,群体判别成功率在95%以上。但冯波等[18]利用地标法进行短吻鲾(Leiognathus brevirostris)地方种群区分效果较差,可能与选取了较多Ⅲ型地标点,且贡献率较高的地标点均为Ⅲ型地标点有关。因此,Ⅰ型和Ⅱ型地标点在区分不同群体的形态学效果上均优于Ⅲ型地标点。综上所述,基于地标点的几何形态学测量法的区分效果如何,主要取决于地标点的选择,为避免信息缺失,提高判别准确性,在选择地标点时,应以Ⅰ型和Ⅱ型地标点为主,Ⅲ型地标点为辅。
3.2 大菱鲆引进群体和养殖群体的形态差异由于遗传信息及养殖环境差异,大菱鲆群体之间会呈现出形态差异。本研究通过几何形态测量学方法对6个群体的大菱鲆进行形态学分析,其研究结果较传统形态学方法具有更多的可量性状做基础,可更全面的反映各群体之间的形态差异。由于几何形态学分析采用二维整体的分析方法,因此比传统分析更具多变性,这导致本研究得到的主成分多达56个,且贡献率较低。因此,本研究的主成分分析结果与马爱军等[3]、于飞等[5]对大菱鲆不同群体的传统形态学形态特征的主成分分析研究结果类似,不同群体在主成分散点图上存在一定程度的重叠。然而,通过典型变量分析可知,4个大菱鲆引进群体与2个养殖群体之间的形态差异明显,这与刘滨等[19]基于线粒体DLoop区序列的分析结果相吻合,即引进群体和国内累代繁养群体之间存在遗传分化。同时,本研究发现,引进群体间的形态差异显著,而养殖群体之间存在重叠,且两个养殖群体之间的马氏距离和普氏距离均为最短,由此可知,引进群体之间存在较大的形态差异,与关健等[4]基于传统形态学的分析结果“大菱鲆国内累代繁养群体形态趋同”以及姜晓东等[20]对于不同水系野生中华绒螯蟹移至池塘并人工养殖一代后形态特征趋同的结论相一致,随水产生物的累代培养与定向选育,养殖群体形态存在趋同现象。这可能与不同群体水生生物的生存环境各具特点有关,水流、水温和摄食等因素引起了大菱鲆形态及行为方面的差异。另外,由地标点的贡献率及网格变形图可知,颌和鳃峡等头部性状变异是导致6个大菱鲆群体形态特征差异的重要因素,由于鱼类头部的形态差异主要与摄食行为息息相关[21-22],因此推断,大菱鲆不同群体外部形态的改变可能与大菱鲆的生存环境与摄食组成有关。
3.3 大菱鲆种质资源管理策略大菱鲆为原产于欧洲的著名海水养殖特有良种,1992年引入我国后,逐步成为我国北方沿海工厂化养殖业的主导品种之一,但因其为引进种,群体来源较为单一,导致引进亲鱼累代繁殖的现象时有发生,致使近年来种质趋同及退化严重[23]。基于本研究中各引进群体形态差异的显著性,为了更好的保护大菱鲆种质资源,维持其生物多样性,建议定期进行亲本原种的筛选与淘汰,并引进补充与复壮种质资源,实行有效的亲鱼管理策略。另外,基于引进群体与养殖群体形态的差异性,建议将各引进群体活体进行隔离保存,以避免与国内累代养殖群体混杂,进一步维持遗传多样性。
4 结语本研究应用几何形态测量学方法对大菱鲆的4个引进群体和2个养殖群体进行外部形态的差异分析,发现基于30个地标点的几何形态学测量法能够有效识别大菱鲆群体,大菱鲆引进群体之间、引进群体与养殖群体之间均存在显著的形态差异,但养殖群体外部形态存在趋同现象。建议结合传统形态学、几何形态学以及遗传学分析方法,定期对大菱鲆种质资源进行评估,并开展引进亲鱼的补充、更新与复壮工作。本研究为大菱鲆繁育种群管理、外来种群引进、良种选育等提供了科学依据。
| [1] |
韩建, 王茂林, 曹胜男, 等. 光色、光照度和光周期对大菱鲆幼鱼生长和摄食的影响[J]. 大连海洋大学学报, 2023, 38(5): 787-794. Han J, Wang M L, Cao S N, et al. Effects of light color, light intensity and photoperiod on growth and feeding of juvenile turbot (Scophthalmus maximus)[J]. Journal of Dalian Ocean University, 2023, 38(5): 787-794. (  0) 0) |
| [2] |
关长涛, 杨正勇, 王启要, 等. 大菱鲆产业发展报告[J]. 中国水产, 2021(1): 22-35. Guan C T, Yang Z Y, Wang Q Y, et al. Development report on turbot (Scophthalmus macimus L.) industry[J]. China Fisheries, 2021(1): 22-35. (  0) 0) |
| [3] |
马爱军, 王新安, 雷霁霖, 等. 大菱鲆(Scophthalmus maximus)四个不同地理群体数量形态特征比较[J]. 海洋与湖沼, 2008(1): 24-29. Ma A J, Wang X A, Lei J L, et al. Statistic morphology difference among four turbot (Scophthalmus maximus) populations[J]. Oceanologia et Limnologia Sinica, 2008(1): 24-29. (  0) 0) |
| [4] |
关健, 刘洪军, 官曙光, 等. 大菱鲆引进亲鱼与国内累代繁养亲鱼群体的形态特征比较[J]. 渔业科学进展, 2012, 33(3): 48-53. Guan J, Liu H J, Guan S G, et al. Analysis on morphological variations among introduced and Chinese farmed turbot Scophthalmus maximus parentfish populations[J]. Progress in Fishery Scinences, 2012, 33(3): 48-53. (  0) 0) |
| [5] |
于飞, 张庆文, 孔杰, 等. 大菱鲆4个进口群体的形态差异分析[J]. 海洋水产研究, 2008(5): 27-32. Yu F, Zhang Q W, Kong J, et al. Morphological variations and analyses of four imported turbot stocks, Scophthalmus maximus[J]. Marine Fisheries Research, 2008(5): 27-32. (  0) 0) |
| [6] |
章翊涵, 王咏雪, 梁海, 等. 多鳞四指马鲅5个地理群体的形态差异[J]. 水产学报, 2022, 46(8): 1334-1344. Zhang Y H, Wang Y X, Liang H, et al. Morphological differences of five Eleueheronema rhadinum geographical stocks[J]. Journal of Fisheries of China, 2022, 46(8): 1334-1344. (  0) 0) |
| [7] |
Bookstein F L. Size and shape spaces for landmark data in two dimensions[J]. Statistical Science, 1986, 1(2): 181-222. (  0) 0) |
| [8] |
Rohlf F J, Slice D. Extensions of the procrustes method for the optimal superimposition of landmarks[J]. Systematic Biology, 1990, 39(1): 40-59. (  0) 0) |
| [9] |
李晓慧, 汤永涛, 田菲, 等. 几何形态测量法结合Micro CT扫描对两水系花斑裸鲤的形态分析[J]. 水生生物学报, 2020, 44(4): 853-861. Li X H, Tang Y T, Tian F, et al. Morphological analysis used by geometric morphometrics combined with micro CT among Gymnocypris eckloni in two drainage (Teleostei: Cyprinidae)[J]. Acta Hydrobiologica Sinica, 2020, 44(4): 853-861. (  0) 0) |
| [10] |
Silva A. Morphometric variation among sardine (Sardina pilchardus) populations from the northeastern Atlantic and the western Mediterranean[J]. ICES Journal of Marine Science, 2003, 60(6): 1352-1360. (  0) 0) |
| [11] |
Cabuga Jr C C, Angco M K A, Codaste Y G, et al. A geometric morphometric study in the population of Sharpnose Hammer Coacker (Johnius borneensis, Blecker 1851) from Butuan Bay, Caraga, Philippines[J]. Computational Ecology and Software, 2022, 12(1): 1-11. (  0) 0) |
| [12] |
张秀霞, 朱巧莹, 赵俊. 利用几何形态测量学方法分析唐鱼群体的形态变异[J]. 水产学报, 2017, 41(9): 1365-1373. Zhang X X, Zhu Q Y, Zhao J. Geometric morphometric analysis of body-form variability in populations of Tanichthys albonubes[J]. Journal of Fisheries of China, 2017, 41(9): 1365-1373. (  0) 0) |
| [13] |
朱国平, 刘芳沁. 几何形态测量学及其在鱼类生态学研究中的应用进展[J]. 上海海洋大学学报, 2022, 31(5): 1180-1189. Zhu G P, Liu F Q. Geometric morphometrics and its application in fish ecology: A review[J]. Journal of Shanhai Ocean University, 2022, 31(5): 1180-1189. (  0) 0) |
| [14] |
陈新军, 方舟, 苏杭, 等. 几何形态测量学在水生动物中的应用及其进展[J]. 水产学报, 2013, 37(12): 1873-1885. Chen X J, Fang Z, Su H, et al. Review and application of geometric morphometrics in aquatic animals[J]. Journal of Fisheries of China, 2013, 37(12): 1873-1885. (  0) 0) |
| [15] |
薛竣仁, 姜涛, 陈修报, 等. 阳澄湖原产及"洗澡"中华绒螯蟹背甲的几何形态分析[J]. 水生生物学报, 2020, 44(3): 587-594. Xue J R, Jiang T, Chen X B, et al. Geomentric morphometic analysis on the carapace difference between "bathed" and yangcheng lake originated Eriocheir sinensis[J]. Acta Hydrobiologica Sinica, 2020, 44(3): 587-594. (  0) 0) |
| [16] |
侯刚, 刘丹丹, 冯波, 等. 基于地标点几何形态测量法识别北部湾4种白姑鱼矢耳石形态[J]. 中国水产科学, 2013, 20(6): 1293-1302. Hou G, Liu D D, Feng B, et al. Using landmark-based geometric morphometrics analysis to identify sagittal otolith of four Pennahia fish species[J]. Journal of Fishery Sciences of China, 2013, 20(6): 1293-1302. (  0) 0) |
| [17] |
许颖, 姜涛, 刘洪波, 等. 基于耳石几何形态测量学的长江安徽江段刀鲚群体识别研究[J]. 水生生物学报, 2023, 47(9): 1497-1505. Xu Y, Jiang T, Liu H B, et al. Population identification for Coilia nasus in anhui section of the Changjiang River based on otolith geometric morphometric analysis[J]. Acta Hydrobiologica Sinica, 2023, 47(9): 1497-1505. (  0) 0) |
| [18] |
冯波, 程罗妹. 几何形态学方法区分短吻鲾地方种群的研究[J]. 上海海洋大学学报, 2011, 20(5): 677-681. Feng B, Chen L M. Identifying Leiognathus brevirostris stocks by geometric morphometrics[J]. Journal of Shanhai Ocean University, 2011, 20(5): 677-681. (  0) 0) |
| [19] |
刘滨, 刘新富, 刘思涛, 等. 大菱鲆引进群体与国内累代繁养群体线粒体D-loop区部分序列的遗传多态性分析[J]. 渔业科学进展, 2013, 34(6): 31-36. Liu B, Liu X F, Liu S T, et al. Genetic diversity of partial mtDNA D-loop region among stocks of turbot Scophthalmus maximus recently introduced and long-farmed in China[J]. Progress in Fishery Sciences, 2013, 34(6): 31-36. (  0) 0) |
| [20] |
姜晓东, 成永旭, 吴旭干. 长江和闽江水系野生中华绒螯蟹及其养殖子一代形态特征比较[J]. 上海海洋大学学报, 2021, 30(1): 21-28. Jiang X D, Chen Y X, Wu X G. Landmark-based morphometric identification of wild Chinese mitten crab and their pond-reared offspring originated form the Yangtze River and Minjiang River[J]. Journal of Shanhai Ocean University, 2021, 30(1): 21-28. (  0) 0) |
| [21] |
Forsman A. Adaptive variation in head size in Vipera berus L. populations[J]. Biological Journal of the Linnean Society, 1991, 43(4): 281-296. (  0) 0) |
| [22] |
Pouilly M, Barrera S, Rosales C. Changes of taxonomic and trophic structure of fish assemblages along an environmental gradient in the Upper Beni watershed (Bolivia)[J]. Journal of Fish Biology, 2006, 68(1): 137-156. (  0) 0) |
| [23] |
王新安, 马爱军, 侯仕营, 等. 大菱鲆4个不同地理群体生长性能的比较[J]. 渔业科学进展, 2010, 31(1): 34-39. Wang X A, Ma A J, Hou S Y, et al. Comparison of growth performance in stocks of turbot Scophthalmus maximus L. from Britain, France, Denmark and Norway[J]. Progress in Fishery Sciences, 2010, 31(1): 34-39. (  0) 0) |
2. Shandong Key Laboratory of Intelligent Marine Ranch (under preparation), Qingdao 266104, China;
3. Engineering Laboratory for Exploration and Utilization of Marine Germplasm Resources of Qingdao, Qingdao 266104, China
 2025, Vol. 55
2025, Vol. 55


