随着近年来海水养殖的迅速发展,中国已成为世界第一水产养殖大国,2014年海水养殖总产量达到1 813万t[1]。然而,海水养殖过程存在严重的自身污染,投喂残饵、代谢产物及排泄物等向海洋环境输出大量的营养负荷,造成养殖区水环境严重的富营养化。其中,养殖环境中的硫化物是伴随着饵料残渣生物降解、氧气过度消耗而产生的主要污染物之一[2],由于其强烈的生物毒性,对养殖区生态系统的结构和功能造成了严重危害,已成为制约海水养殖业健康发展的关键问题。
硫化物的修复方法主要包括物理、化学及生物方法,其中物理方法如吹脱、曝气及颗粒活性炭吸附等[3],具有设备简易、操作便捷的优点,然而该方法存在效率低、不能持久且易反复等问题;化学控制如化学氧化法[4]及化学沉淀法[5]等,化学方法去除硫化物速度快,但治理费用较高且易对环境造成二次污染。相对于物理化学方法,硫化物的生物控制技术具有费用低、耗时短、无二次污染、不破坏生态平衡等优点[6],已成为硫化物污染治理及回用的重要方法。硫氧化菌(Sulfur-oxidizing bacteria, SOB)是一类可将硫化物氧化产生单质硫,或将单质硫进一步氧化为硫酸盐的微生物[7],对环境中还原性硫化物具有很好的控制作用。然而,直接使用游离细菌存在大量弊端,如细菌易被流水冲走、微生物难以适应实际环境等弊端严重限制了生物修复的应用[8-11]。为解决上述问题,微生物固定化技术应运而生。
微生物固定化技术总体上分为载体吸附法、交联法和包埋法三大类。其中,载体吸附法通过物理吸附、化学或离子结合的方式将微生物细胞吸附到载体表面,其成本较低、操作简单、对细胞的活性影响较小,易于推广应用[12]。Skoronski等[13]利用石墨烯固定从Aspergillusoryzae提取的漆酶,研究发现固定后的漆酶对pH值及温度耐受范围增大;Vichuviwat等[14]分析了砖粒和沸石两种载体对菌株Clostridium beijerinckii TISTR 1461的固定效果,结果表明两种固定化载体均提高了该菌株的丁醇产量。与其他载体相比,陶粒对微生物无毒,机械强度高,物理化学性质稳定,使用寿命长且价格低廉,因此被作为合适的细胞固定化载体广泛使用。龚浩等[15]利用陶粒作为滤料吸附去除水中的卡马西平(CBZ),当进水CBZ浓度为2 μg·L-1时,其最高去除率可达到40%;Zhou等[16]的研究表明以陶粒为载体的生物反应器固定氨氧化细菌可取得良好的去除效果,硝酸根的去除率稳定在90%左右;Rattanapan等[17]将2株硫氧化菌固定到陶粒上并应用到生物滤池中,该系统表现出对硫化氢气体较好的去除作用。国内外对硫氧化菌固定化的研究和应用主要集中在对生物反应器中硫化氢气体脱硫方面,应用固定化硫氧化菌对海水养殖生境硫化物污染进行控制的研究较少。
在此背景下,本研究以胶州湾养殖区分离得到的硫氧化菌株嗜热氢弧菌(Hydrogenovibrio thermophilus)TT为对象,利用陶粒和沸石作为固定化载体,考察不同载体固定条件对其去除还原性硫化物的影响,并通过对载体进行改性进一步提高其对菌体的吸附作用,从而为海水养殖环境中硫化物的生物控制提供基础材料。
1 材料和方法 1.1 材料 1.1.1 微生物菌株来源实验采用的硫氧化菌株TT分离自胶州湾海水养殖区,经16S rDNA序列测序比对鉴定该菌株为嗜热氢弧菌(Hydrogenovibrio thermophilus)。该菌株微需氧,可同时利用有机碳源和无机碳源,将还原性硫化物氧化成单质硫和硫酸盐。该菌在较宽泛的温度和pH范围内都能生长,最优生长条件为:温度30~40℃、pH=7~9,能较好的适应海水养殖环境。
1.1.2 培养基选择性培养基成分(g·L-1):Na2S·9H2O 4.5,NaHCO3 2.0,K2HPO4 1.2,KH2PO4 1.2,NH4Cl 0.4,MgCl20.2,FeC6H5O7 0.01,经0.45 μm孔径滤膜过滤的陈海水进行配制,用1 mol·L-1 NaOH溶液调节pH为7.0,配制完成后120 ℃高温高压灭菌20 min,使用氮气吹脱10 min以去除培养基中的溶解氧,创造缺氧环境。
无机盐培养基:由于Na2S·9H2O极易被氧化,不易测得其准确浓度,故选择Na2S2O3·5H2O代替培养基中的Na2S·9H2O来配制无机盐培养基[18],用于测定菌株氧化去除硫化物的效果,其它成分及操作不变。
1.2 固定化载体本文使用的固定化载体为沸石和陶粒,将载体研磨过筛,得到18目(直径为1 ~ 2 mm)、30目(直径为0.6 ~1.0 mm)及60目(直径为0.25 ~0.6 mm)三种粒径的载体。
1.3 载体的预处理使用0.1 mol·L-1的磷酸和氢氧化钠调节蒸馏水的pH依次为1、3、5、6、8、9、11,取1g载体材料投进5 mL不同pH的溶液中,150 r·min-1振荡吸附30 min,静置24 h,使用蒸馏水冲洗改性载体至冲洗液pH呈中性,105 ℃干燥2 h即得到改性载体;同样取沸石和陶粒,蒸馏水清洗,105 ℃干燥2 h,即未改性载体;所有载体高压蒸汽灭菌后备用。
1.4 固定化过程将菌种按10%的接种量接入50 mL选择性培养基,30 ℃、150 r·min-1条件下培养24 h,然后在菌液(>109 CFU·mL-1)中加入1 g载体材料,继续振荡培养24 h,进行微生物细胞的吸附固定。使用无菌生理盐水冲洗载体3次,除去表面未固定的游离细菌,获得固定化菌剂。
1.5 分析检测项目及方法采用碘量法[19]测定水中硫代硫酸盐的含量(S2O32-);按照参考文献[20]的方法对沸石、陶粒及改性陶粒进行预处理,并应用扫描电镜(SEM)观察;按照参考文献[21]的方法测定改性陶粒及未改性陶粒傅里叶红外光谱图(FT-IR),检验改性对载体表面特性的影响。
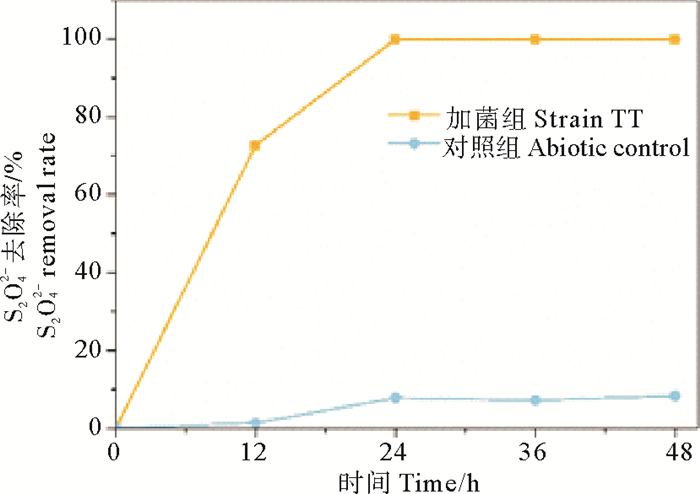
2 结果与讨论 2.1 菌株对硫化物的氧化能力从图 1可以看出,该菌株在24 h时对4.65 g·L-1的Na2S2O3·5H2O的去除率可达到100%;而未加菌的对照组对硫化物也有约5%去除率,这可能是由于培养基中存在的微量氧气造成的。通过与对照比较,可以确定约95%的硫化物去除是由微生物参与完成的。
|
图 1 非固定化硫氧化菌株TT对硫化物的氧化去除能力 Fig. 1 The sulfide removal rate of suspended strain TT |
冯守帅等[22]研究的硫氧化菌Thermithiobacillustepidarius JNU-2以2 g·L-1的Na2S2O3为能源底物,24 h时可去除98%的Na2S2O3,同时单质硫的最大产量可达到0.8 g·L-1。而Chen等[23]将硫氧化菌Penibacillus sp.和Aneurinibacillusaneurinilyticus应用于膨胀颗粒污泥床反应器,其对硫化物的氧化速率达到了3.0 g·(L·d)-1。与上述菌株相比,本文分离得到的硫氧化菌株TT拥有更高效的氧化还原性硫化物的能力。同时,硫化物菌株TT可在20~40 ℃之间均可获得较好的硫氧化能力,其最优生长条件为:30~40 ℃,pH为7.0~9.0。该菌为兼性化能自养菌,可同时利用无机碳和有机碳作为碳源[24]。由于胶州湾养殖区夏季的平均温度为27.8 ℃[25],且该菌在碱性环境中可发挥较好的硫氧化能力,可见菌株TT可作为合适的工程菌株应用于海水养殖生境的生物修复。
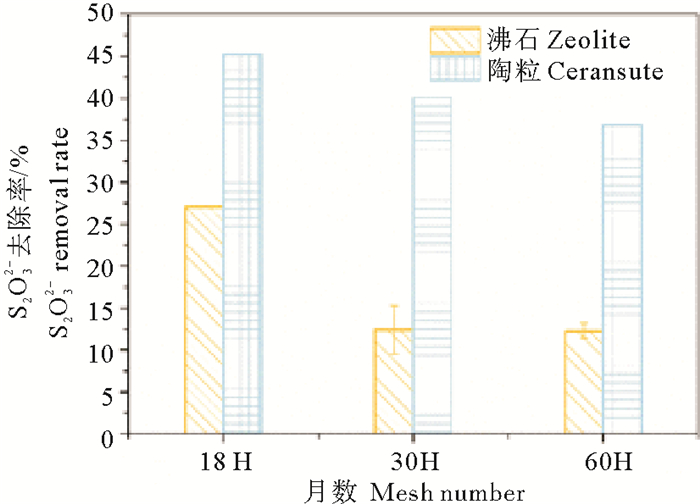
2.2 载体的选择及效果以18、30及60目的沸石和陶粒为载体,采用吸附的方法对硫氧化菌株TT进行了固定化。固定后的载体在pH=7.0、30 ℃条件下对硫代硫酸盐的去除效果如图 2,18目固定化菌剂24 h时对硫代硫酸盐的去除率可达到42.7%, 去除效果最好。
|
图 2 不同载体和粒径对固定化效果的影响 Fig. 2 The effect of different carriers and particle size on immobilization |
已知游离的菌液24 h时对硫代硫酸盐的去除率为100%(见图 2),可见固定化菌剂的去除率有所降低,这可能是由于大量的微生物细胞并未吸附到固定化载体上[26],或是由于硫化物在载体材料中的扩散迁移受到了限制[27],从而导致固定后的菌剂硫氧化能力下降。与陶粒相比, 不同粒径沸石固定化菌剂对还原性硫化物的氧化能力远低于陶粒,这可能与载体的表面形态有关。沸石和陶粒的SEM图如图 3,沸石表面无孔隙,但表面较粗糙;而陶粒表面有许多孔隙,比表面积较大,能够吸附大量的微生物细胞并为其提供生长空间[28]。

|
图 3 未吸附载体沸石(a)及陶粒(b) Fig. 3 SEM observation of zeolite(a) and ceramsite(b) |
陶粒及沸石两种载体均在18目粒径下表现出了更好的硫氧化性能。研究表明,固-液界面相互作用过程中,渗透性较差的多孔介质表面形成的水化膜限制了污染物的扩散迁移,使得功能微生物无法与污染物充分接触,从而影响固定化载体对目标污染物的去除效果。颗粒粒径会对多孔介质的渗透性产生重要影响[29]。粒径越大,多孔介质的渗透性越好,良好的渗透性能够保证液体中污染物与固定化菌剂中微生物进行充分接触,从而达到较好的去除效果。这也可能是18目粒径下的固定化菌剂对硫化物去除效果好的原因。同时由于粒径较小的载体较难与游离态菌液分离,难以应用于实际养殖环境,故选择18目的陶粒进行以下研究。
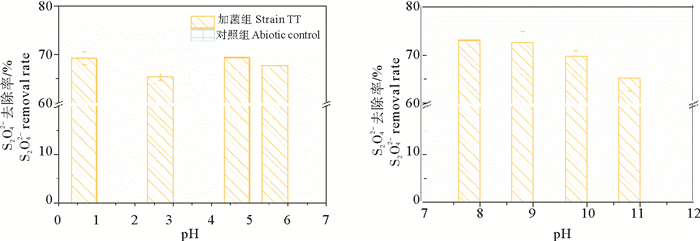
2.3 载体的预处理对载体材料表面基团或孔结构进行优化,从而获得合适的固定化材料已成为细胞固定化研究的重要方向[30]。陶粒内部呈细密蜂窝状微孔结构,利用酸碱对陶粒进行改性,置换陶粒孔道中原有的半径大的阳离子,使孔洞的有效孔径拓宽,增加表面积[31],从而影响陶粒的离子交换和吸附吸能,增加吸附活性中心[32]。用酸碱改性处理后的陶粒分别吸附固定化硫氧化菌株TT,研究其对硫代硫酸盐的去除能力,结果如图 4。
|
图 4 酸、碱改性对固定化效果的影响 Fig. 4 The effects of modified carriers onimmobilization |
与未改性陶粒相比,采用酸碱改性方法处理过后的固定化菌剂对硫代硫酸盐的去除能力均有显著提高,而用1.0 mol·L-1NaOH处理的陶粒吸附菌可获得更好的固定化效果。其中利用pH=8的NaOH溶液对陶粒载体进行改性后进行固定化,其固定化菌株的硫氧化能力提高了35%左右。
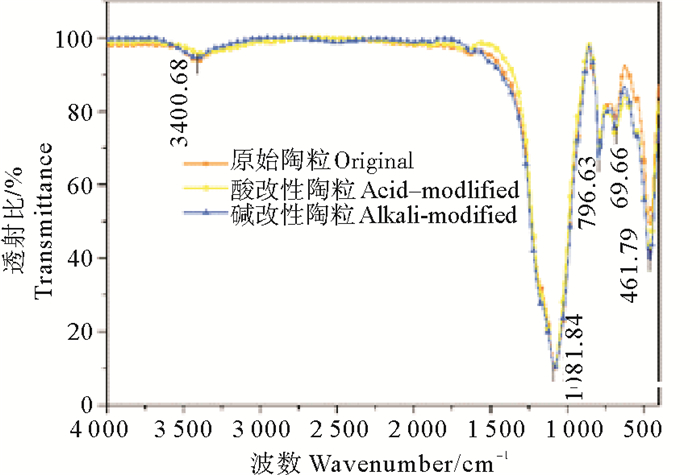
2.4 固定化颗粒表面结构分析载体的吸附特性不仅取决于它的孔隙结构,同时其表面化学性质也具有很大影响。而表面化学性质主要由表面的官能团决定,不同的官能团对不同的吸附质有明显的吸附差别。采用傅里叶红外光谱对未改性陶粒、酸改性陶粒及碱改性陶粒的表面结构进行测定,结果如图 5。陶粒在3 400 cm-1处有一个O-H伸缩振动吸收峰,1 081 cm-1为Si-O伸缩振动峰,796、691及462 cm-1处为Si-O、Al-O弯曲振动峰;酸碱改性并未改变陶粒红外骨架,主要影响了陶粒本身的O-H含量,酸改性陶粒较未改性陶粒的O-H峰强度减弱,而碱改性的陶粒O-H峰强度增强。O-H这种极性较强的基团的增加可以提高载体对弱极性物质吸附的表面活性[33]。这可能是碱改性载体固定化效果提高的原因。
|
图 5 陶粒在不同改性条件下的FTIR谱图 Fig. 5 FTIR spectrum of ceramsite obtained from different modified conditions |
不同处理条件下的陶粒扫描电镜图谱如图 6。与未处理陶粒相比(见图 3),酸碱改性的陶粒孔隙增多,比表面积增大,这可能是酸碱改性后载体吸附能力提高的原因之一。同时碱改性陶粒5 μm左右的大孔隙较多,由于本研究中使用的微生物细胞长度>1 μm,因此大孔隙的增加有利于微生物细胞的吸附。

|
图 6 陶粒酸改性(a)及碱改性(b)后的扫描电镜照片及吸附的菌体(c) Fig. 6 SEM of acid(a) and alkali-modifiedceramsite(b) and strain TT on carrier(c) |
固定化的一大优势就是固定化载体的重复利用,不同的固定方式决定了不同的复用性[34]。而相比较于其他的固定方法,吸附法的复用性最好[35]。固定化菌剂的复用性结果如图 7。
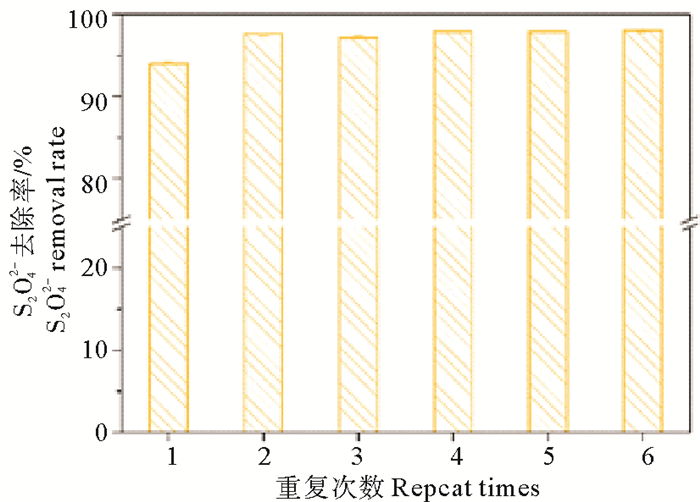
|
图 7 固定化菌剂的复用性 Fig. 7 The reusability of the immobilized sulfur-oxidizing bacteria cell |
固定化菌剂在第一次使用过后,其对还原性硫化物的氧化能力得到了一定的提升,这表明微生物细胞可在陶粒载体上进一步增殖。吸附于载体上的微生物细胞与载体间除物理吸附外可能发生了生物吸附,从而形成菌膜,增加菌体密度[36]。同时,重复使用过程中,载体上脱落下来的微生物会在底物充足的情况下进一步增殖,在水中及吸附在载体上的微生物进一步增多,导致重复使用后固定化菌剂对硫化物的去除率提高。6次重复使用后,固定化菌剂的硫氧化能力并没有明显变化,仍表现出显著的分解代谢能力,说明该固定化菌剂具有较好的复用性并且能够长期应用于海水养殖环境。
3 结语以陶粒和沸石为载体,采用吸附的方法对具有高效硫氧化能力的菌株TT进行了固定化。为了进一步提高固定化效果,采用不同的改性方法提高载体的吸附性能,并考察了固定化菌剂的硫氧化能力。陶粒由于孔隙较多,固定化效果比沸石更好些;通过酸碱改性可提高固定化载体的吸附效果,其中碱改性陶粒(pH=8)的效果最好,硫氧化能力提高了35%,达到75%左右;碱改性陶粒对硫氧化菌株具有较好的吸附固定化能力,且复用性较好,在海水养殖生境修复领域具有很好的应用前景。
| [1] |
宗虎民, 袁秀堂, 王立军, 等. 我国海水养殖业氮、磷产出量的初步评估[J]. 海洋环境科学, 2017, 36(3): 336-342. Zhong H M, Yuan X T, Wang L J, et al. Preliminary evaluation on the nitrogen and phosphorus loads by mariculture in China[J]. Marine Environmental Science, 2017, 36(3): 336-342. (  0) 0) |
| [2] |
陈小红, 陈宇锋, 郑惠东, 等. 网箱养殖沉积环境中硫氧化菌的分离鉴定及生长特性[J]. 渔业研究, 2016, 38(6): 431-436. Chen X H, Chen Y F, Zheng H D, et al. Isolation, identification and characteristics of a sulfide-oxidizing bacterium in sediment of marine[J]. Journal of Fisheries Research, 2016, 38(6): 431-436. (  0) 0) |
| [3] |
Asaoka S, Yamamoto T, Yoshioka I, et al. Remediation of coastal marine sediments using granulated coal ash[J]. Journal of Hazardous Materials, 2009, 172(1): 92-98. DOI:10.1016/j.jhazmat.2009.06.140
(  0) 0) |
| [4] |
张文革. 南美白对虾养殖过程中硫化物的控制[J]. 河北渔业, 2011(4): 50-52. Zhang W G. The technology of sulfide control in the culture of Penaeus vannamei[J]. Hebei Fisheries, 2011(4): 50-52. DOI:10.3969/j.issn.1004-6755.2011.04.022 (  0) 0) |
| [5] |
Sun J, Zhou J, Shang C, et al. Removal of aqueous hydrogen sulfide by granular ferric hydroxide-kinetics, capacity and reuse[J]. Chemosphere, 2014, 117: 324-329. DOI:10.1016/j.chemosphere.2014.07.086
(  0) 0) |
| [6] |
杨娟, 谢翼飞, 李旭东, 等. 一株耐盐硫氧化细菌的分离鉴定及脱硫机理[J]. 应用与环境生物学报, 2015(5): 819-823. Yang J, Xie Y F, Li X D, et al. Isolation, identification and desulfurization mechanism of a sulfur-oxidizing bacterium with salt tolerance[J]. Marine Environmental Science, 2015(5): 819-823. (  0) 0) |
| [7] |
贡俊, 张肇铭, 王玉芬, 等. 一株高效脱硫菌的分离鉴定和脱硫特性研究[J]. 环境工程学报, 2009, 3(11): 2031-2036. Gong J, Zhang Z M, Wang Y F, et al. Isolation, identification and desulfurization characteristics of an efficient desulfurization strain[J]. Chinese Journal of Environmental Engineering, 2009, 3(11): 2031-2036. (  0) 0) |
| [8] |
Hou D, Shen X, Luo Q, et al. Enhancement of the diesel oil degradation ability of a marine bacterial strain by immobilization on a novel compound carrier material[J]. Marine Pollution Bulletin, 2013, 67(1): 146-151.
(  0) 0) |
| [9] |
Sekaran G, Karthikeyan S, Gupta V K, et al. Immobilization of Bacillus sp. in mesoporous activated carbon for degradation of sulphonated phenolic compound in wastewater[J]. Materials Science and Engineering: C, 2013, 33(2): 735-745. DOI:10.1016/j.msec.2012.10.026
(  0) 0) |
| [10] |
郑宇, 王晓琼, 赵阳国, 等. 包埋法固定化对硫氧化微生物菌群结构和功能的影响[J]. 微生物学报, 2016, 56(9): 1504-1512. Zheng Y, Wang X Q, Zhao Y G, et al. Effects of immobilization on community structure and function ofsulfide oxidizing microbiota[J]. Acta Microbiologica Sinica, 2016, 56(9): 1504-1512. (  0) 0) |
| [11] |
Ravichandra P, Gopal M, Annapurna J. Biological sulfide oxidation using autotrophic Thiobacillus sp.: Evaluation of different immobilization methods and bioreactors[J]. Journal of Applied Microbiology, 2009, 106(4): 1280-1291. DOI:10.1111/jam.2009.106.issue-4
(  0) 0) |
| [12] |
邓晓皋. 吸附法固定微生物细胞的研究进展[J]. 生物工程进展, 1993, 13(4): 7-10. Deng X G. Research progress of immobilized microbial cells by adsorption method[J]. Progress in Biotechnology, 1993, 13(4): 7-10. (  0) 0) |
| [13] |
Skoronski E, Souza D H, Ely C, et al. Immobilization of laccase from Aspergillus oryzae on graphene nanosheets[J]. International Journal of Biological Macromolecules, 2017, 99: 121-127. DOI:10.1016/j.ijbiomac.2017.02.076
(  0) 0) |
| [14] |
Vichuviwat R, Boonsombuti A, Luengnaruemitchai A, et al. Enhanced butanol production by immobilized Clostridium beijerinckii TISTR 1461 using zeolite 13X as a carrier[J]. Bioresource Technology, 2014, 172: 76-82. DOI:10.1016/j.biortech.2014.09.008
(  0) 0) |
| [15] |
龚浩, 郭劲松, 方芳, 等. 改性陶粒对水中卡马西平去除的动态吸附实验及模型[J]. 环境工程学报, 2016, 10(7): 3573-3579. Gong H, Guo J S, Fang F, et al. Experiments and model for dynamic adsorption of carbamazepine onto modified ceramisite in drinking water[J]. Chinese Journal of Environmental Engineering, 2016, 10(7): 3573-3579. (  0) 0) |
| [16] |
Zhou W, Liu X, Dong X, et al. Sulfur-based autotrophic denitrification from the micro-polluted water[J]. Journal of Environmental Sciences, 2016, 44: 180-188. DOI:10.1016/j.jes.2016.01.002
(  0) 0) |
| [17] |
Rattanapan C, Boonsawang P, Kantachote D. Removal of H2S in down-flow GAC biofiltration using sulfide oxidizing bacteria from concentrated latex wastewater[J]. Bioresource Technology, 2009, 100(1): 125-130. DOI:10.1016/j.biortech.2008.05.049
(  0) 0) |
| [18] |
Luo J, Tian G, Lin W. Enrichment, isolation and identification of sulfur-oxidizing bacteria from sulfide removing bioreactor[J]. Journal of Environmental Sciences, 2013, 25(7): 1393-1399. DOI:10.1016/S1001-0742(12)60179-X
(  0) 0) |
| [19] |
Pawlak Z, Pawlak A S. Modification of iodometric determination of total and reactive sulfide in environmental samples[J]. Talanta, 1999, 48(2): 347-353. DOI:10.1016/S0039-9140(98)00253-7
(  0) 0) |
| [20] |
Chung K, Okabe S. Continuous power generation and microbial community structure of the anode biofilms in a three-stage microbial fuel cell system[J]. Applied Microbiology and Biotechnology, 2009, 83(5): 965-977. DOI:10.1007/s00253-009-1990-z
(  0) 0) |
| [21] |
Zhou J, Sui Z, Zhu J, et al. Characterization of surface oxygen complexes on carbon nanofibers by TPD, XPS and FT-IR[J]. Carbon, 2007, 45(4): 785-796. DOI:10.1016/j.carbon.2006.11.019
(  0) 0) |
| [22] |
冯守帅, 计云鹤, 杨海麟. 硫氧化菌种脱除硫化物生成单质硫限制性因素优化[J]. 微生物学通报, 2016, 43(1): 36-43. Feng S S, Ji Y H, Yang H L. Optimization of restrictive factors during process of removing sulfide into elemental sulfur by sulfur oxidizer[J]. Microbiology China, 2016, 43(1): 36-43. (  0) 0) |
| [23] |
Chen C, Wang A, Ren N, et al. Enhancing denitrifying sulfide removal with functional strains under micro-aerobic condition[J]. Process Biochemistry, 2010, 45(6): 1007-1010. DOI:10.1016/j.procbio.2010.02.013
(  0) 0) |
| [24] |
Takai K, Hirayama H, Nakagawa T, et al. Thiomicrospira thermophila sp. nov., a novel microaerobic, thermotolerant, sulfur-oxidizing chemolithomixotroph isolated from a deep-sea hydrothermal fumarole in the TOTO caldera, Mariana Arc, Western Pacific[J]. Int J Syst Evol Microbiol, 2004, 54(Pt6): 2325-2333.
(  0) 0) |
| [25] |
Liu D, Sun J, Zhang J, et al. Response of the diatom flora in Jiaozhou Bay, China to environmental changes during the last century[J]. Marine Micropaleontology, 2008, 66(3): 279-290.
(  0) 0) |
| [26] |
王克明, 许文友, 庄树宏. 固定化桔青霉气升式反应器生产核酸酶P1的研究[J]. 烟台大学学报(自然科学与工程版), 2001, 14(1): 37-41. Wang K M, Xu W Y, Zhuang S H. Study on production of nuclease P1 by immobilized penicilium citrinum cell in three phase airlift reactor[J]. Journal of Yantai University(Natural Science and Engineering Edition), 2001, 14(1): 37-41. DOI:10.3969/j.issn.1004-8820.2001.01.009 (  0) 0) |
| [27] |
Ma C, Qin D, Sun Q, et al. Removal of environmental estrogens by bacterial cell immobilization technique[J]. Chemosphere, 2016, 144: 607-614. DOI:10.1016/j.chemosphere.2015.09.014
(  0) 0) |
| [28] |
Elliott C, Ye Z, Mojumdar S C, et al. A potential bacterial carrier for bioremediation[J]. Journal of Thermal Analysis and Calorimetry, 2007, 90(3): 707-711. DOI:10.1007/s10973-007-8526-5
(  0) 0) |
| [29] |
彭昌盛, 刘慧, 张倩, 等. 颗粒粒径和水溶液性质对多孔介质渗透性的影响[J]. 中国海洋大学学报(自然科学版), 2015, 45(3): 107-115. Peng C S, Liu H, Zhang Q, et al. Effects of particle size and solution properties on permeability of porous media[J]. Periodical of Ocean University of China, 2015, 45(3): 107-115. (  0) 0) |
| [30] |
张桂芝, 廖强, 王永忠. 微生物固定化载体材料研究进展[J]. 材料导报, 2011, 25(17): 105-109. He X M, Ding L L, Zhang L L, et al. Performance, sludge characteristics and the microbial community dynamics of bulking sludge under different nitrogen and phosphorus imbalances[J]. Environmental Science, 2011, 25(17): 105-109. (  0) 0) |
| [31] |
于凤娥, 叶志平, 郭杏妹, 等. 沸石的改性及其在废水处理中的应用[J]. 广东化工, 2016, 38(6): 431-436. Yu F E, Ye Z P, Guo X M, et al. The method of modifying zeolite and their application in wastewater treatment[J]. Guangdong Chemical Industry, 2016, 38(6): 431-436. (  0) 0) |
| [32] |
姜霞, 周小宁, 丁明玉, 等. 天然沸石及改性沸石去除低浓度氨氮的研究[J]. 环境科学研究, 2008, 21(5): 37-42. Jiang X, Zhou X N, Ding M Y, et al. Study on low concentration ammonia nitrogen removal by natural and modified clinoptilolites[J]. Research of Environmental Sciences, 2008, 21(5): 37-42. (  0) 0) |
| [33] |
姚丽群, 高利平, 托罗别克, 等. 活性炭的表面化学改性及其对有机硫化物的吸附性能的研究[J]. 燃料化学学报, 2006, 34(6): 749-752. Yao L Q, Gao L P, Tuo L P K, et al. Chemicalmodification of activated carbon surface and its adsorption propertyof organic sulfur complexes[J]. Journal of Fuel Chemistry and Technology, 2006, 34(6): 749-752. DOI:10.3969/j.issn.0253-2409.2006.06.022 (  0) 0) |
| [34] |
Bayazidi P, Almasi H, Asl A K. Immobilization of lysozyme on bacterial cellulose nanofibers: Characteristics, antimicrobial activity and morphological properties[J]. International Journal of Biological Macromolecules, 2018, 107: 2544-2551. DOI:10.1016/j.ijbiomac.2017.10.137
(  0) 0) |
| [35] |
Lian Z, Ma Z, Wei J, et al. Preparation and characterization of immobilized lysozyme and evaluation of its application in edible coatings[J]. Process Biochemistry, 2012, 47(2): 201-208.
(  0) 0) |
| [36] |
梅佳军, 张常青, 刘嵘明, 等. 利用改性载体固定化大肠杆菌产琥珀酸[J]. 化工进展, 2013, 32(1): 161-165. Mei J J, Zhang C Q, Liu R M, et al. Succinic acid production with immobilized cells of Escherichia coli onmodified carrier[J]. Chemical Industry and Engineering Progress, 2013, 32(1): 161-165. (  0) 0) |
 2019, Vol. 49
2019, Vol. 49


