2. 中国海洋大学化学化工学院,山东 青岛 266100;
3. 江汉大学环境与健康研究院,湖北 武汉 430056
汞(Hg)是一种广泛存在于自然环境的全球性有毒污染物。汞可通过大气环流在全球范围内传输[1],对人及动物的神经系统有很强的毒性,是世界卫生组织公认的十大危害公众健康的化学物质之一[2]。海洋在全球汞循环中起着重要作用,是汞重要的源和汇[3]。干湿沉降或直接排放至海洋环境中的无机汞经微生物甲基化可以转化为毒性很强的单甲基汞[4],再经过生物富集和食物链放大,最终可以在鱼体内累积到较高浓度,从而对人类和其它生物造成巨大威胁[5]。
汞在海洋环境中主要有四种存在形式:零价汞(Hg0)、二价汞(Hg2+)、单甲基汞(MMHg)和二甲基汞(DMHg)[6-7]。总甲基汞(TMeHg)包括MMHg和DMHg,其中,DMHg是目前已知的毒性最强的有机汞化合物之一,可对人的神经系统产生严重危害,数微升即可致死[8-9]。DMHg具有易挥发的特点,尽管海水中浓度较低,但其在海洋汞循环中起着重要作用。已有研究结果显示,DMHg广泛分布于大洋深层水(如太平洋[10]、地中海[11-12]、阿尔沃兰海[13]等)、沿岸上升流区[14]以及极地海域[15]。据估算,每年通过海-气交换进入大气中的DMHg总量约为2 t[16]。海洋中DMHg浓度较低,可能与水体中DMHg的较快降解有关[6]。在对极地水体的研究中发现,海水中MMHg进一步甲基化生成DMHg的速率显著高于Hg2+甲基化生成DMHg的速率,推测海水中的DMHg很可能主要来源于单甲基汞的再甲基化[14]。此外,有研究表明,DMHg是大洋深层水中汞的主要甲基化形态[10],并推测大洋深层水中单甲基汞很可能主要来源于DMHg的生物降解。DMHg降解生成的MMHg会提高深层水中MMHg的生物可利用性,使MMHg能够随食物链富集,并最终对人体健康产生危害[17-18]。
东海是中国重要的陆架边缘海,沿岸工业生产和人类活动导致大量汞排入东海。据估算每年由陆源输入到东海的汞总量高达144 t[19]。目前关于东海的汞污染研究主要集中在沉积物及水体中总甲基汞、总汞的分布情况[20-21],对于该海域DMHg浓度、分布及其控制因素尚无报道,制约了对东海汞赋存形态和循环的理解和认识。本研究于2018年夏季在东海开展了航次调查,测定了水体中DMHg、TMeHg浓度及相关的环境参数,探究了东海水体中DMHg的空间分布特征,并通过Spearman相关性分析和多元回归分析识别了影响东海水体中DMHg分布的主要环境因素。
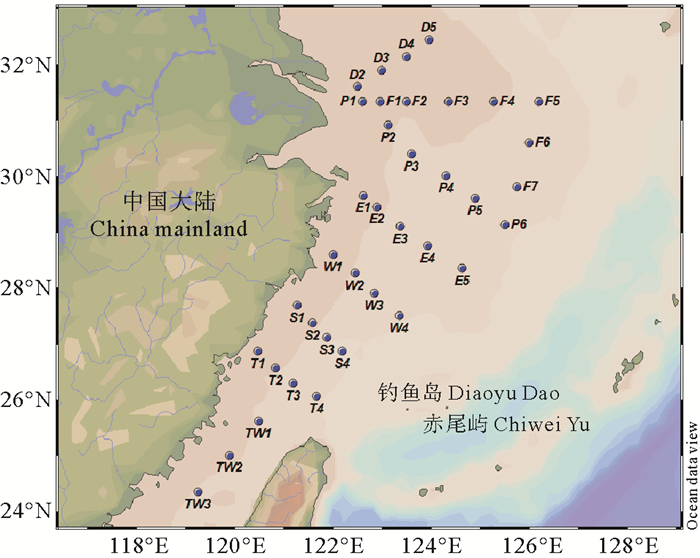
1 材料和方法 1.1 采样本研究于2018年6月搭载“东方红2”科考调查船在东海海域开展了现场调查,设置采样站位37个,调查海区及取样站位如图 1所示。使用Niskin(24个×12 L)采水器(General Oceanics, USA)分别采集表层(0~3 m)、10、30、50和75 m和底层海水,将采集的海水缓慢转移至2 L硼硅玻璃瓶中,直至顶空,用于现场测定DMHg。向45 mL未过滤海水中加入一定体积的盐酸至0.5%(v/v),-20 ℃条件下冷冻保存用于测定TMeHg。
|
图 1 2018年夏季东海航次采样站位 Fig. 1 Sampling stations in the East China Sea in summer 2018 |
海水中DMHg测定参照Tseng[22]和Lamborg[23]的方法。将采集样品缓慢转移至2.5 L的气泡瓶中(包裹铝箔纸),气泡瓶出气口连接Tenax捕集管,高纯氮气(600 mL/min)吹扫20 min后将捕集管取下,氮气吹扫5 min使其干燥。捕集在Tenax管上的DMHg在200 ℃热解吸后,经OV-3填充柱气相色谱分离(70 ℃)和800 ℃热裂解后由冷原子荧光仪(MODEL Ⅲ,美国Brooks Rand公司)检测(载气流速为10 mL/min)。本研究中DMHg的出峰时间参照孙婷等的方法[24],在实验室合成DMHg捕集至Tenax管中,并用于现场测定时DMHg出峰时间的确定。
TMeHg的测定参照美国EPA1630方法[25]。向特氟龙蒸馏瓶内加入45 mL样品,然后加入200 μL 1%APDC溶液,125 ℃加热条件下通高纯氮气(90 mL/min)蒸馏,约2.5~4 h后收集得到35 mL蒸馏样品。将蒸馏后的样品转移至气泡瓶内,补充超纯水至100 mL,加入2 mL醋酸缓冲液、50 μL四乙基硼化钠(NaBEt4)反应15 min,然后通高纯氮气(200 mL/min)吹扫15 min将乙基化产物捕集于Tenax管上。捕集在Tenax管上的甲基乙基汞在200 ℃热解吸后,经OV-3填充柱气相色谱分离(70 ℃)和800 ℃热裂解后由冷原子荧光仪(MODEL Ⅲ,美国Brooks Rand公司)检测(载气流速为35 mL/min)。
1.3 质量控制TMeHg和DMHg的检出限分别为0.02 ng/L和0.04 pg/L。为保证TMeHg分析结果的准确性,每测定20个样品添加2个方法空白、2个加标回收,并随机抽取一个样品测定三次。本研究中TMeHg和DMHg的方法空白为0.01~0.02 ng/L和(0.04±0.02) pg/L。TMeHg样品的加标回收率为90%~123%,在EPA方法可接受的回收率范围内(65%~135%); 平行样的相对标准偏差为2.8%~11.2%,在EPA方法要求范围内(小于15%)。
1.4 数据处理平面分布、垂直分布采用Ocean Data View(AWI,Germany)绘制。Spearman相关性分析、多元回归分析和one-way ANOVA分析使用SPSS 16.0(SPSS Inc.,Chicago,IL)软件完成。
2 结果与讨论 2.1 东海水体中二甲基汞浓度的平面分布特征2018年夏季东海航次采集海水中DMHg浓度为(0.66±1.48) pg/L(0~8.82 pg/L),DMHg占TMeHg的比例(DMHg/TMeHg)为(0.6±4.9)%(TMeHg的平均浓度为(0.11±0.035) ng/L(0.05~0.23 ng/L)。与其他海洋体系相比,东海水体中DMHg浓度显著低于多数大洋水体(如北大西洋[11]、蒙特雷湾[23]等),而与报道的地中海亚得里亚海(0.04~5.87 pg/L)结果相近[11]。
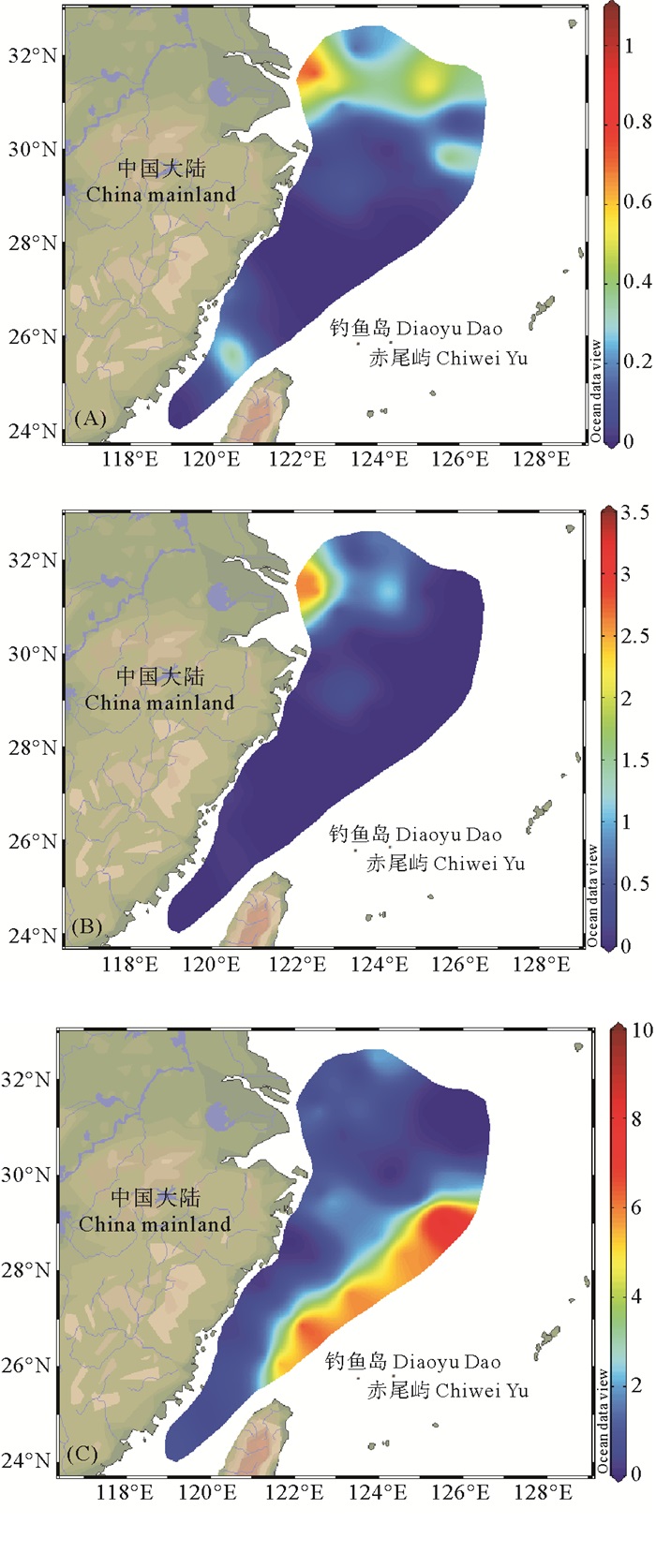
在平面分布上,夏季东海水体中DMHg检出区域主要集中分布在长江口附近的表层水和10 m水层(见图 2(A)、(B)); 东海外海站位的底层水中也存在DMHg的分布高值区,并呈现出相对集中的分布趋势(见图 2(C))。目前关于海水中DMHg的产生机制尚不明确,已有研究表明,水体中浮游植物及深层水中的厌氧微生物能够促进DMHg的生成[26],在本研究中近岸浅层水中较高的DMHg浓度可能是由于藻类活动促进了DMHg的原位生成,东海外海深层水中高值区可能归因于厌氧微生物,相关机制尚需进一步研究。
|
图 2 夏季东海表层(A)、10 m层(B)和底层(C) 水体中DMHg (pg/L)的平面分布 Fig. 2 Spatial distribution of DMHg (pg/L) in surface (A), 10 m (B) and bottom (C) water of the East China Sea in summer |
在垂直分布上,夏季东海水体中DMHg的浓度在表层为(0.17±0.28) pg/L(0~1.21 pg/L),10 m层为(0.32±0.76) pg/L(0~3.37 pg/L),30 m层为(0.43±0.85) pg/L(0~4.31 pg/L),50 m层为(0.47±0.51) pg/L(0~1.56 pg/L),75 m层为(3.80±3.20) pg/L(0.82~8.82 pg/L),底层为(1.33±2.25) pg/L(0~8.72 pg/L)。结果显示,75 m层和底层水中DMHg的浓度较高; 随着水深的增加,DMHg的浓度呈递增趋势。
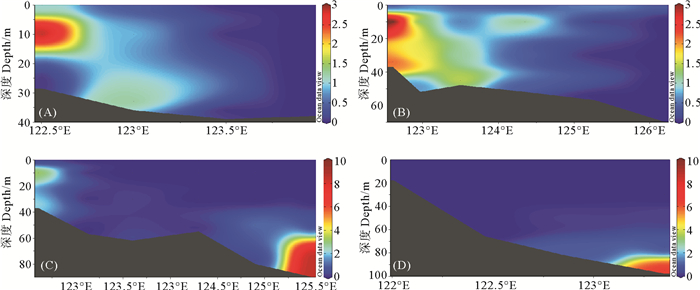
本研究选取了4个断面(D2-D3-D4-D5、P1-F1-F2-F3-F4-F5、P1-P2-P3-P4-P5-P6和W1-W2-W3-W4)来探究东海水体中DMHg的垂直分布特征(见图 3)。结果显示,在D2-D5和P1-F5断面,海水中DMHg呈现出相似的分布趋势,高值区主要位于长江口附近,呈近岸高、外海低的分布趋势。据研究,河口区域藻类活动会促进甲基态汞(主要是单甲基汞和二甲基汞)的形成[33],推测长江口附近较高浓度的DMHg可能是由于该区域的藻类活动造成的。此外,在对近岸浅层水的研究中发现,受沿岸上升流及温跃层的影响,浅层水体中可以检测到一定浓度的DMHg[13],推测东海浅层水体中DMHg还可能来源于上升流输送。在W1-W4及P1-P6断面,水体中DMHg呈现出典型的集中分布趋势,高值区主要集中在外海的底层水中(低温、高盐环境)。有研究表明,厌氧环境中MMHg可与细菌产生的硫化物发生反应后缓慢分解产生DMHg[26, 34],同时,矿物或有机质表面的还原性硫基可吸附MMHg,通过降解吸附的MMHg可以促进DMHg的生成[35]。由此推测底层水中DMHg产生由生物途径与非生物途径共同介导[26]。
|
图 3 夏季东海水体中DMHg(pg/L)在D2-D5(A)、P1-F5(B)、P1-P6(C)和W1-W4(D)断面的垂直分布 Fig. 3 Vertical distribution of DMHg (pg/L) at sections of D2-D5 (A), P1-F5 (B), P1-P6 (C) and W1-W4 (D) in East China Sea water in summer |
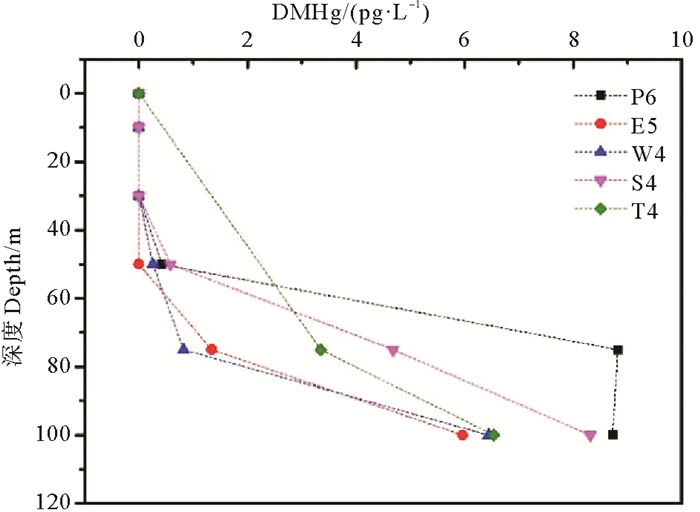
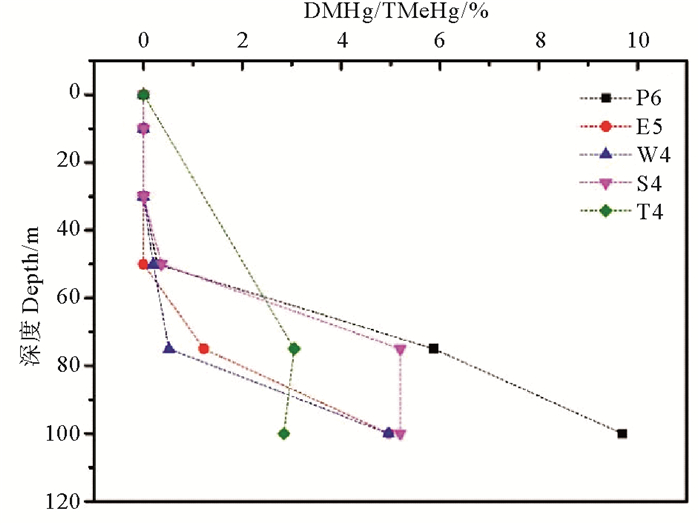
本研究进一步选取了采集区域靠近外海的5个站位(P6、E5、W4、S4、T4)来探索海水中DMHg浓度的垂直变化特征(见图 4)。结果表明,在水深小于50 m时,DMHg均未检出; 随着水深的增加,东海外海站位水体中DMHg浓度明显上升,检出区域主要集中在75 m层和底层海水中。研究表明,在光照或者存在氧化剂(·OH)的条件下,水体中的DMHg易被氧化而降解生成MMHg[36],这与本研究中东海表层水DMHg较低的检出率相吻合。
|
图 4 夏季东海外海站位水体中DMHg浓度垂直分布 Fig. 4 Vertical distribution of DMHg at the offshore stations in ECS water in summer |
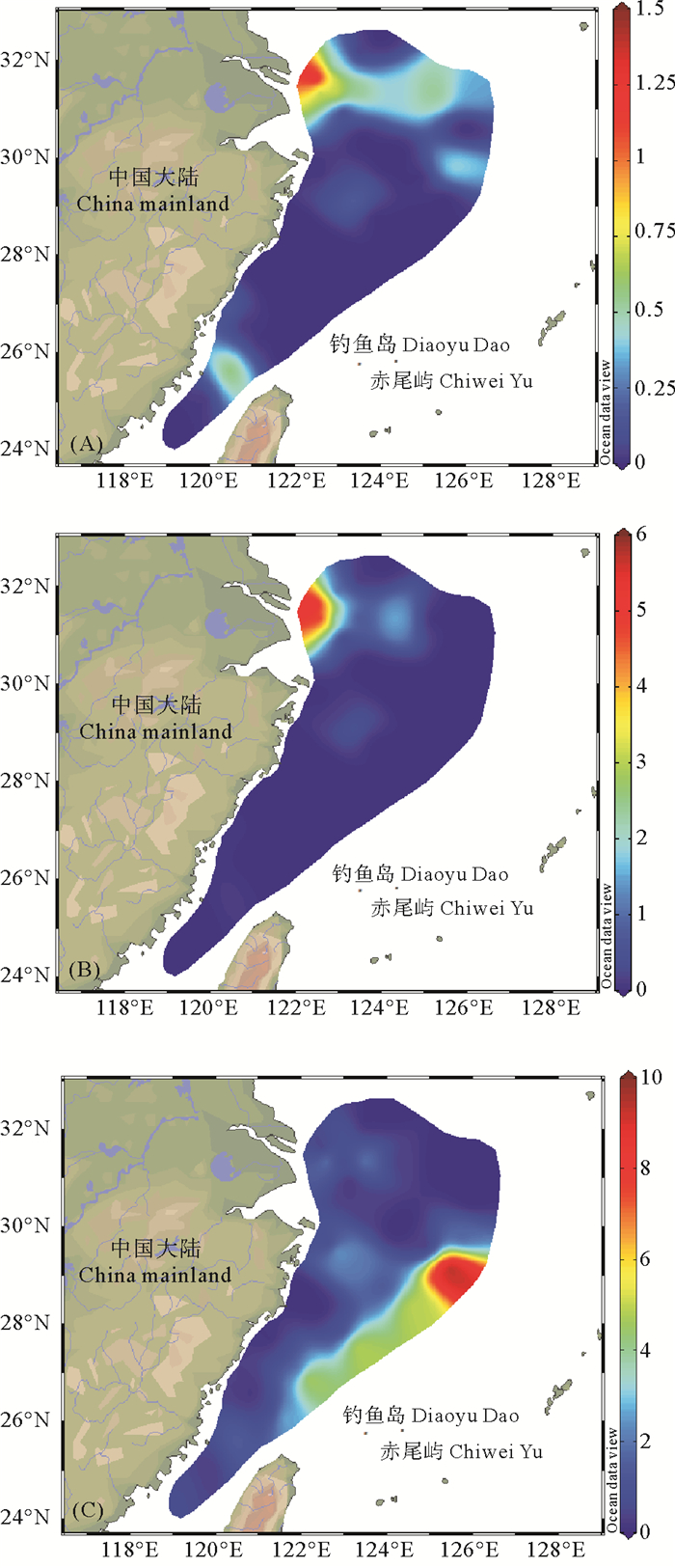
DMHg占TMeHg的比例(DMHg/TMeHg)为(0.6±4.9)%(见表 1),目前关于DMHg/TMeHg的研究报道较少,其中北冰洋的夏季表层水和底层水中DMHg/TMeHg为27.8%和53.3% [28],高于东海DMHg占TMeHg的占比。地中海区域的亚得里亚海报道的DMHg/TMeHg为1.7%[11],与本研究结果相近。平面分布上,DMHg/TMeHg高值区与DMHg浓度高值区基本吻合,主要集中分布在长江口附近的浅层水(见图 5(A)和图 5(B))以及东海外海站位的底层水中(见图 5(C))。与DMHg分布趋势不同,外海底层DMHg/TMeHg高值区分布更为集中。DMHg/TMeHg的垂直变化趋势与DMHg相吻合,随着深度的增加DMHg占比逐渐增加(见图 6)。
|
|
表 1 东海水体中TMeHg、DMHg、DMHg/TMeHg(%) 及与其他海洋体系比较 Table 1 Comparison of TMeHg, DMHg concentrations and DMHg/TMeHg ratio in seawater of the East China Sea with other marine systems |
|
图 5 夏季东海表层(A)、10 m层(B)和底层(C) 水体中DMHg/TMeHg(%)的平面分布 Fig. 5 Spatial distribution of DMHg/TMeHg(%) in surface (A), 10 m (B) and bottom (C) water of the East China Sea in summer |
|
图 6 夏季东海外海站位水体中DMHg/TMeHg垂直分布 Fig. 6 Vertical distribution of DMHg/TMeHg at the offshore stations in ECS water in summer |
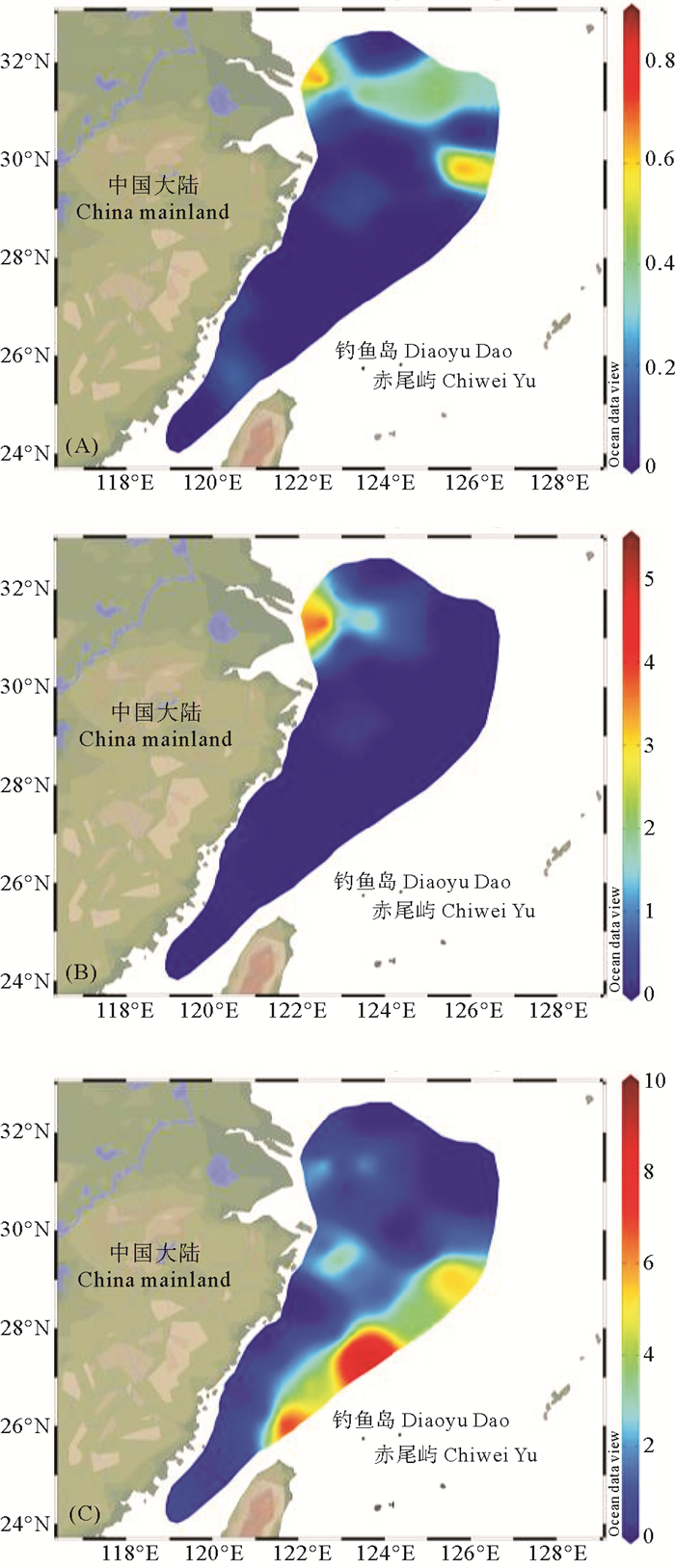
溶解气态汞(DGM)包括Hg0和DMHg,是参与海-气界面交换的主要汞形态,DGM的再释放过程可以影响海洋汞赋存量,DMHg是海水气态汞循环中重要的组成部分[27]。DMHg占DGM的比例(DMHg/DGM)为(0.6±1.5)% (DGM数据引自文献[37])。有研究表明,近海及浅层大洋水体中DGM主要以Hg0为主,而DMHg占比较低(< 5%)[27, 38],与本研究结果比较吻合。大洋深层海水中DGM主要以DMHg为主(70%以上)[10, 39],要远高于东海占比。平面分布上,DMHg/DGM高值区与DMHg浓度高值区基本吻合,主要集中分布在长江口附近的浅层水(见图 7(A)和图 7(B))以及东海外海站位的底层水中(见图 7(C)),且在外海底层呈斑块状分布。
|
图 7 夏季东海表层(A)、10 m层(B)和底层(C) 水体中DMHg/DGM的平面分布 Fig. 7 Spatial distribution of DMHg/DGM in surface (A), 10 m (B) and bottom (C) water of the East China Sea in summer |
首先利用Spearman相关性分析挑选出与DMHg相关的环境参数(P < 0.05),再通过多元回归分析识别出主要的控制因素。Spearman相关性分析结果表明,夏季东海水体中DMHg与水温T(R=-0.49,P < 0.001)、溶解氧DO(R=-0.31,P < 0.001)和溶解有机碳DOC(R=-0.31,P < 0.001)呈显著负相关关系,而与盐度(R=0.38,P < 0.001)呈显著正相关。多元回归分析结果表明,溶解氧(β=-0.29)、水温(β=-0.24)和溶解有机碳(β=-0.11)可能是影响水体中DMHg分布的关键控制因素。
微生物途径是海洋DMHg生成的主要途径[35]。研究表明,微生物在厌氧条件下产生的硫化氢(H2S)能够与单甲基汞发生歧化反应生成不稳定的二甲基硫化汞((MeHg)2S)中间体,随后又会快速降解为DMHg和硫化汞(HgS)[26]。本研究中夏季东海水体DMHg与DO呈负相关关系,推测DO通过影响微生物介导的H2S与单甲基汞的歧化反应从而影响了DMHg的生成。甲基汞广泛存在于各种介质中,而报道的DMHg大多存在于深层海水中,且总是相对集中地分布在特定区域[10, 12],可能是由于表层海水中海-气交换以及水温和光照的增强均会促进DMHg的降解[17, 32, 40],这可能是DMHg与水温呈负相关的原因之一。此外,温度也会影响生成或降解DMHg的微生物的活性,从而影响DMHg的分布。溶解性有机质(DOM)也是影响微生物活性的重要环境因素[41],可能通过影响生成或降解DMHg微生物的活性影响DMHg的分布。此外,DOM可以与MMHg络合,络合后可以显著降低MMHg进一步甲基化生成二甲基汞的活性[42],这可能也是DMHg与DOC呈负相关的主要原因之一。
本文对于东海水体中二甲基汞控制因素的识别主要基于相关性分析结果推测,鉴于相关性分析的局限性,相关结论需要在明确东海二甲基汞产生途径基础上通过现场条件培养实验进一步进行验证。
|
|
表 2 夏季东海水体中DMHg与环境参数的关系 Table 2 The relationships of DMHg with environmental parameters in East China Sea water in summer |
2018年夏季东海航次水体中DMHg浓度为(0.66±1.48) pg/L(0~8.82 pg/L),DMHg浓度显著低于多数大洋水体。东海水体DMHg占TMeHg的比例(DMHg/TMeHg)为(0.6±4.9)%,DMHg占DGM的比例(DMHg/DGM)为(0.6±1.5)%。平面分布上,DMHg高值区主要位于长江口附近的表层水、10 m水层以及东海外海的底层水中; 垂直分布上,DMHg的浓度随水深的增加呈递增趋势。东海水体中DMHg可能主要受原位生成过程控制。Spearman相关性分析和多元回归分析结果表明,溶解氧、水温和溶解有机碳是影响水体中DMHg分布的关键控制因素。
| [1] |
Ci Z J, Zhang X S, Wang Z W, et al. Distribution and air-sea exchange of mercury (Hg) in the Yellow Sea[J]. Atmospheric Chemistry and Physics, 2011, 11(6): 2881-2892. DOI:10.5194/acp-11-2881-2011 (  0) 0) |
| [2] |
Ullrich S M, Tanton T W, Abdrashitova S A. Mercury in the aquatic environment: A review of factors affecting methylation[J]. Critical Reviews in Environmental Science and Technology, 2001, 31(3): 241-293. DOI:10.1080/20016491089226 (  0) 0) |
| [3] |
UNEP, Global Mercury Assessment 2018: Sources, Emissions, Release, and Environmental transport[R]. Geneva, Switzerland: UNEP Chemical Branch, 2018.
(  0) 0) |
| [4] |
Li M, Schartup A T, Valberg A P, et al. Environmental origins of methylmercury accumulated in subarctic estuarine fish indicated by mercury stable isotopes[J]. Environmental Science & Technology, 2016, 50(21): 11559-11568. (  0) 0) |
| [5] |
Clarkson T W, Magos L. The toxicology of mercury and its chemical compounds[J]. Critical Reviews in Toxicology, 2006, 36(8): 609-662. DOI:10.1080/10408440600845619 (  0) 0) |
| [6] |
Mason R P, Fitzgerald W F. The distribution and biogeochemical cycling of mercury in the equatorial Pacific-Ocean[J]. Deep-Sea Research Part Ⅰ-Oceanographic Research Papers, 1993, 40(9): 1897-1924. DOI:10.1016/0967-0637(93)90037-4 (  0) 0) |
| [7] |
Bowman K L, Hammerschmidt C R, Lamborg C H, et al. Distribution of mercury species across a zonal section of the eastern tropical south pacific ocean (US GEOTRACES GP16)[J]. Marine Chemistry, 2016, 186: 156-166. DOI:10.1016/j.marchem.2016.09.005 (  0) 0) |
| [8] |
Kirk J L, Louis V L S, Hintelmann H, et al. Methylated mercury species in marine waters of the Canadian high and sub Arctic[J]. Environmental Science & Technology, 2008, 42(22): 8367-8373. (  0) 0) |
| [9] |
Fitzgerald W F, Lamborg C H, Hammerschmidt C R. Marine biogeochemical cycling of mercury[J]. Chemical Reviews, 2007, 107(2): 641-662. DOI:10.1021/cr050353m (  0) 0) |
| [10] |
Mason R P, Morel F M M, Hemond H F. The role of microorganisms in elemental mercury formation in natural-waters[J]. Water Air and Soil Pollution, 1995, 80(1-4): 775-787. DOI:10.1007/BF01189729 (  0) 0) |
| [11] |
Kotnik J, Horvat M, Ogrinc N, et al. Mercury speciation in the Adriatic Sea[J]. Marine Pollution Bulletin, 2015, 96(1-2): 136-148. DOI:10.1016/j.marpolbul.2015.05.037 (  0) 0) |
| [12] |
Kotnik J, Horvat M, Begu E, et al. Dissolved gaseous mercury (DGM) in the Mediterranean Sea: Spatial and temporal trends[J]. Marine Chemistry, 2017, 193: 8-19. DOI:10.1016/j.marchem.2017.03.002 (  0) 0) |
| [13] |
Cossa D, Martin J M, Sanjuan J. Dimethylmercury formation in the Alboran Sea[J]. Marine Pollution Bulletin, 1994, 28(6): 381-384. DOI:10.1016/0025-326X(94)90276-3 (  0) 0) |
| [14] |
Conaway C H, Black F J, Gault-Ringold M, et al. Dimethylmercury in coastal upwelling waters, Monterey Bay, California[J]. Environmental Science & Technology, 2009, 43(5): 1305-1309. (  0) 0) |
| [15] |
Lehnherr I, St Louis V L, Hintelmann H, et al. Methylation of inorganic mercury in polar marine waters[J]. Nature Geoscience, 2011, 4(5): 298-302. DOI:10.1038/ngeo1134 (  0) 0) |
| [16] |
Mason R P, Choi A L, Fitzgerald W F, et al. Mercury biogeochemical cycling in the ocean and policy implications[J]. Environmental Research, 2012, 119: 101-117. DOI:10.1016/j.envres.2012.03.013 (  0) 0) |
| [17] |
Morel F M M, Kraepiel A M L, Amyot M. The chemical cycle and bioaccumulation of mercury[J]. Annual Review of Ecology and Systematics, 1998, 29: 543-566. DOI:10.1146/annurev.ecolsys.29.1.543 (  0) 0) |
| [18] |
Mergler D, Anderson H A, Chan L H M, et al. Methylmercury exposure and health effects in humans: A worldwide concern[J]. Ambio, 2007, 36(1): 3-11. DOI:10.1579/0044-7447(2007)36[3:MEAHEI]2.0.CO;2 (  0) 0) |
| [19] |
Liu M, Chen L, Wang X, et al. Mercury export from mainland china to adjacent seas and its influence on the marine mercury balance[J]. Environmental Science & Technology, 2016, 50(12): 6224-6232. (  0) 0) |
| [20] |
Duan L Q, Song J M, Yu Y, et al. Spatial variation, fractionation and sedimentary records of mercury in the East China Sea[J]. Marine Pollution Bulletin, 2015, 101(1): 434-441. DOI:10.1016/j.marpolbul.2015.09.050 (  0) 0) |
| [21] |
Liu C, Chen L F, Liang S K, et al. Distribution of total mercury and methylmercury and their controlling factors in the East China Sea[J]. Environmental Pollution, 2020, 258: 1-10. (  0) 0) |
| [22] |
Tseng C M, Lamborg C, Fitzgerald W F, et al. Cycling of dissolved elemental mercury in Arctic Alaskan lakes[J]. Geochimica Et Cosmochimica Acta, 2004, 68(6): 1173-1184. DOI:10.1016/j.gca.2003.07.023 (  0) 0) |
| [23] |
Lamborg C H, Yigiterhan O, Fitzgerald W F, et al. Vertical distribution of mercury species at two sites in the western Black Sea[J]. Marine Chemistry, 2008, 111(1-2): 77-89. DOI:10.1016/j.marchem.2007.01.011 (  0) 0) |
| [24] |
孙婷, 王章玮, 陈剑, 等. 气态二甲基汞的发生系统与产生速率[J]. 环境化学, 2016, 35(9): 1792-1798. Sun T, Wang Z W, Chen J, et al. Efficient and stable gaseous dimethymercury generation system and generation rate[J]. Environmental Chemistry, 2016, 35(9): 1792-1798. (  0) 0) |
| [25] |
Liu G, Cai Y, Philippi T, et al. Distribution of total and methylmercury in different ecosystem compartments in the everglades: Implications for mercury bioaccumulation[J]. Environmental Pollution, 2008, 153(2): 257-265. DOI:10.1016/j.envpol.2007.08.030 (  0) 0) |
| [26] |
Rowland I R, Davies M J, Grasso P. Volatilisation of methylmercuric chloride by hydrogen sulphide[J]. Nature, 1977, 265(5596): 718-719. DOI:10.1038/265718a0 (  0) 0) |
| [27] |
Bowman K L, Hammerschmidt C R, Lamborg C H, et al. Mercury in the north Atlantic Ocean: The US GEOTRACES zonal and meridional sections[J]. Deep-Sea Research Part Ii-Topical Studies In Oceanography, 2015, 116: 251-261. DOI:10.1016/j.dsr2.2014.07.004 (  0) 0) |
| [28] |
Baya P A, Gosselin M, Lehnherr I, et al. Determination of monomethylmercury and dimethylmercury in the Arctic marine boundary layer[J]. Environmental Science & Technology, 2015, 49(1): 223-232. (  0) 0) |
| [29] |
St Louis V L, Hintelmann H, Graydon J A, et al. Methylated mercury species in Canadian high arctic marine surface waters and snowpacks[J]. Environmental Science & Technology, 2007, 41(18): 6433-6441. (  0) 0) |
| [30] |
Mason P R, Rolfhus K R, Fitzgerald W F. Mercury in the north Atlantic[J]. Marine Chemistry, 1998, 61(1-2): 37-53. DOI:10.1016/S0304-4203(98)00006-1 (  0) 0) |
| [31] |
Di Leonardo R, Bellanca A, Angelone M, et al. Impact of human activities on the central Mediterranean offshore: Evidence from Hg distribution in box-core sediments from the ionian sea[J]. Applied Geochemistry, 2008, 23(12): 3756-3766. DOI:10.1016/j.apgeochem.2008.09.010 (  0) 0) |
| [32] |
Horvat M, Kotnik J, Logar M, et al. Speciation of mercury in surface and deep-sea waters in the Mediterranean Sea[J]. Atmospheric Environment, 2003, 37: 93-108. (  0) 0) |
| [33] |
Pongratz R, Heumann K G. Production of methylated mercury, lead, and cadmium by marine bacteria as a significant natural source for atmospheric heavy metals in polar regions[J]. Chemosphere, 1999, 39(1): 89-102. DOI:10.1016/S0045-6535(98)00591-8 (  0) 0) |
| [34] |
Macinnis-Ng C M O, Ralph P J. Towards a more ecologically relevant assessment of the impact of heavy metals on the photosynthesis of the seagrass, Zostera capricorni[J]. Marine Pollution Bulletin, 2002, 45(1-12): 100-106. DOI:10.1016/S0025-326X(01)00300-9 (  0) 0) |
| [35] |
Jonsson S, Mazrui N M, Mason R P. Dimethylmercury formation mediated by inorganic and organic reduced sulfur surfaces[J]. Scientific Reports, 2016, 6: 27958. DOI:10.1038/srep27958 (  0) 0) |
| [36] |
Niki H M, Savage C M, Breitenbach L P. A fourier transform infrared study of the kinetics and mechanism for the reaction HO+ CH3COOH[J]. Cheminform, 1983, 14(39): 2190-2193. (  0) 0) |
| [37] |
程国益, 陈路锋, 刘畅, 等. 东海夏季溶解气态汞和活性汞分布特征及控制因素[J]. 海洋环境科学, 2020, 39(5): 768-775. Cheng G Y, Chen L F, Liu C, et al. Distribution of dissolved gaseous mercury and reactive Hg and their controlling factors in the East China Sea in summer[J]. Marine Environmental Science, 2020, 39(5): 768-775. (  0) 0) |
| [38] |
Kotnik J, Horvat M, Begu E, et al. Dissolved gaseous mercury (DGM) in the Mediterranean Sea: Spatial and temporal trends[J]. Marine Chemistry, 2017, 193: 8-19. DOI:10.1016/j.marchem.2017.03.002 (  0) 0) |
| [39] |
Cossa D, Heimbuerger L E, Lannuzel D, et al. Mercury in the Southern Ocean[J]. Geochimica et Cosmochimica Acta, 2011, 75(14): 4037-4052. DOI:10.1016/j.gca.2011.05.001 (  0) 0) |
| [40] |
Black F J, Conaway C H, Flegal A R. Stability of dimethyl mercury in seawater and its conversion to monomethyl mercury[J]. Environmental Science & Technology, 2009, 43(11): 4056-4062. (  0) 0) |
| [41] |
Liu Y R, Dong J X, Han L L, et al. Influence of rice straw amendment on mercury methylation and nitrification in paddy soils[J]. Environmental Pollution, 2016, 209: 53-59. DOI:10.1016/j.envpol.2015.11.023 (  0) 0) |
| [42] |
Outridge P M, Sanei L H, Stern G A, et al. Evidence for control of mercury accumulation rates in Canadian High Arctic lake sediments by variations of aquatic primary productivity[J]. Environmental Science & Technology, 2007, 41(15): 5259-5265. (  0) 0) |
2. The Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Ocean University of China, Qingdao 266100, China;
3. Institute of Environment and Health, Jianghan University, Wuhan 430056, China
 2022, Vol. 52
2022, Vol. 52


