三疣梭子蟹(Portunus trituberculatus)作为重要的海洋经济蟹类,含有丰富的蛋白质、多种矿物质及微量元素。三疣梭子蟹死后肌肉极易软化,很快出现空壳现象,不耐贮存。许多水产品在加工及贮藏过程中易出现自溶现象,有研究表明水产品中的内源酶直接或间接地加速了自身的肌肉软化[1-2],促进了自溶现象的发生。从海水鱼蓝圆鲹(Decapterus maruadsi)肌肉中分离纯化的可溶性丝氨酸蛋白酶,可强烈分解明胶和胶原蛋白,推测该丝氨酸蛋白酶参与鱼死后肌肉中胶原蛋白的分解,从而使肌肉软化[3]。三疣梭子蟹中也存在大量的蛋白酶类,其在分解自身蛋白和加速肌肉软化方面可能发挥着重要作用,因此合理控制蛋白酶类活性对于保障产品品质显得尤为重要。
酶变性失活的方法,大致可分为化学变性法和物理变性法。化学变性包括酸碱处理以及蛋白酶抑制剂处理,物理变性包括加热、超高压、超声和微波处理等。物理变性中又分为热处理和冷处理法,如加热属于热处理,超高压和超声则属于冷处理。超声波释放的能量也能使酶分子构象发生变化,从而导致酶的功能发生变化[4]。近年来,超声波技术作为一种非热加工方式已广泛应用于食品加工行业中,食品中酶的超声钝化成为研究热点[5],对果汁、乳制品的钝酶效果已被广泛报道[6-7]。本研究为探讨不同处理方式对酶的影响,选取了超声和加热两种处理方式处理实验室制备的三疣梭子蟹肝胰腺中丝氨酸蛋白酶(S75-1),对其结构和活性变化进行了比较分析。
1 材料与方法 1.1 材料与仪器鲜活的三疣梭子蟹,平均质量162 g左右,观察体表健康无病。购于青岛市团岛海鲜市场,冰温运输,30 min内到达实验室后立即处理,取出内脏放于-20 ℃备用。
Boc-Phe-Ser-Arg-MCA(PEPTIDE INSTITUTE, INC公司);7-氨基-4-甲基香豆素(AMC)(Sigma公司);电泳标准蛋白样液(宝日医生物技术有限公司);四甲基乙二胺(TEMED)、过硫酸铵(AP)、十二烷基磺酸钠(SDS)(上海索莱宝生物科技有限公司);三羟甲基氨基甲烷(Tris)、甲醇、异丙醇、丙酮、冰醋酸(上海国药集团化学试剂有限公司); Q Sephrose Fast Flow凝胶、Superdex 75凝胶(美国GE Healthcare公司)。
DYC-24D型垂直电泳槽(北京六一仪器厂);DYY-Ⅲ-4型稳压稳流电泳仪(北京六一仪器厂);Gel DocTM XR型凝胶成像分析仪(Bio-Rad公司);UV-2012PC紫外分光光度计(龙尼柯上海仪器有限公司);DK-S24型电热恒温水浴锅(精宏实验设备有限公司);KH5200DE型超声波清洗机(昆山禾创超声仪器公司);F-4600型荧光分光光度计(日本Hitachi公司);DS-1高速组织捣碎机(无锡沃信仪器有限公司)。
1.2 实验方法 1.2.1 丝氨酸蛋白酶的提取以三疣梭子蟹的肝胰腺为原料,分离纯化丝氨酸蛋白酶,具体参照前期方法[8]和Klomklao等[9]报道方法。提取制备流程:螃蟹取肝胰腺60 g→以料液比1:3(w/v)比例加入180 mL丙酮(-20 ℃)→组织捣碎机匀浆3 min→4层滤纸真空抽滤→残留物风干后获得粗酶粉末→以料液比1:4(w/v)比例加入240 mL预冷的Tris-HCl缓冲液(50 mol/L, pH=7.5)→匀浆1 h→静置3 h→离心15 min(4 ℃,12 000 r/min)→上清液即为粗酶液→对粗酶液进行30%~70%硫酸铵沉淀→沉淀用缓冲液复溶、透析→酶液进行Q Sepharose Fast Flow阴离子交换层析(0.4~1.2 mol/L NaCl)→Superdex 75凝胶过滤→获得纯化丝氨酸蛋白酶(记为S75-1)。
1.2.2 超声处理取10 mL上述纯化后的酶液S75-1,经稀释后采用功率依次为0、100、200、300、400和500 W超声波处理2 min;在功率为200 W超声波下对酶液分别处理0、2、4、6、8和10 min。处理后酶液采用荧光法测定吸光值,依据1.2.4中方法计算相对酶活力百分数。其中超声间歇比2:1 (超声2 s,间歇1 s)。
取10 mL未经稀释的酶液,在超声功率200 W作用下,处理30 min,随后再在400 W功率下处理20 min,超声间歇比2:1 (超声2 s,间歇1 s)。处理后酶液进行紫外光谱、荧光光谱和SDS-PAGE变性凝胶电泳分析。
1.2.3 加热处理将纯化后的酶液稀释103倍后,以Boc-Phe-Ser-Arg-MCA为底物,采用荧光法测定酶活力。具体操作为:将反应液(0.8 mL缓冲液、0.1 mL酶液和0.1 mL荧光底物的混合液)分别放入4、20、30、40、50、60、65、70和80 ℃水浴锅中,反应10 min后用1.5 mL荧光终止液终止反应;反应液用荧光分光光度计在激发波长380 nm和发射波长450 nm下测定荧光吸光值,计算相对酶活力百分数,测定其最适温度。
取1 mL稀释后的酶液放置于上述各温度下孵育15 min后,立即放入冰水中,用荧光法测定吸光值,计算相对酶活力百分数,测定酶的热稳定性。
取1 mL未经稀释的酶液,在65 ℃下加热处理15 min。处理后的酶液与未经处理的酶液进行紫外光谱和荧光光谱分析。
取1 mL未经稀释的酶液,在65 ℃下分别加热30 s、60 s、5 min、10 min、15 min。将处理后的酶液与未经处理的酶液进行SDS-PAGE变性凝胶电泳。
1.2.4 丝氨酸蛋白酶活力的测定参照Yoshida等[10]的方法,以Boc-Phe-Ser-Arg-MCA为底物,用荧光法测定酶活力。取0.1 mL待测样品加入0.8 mL Tris-HCl缓冲液(50 mmol/L,pH=7.5),随后加入0.1 mL,50 μmol/L荧光底物Boc-Phe-Ser-Arg-MCA,在55 ℃下反应10 min后,加入1.5 mL荧光终止液(甲醇:异丙醇:水=35:35:30)终止反应。混匀后,在激发波长380 nm和发射波长450 nm下测定其吸光值。以加入0.9 mL缓冲液、0.1 mL荧光底物和1.5 mL荧光终止液作为空白对照。每个样品作3组平行试验。该条件下,定义每分钟水解产生1 nmol AMC的酶量为一个蛋白酶活力单位(U)。
1.2.5 紫外光谱外界条件的影响能造成蛋白质紫外光谱峰位的变化。将经过超声和加热处理的样品与未经过处理的酶液,用紫外分光光度计进行紫外光谱扫描,波长范围为230~320 nm。
1.2.6 常规内源荧光将待测样品进行荧光光谱扫描,其中激发波长为280 nm时,发射光谱扫描范围300~400 nm;激发波长为295 nm时,发射光谱扫描范围320~370 nm。激发与发射狭缝宽度5 nm,扫描速率1 200 nm/min。
1.2.7 同步内源荧光将待测样品分别在波长差为15和60 nm下进行同步荧光扫描。同步荧光测定Δλ=15 nm时,扫描范围为270~320 nm;Δλ=60 nm时,扫描范围为250~320 nm。激发与发射狭缝宽度5 nm,扫描速率1 200 nm/min。
1.2.8 SDS-PAGE将待测样品进行SDS-PAGE电泳,电泳条件为:12%分离胶,5%浓缩胶,4倍上样缓冲液,上样量15μL,浓缩胶电压80 V,分离胶电压100 V;Marker分子质量为(6.5~200 kD)。电泳后,采用考马斯亮蓝R250染色30 min,甲醇和冰醋酸混合液脱色后进行对比分析。
1.3 数据分析数据处理采用软件SPSS 19.0和OriginPro8.5。试验结果取3次平行试验的平均值,并进行了显著性分析。
2 结果与分析 2.1 超声波处理对丝氨酸蛋白酶S75-1酶活力的影响超声波处理会对酶的活性造成重要影响。不同超声功率对S75-1酶活力的影响情况,如图 1A所示。在超声处理2 min条件下,不同超声波功率对S75-1的相对酶活力百分数均有极显著性影响(P<0.01)。当超声波功率为100 W时,S75-1的相对酶活力百分数显著性上升了6.93%,当超声波的功率超过100 W后,随着超声波功率的增加,其相对酶活力百分数逐渐降低;当功率达到500 W时,S75-1相对酶活力百分数降低了37.53%。
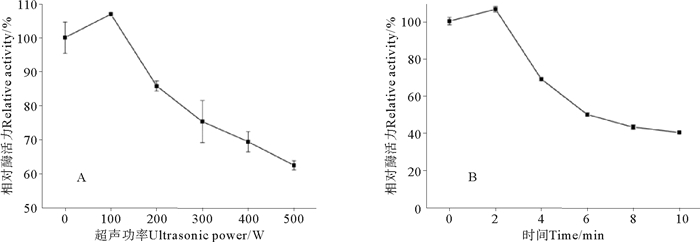
|
(A.超声时间2 min; B.超声功率200 W。A.Ultrasonic time 2 min; B.Ultrasonic power 200 W.) 图 1 超声功率(A)和超声时间(B)对丝氨酸蛋白酶S75-1活力的影响 Fig. 1 Effect of ultrasonic power (A) and time (B) treatment on the activity of serine enzyme S75-1 |
在超声波功率100 W情况下,不同处理时间对S75-1的相对酶活力百分数均有极显著性影响(P<0.01),如图 1B所示。当超声处理时间为2 min时,S75-1相对酶活力百分数显著上升6.44%,此结果也与上述超声波功率处理结果相一致;当超声的处理时间达到10 min时,相对酶活力百分数降低59.71%。由此可知,小功率、短时间超声波处理可显著增加S75-1的酶活力,但随着超声功率及处理时间的延长,酶活力会显著降低。
酶作为一种生物大分子,其活力的保持取决于酶的分子构象。超声波作用于酶分子时,所释放出的能量可能会使酶分子构象发生变化;若能量强度适中,在促使酶分子能量增加和介质温度增大的同时,也会使酶分子的微结构更加合理,从而使酶表现出更高的催化活性[11]。很多文献提出,在一定条件下,超声处理能增加某些酶的酶活,如超声功率250 W条件下,处理10 min能将胰蛋白酶水解率提高33%[12]。Vargas[13]等用20 kHz超声波处理器处理黑曲霉中转移酶,发现在振幅为20%的情况下,处理8 min能显著提高转移酶活;Wang J[14]等指出当超声条件为超声强度0.5 W/cm2、超声频率40 kHz时,蒜氨酸酶活显著提高。本试验中随着功率或时间的增加,丝氨酸蛋白酶酶活力降低,也与文献[15-17]报道结果类似,其可能是由于蛋白质结构中的侧链基团发生了变化,导致了酶的聚合,影响了酶的活性位点,从而降低了酶的稳定性[18],也可能是加热处理使酶中部分结构降解从而失活[16]。
2.2 加热处理对丝氨酸蛋白酶S75-1酶活力的影响以Boc-Phe-Ser-Arg-MCA为底物,温度为横坐标,相对酶活力为纵坐标绘制曲线。
由图 2A结果可见,不同温度对S75-1的相对酶活力有显著性影响(P<0.05)。当处理温度为4~60℃时,S75-1相对酶活力随温度的升高而增加;当温度达到60℃时,S75-1的相对酶活力达到最大;但当温度超过60℃后,其相对酶活力逐渐降低;当温度超过65℃后,相对酶活力极显著降低(P<0.01),其相对酶活力不到30%。由图 2B可见,S75-1在低于55℃下孵育15 min,相对酶活均保持在80%以上,其在50℃时具有最高酶活力,然后随着温度的升高相对酶活力呈下降趋势,当温度到达65℃以上时,S75-1酶活几乎全部丧失。
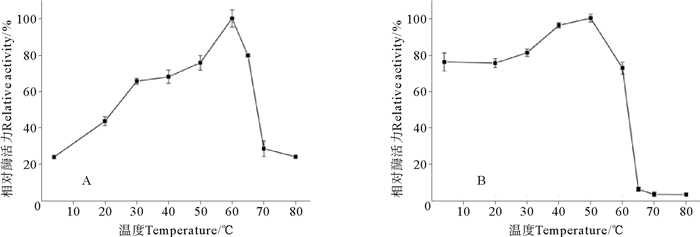
|
(A.最适温度; B.热稳定性。A.Optimum temperature; B.Thermal stability.) 图 2 加热处理对丝氨酸蛋白酶S75-1酶活力的影响 Fig. 2 Effect of heat treatment on the enzyme activity of serine protease S75-1 |
丝氨酸蛋白酶S75-1在以Boc-Phe-Ser-Arg-MCA为底物时,在反应温度为60℃时酶活最大,此结果与远洋梭子蟹(Portunus pelagicus)[19]类胰蛋白酶和鲶鱼(Clarias macrocephalus×Clarias gariepinus)[20]内脏中胰蛋白酶的最适温度60℃相同,高于以BAPNA为底物测定蓝鱼(Pomatomus saltatrix)[21]幽门盲囊中胰蛋白酶的最适温度55℃,高于以Boc-Phe-Ser-Arg-MCA为底物测定皇家红虾(Haliporoides sibogae)[22]胰蛋白酶的最适温度50℃,以及同样以此底物测定日本鲈鱼(Lateolabrax japonicus)[23]肝胰腺中2种胰蛋白酶的最适温度40℃。不同生物同种类型的酶最适温度也有所不同,这可能是由于不同生物生长环境的温度不同导致的。
在热稳定性研究中,丝氨酸蛋白酶S75-1在温度低于55℃时均保持较高活性,超过此温度后,酶活力开始降低。远洋梭子蟹[19]类胰蛋白酶为65℃,鲶鱼[20]内脏中胰蛋白酶、皇家红虾[22]胰蛋白酶均为50℃,从日本鲈[23]肝胰腺中的2种胰蛋白酶的45℃,明太鱼(Theragra chalcogramma)[24]幽门盲囊中的胰蛋白酶为30℃。S75-1在温度达到65℃时,酶活基本丧失,可能是由于热失活作用导致的。酶在高温下失活,可能是由于酶结构在高温下会部分伸展,破坏酶的作用位点,从而导致酶的活性降低或丧失。
2.3 超声和加热处理对丝氨酸蛋白酶S75-1的紫外光谱的影响在温度、pH和抑制剂等条件影响下,蛋白质溶液的紫外光谱通常会发生变化。通过紫外光谱的变化情况,可判断蛋白质中芳香族氨基酸残基的微环境是否发生了变化以及变化的趋势[25],也可以推断出蛋白质分子的构象变化。因为蛋白质分子的生色基团处于不同的微环境,蛋白质的分子构象影响微环境的性质。改变蛋白质的分子构象,其所处的微环境发生变化,生色基团的紫外吸收光谱随之改变[26]。
在组成蛋白质的氨基酸中,除含硫氨基酸外,仅有3种氨基酸在230~310 nm间有吸收,分别是色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)。当紫外光谱在280 nm处发生蓝移或红移时,说明蛋白质中这几种氨基酸残基的微环境发生了一定程度的变化。当光谱蓝移时,芳香族氨基酸残基的微环境疏水性增强,亲水性减弱;反之,当光谱红移时,芳香族氨基酸残基的微环境亲水性增强,疏水性减弱[27]。
超声处理和加热处理对S75-1紫外光谱的影响情况见图 3。从图 3可看出无论是超声处理还是加热处理,S75-1的紫外吸光度都出现了不同程度的上升。当酶液S75-1经过超声处理后,其紫外吸光值在250~280 nm处的峰位有发生蓝移,从280 nm蓝移到274 nm。这说明超声处理可能使S75-1中芳香族氨基酸的微环境疏水性增加。当酶液经过加热处理后,其紫外吸光值在250~280 nm处的峰位未有较大影响(迁移距离等于1 nm),峰位没有明显变化,说明温度对丝氨酸蛋白酶S75-1微环境的影响不大。
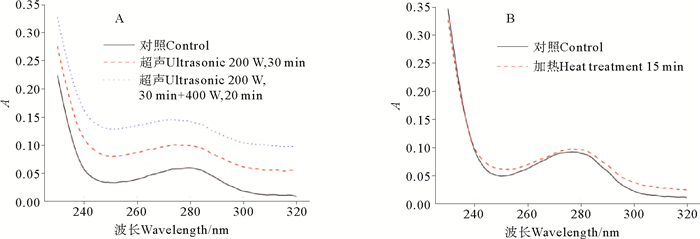
|
图 3 超声(A)和加热(B)处理对丝氨酸蛋白酶S75-1紫外光谱的影响 Fig. 3 Effect of ultrasonic (A) and heat (B) treatment on UV spectra of serine protease S75-1 |
外界条件同样影响蛋白质溶液的荧光光谱,通过在不同激发波长的内源荧光变化情况,可判断蛋白质的生色基团微环境是否发生了变化以及变化的趋势[28]。在组成蛋白质所有的氨基酸残基中,Trp、Tyr和Phe均能产生内源荧光,三者的荧光发射峰分别为348、303和282 nm[29]。所以,通常在发射波长为280和295 nm处能检测到荧光光谱,但Phe的荧光强度较弱,不容易被检测到,所以一般认为蛋白质的内源荧光大部分来源于Trp和Tyr。当激发波长为280 nm时,荧光全部来源于Trp和Tyr,但是以Trp为主,当激发波长为295 nm时,蛋白质的内源荧光全部来源于Trp[30-31]。
从图 4可以看出,三疣梭子蟹肝胰腺中S75-1在荧光激发波长280和295 nm下,超声和加热处理都使其荧光强度出现了不同程度的降低,这说明超声和加热都能引起S75-1在激发波长280和295 nm处的荧光猝灭效应。
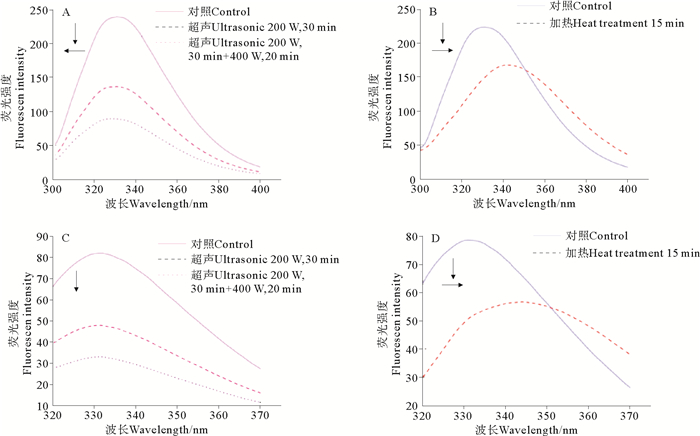
|
(A、B:激发波长280 nm;C、D:激发波长295 nm。A、B: Excitation wavelength 280 nm; C、D: Excitation wavelength 295 nm.) 图 4 超声和加热处理对丝氨酸蛋白酶S75-1荧光光谱的影响 Fig. 4 Effect of ultrasonic and heat treatment on fluorescence spectra of serine protease S75-1 |
当荧光激发波长为280 nm时,S75-1经过超声处理后,其内源荧光峰位发生了蓝移现象(见图 4A),即从331.2 nm蓝移到328.6 nm。经过加热处理后,S75-1内源荧光峰位发生了红移现象(见图 4B),即峰位从331.0 nm红移到343.0 nm。酶液S75-1内源荧光峰位发生蓝移,说明超声处理能使酶的荧光残基疏水性增强、亲水性减弱,由此推测,超声处理使得荧光残基微环境更加聚合,使其更加包埋在蛋白质结构内部,从而使其非极性增强,导致荧光光谱蓝移,此结果也与上述在紫外光谱检测结果一致[27]。加热处理却能使2种酶的内源荧光峰位发生红移,这说明加热处理能使酶的荧光残基亲水性增强、疏水性减弱,推测加热能使丝氨酸蛋白酶荧光残基处蛋白质结构更加疏松,荧光残基暴露在外面,极性增加,导致荧光光谱峰位红移[31]。
当荧光激发波长为295 nm时,超声处理(见图 4C)后S75-1的内源荧光峰位出现轻微迁移现象(迁移距离小于1 nm)。加热处理(见图 4D)后其内源荧光峰位发生了红移现象,峰位从331.2 nm红移到344.0 nm。加热处理能使其内源荧光峰位红移,这说明加热处理能使酶的Trp残基亲水性增强、疏水性减弱,同样推测,加热能使丝氨酸蛋白酶Trp残基的微环境更加疏松延展,导致荧光光谱峰位红移。
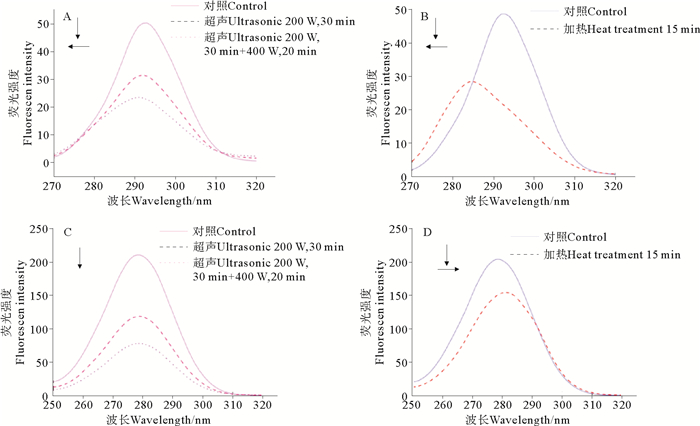
2.5 超声和加热处理对丝氨酸蛋白酶S75-1同步荧光光谱的影响同步荧光光谱技术是同时扫描激发和发射两个单色器波长,通过选择合适波长差(Δλ),可将在普通荧光光谱上相互重叠的荧光峰分开,具有简化光谱、窄化谱带和避免干扰等优点,常用来研究蛋白质构象的变化[32]。当Δλ=15 nm时,荧光光谱的红、蓝移反应蛋白质中Tyr微环境极性的变化情况;当Δλ=60 nm时,反映Trp微环境极性的变化情况[33]。
如图 5所示,当激发波长和发射波长之差为15和60 nm时,超声和加热处理都使S75-1的荧光强度出现了不同程度的降低,这说明超声和加热都能引起酶在激发波长和发射波长在波长差15和60 nm处的荧光猝灭效应。
|
(A、B:Δλ=15 nm;C、D:Δλ=60 nm) 图 5 超声和加热处理对丝氨酸蛋白酶S75-1的同步荧光光谱的影响 Fig. 5 Effect of ultrasonic and heat treatment on synchronous fluorescence spectra of serine protease S75-1 |
当Δλ=15 nm时,超声处理(见图 5A)使S75-1的峰位从292.4 nm蓝移到290.8 nm,说明超声处理使得S75-1的Tyr残基更加包埋在蛋白质结构内部而使其非极性增强,导致荧光光谱蓝移。加热处理(见图 5B)使其峰位从292.8 nm蓝移到284.8 nm,表明加热处理能使酶的Tyr残基疏水性增强、亲水性减弱。由此推测,加热能使酶发光基团Tyr残基的微环境更加聚合,导致荧光光谱蓝移,但是从激发波长280和295 nm的红移来看,加热对S75-1中Tyr残基的微环境的影响小于对Trp残基微环境的影响。
在Δλ=60 nm时,S75-1酶液经过超声处理后,其内源荧光峰位迁移现象不明显(迁移距离小于1 nm)(见图 5C)。当S75-1酶液经过加热处理后(见图 5D),酶的内源荧光峰位发生了红移现象,从278.6 nm红移到281.4 nm。这与上述在激发波长295 nm处所得结论相印证,由此推测,加热能使S75-1中Trp残基的微环境更加疏松延展,导致荧光峰位红移。
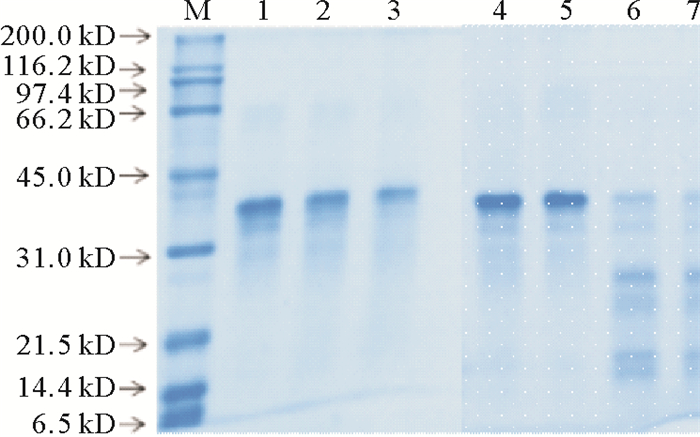
2.6 超声和加热处理对丝氨酸蛋白酶S75-1降解情况的影响超声波和加热处理对S75-1降解情况的影响(见图 6)。超声波处理使S75-1发生降解,酶降解后,原电泳条带下方呈现一片低分子量条带。
|
(M:标准蛋白; 1:未处理的丝氨酸蛋白酶S75-1;2:酶超声处理200 W 30 min;3:酶超声处理200 W 30 min+400 W 20 min;4:加热处理30 s;5:加热处理60 s;6:加热处理5 min;7:加热处理10 min。M: standard protein; 1: untreated serine protease S75-1; 2: ultrasonic treatment 200 W 30 min; 3: ultrasonic treatment 200 W 30 min+400 W 20 min; 4: heat treatment 30 s; 5: heat treatment 60 s; 6: heat treatment 5 min; 7: heat treatment 10 min.) 图 6 超声和加热处理对丝氨酸蛋白酶S75-1的降解影响 Fig. 6 Effect of ultrasonic treatment and heat treatment on degradation of serine protease S75-1 |
丝氨酸蛋白酶S75-1在加热5 min后,42和35 kD左右处的2条电泳条带均变浅,说明加热5 min后,大部分的酶已经被降解。随着加热时间的延长,在分子量25和15 kD左右出现几条明显条带,且蛋白条带颜色越来越深。
从图 6可看出,超声和加热对酶的降解机制不同,超声对酶的降解可能是无规则的断裂酶的肽键。Tian等[16]发现,经超声处理后的胰蛋白酶用高效液相-质谱法检测出很多片段,此结果也与本试验结果相互印证。而加热则是高温使酶内部的某个肽键处断裂而呈现出一种规律性,此结果与David[19]研究得出的结论类似。
3 结论超声和加热处理会对丝氨酸蛋白酶的结构和酶活产生不同程度的影响。就对酶活而言,低功率短时间超声处理,使酶活有一定程度的上升,反之均能使酶的活性降低。在65 ℃热处理15 min时,丝氨酸蛋白酶活基本丧失。与超声处理相比,加热处理更易控制酶活。就丝氨酸蛋白酶结构而言,超声和加热处理均能导致丝氨酸蛋白酶的构象变化。超声处理能引起丝氨酸蛋白酶芳香族基团更加包埋在蛋白质结构内部,使其非极性增强。加热处理对蛋白酶有荧光猝灭作用,使丝氨酸蛋白酶荧光残基处蛋白质结构更加疏松,极性增加。超声和加热两种处理方法都能引起丝氨酸蛋白酶的降解,并且两种处理方法的降解机制不同,加热降解更具规律性。
| [1] |
Lu B J, Zhou L G, Cai Q F, et al. Purification and characterisation of trypsins from the pyloric caeca of mandarin fish (Siniperca chuatsi)[J]. Food Chemistry, 2008, 110(2): 352-360. DOI:10.1016/j.foodchem.2008.02.010
(  0) 0) |
| [2] |
Siringan P, Raksakulthai N, Yongsawatdigul J. Partial purification and characterization of trypsin-like proteinases in Indian anchovy (Stolephorus spp.)[J]. Food Chemistry, 2007, 101(1): 82-89. DOI:10.1016/j.foodchem.2005.11.049
(  0) 0) |
| [3] |
王梦想, 钟婵, 蔡秋凤, 等. 蓝圆鲹肌肉中丝氨酸蛋白酶的分离纯化及性质研究[J]. 食品工业科技, 2012, 33(19): 58-62, 67. WANG Meng-Xiang, ZHONG Chan, CAI Qiu-Feng, et al. Study on purification and characterization of a serine proteinase from the skeletal muscle of blue scad(Decapterus maruadsi)[J]. Science and Technology of Food Industry, 2012, 33(19): 58-62, 67. (  0) 0) |
| [4] |
高振鹏, 岳田利, 袁亚宏, 等. 超声波对糖化酶酶解作用的影响[J]. 农业机械学报, 2012, 43(10): 138-142. GAO Zhen-Peng, YUE Tian-Li, YUAN Ya-Hong. Effect of ultrasonic on enzymolysis for glucoamylase[J]. Transactions of the Chinese Society for Agricultural Machinery, 2012, 43(10): 138-142. DOI:10.6041/j.issn.1000-1298.2012.10.025 (  0) 0) |
| [5] |
程新峰, 蒋凯丽, 朱玉钢, 等. 超声波灭酶机制及其在食品加工中的应用[J]. 食品工业科技, 2016, 37(8): 351-357. CHENG Xin-Feng, JIANG Kai-Li, ZHU Yu-Gang. The mechanism of enzyme inactivation induced by ultrasound and its application in food processing[J]. Science and Technology of Food Industry, 2016, 37(8): 351-357. (  0) 0) |
| [6] |
Dubrovic I, Herceg Z, Jambrak A R, et al. Effect of high intensity ultrasound and pasteurization on anthocyanin content in strawberry juice[J]. Food Technology and Biotechnology, 2011, 49(2): 196-204.
(  0) 0) |
| [7] |
Villamiel M, De Jong P. Influence of high-intensity ultrasound and heat treatment in continuous flow on fat, proteins, and native enzymes of milk[J]. Journal of Agricultural and Food Chemistry, 2000, 48(2): 472-478. DOI:10.1021/jf990181s
(  0) 0) |
| [8] |
杨利珠, 张莉, 黄琳, 等. 三疣梭子蟹(Portunus trituberculatus)肝胰腺内源酶性质的初步研究[J]. 海洋科学, 2016, 40(10): 97-104. YANG Li-Zhu, ZHANG Li, HUANG Lin, et al. Characterization of endogenous protease from hepatopancreas of swimming crab(P. trituberculatus)[J]. Marine Sciences, 2016, 40(10): 97-104. DOI:10.11759//hykx20151224003 (  0) 0) |
| [9] |
Klomklao S, Kishimur H, Benjakul S, et al. Cationic trypsin:A perdominant proteinase in pacific saury (Cololabis saira) pyloric ceca[J]. Food Biochemistry, 2010(34): 1105-1123.
(  0) 0) |
| [10] |
Yoshida A, Bae I, Sonoda H, et al. Characterization of gelatinolytic enzymes in the skeletal muscle of red sea bream Pagrus major[J]. Fisheries Science, 2009, 75(5): 1317-1322. DOI:10.1007/s12562-009-0132-y
(  0) 0) |
| [11] |
莫英杰.超声波对蒜氨酸酶性质和结构的影响研究[D].北京: 北京工商大学, 2010. MO Ying-Jie. The Effect of Ultrasound on the Properties and Conformation of Alliinase[D]. Beijing: Beijing Technology and Business University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10011-1011283580.htm (  0) 0) |
| [12] |
朱少娟.超声波加速胰蛋白酶反应及其机理的探讨[D].无锡: 江南大学, 2004. ZHU Shao-Juan. Study on the Mechanism of Trypsin Hydrolysis Reaction Enhanced by Ultrasound[D]. Wuxi: Jiangnan University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10295-2004121347.htm (  0) 0) |
| [13] |
Vargas L H M, Pião A C S, Domingos R N, et al. Ultrasound effects on invertase from Aspergillus niger[J]. World Journal of Microbiology and Biotechnology, 2004, 20(2): 137-142. DOI:10.1023/B:WIBI.0000021726.69233.12
(  0) 0) |
| [14] |
Wang J, Cao Y, Sun B, et al. Effect of ultrasound on the activity of alliinase from fresh garlic[J]. Ultrasonics Sonochemistry, 2011, 18(2): 534-540. DOI:10.1016/j.ultsonch.2010.09.008
(  0) 0) |
| [15] |
Ovsianko S L, Chernyavsky E A, Minchenya V T, et al. Effect of ultrasound on activation of serine proteases precursors[J]. Ultrasonics Sonochemistry, 2005, 12(3): 219-223. DOI:10.1016/j.ultsonch.2003.10.012
(  0) 0) |
| [16] |
Tian Z M, Wan M X, Wang S P, et al. Effects of ultrasound and additives on the function and structure of trypsin[J]. Ultrasonics Sonochemistry, 2004, 11(6): 399-404.
(  0) 0) |
| [17] |
Kuldiloke J. Effect of Ultrasound, Temperature and Pressur Treatments on Enzyme Activity and Quality Indicators of Fruit and Vegetable Juices[D]. Berlin: der Technischen Universitt Berlin, 2002. https://www.sciencedirect.com/science/article/pii/S1350417710001884
(  0) 0) |
| [18] |
Rokhina E V, Lens P, Virkutyte J. Low-frequency ultrasound in biotechnology: state of the art[J]. Trends in Biotechnology, 2009, 27(5): 298-306. DOI:10.1016/j.tibtech.2009.02.001
(  0) 0) |
| [19] |
Dionysius D A, Hoek K S, Milne J M, et al. Trypsin-like enzyme from sand crab (Portunus pelagicus): Purification and characterization[J]. Journal of Food Science, 1993, 58(4): 780-784. DOI:10.1111/jfds.1993.58.issue-4
(  0) 0) |
| [20] |
Klomklao S, Benjakul S, Kishimura H, et al. 24kDa Trypsin: A predominant protease purified from the viscera of hybrid catfish (Clarias macrocephalus×Clarias gariepinus)[J]. Food Chemistry, 2011, 129(3): 739-746. DOI:10.1016/j.foodchem.2011.05.014
(  0) 0) |
| [21] |
Klomklao S, Benjakul S, Visessanguan W, et al. Trypsin from the pyloric caeca of bluefish (Pomatomus saltatrix)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 148(4): 382-389. DOI:10.1016/j.cbpb.2007.07.004
(  0) 0) |
| [22] |
Sriket P, Sriket C. A trypsin from royal red prawn (Haliporoides sibogae) and its possible application for collagen hydrolysis[J]. Separation Science and Technology, 2015, 50(7): 1073-1082. DOI:10.1080/01496395.2014.1002931
(  0) 0) |
| [23] |
Cai Q F, Jiang Y K, Zhou L G, et al. Biochemical characterization of trypsins from the hepatopancreas of Japanese sea bass (Lateolabrax japonicus)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2011, 159(3): 183-189. DOI:10.1016/j.cbpb.2011.04.002
(  0) 0) |
| [24] |
Kishimura H, Klomklao S, Benjakul S, et al. Characteristics of trypsin from the pyloric ceca of walleye pollock (Theragra chalcogramma)[J]. Food Chemistry, 2008, 106(1): 194-199. DOI:10.1016/j.foodchem.2007.05.056
(  0) 0) |
| [25] |
吴丹, 徐桂英. 光谱法研究蛋白质与表面活性剂的相互作用[J]. 物理化学学报, 2006, 22(2): 254-260. WU Dan, XU Gui-Ying. Study on protein-surfactant interaction by spectroscopic methods[J]. Acta Phys Chem Sin, 2006, 22(2): 254-260. DOI:10.3866/PKU.WHXB20060225 (  0) 0) |
| [26] |
郭晓娜, 姚惠源. 光谱法研究变性剂对苦荞麦蛋白质构象的影响[J]. 光谱学与光谱分析, 2011, 31(6): 1611-1614. GUO Xiao-Na, YAO Hui-Yuan. Spectrometric study on the effect of denaturant on the conformation of tartary buckwheat protein[J]. Spectroscopy and Spectral Analysis, 2011, 31(6): 1611-1614. DOI:10.3964/j.issn.1000-0593(2011)06-1611-04 (  0) 0) |
| [27] |
刘高梅, 任海伟. 不同功率超声波对芸豆蛋白理化和功能性质的影响[J]. 中国粮油学报, 2012, 27(12): 17-21. LIU Gao-Mei, REN Hai-Wei. Effect of ultrasonic power on physicochemical and functional properties of kidney bean protein(KBP)[J]. Journal of the Chinese Cereals and Oils Association, 2012, 27(12): 17-21. DOI:10.3969/j.issn.1003-0174.2012.12.004 (  0) 0) |
| [28] |
涂宗财, 马达, 王辉, 等. 超声波对肌肉鸡浆蛋白理化性质和结构的影响[J]. 食品科学, 2013, 34(19): 32-36. TU Zong-Cai, MA Da, WANG Hui, et al. Effects of ultrasonic treatment on the physico-chemical properties and structure of chicken sarcoplasmic proteins[J]. Food Science, 2013, 34(19): 32-36. DOI:10.7506/spkx1002-6630-201319008 (  0) 0) |
| [29] |
梁晶.药物小分子与蛋白质相互作用的光谱及分子对接研究[D].新乡: 河南师范大学, 2011. LIANG Jing. Investigations of the Interaction Between Drugs and Protein by Spectroscopic and Molecular Modeling Methods[D]. Xin-xiang: Henan Normal University, 2011. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1960802 (  0) 0) |
| [30] |
Divsalar A, Bagheri M J, Saboury A A, et al. Investigation on the interaction of newly designed anticancer Pd (Ⅱ) complexes with different aliphatic tails and human serum albumin[J]. The Journal of Physical Chemistry B, 2009, 113(42): 14035-14042. DOI:10.1021/jp904822n
(  0) 0) |
| [31] |
李清正, 张顺亮, 罗永康, 等. 温度对复合肌原纤维蛋白结构及其表面疏水性的影响[J]. 肉类研究, 2017, 31(2): 6-10. LI Qing-Zheng, ZHANG Shun-Liang, LUO Yong-Kang, et al. Effects of temperature on the structure and surface hydrophobicity of mixed myofibrillar proteins[J]. Meat Research, 2017, 31(2): 6-10. (  0) 0) |
| [32] |
Qin P, Liu R, Pan X, et al. Impact of carbon chain length on binding of perfluoroalkyl acids to bovine serum albumin determined by spectroscopic methods[J]. Journal of Agricultural and Food Chemistry, 2010, 58(9): 5561-5567. DOI:10.1021/jf100412q
(  0) 0) |
| [33] |
Ibrahim N, Ibrahim H, Kim S, et al. Interactions between antimalarial indolone-N-oxide derivatives and human serum albumin[J]. Biomacromolecules, 2010, 11(12): 3341-3351. DOI:10.1021/bm100814n
(  0) 0) |
 2018, Vol. 48
2018, Vol. 48


