拓扑异构酶Ⅰ(Topoisomerase Ⅰ,Topo Ⅰ)作为一种重要的核酶,在细胞DNA的复制、转录、重组和修复等过程中发挥重要的作用[1-2]。研究发现肿瘤组织中Topo Ⅰ的含量和活性明显高于正常组织[2-3]。喜树碱(Camptothecin, CPT)提取于喜树中的一种五环生物碱,是最早报道的具有抗肿瘤活性的Topo Ⅰ抑制剂[4]。CPT能整合到Topo Ⅰ/DNA共价复合物中形成三元络合物,从而选择性抑制Topo Ⅰ功能,导致DNA复制过程中缺口不能重新接合而引起细胞死亡[5]。CPT类化合物为细胞周期S期特异性药物,对G0期细胞无作用,对G1、G2与M期细胞有微弱的作用[6-8]。目前,临床广泛应用的伊立替康和拓扑替康都是CPT的衍生物,但均表现出严重的不良反应,这些毒性与Topo Ⅰ靶向有关[9]。据报道,喜树碱具有的平面结构可以转化为分子作用不同的新结构[10-12],因此开发新的不具有Topo Ⅰ抑制活性的CPT类似物将是未来开发低毒(由于Topo Ⅰ活性的低抑制)和高效的抗肿瘤药物的希望所在[13-14]。
本论文对10, 11-亚甲二氧基喜树碱的12位进行了结构改造,通过Suzuki偶联反应引入3, 5-二甲基异噁唑,获得了一个低Topo Ⅰ抑制活性的新型衍生物-39。研究发现39可以强效抑制多个肿瘤细胞的生长,其中对非小细胞肺癌细胞A549作用最为显著,与伊立替康的活性成分SN-38具有不同的细胞毒谱,体内能抑制A549移植瘤的生长,动物毒性低于伊立替康。
1 材料 1.1 主要试剂与仪器核磁共振波谱仪:JEOL-JNM-ECP 600型、Agilent DD2-500型(内标:TMS;单位:ppm;室温);质谱仪:Waters Q-Tof Ultima Global型(ESI电喷雾检测器);熔点仪:X-4数字显示显微熔点测定仪,北京泰克有限公司;薄层硅胶板:德国默克公司产品,青岛美高化工200~300目柱色谱硅胶;所有溶剂均为市售分析产品;胎牛血清(德国PAN公司);凋亡试剂盒(爱必信(上海)生物科技有限公司);羊抗兔二抗、羊抗鼠二抗(上海雅酶生物医药科技有限公司), 其余抗体(美国Cell Signaling Technology公司);ECL化学发光液(上海雅酶生物医药科技有限公司);PBR322DNA、Topo Ⅰ酶(日本Takara Bio公司);Epoch酶标仪;ECL发光仪(上海天能科技有限公司)。
1.2 细胞株及细胞培养人非小细胞肺癌细胞A549、H1975、H1299;人小细胞肺癌细胞H446;人胰腺癌细胞ASPC-1;人结直肠癌细胞HCT116;人神经母细胞瘤细胞SH-SY5Y;人肝癌细胞HepG2;人胃癌细胞MGC-803;人前列腺癌细胞PC-3;人乳腺癌细胞MCF-7、MCF-7阿霉素耐药株MCF-7ADR、人三阴性乳腺癌细胞MDA-MB-231;人宫颈癌细胞Hela;人慢性髓原白血病细胞K562、人早幼粒急性白血病细胞HL-60;人血管内皮细胞HUVEC;人正常肝细胞L02;人胚肺成纤维细胞HELF均购自中科院上海细胞库。除MDA-MB-231细胞置于37 ℃,无CO2条件下培养,其余细胞均置于37 ℃,5% CO2条件下培养。
1.3 实验动物SPF级雄性BALB/c裸鼠,6周龄,购自于北京维通利华实验动物技术有限公司。合格证号:SCXK(京)2021-0006。饲养条件:温度20~24 ℃,湿度40%~60%,照明12 h/d。
2 实验方法 2.1 SRB法和MTT法检测细胞活力取对数生长期的细胞,经胰酶消化后接种于96孔板中,接种密度为5 × 103/孔。贴壁后,加入不同浓度39或者SN-38继续培养72 h,对照组加入等倍稀释的细胞级别DMSO。采用SRB法测定515 nm处的吸光度值。对于悬浮细胞K562细胞、HL-60细胞,则在培养结束后使用MTT法测定570 nm处的吸光度值。吸光度值(OD值)反映细胞活力,根据OD值计算化合物对细胞的增殖抑制率(OD对照组-OD39组)/OD对照组×100%。使用SPSS11.0软件,根据细胞增殖抑制率计算IC50。
2.2 平板克隆实验检测细胞克隆形成能力取对数生长期的A549细胞,胰酶消化,以每孔300~500个细胞接种于6孔板中。贴壁后,加入终浓度为10、30、90 nmol·L-1的39继续培养14 d,并设置对照组。弃掉培养基,每孔加入2 mL甲醇固定细胞3 min,弃掉甲醇自然晾干。吉姆萨染液染色15 min,流水缓慢洗去浮色自然晾干,计数并拍照。显微镜下计数超过50个细胞的克隆数。
2.3 流式细胞术检测细胞周期分布将A549细胞接种于6孔板中,每孔细胞密度为3× 105。贴壁后加入终浓度为10、30、90 nmol·L-1的39继续培养48 h,并设置对照组。结束后用胰酶消化并离心收集细胞。收集的细胞样品用500 μL PBS吹悬细胞,逐滴加入2 mL的95%冷乙醇,放于-20 ℃固定细胞过夜;固定好的样品离心弃掉上清,加入PBS溶液离心洗涤2遍,再用400 μL PBS吹悬细胞,随后加入3~ 4 μL的RNase-A和PI,4 ℃避光染色20~30 min。染色结束后上机检测细胞周期分布情况,数据使用FlowJo V10软件进行分析。
2.4 流式细胞术检测细胞凋亡将A549细胞接种于6孔板中,每孔细胞密度为3× 105。贴壁后加入终浓度为10、30、90 nmol·L-1的39继续培养72 h,并设置对照组。结束后用无EDTA的胰酶消化并离心收集细胞。收集的细胞样品使用预冷的PBS离心洗涤2遍,根据试剂盒说明操作,使用Annexin V-FITC/PI双染色并上机检测细胞凋亡率,数据使用FlowJo V10软件进行分析。
2.5 Western Blotting检测增殖相关蛋白和凋亡相关蛋白收集细胞,加入loading buffer裂解细胞45 min后收集样品,煮沸15~20 min,样品放于-20 ℃保存。配制8%的SDS-PAGE凝胶,加入样品并进行蛋白电泳。待电泳结束后,将条带转印至NC膜上。用快速封闭液封闭15 min,4 ℃孵育一抗过夜。TBST洗涤4次,室温孵育二抗1 h,ECL发光检测蛋白表达情况。
2.6 DNA松弛实验检测39对Topo Ⅰ活性的影响根据DNA松弛实验[15],将CPT,SN-38和39提前稀释,使得最终浓度可以达到100 μmol·L-1和1 mmol·L-1。在EP管中加入1 μL PBR322 DNA和或0.05 μL Topo Ⅰ酶,4 μL缓冲buffer,1 μL CPT或1 μL SN-38或1 μL 39(对照组为1 μL ddH2O和1 μL DMSO),加ddH2O构成20 μL的混合体系,置于37 ℃培养箱孵育30 min。结束后使用10 × DNA loading buffer终止反应并形成DNA电泳样品,在DNA琼脂糖凝胶孔中上样并电泳,电泳结束后将凝胶放在50 μL的核酸染料中于摇床上慢摇染色15 min。使用凝胶成像系统拍照。
2.7 裸鼠异种移植瘤模型检测39体内抗肿瘤效果BALB/c裸鼠于动物房中适应性饲养7 d后。A549细胞使用胰酶消化,用预冷PBS离心洗涤细胞2遍,最终用预冷PBS吹悬细胞,以8 × 106/只的数量皮下接种于裸鼠腋下,待裸鼠腋下瘤体积平均达到100 mm3时,将裸鼠分成对照组(腹腔注射溶解39的溶剂(1.62% DMSO,3.25% PEG400,0.13% HPBCD,95.00%生理盐水),每天一次)、39组(10 mg/kg,每天一次),两组间裸鼠的瘤体积和体重没有显著性差异。A549细胞以8 × 106/只的数量皮下接种于裸鼠腋下,待裸鼠腋下瘤体积平均达到250 mm3时,将裸鼠分成对照组(腹腔注射溶解39的溶剂(1.62% DMSO,3.25% PEG400,0.13% HPBCD,95.00%生理盐水),每天一次),伊立替康组(100 mg/kg,每周一次,其余时间每天一次腹腔注射溶剂)和39组(10 mg/kg,每天一次),三组间裸鼠的瘤体积和体重没有显著性差异。两批动物实验均每天称量裸鼠体重,每周三次用游标卡尺量瘤的长径和短径,计算瘤体积(瘤体积=长径×短径2× 0.5)。给药第25天处死裸鼠,解剖瘤组织,称量瘤体重,计算抑瘤率(抑瘤率= (对照组瘤体重均值-给药组瘤体重均值)/对照组瘤体重均值)。
2.8 统计学分析采用SPSS 11.0软件对实验结果进行分析,实验结果以mean ± SEM表示。多组数据之间采用单因素方差分析。统计学显著、非常显著、极非常显著差异分别表示为*P < 0.05、**P < 0.01、***P < 0.001。
3 结果 3.1 化合物39的合成39的合成路线和化学结构(见图 1),结构经过1H NMR、13C NMR、MS和HRMS进行确证,分子量为487。
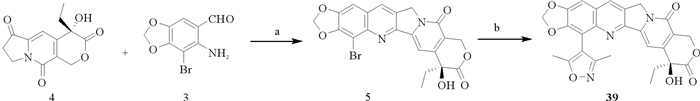
|
(a:对甲苯磺酸,甲醇,回流,12 h;b:四三苯基膦钯,氟化铯,3, 5-二甲基异噁唑-4-硼酸频哪醇酯,甲醇,回流,12 h。a: p-TsOH, toluene, reflux, 12 h; b: Pd(PPh3)4, CsF, 3, 5-Dimethylisoxazole-4-boronic acid, toluene, reflux, 12 h. ) 图 1 39的合成路线 Fig. 1 Synthesis route of 39 |
首先采用SRB法和MTT法检测化合物39对多种人肿瘤细胞的细胞毒活性。结果发现39作用72 h对不同肿瘤细胞具有一定的选择性抑制作用,对A549细胞生长抑制作用最强(见图 2 (a))。进一步比较了39和伊立替康活性成分SN-38(伊立替康是前药)对多种肿瘤细胞的细胞毒活性(见图 2(b))。结果发现,SN-38对HepG2、HCT116和MGC-803细胞作用较强,这与伊立替康在临床上主要用于治疗消化道肿瘤一致[5],化合物39虽然IC50总体大于SN-38,但细胞毒活性谱发生变化,对A549细胞作用最强(72 h的IC50为(30.55 ± 3.04) nmol·L-1)。通过比较SN-38与39对正常细胞的生长影响并计算治疗指数(以IC50(Normal cells)/IC50(A549)表示)。发现对于A549,39的治疗指数明显高于SN-38(*P < 0.05,**P < 0.01,***P < 0.001)(见图 2(c))。这些研究结果表明,39对非小细胞肺癌细胞A549细胞选择性作用较强,且比伊立替康安全。
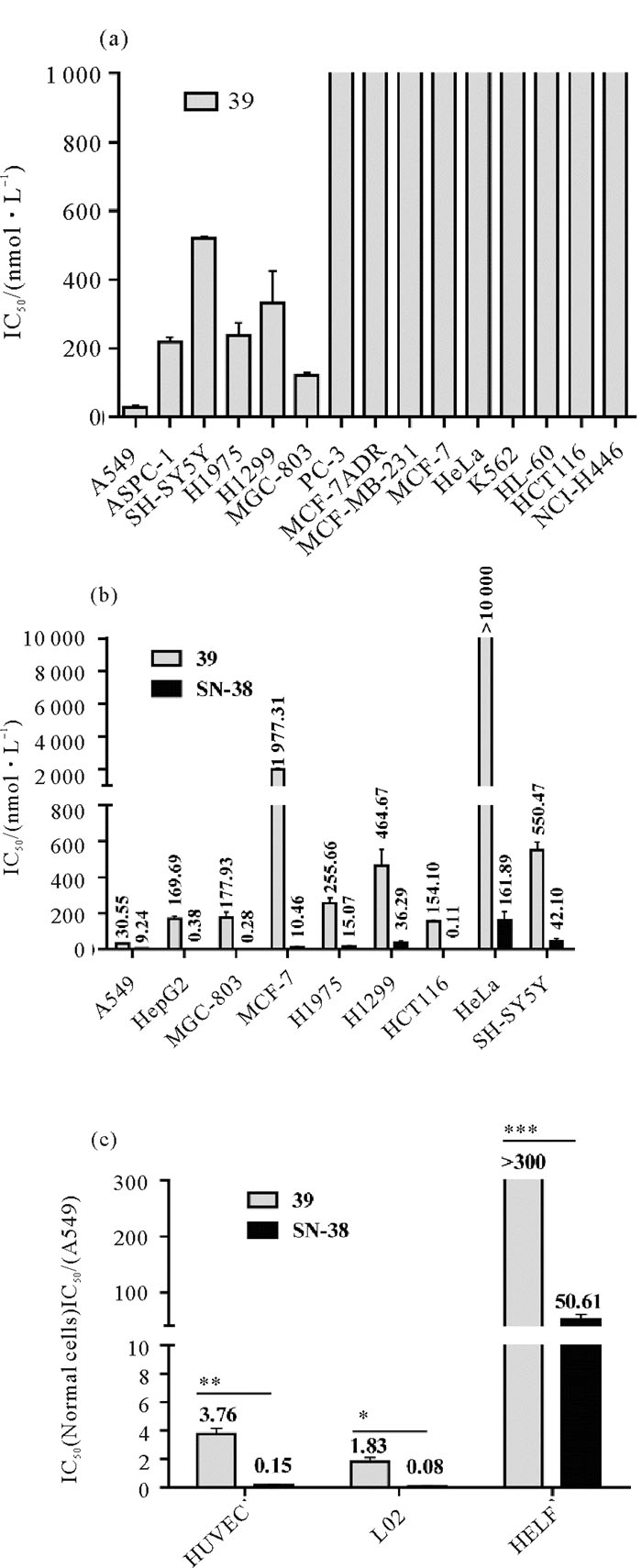
|
((a), (b)SRB法和MTT法检测39和SN-38作用于不同肿瘤细胞72 h的细胞活力,并计算细胞增殖抑制率和IC50;(c)SRB法检测39和SN-38作用于三种正常细胞72 h的细胞活力,并计算IC50和对A549细胞的治疗指数(以IC50(Normal cells)/IC50(A549)表示), *P < 0.05,**P < 0.01,***P < 0.01 vs SN-38。数据以三次独立重复实验的平均值±标准误表示。(a), (b): After treatment with 39 or SN-38 for 72 h, cell viability of each cell line was determined by SRB method and MTT method. The proliferation inhibition rate and IC50 were calculated according to cell viability; (c): After treatment with 39 or SN-38 for 72 h, cell viability of three normal cell lines was determined by SRB method and safety index was calculated as IC50(Normal cells)/IC50(A549), *P < 0.05, **P < 0.01, ***P < 0.01 vs SN-38. Data are presented as the mean ± SEM of three replicate assays. ) 图 2 39体外选择性抑制A549细胞的生长 Fig. 2 39 selectively inhibited the growth of A549 cells in vitro |
采用SRB法检测不同浓度39作用不同时间对A549细胞生长的影响。结果表明,化合物39以浓度依赖和时间依赖的方式抑制A549细胞的生长(见图 3 a),24 h就表现出明显的生长抑制作用。为了进一步证明39对细胞的生长抑制作用,又采用平板克隆实验方法检测39对A549细胞单个细胞增殖的影响。与对照组相比,39能够明显抑制细胞克隆形成。在30和90 nmol·L-1浓度下克隆形成率分别下降了(50.66 ± 7.76)%(*P < 0.05)、(87.60± 19.55)%(**P < 0.01)(见图 3 b, c)。为了观察39的细胞生长抑制作用是否与细胞周期的阻滞有关,采用流式细胞术检测了化合物39对A549细胞细胞周期的影响。结果显示,与对照组相比,39处理A549细胞48 h后,A549细胞被明显阻滞在G2/M期,30 nmol·L-1、90 nmol·L-1的39引起的G2/M期细胞比例分别为(33.75 ± 1.06)%(*P < 0.05)、(53.25± 2.33)%(**P < 0.01),对照组的G2/M期细胞比例为(21.86± 2.99)%(见图 3 d, e)。细胞周期蛋白B(cyclin B)/周期蛋白依赖激酶(P34CDC2)复合物的活化是调控G2期到M期的重要因素,目前对G2/M期阻滞的研究主要集中在cyclin B和P34CDC2上[16-17]。Western Blotting结果显示39下调cyclin B的表达并抑制CDC2(Thr161)的磷酸化(见图 3 f),使细胞周期蛋白B(cyclin B)/周期蛋白依赖激酶(P34CDC2)复合物失活,从而引起G2/M期阻滞。进一步,为了观察细胞阻滞是否诱导细胞凋亡,采用Annexin V-FITC/PI染色方法检测了细胞凋亡,结果发现化合物39作用A549细胞72 h后明显促进A549细胞的凋亡,10、30、90 nmol·L-1浓度下细胞凋亡率分别为(7.2 ± 0.4)%(*P < 0.05)、(18.1 ± 2.6)%(*P < 0.05)、(33.6 ± 2.7)%(**P < 0.01),对照组的细胞凋亡比例为(4.23 ± 0.36)%(见图 3 g, h)。采用Western Blotting检测了凋亡进程中Bcl-2蛋白家族的Bcl-2和Bax的表达,和caspase级联反应caspase 9,caspase 3和PARP的活化情况,发现化合物39呈浓度依赖性降低抗凋亡蛋白Bcl-2,增加促凋亡蛋白Bax的表达,促进促凋亡蛋白caspase 9,caspase 3和PARP的活化,而不影响死亡受体途径的关键启动分子caspase 8(见图 3 i)。表明化合物39通过线粒体内源途径促进A549细胞凋亡。以上结果表明,化合物39通过细胞周期阻滞及诱导细胞凋亡来抑制A549细胞的生长。
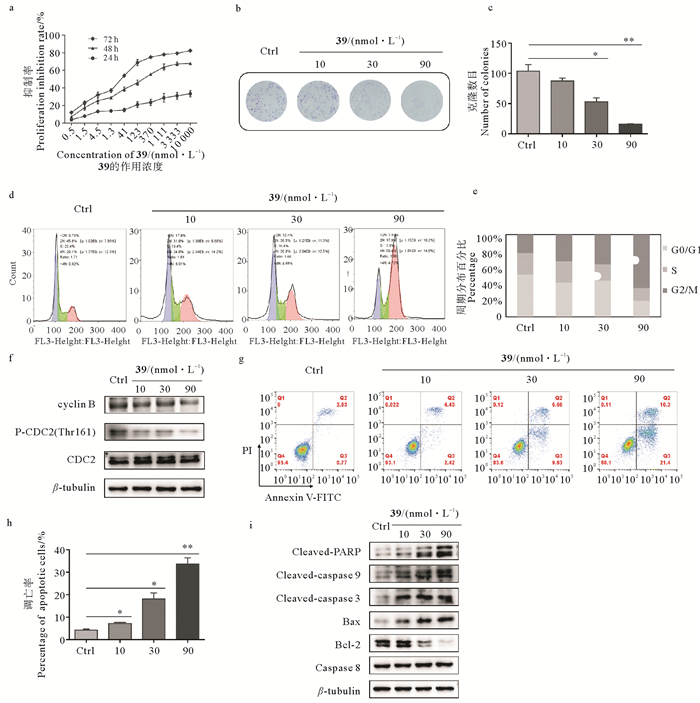
|
(a:SRB法检测不同浓度39作用A549细胞24 h,48 h,72 h的细胞活力,并根据细胞活力计算细胞增殖抑制率;b, c: 平板克隆实验检测39对A549细胞克隆形成的影响,*P < 0.05,**P < 0.01 vs Ctrl;d, e: 流式细胞术检测39作用A549细胞48 h的细胞周期分布;f:Western Blotting检测39作用A549细胞48 h对G2/M期相关蛋白的影响;g, h:流式细胞术检测39作用72 h后A549细胞的凋亡情况,总凋亡率为早期凋亡(Q3)与晚期凋亡(Q2)之和;i:Western blotting检测39作用A549细胞72 h对凋亡相关蛋白的影响。数据以三次独立重复实验的平均值±标准误表示。a: Exposed to a gradient dilution of 39 for 24 h, 48 h and 72 h, cell viability of A549 cells was determined by SRB method. The proliferation inhibition rate of 39 on A549 cells was calculated according to cell viability; b, c: The inhibition of 39 on colony formation of A549 cells was detected by plate clone formation assay, *P < 0.05, **P < 0.01 vs Ctrl; d, e: Cell cycle distribution and percentage of each cycle of A549 cells treated with 39 for 48 h was analyzed by flow cytometry; f: The effects of 39 for 48 h treatment on proteins related to G2/M-phase in A549 cells were detected by Western Blotting; g, h: Apoptosis rate of A549 cells induced by 39 for 72 h treatment was analyzed by flow cytometry. Sums of percentages of early apoptosis (Q3) and late apoptosis (Q2) were calculated as total apoptosis rate, *P < 0.05, **P < 0.01 vs Ctrl; i: Western Blotting analyses of the expression levels of apoptosis-related proteins in A549 cells treated with 39 for 72 h. Data are presented as the mean ± SEM of three replicate assays. ) 图 3 39阻滞细胞周期于G2/M期并诱导A549细胞凋亡 Fig. 3 39 induced G2/M-phase arrest and apoptosis in A549 cells |
Topo Ⅰ的关键功能是与DNA形成Topo Ⅰ-DNA可裂解复合物,引起DNA单链断裂,使得超螺旋得到松弛[18]。DNA拓扑异构酶Ⅰ已被证实是CPT类化合物的分子靶点[19-20],CPT类化合物在Topo Ⅰ和DNA间形成非共价化合物,阻碍DNA链的闭合,从而干扰DNA的结构和功能,最终引起细胞死亡[21]。通过DNA松弛状态可以判断化合物对Topo Ⅰ的活性的影响。图 4中可以看出,加入Topo Ⅰ可以促进超螺旋DNA松弛。CPT(100 μmol·L-1)和SN-38(100 μmol·L-1) 即可以逆转Topo Ⅰ的DNA松弛作用,DNA仍表现出高比率的超螺旋状态,而相同浓度的39对Topo Ⅰ活性的抑制作用明显低于CPT和SN-38,DNA基本处于松弛态。只有当39的浓度提高到1 mmol·L-1时,才与100 μmol·L-1的CPT或SN-38的Topo Ⅰ抑制作用相当,考虑到39阻滞细胞周期于G2/M期,提示39抑制A549细胞的生长作用与其它分子靶点有关。
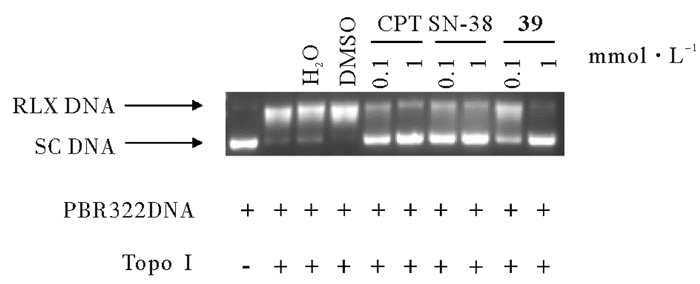
|
( DNA松弛实验:CPT、SN-38和39分别以图所示浓度,与Topo Ⅰ和超螺旋DNA共孵育30 min,通过DNA的状态反映出CPT、SN-38和39对Topo Ⅰ活性的抑制作用。进行三次独立重复实验。DNA relaxation assay: CPT, SN-38 and 39 were co-cultured with Topo Ⅰ and supercoiled DNA for 30 min at the concentration shown in the figure, respectively. The inhibition of CPT, SN-38 and 39 on the activity of Topo Ⅰ was reflected by the state of DNA. The experiment was repeated three times independently. ) 图 4 39对拓扑异构酶Ⅰ活性的影响 Fig. 4 Effect of 39 on the activity of Topo Ⅰ |
为了阐明39抗肿瘤的作用机制,采用Western Blotting检测了39对细胞常见增殖信号分子的影响。结果发现(见图 5 a),化合物39处理A549细胞24 h后,P-AKT和P-ERK没有发生变化,而P-STAT 3的水平明显下降。考虑到作为STAT 3上游的EGFR在肺癌中往往高表达,本文又检测了EGFR的表达和活化,结果发现EGFR和P-EGFR均呈浓度依赖性地下降,表明39抑制A549细胞增殖的作用机制可能与调控EGFR表达有关。此外,我们检测了几种肿瘤细胞的EGFR表达情况,发现对39最敏感的A549细胞在几种肿瘤细胞中EGFR的表达最高,其表达也受到了39的明显抑制(见图 5 b),这与39选择性抑制A549细胞的结果一致。采用蛋白翻译延伸抑制剂放线菌酮(Cycloheximide,CHX)探讨39引起EGFR蛋白水平下降的机制,发现与单独使用CHX相比,共加CHX和化合物39使得EGFR蛋白水平下降的更加明显,表明39降低了EGFR蛋白的稳定性而导致EGFR蛋白降解(见图 5 c, d)。这些结果表明39选择性抑制A549细胞生长与A549细胞高表达EGFR及39能够降低EGFR含量有关。
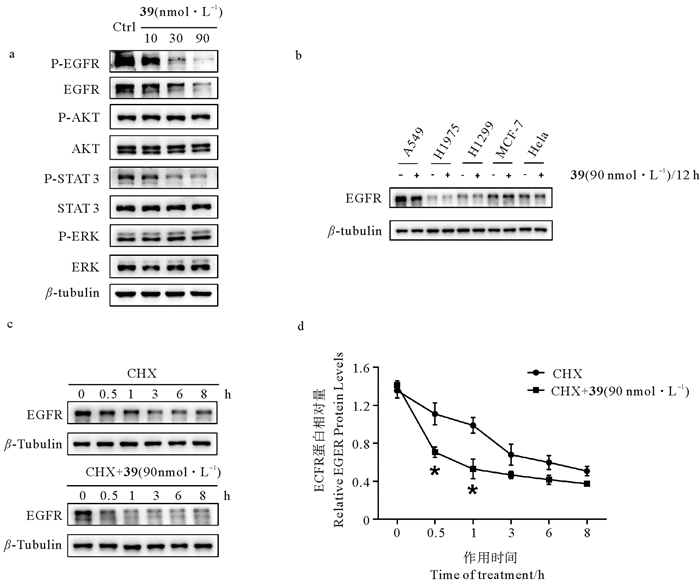
|
( a:Western Blotting检测39作用A549细胞24 h对EGFR, P-EGFR, STAT 3, P-STAT 3, ERK, P-ERK, AKT, P-AKT的影响;b:A549细胞, H1975细胞, H1299细胞, MCF-7细胞和Hela细胞EGFR蛋白的表达情况;c, d:蛋白翻译延伸抑制剂放线菌酮(40 μg/mL)单独或与39(90 nmol·L-1)共作用对EGFR蛋白水平的影响,*P < 0.05 vs CHX + 39。数据以三次独立重复实验的平均值±标准误表示。a: Western Blotting analyses of EGFR, P-EGFR, STAT 3, P-STAT 3, ERK, P-ERK, AKT, P-AKT in A549 cells treated with 39 for 24 h; b: The expression levels of EGFR in A549 cells, H1975 cells, H1299 cells, MCF-7 cells and Hela cells; c, d: EGFR protein levels in A549 cells treated with 40 μg/mL Cycloheximide (CHX) with or without 90 nmol·L-1 39 for indicated lengths of time, *P < 0.05 vs CHX + 39. Data are presented as the mean ± SEM of three replicate assays. ) 图 5 39对细胞增殖相关信号蛋白的影响 Fig. 5 Effects of 39 on signal proteins in cell proliferation |
A549细胞接种于裸鼠腋下,待瘤体积平均达到约100 mm3。39组腹腔注射10 mg/kg,每天一次;对照组给予相应的溶剂(1.62% DMSO,3.25% PEG400,0.13% HPBCD,95.00%生理盐水),每天一次,给药第25天处死裸鼠并解剖瘤组织。与对照组相比,39明显抑制A549异种移植瘤的生长(***P < 0.001)(见图 6 a),抑瘤率达到69.86%(见图 6 c, d),且不引起裸鼠体重明显的变化(见图 6 b)。还对比了39和伊立替康抑制A549异种移植瘤的作用。将A549细胞接种于裸鼠腋下,待瘤体积平均达到250 mm3。39组腹腔注射10 mg/kg,每天一次;对照组腹腔注射相应的溶剂(1.62% DMSO,3.25% PEG400,0.13% HPBCD,95.00%生理盐水),每天一次;实验室前期发现伊立替康在39一样的剂量和给药条件下无任何抑瘤作用,为了比较39与伊立替康的药效与毒性,伊立替康组每周一次腹腔注射100 mg/kg(最大耐受量),其它时间腹腔注射溶剂。给药第25天处死裸鼠并解剖瘤组织。与对照组相比,伊立替康(**P < 0.01)和39(***P < 0.001)显著抑制A549异种移植瘤的生长(见图 6 e),伊立替康在最大耐受量下的抑瘤率为52.45%,39的抑瘤率强于伊立替康,达到68.91%(见图 6 g, h),且39对小鼠体重无明显影响(见图 6 f)。这些结果表明,与伊立替康对比,39对A549能够发挥更强的抗肿瘤效果和较低的动物毒性。
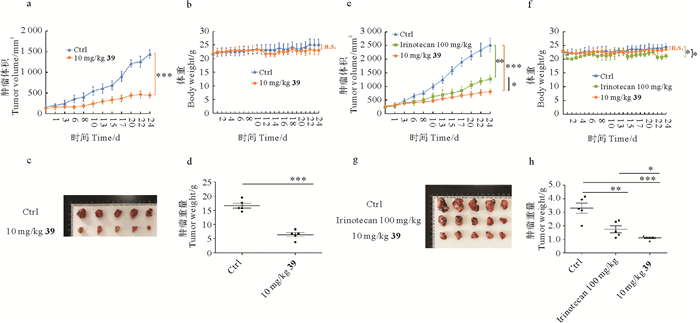
|
( 荷瘤裸鼠,腹腔注射10 mg/kg的39,一天一次。a:裸鼠瘤体积,***P < 0.001 vs Ctrl;b:裸鼠体重,n.s.P>0.05 vs Ctrl;c:剥取的瘤组织;d:瘤组织重量,***P < 0.001 vs Ctrl。荷瘤裸鼠,腹腔注射10 mg/kg的39,一天一次,或腹腔注射100 mg/kg的伊立替康,每周一次。e:裸鼠瘤体积,***P < 0.001 39 vs Ctrl, *P < 0.05 39 vs Irinotecan,**P < 0.01 Irinotecan vs Ctrl;f:裸鼠体重,n.s.P>0.05 39 vs Ctrl,*P < 0.05 39 vs Irinotecan,*P < 0.05 Irinotecan vs Ctrl;g:剥取的瘤组织;h:瘤组织重量,***P < 0.001 39 vs Ctrl, *P < 0.05 39 vs Irinotecan,**P < 0.01 Irinotecan vs Ctrl。每组有5只裸鼠,数据以平均值±标准误表示。Balb/C nude mice bearing A549 cells xenografts were treated with 39 at dose of 10 mg/kg by intraperitoneal injection once a day.a: Tumor volumes of nude mice, ***P < 0.001 vs Ctrl; b: Body weights of nude mice, n.s.P>0.05 vs Ctrl; c: Tumor tissues excised from nude mice; d: Tumor weights of nude mice, ***P < 0.001 vs Ctrl. Balb/C nude mice bearing A549 cells xenografts were treated with 39 at dose of 10 mg/kg once a day or Irinotecan at dose of 100 mg/kg once a week by intraperitoneal injection.e: Tumor volumes of nude mice, ***P < 0.001 39 vs Ctrl, *P < 0.05 39 vs Irinotecan, **P < 0.01 Irinotecan vs Ctrl; f: Body weights of nude mice, n.s.P>0.05 39 vs Ctrl, *P < 0.05 39 vs Irinotecan, *P < 0.05 Irinotecan vs Ctrl; g: Tumor tissues excised from nude mice; h: Tumor weights of nude mice, ***P < 0.001 39 vs Ctrl, *P < 0.05 39 vs Irinotecan, **P < 0.01 Irinotecan vs Ctrl. There were 5 nude mice in each group, and data are presented as the mean ± SEM. ) 图 6 39体内抗非小细胞肺癌A549细胞异种移植瘤作用 Fig. 6 Antitumor efficacy of 39 in xenograft model of A549 cells |
本文设计合成了一种新型CPT衍生物-39,并进行了体内外抗肿瘤作用与机制的研究。体外细胞毒作用能够反映化合物基本的生物活性,了解化合物的抗瘤谱。因此首先检测了39与伊立替康体内活性成分SN-38的体外细胞毒作用。发现SN-38如报道的一样,几乎对所检测的肿瘤细胞表现出强的抑制作用。而39的细胞毒谱不如SN-38广泛,对不同细胞表现出差异性的抑制作用,其对非小细胞肺癌A549细胞的抑制作用最强。尽管39在A549细胞上的IC50值要高于SN-38,但是通过对三种正常细胞的增殖抑制率和IC50计算了39和SN-38对A549细胞的治疗指数,衡量二者的安全性。结果发现39的治疗指数明显高于SN-38,这提示39可能是比伊立替康更安全的非小细胞肺癌治疗药物。因此本文选择A549细胞作为研究对象进行接下来的研究。
肿瘤发生发展的重要原因包括不受调控的细胞周期、丧失凋亡的能力等[22]。为了确认39对A549的生长抑制作用是否与细胞周期阻滞和细胞凋亡有关,本文采用了流式细胞术和Western Blotting检测了39对A549细胞周期和细胞凋亡的影响。流式结果发现39将A549细胞阻滞于G2/M期,Western Blotting结果也证实了这一点。因为39降低了cyclin B的表达和CDC2(Thr 161)的磷酸化,cyclin B和P-CDC2(Thr 161)水平的降低会引起cyclin B-CDC2复合物的失活并引发G2/M期阻滞[16]。此外,流式结果显示39诱导A549细胞发生凋亡。采用Western Blotting检测39诱导A549凋亡的途径,结果显示39作用后增加Bax/Bcl-2比例,增加caspase 9、caspase 3活化形式的表达及PARP的切割,但39并不影响死亡受体途径中的起始诱导信号caspase 8的表达。这说明39通过线粒体内源途径诱导A549细胞凋亡。这些结果表明39阻滞细胞于G2/M期及通过线粒体内源途径诱导细胞凋亡从而抑制A549细胞生长。
Topo Ⅰ是CPT类化合物发挥抗肿瘤作用的靶点。Topo Ⅰ与DNA结合,将DNA单链切断,随后另一条完整的DNA单链穿过切口,先前断开的单链重新连接,从而达到松弛超螺旋的结果[23]。CPT类化合物在Topo Ⅰ和DNA间形成非共价键,阻碍断裂的DNA单链重连,从而干扰DNA的结构和功能,最终引起细胞死亡[21]。为了确认39是否影响Topo Ⅰ的功能,本文采用DNA松弛实验检测39与Topo Ⅰ和超螺旋DNA共孵育后的DNA状态。结果发现在100 μmol·L-1时,39对Topo Ⅰ的抑制作用远低于相同浓度下CPT和SN-38的作用。因此与CPT、SN-38相比,39是弱Topo Ⅰ抑制剂。CPT及其类似物抑制Topo Ⅰ并阻滞细胞于S期[5],而39对Topo Ⅰ抑制作用弱且将细胞阻滞于G2/M期。这提示39对A549细胞的生长作用不依赖于Topo Ⅰ,而与其他分子靶点有关。
Li Fengzhi等发现一种新型CPT衍生物-FL118减少了靶向Topo Ⅰ作用,而涉及抑制Survivin, XIAP, Mcl-1和cIAP2等抗凋亡蛋白的表达发挥抗肿瘤作用[9],这说明CPT衍生物可以通过Topo Ⅰ独立的机制发挥抗肿瘤作用。此外,有报道称拓扑替康可以通过靶向Topo Ⅰ以外的病毒复制因子抑制I型免疫缺陷病毒感染Topo Ⅰ突变的细胞[24]。最近也有报道提出了伊立替康作为E3泛素连接酶MDM2和抗凋亡蛋白Bcl-xL双靶点抑制剂发挥抗肿瘤作用的新机制[25]。但是少有CPT及其类似物对于表皮生长因子受体EGFR信号分子影响的报道。考虑到EGFR在非小细胞肺癌的病因和进展中发挥重要作用,本文将EGFR信号通路作为主要研究对象。EGFR是一种具有酪氨酸激酶活性的跨膜蛋白,主要通过RAS-RAF-MEK-MAPK通路、PI3K-AKT通路和JAK-STAT通路传递生长信号,促进细胞增殖、抑制细胞凋亡[26]。EGFR在超过60%的非小细胞肺癌中高表达和异常突变,EGFR高表达或者发生异常突变,均可使得细胞获得自主和失调增殖的能力,抑制细胞凋亡,促进侵袭或者转移,诱导新生血管生成,最终促进肿瘤发生、发展[27],因此EGFR是非小细胞肺癌治疗的一个重要靶点[26]。目前有大量的研究工作集中在EGFR激活突变的非小细胞肺癌上面,相应的靶向药物如EGFR酪氨酸激酶抑制剂吉非替尼、奥西替尼等被研发出来并在临床上取得较好的治疗效果,而野生高表达蛋白引起的肿瘤仍缺少相应治疗药物[28]。本文发现39能够降低A549细胞野生型EGFR蛋白的稳定性,导致EGFR蛋白降解,进而下调其下游STAT 3的磷酸化水平,而STAT 3的磷酸化与凋亡抑制、血管生成相关[29]。Naoyuki Nishiya等对一种海洋来源非CPT类化合物的Topo Ⅰ抑制剂Lamellarin N进行结构改造,发现改造后的化合物失去了Topo Ⅰ抑制活性而具有EGFR酪氨酸激酶抑制活性[14],本文的结果发现39影响了EGFR的稳定性,相关机制仍需进一步研究。已有报道证明抑制EGFR激活可快速诱导激酶组“重新连接”,招募替代的、未受抑制的激酶作为异二聚化伙伴,导致相同的下游分子磷酸化,恢复致癌信号;而与抑制EGFR活性相比,对其降解后使得传导信号的受体关闭,有可能产生更完整和持久的下游信号失活,并绕过替代激酶代偿反馈激活信号问题[28]。因此本文认为39对于高表达EGFR的非小细胞肺癌的治疗具有优势。
一个好的抗肿瘤药物不仅需要对肿瘤细胞具有抑制作用,还需要在肿瘤细胞和正常细胞之间表现出选择性。39不仅在体外对A549的治疗指数高于SN-38,两次体内动物实验也证明了39能够显著抑制A549异种移植瘤的生长(抑瘤率>65%),而且相比于伊立替康最大耐受量给药,39具有更高的抑瘤效果和更低的动物毒性。这些结果支持39在肿瘤细胞和正常细胞之间表现出更好的选择性。
综上所述,39能够通过抑制EGFR稳定性以Topo Ⅰ非依赖的方式低毒性地拮抗非小细胞肺癌A549细胞生长。本研究为喜树碱衍生物39进一步开发成为一种新型抗肺癌药物奠定了工作基础,也证明了CPT类似物可以通过分子改造以Topo Ⅰ非依赖方式靶向重要的致癌蛋白,从而获得不同的肿瘤治疗谱和较低的毒性作用。
| [1] |
Champoux J J. DNA topoisomerases: structure, function, and mechanism[J]. Annual Review of Biochemistry, 2001, 70: 369-413. DOI:10.1146/annurev.biochem.70.1.369 (  0) 0) |
| [2] |
Buzun K, Bielawska A, Bielawski K, et al. DNA topoisomerases as molecular targets for anticancer drugs[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2020, 35(1): 1781-1799. DOI:10.1080/14756366.2020.1821676 (  0) 0) |
| [3] |
Cinelli M A. Topoisomerase 1B poisons: Over a half-century of drug leads, clinical candidates, and serendipitous discoveries[J]. Medicinal Research Reviews, 2019, 39(4): 1294-1337. DOI:10.1002/med.21546 (  0) 0) |
| [4] |
Hsiang Y H, Hertzberg R, Hecht S, et al. Camptothecin induces protein-linked DNA breaks via mammalian DNA topoisomerase Ⅰ[J]. The Journal of Biological Chemistry, 1985, 260(27): 14873-14878. DOI:10.1016/S0021-9258(17)38654-4 (  0) 0) |
| [5] |
Pizzolato J F, Saltz L B. The camptothecins[J]. Lancet, 2003, 361(9376): 2235-2242. DOI:10.1016/S0140-6736(03)13780-4 (  0) 0) |
| [6] |
Goldwasser F, Shimizu T, Jackman J, et al. Correlations between S and G2 arrest and the cytotoxicity of camptothecin in human colon carcinoma cells[J]. Cancer Research, 1996, 56(19): 4430-4437. (  0) 0) |
| [7] |
Horwitz S B, Horwitz M S. Effects of camptothecin on the breakage and repair of DNA during the cell cycle[J]. Cancer Research, 1973, 33(11): 2834-2836. (  0) 0) |
| [8] |
Tsao Y P, D'Arpa P, Liu L F. The involvement of active DNA synthesis in camptothecin-induced G2 Arrest: Altered regulation of p34cdc2/cyclin B[J]. Cancer Research, 1992, 52(7): 1823-1829. (  0) 0) |
| [9] |
Li F Z, Ling X, Harris D L, et al. Topoisomerase Ⅰ (Top1): A major target of FL118 for its antitumor efficacy or mainly involved in its side effects of hematopoietic toxicity?[J]. American Journal of Cancer Research, 2017, 7(2): 370-382. (  0) 0) |
| [10] |
Demarquay D, Huchet M, Coulomb H, et al. BN80927: A novel homocamptothecin that inhibits proliferation of human tumor cells in vitro and in vivo[J]. Cancer Research, 2004, 64(14): 4942-4949. DOI:10.1158/0008-5472.CAN-03-3872 (  0) 0) |
| [11] |
Ling X, Cao S, Cheng Q, et al. A novel small molecule FL118 that selectively inhibits survivin, Mcl-1, XIAP and cIAP2 in a p53-independent manner, shows superior antitumor activity[J]. PLoS One, 2012, 7(9): 45571. DOI:10.1371/journal.pone.0045571 (  0) 0) |
| [12] |
杨松, 张万年. 高喜树碱——极具开发价值的拓扑异构酶Ⅰ抑制剂[J]. 药学学报, 2004, 39(5): 396-400. Yang S, Zhang W N. Homocamptothecins-novel promising anticancer drugs as inhibitors of topoisomerase Ⅰ[J]. Acta Pharmaceutica Sinica, 2004, 39(5): 396-400. DOI:10.16438/j.0513-4870.2004.05.019 (  0) 0) |
| [13] |
Li F Z, Jiang T, Li Q Y, et al. Camptothecin (CPT) and its derivatives are known to target topoisomerase Ⅰ (Top1) as their mechanism of action: Did we miss something in CPT analogue molecular targets for treating human disease such as cancer?[J]. American Journal of Cancer Research, 2017, 7(12): 2350-2394. (  0) 0) |
| [14] |
Nishiya N, Oku Y, Ishikawa C, et al. Lamellarin 14, a derivative of marine alkaloids, inhibits the T790M/C797S mutant epidermal growth factor receptor[J]. Cancer Science, 2021, 112(5): 1963-1974. DOI:10.1111/cas.14839 (  0) 0) |
| [15] |
Nitiss J L, Soans E, Rogojina A, et al. Topoisomerase assays[J]. [s. 1. ]. Current Protocols in Pharmacology, 2012.
(  0) 0) |
| [16] |
Stark G R, Taylor W R. Analyzing the G2/M checkpoint[J]. Methods in Molecular Biology, 2004, 280: 51-82. (  0) 0) |
| [17] |
王凡平, 乔彩娟, 孙彦威, 等. 莱菔硫烷诱导急性髓系白血病KG1a和KG1细胞G_2/M期阻滞的作用和相关机制[J]. 中国实验血液学杂志, 2021, 29(4): 1050-1055. Wang F P, Qiao C J, Sun Y W, et al. Effect and mechanism of sulforaphane on g2/m phase arrest of acute myeloid leukemia KG1a and KG1 Cells[J]. Journal of Experimental Hematology, 2021, 29(4): 1050-1055. (  0) 0) |
| [18] |
Pommier Y. Topoisomerase Ⅰ inhibitors: Camptothecins and beyond[J]. Nature Reviews Cancer, 2006, 6(10): 789-802. DOI:10.1038/nrc1977 (  0) 0) |
| [19] |
Hsiang Y H, Liu L F. Identification of mammalian DNA topoisomerase Ⅰ as an intracellular target of the anticancer drug camptothecin[J]. Cancer Research, 1988, 48(7): 1722-1726. (  0) 0) |
| [20] |
Martino E, Della Volpe S, Terribile E, et al. The long story of camptothecin: From traditional medicine to drugs[J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(4): 701-707. (  0) 0) |
| [21] |
谭慧心. 拓扑异构酶Ⅰ抑制剂研究进展[J]. 中国药理学通报, 2009, 25(4): 436-441. Tan H X. Research progress on topoisomerase Ⅰ inhibitors[J]. Chinese Pharmacological Bulletin, 2009, 25(4): 436-441. (  0) 0) |
| [22] |
Mohammad R M, Muqbil I, Lowe L, et al. Broad targeting of resistance to apoptosis in cancer[J]. Seminars in Cancer Biology, 2015, 35(Suppl): 78-103. (  0) 0) |
| [23] |
Li Q Y, Zu Y G, Shi R Z, et al. Review camptothecin: Current perspectives[J]. Current Medicinal Chemistry, 2006, 13(17): 2021-2039. DOI:10.2174/092986706777585004 (  0) 0) |
| [24] |
Zhang J L, Sharma P L, Li C J, et al. Topotecan inhibits human immunodeficiency virus type 1 infection through a topoisomerase-independent mechanism in a cell line with altered topoisomerase Ⅰ[J]. Antimicrobial Agents and Chemotherapy, 1997, 41(5): 977-981. DOI:10.1128/AAC.41.5.977 (  0) 0) |
| [25] |
Lee B, Min J A, Nashed A, et al. A novel mechanism of irinotecan targeting MDM2 and Bcl-xL[J]. Biochemical and Biophysical Research Communications, 2019, 514(2): 518-523. DOI:10.1016/j.bbrc.2019.04.009 (  0) 0) |
| [26] |
da Cunha Santos G, Shepherd F A, Tsao M S, et al. EGFR mutations and lung cancer[J]. Annual Review of Pathology, 2011, 6: 49-69. (  0) 0) |
| [27] |
Ciardiello F, Tortora G. EGFR antagonists in cancer treatment[J]. The New England Journal of Medicine, 2008, 358(11): 1160-1174. (  0) 0) |
| [28] |
Burslem G M, Smith B E, Lai A C, et al. The advantages of targeted protein degradation over inhibition: An RTK case study[J]. Cell Chemical Biology, 2018, 25(1): 67-77. (  0) 0) |
| [29] |
Huang L H, Fu L W. Mechanisms of resistance to EGFR tyrosine kinase inhibitors[J]. Acta pharmaceutica Sinica B, 2015, 5(5): 390-401. (  0) 0) |
 2023, Vol. 53
2023, Vol. 53


