2. 河南中医药大学第二临床医学院肝胆脾胃科三区, 河南 郑州 450046;
3. 河南中医药大学电镜中心, 河南 郑州 450046;
4. 河南医学高等专科学校病理学教研室, 河南 郑州 451191;
5. 河南中医药大学肝病研究所, 河南 郑州 450046
2. The Section Ⅲ of Hepatobilia-ry-Spleen-Stomach Department, The Second Clinical Medical College, Henan University of Chinese Medicine, Zhengzhou 450046, China;
3. Electron Microscope Center, Henan University of Chinese Medicine, Zhengzhou 450046, China;
4. Department of Pathology, Henan Medical College, Zhengzhou 451191, China;
5. Institute of Hepatology, Henan University of Chinese Medicine, Zhengzhou 450046, China
炎症是机体对生物性、物理性、化学性等因素造成的损伤产生防御反应。炎症反应的产生伴随炎细胞的渗出激活、吞噬免疫作用及炎症介质的合成、释放过程。炎症若迁延不愈,持续存在,便会呈现慢性炎症状态。研究[1-5]证实,慢性炎症与肝硬化、冠心病、糖尿病、神经退行性疾病、肿瘤等多种疾病的发生发展密切相关。巨噬细胞是慢性炎症时发挥免疫吞噬功能的关键细胞,能够产生肿瘤坏死因子-α(TNF-α)、转化生长因子-β(TGF-β)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)等炎症介质[6]。因此,研究巨噬细胞参与慢性炎症的作用机制,可以为进一步开发相应疾病的临床治疗药物提供重要参考。中药源自天然药材,在治疗慢性炎症性疾病方面具有独特优势。黄杞苷(engeletin,CAS号:572-31-6)是从多种药材中分离的黄酮类化合物,在减轻器官损伤、抗肿瘤、抗氧化方面有显著功效[7-9]。为了解黄杞苷的抗炎作用及机制,本研究用脂多糖(lipopolysaccharide,LPS)诱导小鼠RAW264.7单核巨噬细胞构建炎症模型,观察黄杞苷对炎症因子产生和氧化应激水平的干预效果及分子机制,为黄杞苷的开发利用提供一定的依据。
1 材料与方法 1.1 细胞和试剂小鼠RAW264.7细胞株(中山大学病原生物学教研室馈赠),热灭活胎牛血清(美国GIBCO公司,批号1892436),黄杞苷(成都德思特生物技术有限公司,批号DST191028-045),LPS、四甲基偶氮唑蓝(MTT)、二甲亚砜(DMSO)(北京索莱宝科技有限公司,批号530R059、715F056、1121E0323)。小鼠TNF-α、IL-6、IL-1β ELISA试剂盒(苏州卡尔文生物科技有限公司,批号E20220501A、E20220601A、E20220601A),活性氧(reactive oxygen species,ROS)、超氧化物(superoxide,O2·-)、一氧化氮(nitric oxide,NO)检测试剂盒、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号41720200803、081420210429、11020200903、090419191224)。p65、GAPDH抗体(武汉三鹰生物技术有限公司,批号10005701、10017731),辣根过氧化物酶(horseradish peroxidase,HRP)-IgG(H+L)抗体(成都正能生物技术有限公司,批号LL0310N),p-p65和IκBα抗体(美国Cell Signaling公司,批号013346S000204122021、004814T001711182020)。
1.2 试验仪器细胞培养箱、低温离心机(均购自美国Thermo scientific公司),倒置荧光显微镜(日本Olympus公司),酶标仪、蛋白电泳仪、凝胶成像分析仪(均购自美国Bio-rad公司),荧光全波长酶标仪(美国BioTek公司),水平摇床(美国Scilogex公司)。
1.3 细胞培养及分组RAW264.7细胞采用含10%胎牛血清和1%青链霉素的高糖DMEM培养基,置于含5% CO2的37℃培养箱培养,细胞生长密度达80%后,用台盼蓝染色检测细胞存活率达94.25%,表明对数生长期细胞状态良好,可用于后续试验。细胞随机分为对照组、LPS组、不同浓度黄杞苷干预组,对照组给予完全培养基培养,LPS组给予含0.1 μg/mL LPS的完全培养基培养,黄杞苷干预组则是在含0.1 μg/mL LPS的完全培养基中加入不同浓度黄杞苷干预。
1.4 MTT细胞增殖检测及形态拍照取对数生长期的RAW264.7细胞按2×103细胞/孔接种于96孔板,待细胞贴壁后,按照试验分组培养,并采用倒置显微镜观察细胞形态拍照记录。于不同培养时间进行MTT细胞增殖检测,在避光条件下加入20 μL 5 mg/mL的MTT溶液继续培养4 h,弃培养基后加入200 μL DMSO,置于水平振荡仪上快速振荡10 min使结晶物充分溶解,最后置于酶标仪检测各组OD490nm值并计算细胞增殖率,细胞增殖率=(试验组OD490nm-空白组OD490nm)/(OD490nm对照组-空白组OD490nm)×100%。
1.5 ELISA检测上清中TNF-α、IL-6和IL-1β浓度收集各组细胞12、24、36 h培养上清液,3 000 r/min离心后去除杂质,依照ELISA试剂盒说明,标准孔依次加入50 μL倍比稀释的标准品,空白孔加入50 μL样本稀释液,样本孔加入50 μL稀释5倍的培养上清液,除空白孔外,标准孔和样本孔加入HRP标记的抗体工作液100 μL,37℃温育1 h,甩尽孔内液体,洗涤5次后加入四甲基联苯胺(tetramethylbenzidine,TMB)底物A、B各50 μL,37℃避光孵育15 min,加终止液50 μL,终止反应后检测OD450nm值,根据标准曲线计算上清液中TNF-α、IL-6、IL-1β浓度。
1.6 检测细胞产生的ROS、O2·-和NO 1.6.1 ROS检测细胞接种于12孔板培养24 h,依照ROS检测试剂盒说明,在阳性对照组孔内加入Rosup刺激30 min,其余孔按照预先分组培养,弃培养基后各孔加入50 μL 10 μmol/L DCFH-DA探针孵育20 min,用无血清培养基洗涤3次后,采用倒置荧光显微镜观察细胞ROS荧光并拍照,重复试验并将培养板置于荧光全波长酶标仪检测各组OD488/525nm值,ROS=(试验组OD488/525nm-空白组OD488/525nm)/(对照组OD488/525nm-空白组OD488/525nm)×100%。
1.6.2 O2·-检测细胞按预先分组接种于96孔板,LPS+黄杞苷组细胞给予不同浓度黄杞苷预处理24 h,对照组和LPS组不作预处理,弃培养基并用PBS漂洗2次,依照O2·-检测试剂盒说明,加入200 μL检测工作液37℃孵育3 min,随后LPS组和LPS+黄杞苷组加入LPS刺激20 min,置于酶标仪检测各组OD450nm值,因超氧化物歧化酶(superoxide dismutase,SOD)可清除O2·-,以LPS孔中加入2 μL SOD作为有效标准验证整个检测体系。
1.6.3 NO检测收集各组24 h培养上清液样本,依照NO检测试剂盒说明,按50 μL/孔在酶标板中加入0、1、2、5、10、20、40、60、100 μmol/L NO标准品和各组上清液样本,随后依次加入Griess Reagent Ⅰ 50 μL/孔和Griess Reagent Ⅱ 50 μL/孔,检测OD540nm值并根据标准曲线计算各组NO浓度。
1.7 Westernblot检测IκBα、p65、p-p65蛋白表达提取各组细胞总蛋白并检测蛋白浓度,蛋白与5×loading buffer混合后煮沸变性,随后行12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转于聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭2 h,TBST漂洗5次,4℃孵育IκBα(1∶1 000)、p65(1∶2 000)、p-p65(1∶1 000)、GAPDH(1∶20 000)一抗过夜,TBST漂洗5次,室温孵育HRP-IgG H+L二抗(1∶5 000)1 h,TBST漂洗5次,采用ECL发光法成像仪显色,应用Image J软件进行灰度扫描。
1.8 统计学分析应用SPSS 22.0对数据进行统计学分析,试验数据以(x±s)表示,多组间比较采用ANOVA方差分析、Tukey检验方法和LSD检验方法,以P≤0.05为差异有统计学意义。
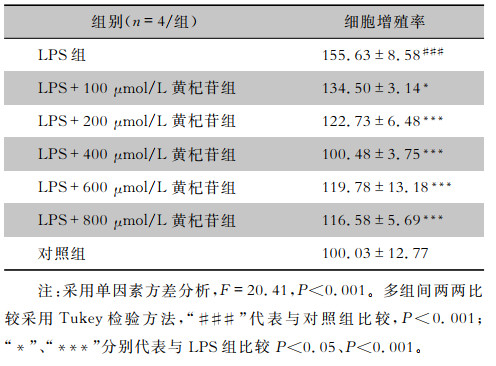
2 结果 2.1 不同浓度黄杞苷对RAW264.7细胞增殖率的影响MTT结果显示,不同组别间细胞增殖率比较,差异有统计学意义(F=20.41,P<0.001);两两比较发现,LPS组较对照组细胞增殖增加(P<0.001),100、200、400、600、800 μmol/L黄杞苷均能抑制LPS诱导的细胞增殖(均P<0.05),其中400 μmol/L抑制效果最明显,因此后续试验均采取该浓度。见表 1。
| 表 1 不同浓度黄杞苷对RAW264.7细胞增殖率的影响(x±s,%) Table 1 Effect of different concentrations of engeletin on the proliferation rate of RAW264.7 cells (x±s, %) |
|
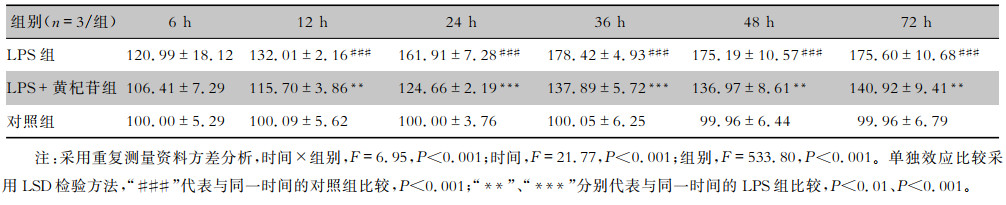
MTT结果显示,时间和组别间有交互效应(F=6.95,P<0.001),尽管组别和时间对细胞增殖率影响比较,差异均有统计学意义(均P<0.001),但不能保证每个时间点的不同组别之间细胞增殖率均有差异。进一步做单独效应比较发现,在12、24、36、48和72 h这些时间点,LPS组较对照组细胞增殖增加(均P<0.001),LPS+黄杞苷组较LPS组细胞增殖减少(均P<0.01),说明400 μmol/L黄杞苷能够抑制LPS诱导的RAW264.7细胞增殖。见表 2。
| 表 2 400 μmol/L黄杞苷干预不同时间对RAW264.7细胞增殖率的影响(x±s,%) Table 2 Effect of 400 μmol/L engeletin on the proliferation rate of RAW264.7 cells at different intervention times(x±s, %) |
|
倒置显微镜观察发现,LPS刺激后RAW264.7细胞数量增多,密度较高,呈抱团生长状态;400 μmol/L黄杞苷干预后,细胞生长受到抑制,密度减少,说明其对RAW264.7细胞生长具有抑制作用,见图 1。
 |
| 图 1 400 μmol/L黄杞苷对RAW264.7细胞生长状态的影响(100×) Figure 1 Effect of 400 μmol/L engeletin on the growth of RAW264.7 cells (100×) |
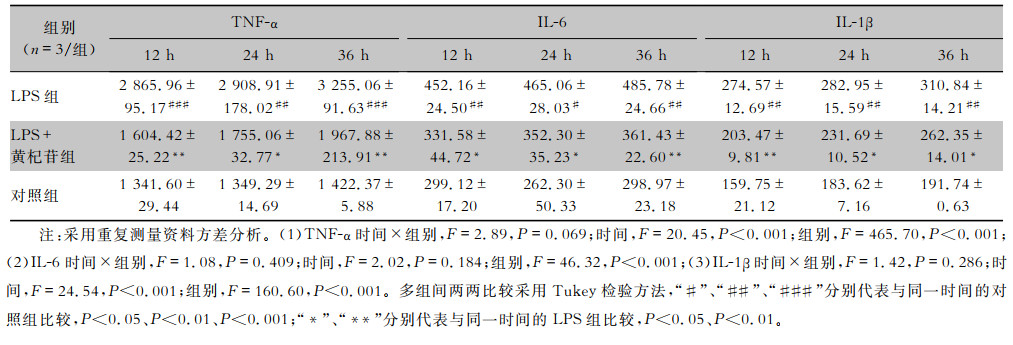
根据TNF-α、IL-6、IL-1β标准品浓度梯度和对应的OD450nm值生成标准曲线,利用标准曲线计算出各组TNF-α、IL-6、IL-1β浓度。结果显示,TNF-α、IL-6、IL-1β时间和组别间均无交互效应(均P>0.05),不同组别间TNF-α、IL-6、IL-1β差异有统计学意义(均P<0.001)。两两比较显示,LPS刺激RAW264.7细胞后12、24、36 h,培养上清液中TNF-α、IL-6、IL-1β均较对照组升高(均P<0.05);400 μmol/L黄杞苷干预12、24、36 h,培养上清液中TNF-α、IL-6、IL-1β均较LPS组下降(均P<0.05),说明黄杞苷可抑制LPS诱导的RAW264.7细胞产生TNF-α、IL-6、IL-1β。见表 3。
| 表 3 400 μmol/L黄杞苷对TNF-α、IL-6、IL-1β生成的影响(x±s,pg/mL) Table 3 Effect of 400 μmol/L engeletin on the production of TNF-α, IL-6 and IL-1β (x±s, pg/mL) |
|
不同组别之间ROS、O2·-、NO释放量比较差异有统计学意义(均P<0.001)。ROS检测结果显示,Rosup组(Rosup可刺激细胞产生ROS)和LPS组较对照组细胞荧光增多,ROS量增加(均P<0.001),说明LPS与Rosup作用类似,能刺激RAW264.7细胞产生ROS;而LPS+黄杞苷组较LPS组细胞荧光减少,ROS量下降(P<0.05),说明黄杞苷可抑制LPS诱导的ROS产生,见图 2和表 4。O2·-检测结果显示,LPS组较对照组细胞O2·-量增加(P<0.001);而LPS+SOD组(SOD可清除细胞产生的O2·-)和LPS+黄杞苷组较LPS组细胞O2·-量下降(均P<0.01),说明黄杞苷与SOD效果类似,能减少LPS诱导的O2·-产生,见表 4。NO检测结果显示,LPS刺激细胞24 h,NO量较对照组增加(P<0.001);而黄杞苷作用于细胞24 h,NO量较LPS组下降(P<0.001),说明黄杞苷可抑制LPS诱导的NO产生,见表 4。
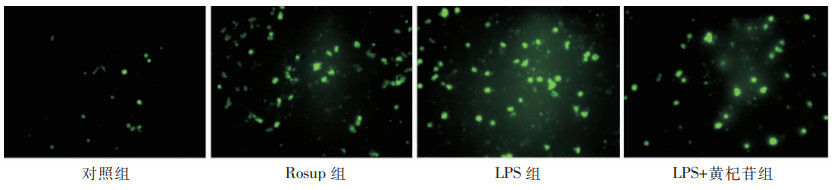 |
| 图 2 400 μmol/L黄杞苷对RAW264.7细胞ROS荧光的影响(400×) Figure 2 Effect of 400 μmol/L engeletin on the ROS fluorescence in RAW264.7 cells (400×) |
| 表 4 400 μmol/L黄杞苷对ROS、O2·-、NO释放的影响(x±s) Table 4 Effect of 400 μmol/L engeletin on the release of ROS, O2·- and NO (x±s) |
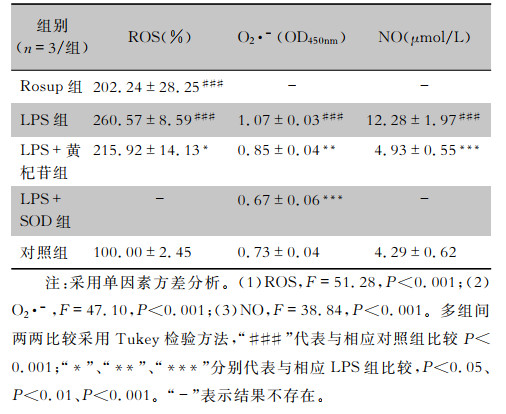
|
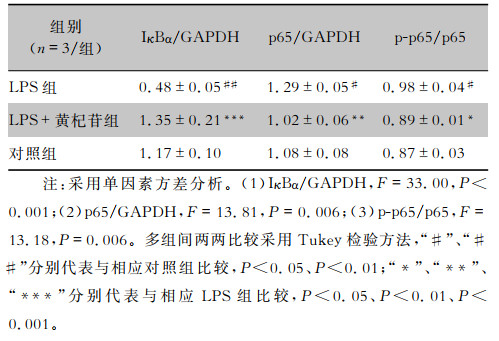
Western blot结果显示,不同组别之间IκBα、p65、p-p65蛋白表达差异有统计学意义(均P<0.05)。两两比较发现,与对照组相比,LPS组细胞IκBα蛋白表达水平下调(P<0.01),而p65蛋白、p-p65蛋白表达水平上调(均P<0.05);与LPS组比较,加入400 μmol/L黄杞苷干预后,IκBα蛋白表达水平上调(P<0.001),而p65蛋白、p-p65蛋白表达水平下调(均P<0.05),提示黄杞苷可干预NF-κB信号通路中IκBα、p65、p-p65蛋白的表达,见图 3和表 5。
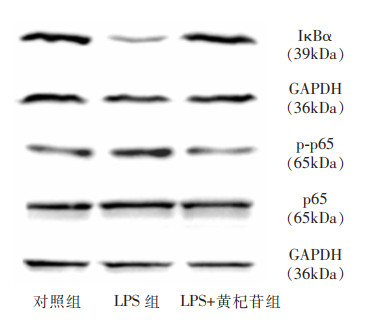 |
| 图 3 400 μmol/L黄杞苷对IκBα、p65、p-p65表达的影响 Figure 3 Effect of 400 μmol/L engeletin on the expression of IκBα, p65 and p-p65 |
| 表 5 400 μmol/L黄杞苷对IκBα、p65、p-p65蛋白表达的影响 Table 5 Effect of 400 μmol/L engeletin on the expression of IκBα, p65 and p-p65 |
|
巨噬细胞是机体的天然免疫细胞,能够吞噬、清除衰老细胞和病原微生物,递呈抗原,并诱导免疫应答反应,具有维持内环境稳态、参与组织修复和抵御感染的重要作用[10]。LPS是革兰阴性菌细胞壁破裂释放的主要成分之一,进入体内可诱发炎症反应,激活巨噬细胞、内皮细胞、上皮细胞等,是临床上感染性休克的主要诱因。作为最常见的外源性细菌内毒素成分,LPS被广泛用于构建体外炎症模型。龙碧莹[11]用LPS刺激小鼠巨噬细胞RAW264.7后,细胞增殖能力增强,成功构建巨噬细胞炎症模型。本研究也发现LPS刺激后,RAW264.7细胞数量增多,密度增高,增殖能力增强。巨噬细胞主要在慢性炎症时大量聚集,发挥吞噬免疫作用,可被不同刺激物激活,并诱导M1型或M2型极化。M1型巨噬细胞可产生TNF-α、IL-1β、IL-6、IL-12等炎症介质,也是体内杀伤性分子O2·-、羟自由基(hydroxyl radical,·OH)、NO等ROS/活性氮簇(reactive nitrogen species,RNS)的重要来源,从而清除病原微生物,发挥防御功能[12]。本研究LPS刺激后RAW264.7细胞发生M1极化,TNF-α、IL-1β、IL-6、ROS、NO、O2·-增多,与前期研究[13-14]一致。其中,NO属于RNS,O2·-属于ROS,两者均可由内、外源性因素诱导产生。LPS作为内毒素的成分,除了诱导巨噬细胞增殖聚集,还能促进炎症细胞因子、ROS/RNS的释放,导致炎症病变时氧化应激水平升高。
黄酮类化合物是从多种中药材中分离的,具有抗菌消炎、抗氧化作用的药效成分,分为黄酮类、黄酮醇类、二氢黄酮类、二氢黄酮醇类、异黄酮类、双黄酮类、查尔酮类及其他黄酮类等,能够治疗多种炎症性疾病。土茯苓总黄酮具有除湿解毒、疏通关节、减轻炎症的药理作用,可减轻痛风性关节炎小鼠的踝关节肿胀度[15];菝葜总黄酮具有祛风消肿、解毒散瘀、抗炎抗菌的药理作用,能降低慢性盆腔炎大鼠子宫组织中IL-6和IL-1β水平,一定程度上改善慢性盆腔炎,缓解盆腔粘连[16]。本研究中的黄杞苷属于土茯苓(光叶菝葜)和菝葜(金刚藤)等菝葜属中药材分离的黄酮类化合物,也能减少LPS诱导的炎症细胞因子TNF-α、IL-6、IL-1β的产生,发挥重要的抗炎作用。此外,黄杞苷还能抑制LPS诱导的ROS/RNS产生。作为细胞氧化还原反应的代谢物,过多的ROS/RNS会引起细胞DNA、蛋白质和脂质的过氧化损伤,诱导细胞死亡[17]。谢雨露等[18]研究发现,黄杞苷通过直接或间接清除氮氧自由基减少ROS/RNS生成,具有重要的抗氧化作用。
抗炎、抗氧化的药物往往具有抑制氧化损伤、保护组织、细胞的功效。文献[19-21]证实,黄杞苷能够减轻LPS诱导的急性肝、肺损伤和子宫内膜炎,其机制与抑制NF-κB信号通路的激活,减少TNF-α、IL-6、IL-1β和诱导型一氧化氮合酶(iNOS)的产生或表达有关。NF-κB是一种广泛存在于细胞内的核转录因子,与类风湿性关节炎、牛皮癣、肠炎、肝纤维化等多种炎症性疾病的发生发展密切相关,是炎症反应和氧化应激级联作用的中心调控器[22-23]。炎症诱导因子LPS可与巨噬细胞表面的Toll样受体4(TLR4)结合,激活NF-κB信号通路,高效诱导细胞因子(TNF-α、IL-6、IL-1)、趋化因子、黏附分子(ICAM-1、VCAM-1)等的表达,启动炎症反应;炎症反应产生大量的ROS/RNS,导致氧化应激水平升高,有利于有效消灭和清除外源感染物[24-25]。黄杞苷缓解椎间盘退行性变、骨盆炎症性疾病、骨关节炎的作用也均与干预NF-κB信号通路有关[26-28]。因此,黄杞苷抑制巨噬细胞增殖,减少炎症细胞因子和ROS/RNS的产生,可能也是通过干预NF-κB信号通路实现。
综上所述,本研究发现黄杞苷可能通过干预NF-κB信号通路,抑制LPS诱导的RAW264.7细胞增殖、炎症因子和ROS/RNS的产生,显示了其抗炎和抗氧化功效,为其治疗炎症性疾病的深入研究提供一定的依据和借鉴。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Koyama Y, Brenner DA. Liver inflammation and fibrosis[J]. J Clin Invest, 2017, 127(1): 55-64. DOI:10.1172/JCI88881 |
| [2] |
Wirtz PH, von Känel R. Psychological stress, inflammation, and coronary heart disease[J]. Curr Cardiol Rep, 2017, 19(11): 111. DOI:10.1007/s11886-017-0919-x |
| [3] |
Rohm TV, Meier DT, Olefsky JM, et al. Inflammation in obesity, diabetes, and related disorders[J]. Immunity, 2022, 55(1): 31-55. DOI:10.1016/j.immuni.2021.12.013 |
| [4] |
Stephenson J, Nutma E, van der Valk P, et al. Inflammation in CNS neurodegenerative diseases[J]. Immunology, 2018, 154(2): 204-219. DOI:10.1111/imm.12922 |
| [5] |
Singh N, Baby D, Rajguru JP, et al. Inflammation and cancer[J]. Ann Afr Med, 2019, 18(3): 121-126. DOI:10.4103/aam.aam_56_18 |
| [6] |
Thapa B, Lee K. Metabolic influence on macrophage polarization and pathogenesis[J]. BMB Rep, 2019, 52(6): 360-372. DOI:10.5483/BMBRep.2019.52.6.140 |
| [7] |
Liu H, Li SC, Xu YY, et al. Engeletin protects against cerebral ischemia/reperfusion injury by modulating the VEGF/vasohibin and Ang-1/Tie-2 pathways[J]. Braz J Med Biol Res, 2021, 54(10): e11028. DOI:10.1590/1414-431x2020e11028 |
| [8] |
Liu T, Li Y, Sun JL, et al. Engeletin suppresses lung cancer progression by inducing apoptotic cell death through modulating the XIAP signaling pathway: a molecular mechanism involving ER stress[J]. Biomed Pharmacother, 2020, 128: 110221. DOI:10.1016/j.biopha.2020.110221 |
| [9] |
刘慧, 闫冬, 徐洋洋, 等. 黄杞苷对H2O2诱导SH-SY5Y细胞氧化应激损伤的保护作用[J]. 滨州医学院学报, 2021, 44(1): 1-6. Liu H, Yan D, Xu YY, et al. Protective effect of engeletin on H2O2 induced oxidative stress injury in SH-SY5Y cells[J]. Journal of Binzhou Medical University, 2021, 44(1): 1-6. |
| [10] |
Li C, Xu MM, Wang KP, et al. Macrophage polarization and Meta-inflammation[J]. Transl Res, 2018, 191: 29-44. DOI:10.1016/j.trsl.2017.10.004 |
| [11] |
龙碧莹. 油酸对脂多糖诱导的小鼠巨噬细胞炎症反应的影响及其机制[D]. 衡阳: 南华大学, 2019. Long BY. Effect of oleic acid on lipopolysaccharide-induced inflammatory response in mouse macrophages and its mechanism[D]. Hengyang: University of South China, 2019. |
| [12] |
Orecchioni M, Ghosheh Y, Pramod AB, et al. Macrophage polarization: different gene signatures in M1(LPS+) vs. alternatively activated macrophages[J]. Front Immunol, 2019, 10: 1084. DOI:10.3389/fimmu.2019.01084 |
| [13] |
Monga S, Fares B, Yashaev R, et al. The effect of natural-based formulation (NBF) on the response of RAW264.7 macrophages to LPS as an in vitro model of inflammation[J]. J Fungi (Basel), 2022, 8(3): 321. DOI:10.3390/jof8030321 |
| [14] |
李思媛, 崔玉顺, 李新星, 等. 黄精皂苷对脂多糖诱导RAW264.7细胞炎症模型的抗炎作用及其机制[J]. 中成药, 2021, 43(10): 2659-2665. Li SY, Cui YS, Li XX, et al. Anti-inflammatory effect and mechanism of Polygonati Rhizoma saponins on inflammation model of LPS-induced RAW264.7 cells[J]. Chinese Traditio-nal Patent Medicine, 2021, 43(10): 2659-2665. DOI:10.3969/j.issn.1001-1528.2021.10.010 |
| [15] |
金晓敏, 张晓熙, 郭璐, 等. 基于NLRP3炎性体轴探讨土茯苓总黄酮对痛风性关节炎的作用和机制[J]. 中国实验方剂学杂志, 2018, 24(4): 90-95. Jin XM, Zhang XX, Guo L, et al. Effect and mechanism of total flavonoids from Smilacis Glabrae Rhizoma in treatment of gouty arthritis based on NLRP3 inflammasomes axis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(4): 90-95. |
| [16] |
Chen JQ, Jin C, Xu BL, et al. Identification of major compounds of total flavonoids from Smilax china and evaluation of anti-inflammatory effect on phenol mucilage-induced pelvic inflammation in rats[J]. J Chin Pharm Sci, 2021, 30(2): 157-168. DOI:10.5246/jcps.2021.02.013 |
| [17] |
周志文, 李姗, 刘湘花, 等. 中药单体调控氧化应激抗肝纤维化的机制和价值[J]. 临床肝胆病杂志, 2021, 37(9): 2198-2202. Zhou ZW, Li S, Liu XH, et al. Research advances in monomers of Chinese herbs in treatment of liver fibrosis by regulating oxidative stress[J]. Journal of Clinical Hepatology, 2021, 37(9): 2198-2202. DOI:10.3969/j.issn.1001-5256.2021.09.039 |
| [18] |
谢雨露, 黄毓珧, 李熙灿. 黄杞苷保护DNA氧化损伤的活性及其可能机制[J]. 中国现代应用药学, 2018, 35(9): 1333-1336. Xie YL, Huang YY, Li XC. Protection effect of engeletin towards DNA against oxidative damage and its possible mechanisms[J]. Chinese Journal of Modern Applied Pharmacy, 2018, 35(9): 1333-1336. |
| [19] |
Tian Q, Wang GJ, Zhang YM, et al. Engeletin inhibits lipopolysaccharide/d-galactosamine-induced liver injury in mice through activating PPAR-γ[J]. J Pharmacol Sci, 2019, 140(3): 218-222. DOI:10.1016/j.jphs.2019.06.011 |
| [20] |
Jiang X, Chen LJ, Zhang Z, et al. Protective and therapeutic effects of engeletin on LPS-induced acute lung injury[J]. Inflammation, 2018, 41(4): 1259-1265. DOI:10.1007/s10753-018-0773-z |
| [21] |
Wu HC, Zhao G, Jiang KF, et al. Engeletin alleviates lipopolysaccharide-induced endometritis in mice by inhibiting TLR4-mediated NF-κB activation[J]. J Agric Food Chem, 2016, 64(31): 6171-6178. DOI:10.1021/acs.jafc.6b02304 |
| [22] |
Morgan MJ, Liu ZG. Crosstalk of reactive oxygen species and NF-κB signaling[J]. Cell Res, 2011, 21(1): 103-115. DOI:10.1038/cr.2010.178 |
| [23] |
Hoesel B, Schmid JA. The complexity of NF-κB signaling in inflammation and cancer[J]. Mol Cancer, 2013, 12: 86. DOI:10.1186/1476-4598-12-86 |
| [24] |
Lawrence T. The nuclear factor NF-kappaB pathway in inflammation[J]. Cold Spring Harb Perspect Biol, 2009, 1(6): a001651. |
| [25] |
于卫华, 周庆彪, 刘颖, 等. 活性氧调控炎症诱发肿瘤机制的研究进展[J]. 癌变·畸变·突变, 2016, 28(2): 158-161. Yu WH, Zhou QB, Liu Y, et al. Research progress on the mechanism of reactive oxygen species regulating inflammation and inducing tumor[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2016, 28(2): 158-161. DOI:10.3969/j.issn.1004-616x.2016.02.017 |
| [26] |
Li BX, Yang X, Zhang P, et al. Engeletin alleviates the inflammation and apoptosis in intervertebral disc degeneration via inhibiting the NF-κB and MAPK pathways[J]. J Inflamm Res, 2022, 15: 5767-5783. DOI:10.2147/JIR.S371809 |
| [27] |
Wang CM, La L, Feng HX, et al. Aldose reductase inhibitor engeletin suppresses pelvic inflammatory disease by blocking the phospholipase C/protein kinase C-dependent/NF-κB and MAPK cascades[J]. J Agric Food Chem, 2020, 68(42): 11747-11757. DOI:10.1021/acs.jafc.0c05102 |
| [28] |
Wang H, Jiang ZX, Pang ZY, et al. Engeletin protects against TNF-α-induced apoptosis and reactive oxygen species generation in chondrocytes and alleviates osteoarthritis in vivo[J]. J Inflamm Res, 2021, 14: 745-760. DOI:10.2147/JIR.S297166 |



