2. 北京大学人民医院感染管理-疾病预防控制处, 北京 100044;
3. 北京市医院感染管理质量控制和改进中心, 北京 100044
2. Department of Healthcare-associated Infection Management-Disease Prevention and Control, Peking University People's Hospital, Beijing 100044, China;
3. Beijing Municipal Center for Quality Control and Improvement on the Management of Healthcare-associated Infection, Beijing 100044, China
近年来我国女性乳腺癌呈迅速增长的趋势,据国家癌症中心2019年公布的数据显示,2015年我国女性乳腺癌新发病例约30.4万例,占新发女性恶性肿瘤的17.1%,位居我国女性恶性肿瘤发病第一位[1-2]。手术治疗是乳腺癌治疗康复过程中的重要一步,而手术部位感染(surgical site infection,SSI)是乳腺癌手术后最常见的并发症之一,导致住院时间延长,增加患者痛苦和经济负担[3]。
目前国内外一些研究已经对乳腺癌患者SSI发病率及其危险因素进行了分析。美国国家医疗保健安全网络(National Healthcare Safety Network, NHSN) 报道2006—2008年住院患者乳房手术后SSI发病率为2.3%,危险因素包括肥胖或体重指数高、高血糖、吸烟、饮酒、美国麻醉师协会(American Society of Anesthesiologists,ASA)评分、既往放射治疗、手术时间长和移植等[4]。国内研究[5-7]也表明手术切口类型、手术时间、基础疾病情况等可能是乳房手术患者SSI的危险因素。但大多数研究均来自单个机构或医院,样本量较小,区域代表性较差。
本研究基于北京市83所二级及以上医疗机构2012—2017年共6年的SSI目标性监测数据,对北京市乳腺癌根治/改良根治术患者的基本信息和临床特征进行描述分析,并通过分析确定乳腺癌根治/改良根治术后发生SSI的危险因素,探讨降低SSI风险的个性化策略。
1 对象与方法 1.1 数据来源研究数据来自北京市医院感染管理质量控制和改进中心的北京医院感染监控管理系统。该系统自2010年起对4种Ⅰ类清洁切口手术进行前瞻性目标监测。北京市共83所二级及以上医疗机构参与了乳腺癌根治/改良根治术的SSI监测,其中二级医院29所,三级医院54所。本研究选取了监测网中2012—2017年的数据。
数据收集时仅保留择期的、被归类为Ⅰ类清洁切口的手术,将急诊手术、手术切口类型为清洁-污染、污染或污秽-感染的排除在外。排除手术相关信息未填写完整、手术时患有肺炎、手术部位或伤口感染、尿路感染、免疫缺陷疾病的患者。见图 1。
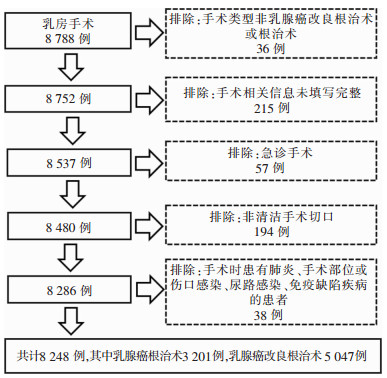 |
| 图 1 北京市乳腺癌根治/改良根治术后SSI目标性监测病例筛选过程 Figure 1 Case screening process for targeted surveillance on SSI after radical mastectomy for breast cancer in Beijing City |
手术类型分类采用国际疾病分类,手术与操作ICD-9-CM-3编码。其中编码85.43为乳腺癌改良根治术,单侧;编码85.46为乳腺癌根治术,双侧;编码85.45为乳腺癌根治术,单侧。SSI诊断依据中华人民共和国卫生部2001年颁布的《医院感染诊断标准(试行)》[8]。
1.3 统计学方法应用SPSS 24.0统计软件进行数据分析,患者特征描述分析中,正态分布的连续性变量以平均值±标准差表示,非正态分布的连续型变量用中位数和四分位数表示,分类变量以例数及构成比表示。术后SSI发病率随时间变化趋势采用趋势性卡方检验。对SSI发生的相关因素,首先对连续变量进行分层,后与其他分类变量一起进行χ2检验进行单因素分析,将有统计学意义的变量和临床上认为与感染关系密切的变量纳入logistic回归模型进行多因素回归分析,分析采用Forward LR法。P≤0.05为差异有统计学意义。
2 结果 2.1 基本临床特征本研究共纳入患者8 248例,其中男性64例,女性8 184例。发生SSI 62例,SSI发病率0.75%,均为女性,其中表浅切口43例(69.35%),深部切口19例(30.65%)。SSI患者的手术前住院日、手术时间、术中失血量均高于非SSI患者,差异均有统计学意义(均P<0.05)。患者术后入住过重症监护病房(ICU),有高血压、糖尿病、高脂血症,ASA评分Ⅲ级及以上,有引流、脂肪液化、联合使用抗菌药物患者的SSI发病率较高,差异均有统计学意义(均P<0.05)。见表 1。
| 表 1 2012—2017年乳腺癌根治/改良根治术患者的基本临床特征 Table 1 Basic clinical characteristics of patients undergoing radical mastectomy/modified mastectomy for breast cancer from 2012 to 2017 |
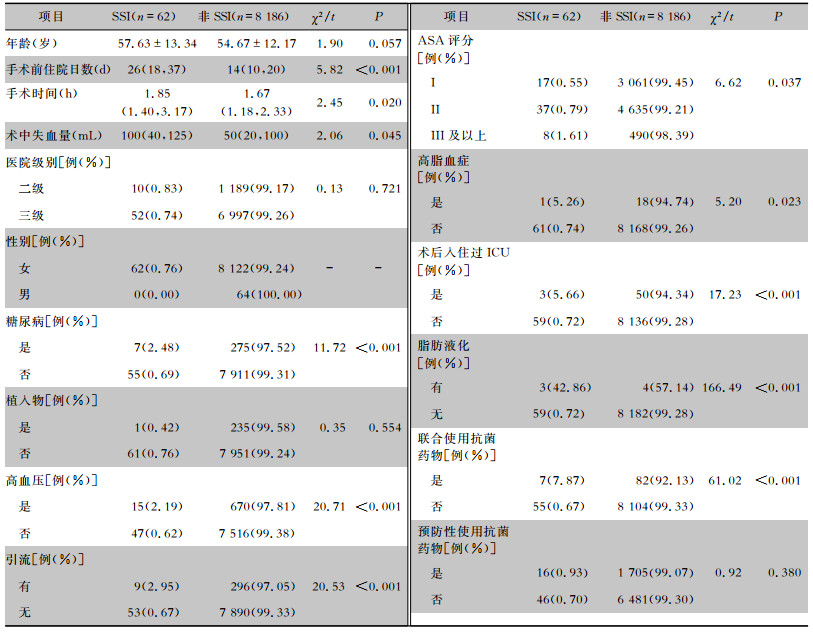
|
2012—2017年乳腺癌根治/改良根治术目标性监测病例逐年上升,从2012年的823例上升至2017年的2 486例。经趋势性卡方检验,乳腺癌根治/改良根治术患者SSI发病率呈逐年递减趋势,差异有统计学意义(χ2=11.94,P<0.05)。见表 2。
| 表 2 2012—2017年乳腺癌根治/改良根治术患者SSI发病情况 Table 2 Occurrence of SSI in patients undergoing radical mastectomy/modified mastectomy for breast can-cer from 2012 to 2017 |
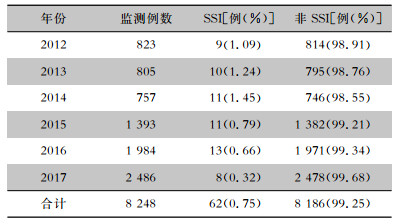
|
将单因素分析显示有意义的危险因素:手术前住院日、手术时间、入住过ICU、失血量、高血压、糖尿病、ASA评分、引流、脂肪液化、联合使用抗菌药物纳入多因素logistic回归分析。logistic回归模型在调整了年龄、医院级别等因素后显示糖尿病、术后入住过ICU、手术时间和ASA评分是乳腺癌手术患者发生SSI的危险因素。Hosmer-Lemesho检验模型拟合优度较好(P=0.47),糖尿病患者相较于非糖尿病患者,术后SSI的风险增加(OR=2.99, 95%CI: 1.33~6.73);术后入住过ICU的患者发生SSI的风险是未入住过ICU的5.72倍(OR=5.72, 95%CI: 1.68~19.45);手术时间每增加1 h,SSI发生的的风险增加27%(OR=1.27, 95%CI: 1.11~1.46);ASA评分每高一个级别,SSI发生的风险将增加54%(OR=1.54, 95%CI: 1.01~2.35)。见表 3。
| 表 3 乳腺癌根治/改良根治术患者SSI多因素分析 Table 3 Multivariate logistic regression analysis on SSI in patients undergoing radical mastectomy/modified mastectomy for breast cancer |
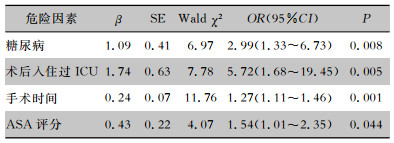
|
NHSN对Ⅰ类清洁切口如乳房手术SSI的发病率预计较低(1%~2%),国外文献[9-11]报道的乳房手术后SSI发病率普遍较高,约5%。王文静等[12]对1 332例乳房手术患者手术后感染情况进行分析,SSI发病率为2.55%。本研究8 248例病例中,发生SSI 62例,发病率为0.75%,低于国内外报道的发病率,分析原因一方面因为SSI发病率的变化取决于手术类型、感染定义、确定感染的监测方法和术后随访时间长短等因素。例如美国乳腺外科医生学会进行的建立质量管理体系的项目中,为了不低估乳腺癌患者的SSI负担,将术后蜂窝织炎患者归为SSI[13]。另一方面,随着医疗技术发展、手术技术的提高、围手术期管理的改善、无菌维持的保障等,SSI发病率逐年降低,本研究中的数据也显示,2012—2017年北京市乳腺癌患者手术后SSI发病率呈降低趋势。
此外,随着医疗服务效率的不断提高,患者平均住院日缩短,而部分患者SSI发生在出院后。《医院感染诊断标准(试行)》和NHSN均建议对手术后30 d或更久(如果涉及到植入物)的SSI进行监测。本研究监测数据主要记录患者住院期间的感染情况,因此获得的SSI发病率和危险因素主要针对患者住院期间的情况。
本研究表明,糖尿病与SSI风险增加有关,与之前的研究结果相符。患者切口并发症的主要原因是术后局部血管供应的中断继发组织缺氧。因此,许多心血管危险因素与切口并发症的发生率增加有关,如吸烟、肥胖、高血压、糖尿病等[14]。Rifkin等[15]对2010—2015年美国外科医师学会(American College of Surgeons) 国家手术质量改善计划(National Surgical Quality Improvement Program)数据库评估发现,在全乳切除术中,糖尿病与浅部切口(OR=1.56;P=0.04)和深部切口(OR=2.07;P=0.04) SSI发病率升高相关。2016年世界卫生组织(WHO) 关于SSI防控措施指南中建议对接受外科手术的糖尿病和非糖尿病成年患者采用围手术期强化血糖控制方案,以降低SSI的风险[16]。美国医疗保健流行病学学会联合美国感染病学会(SHEA/IDSA)和美国医学院(American College of Physicians) 建议对于所有外科手术患者应控制血糖目标水平在140~200 mg/dL (7.8~11.1 mmol/L)或血糖上限控制在180 mg/dL(10mmol/L)或198 mg/dL (11mmol/L),对乳房手术也不例外[17-18]。
本研究结果表明,手术时间每增加1 h,手术后发生SSI的风险将增加27%,SSI患者的平均手术时间比非SSI患者长0.47 h,约30 min。这与一项对81个前瞻性和回顾性研究汇总分析的结果相符,该研究表明延长手术时间与SSI之间的相关性具有统计学意义,手术时间每延长15、30、60 min,发生SSI的概率分别增加13%、17%、37%,SSI患者的平均手术时间比非SSI患者长约30 min[19]。可见延长手术时间会增加SSI的风险。考虑到SSI对患者预后和医疗经济负担的重要性,手术团队应努力通过术前充分细致的评估、准备,术中熟练的操作,彼此间娴熟的配合等减少手术时间,这一目标非一日之功,需要长时间的积累和医务人员工作流程中良好的磨合。
荷兰的一项队列研究发现,高ASA评分(Ⅱ和Ⅲ~Ⅳ)是SSI的危险因素(OR=1.5,95%CI: 1.1~2.0;OR=3.0, 95%CI: 1.7~5.3)[20]。Morikane等[21]对日本医院感染监测系统(Japan Nosocomial Infection Surveillance,JANIS)2008、2010年的数据进行分析显示,在胸外科手术和冠状动脉旁路移植手术中ASA评分较高在SSI风险预测模型中具有重要意义。而国内外尚无证据表明乳腺癌手术后SSI风险与ASA评分的关系。本研究通过数据分析显示,ASA评分每高一个级别,SSI的风险增加54%。乳腺癌手术是限期手术,患者的ASA评分也许并不能在短时间内达到一个更好的级别,但是对于患者在ASA方面的充分评估有利于手术团队重视SSI的预防和监测,最终能让更多的患者获益。
目前尚无专门文献报道乳腺癌手术后进入ICU与患者发生SSI的关系。一项对美国7个脊柱外科中心接受4年选择性脊柱手术患者的研究显示,术后入住过ICU的患者患SSI的风险更高(RR=2.1,P=0.005)[22]。本研究也发现,术后入住过ICU的患者发生SSI风险是未入住过ICU患者的5.72倍。推测可能与术后入住过ICU的患者病情较重、年龄大、基础疾病多等原因相关。因为绝大部分Ⅰ类切口的手术感染微生物来源于切口缝合之前,所以患者在ICU入住过程中发生外源性感染可能性并不大。
本研究是北京地区首次进行的SSI多中心前瞻性队列研究,与以往的单中心小样本研究相比,具有更好的区域代表性。从2012年起参与SSI监测的病例逐年增多,体现了各单位对SSI监测的重视程度以及监测网络的逐步完善。每年北京质控中心会对监测数据进行质量检查,对数据质量的保证也起到了促进作用。本研究通过对SSI监测数据的分析,证实了北京地区乳腺癌手术后发生SSI存在一些危险因素,为临床评估患者感染风险,制定个性化治疗和护理方案提供理论依据,对于乳腺癌拟行根治术的患者,围手术期血糖的控制、患者术前全身状况的调整改善、术前手术团队的充分评估和术中以缩短手术时间为目标的流程优化,于手术后的SSI防控是有帮助的。
本研究仍存在一定的局限性,首先,研究中个别影响因素无法明确与结局的因果关系,如患者是因为感染而进入ICU还是进入ICU后发生相关感染,即在收集数据时未记录暴露因素与感染发生的时间顺序。此外,随着循证医学的不断推进,危险因素的种类也在增加,本次前瞻性队列研究未收集患者身高、体重、吸烟饮酒情况等可能与SSI相关的基本信息。因此,更为精准的循证措施依据依赖不断改进的数据质量,不断调整防控策略。
致谢: 向各医院参与本项目的人员在数据收集中的贡献表示感谢。特别感谢北京大学人民医院、北京肿瘤医院、首都医科大学附属北京朝阳医院(东院)、北京大学第一医院、中日友好医院、北京世纪坛医院、首都医科大学附属北京天坛医院、北京大学首钢医院、北京市顺义区妇幼保健院、北京市房山区良乡医院等对本研究的贡献。
| [1] |
郑莹, 吴春晓, 张敏璐. 乳腺癌在中国的流行状况和疾病特征[J]. 中国癌症杂志, 2013, 23(8): 561-569. DOI:10.3969/j.issn.1007-3969.2013.08.001 |
| [2] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [3] |
Koek MBG, van der Kooi TⅡ, Stigter FCA, et al. Burden of surgical site infections in the Netherlands: cost analyses and disability-adjusted life years[J]. J Hosp Infect, 2019, 103(3): 293-302. DOI:10.1016/j.jhin.2019.07.010 |
| [4] |
Edwards JR, Peterson KD, Mu Y, et al. National Healthcare Safety Network (NHSN) report: data summary for 2006 through 2008, issued December 2009[J]. Am J Infect Control, 2009, 37(10): 783-805. DOI:10.1016/j.ajic.2009.10.001 |
| [5] |
李光明, 段百芸, 许云宝, 等. 乳腺癌患者术后感染特征与危险因素分析[J]. 中华医院感染学杂志, 2016, 26(2): 390-392. |
| [6] |
于伟杰, 刘明明, 韩明玥, 等. 乳腺癌患者手术切口感染的危险因素及血清细胞因子的诊断价值分析[J]. 中华医院感染学杂志, 2019, 29(23): 3608-3613. |
| [7] |
吴晓明, 韩华, 黄光越, 等. 乳腺手术预防性使用抗菌药物与术后切口感染相关性分析[J]. 中华医院感染学杂志, 2018, 28(22): 3474-3477. |
| [8] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [9] |
Shepard J, Ward W, Milstone A, et al. Financial impact of surgical site infections on hospitals: the hospital management perspective[J]. JAMA Surg, 2013, 148(10): 907-914. DOI:10.1001/jamasurg.2013.2246 |
| [10] |
Olsen MA, Nickel KB, Fox IK, et al. Incidence of surgical site infection following mastectomy with and without immedia-te reconstruction using private insurer claims data[J]. Infect Control Hosp Epidemiol, 2015, 36(8): 907-914. DOI:10.1017/ice.2015.108 |
| [11] |
Olsen MA, Nickel KB, Margenthaler JA, et al. Development of a risk prediction model to individualize risk factors for surgical site infection after mastectomy[J]. Ann Surg Oncol, 2016, 23(8): 2471-2479. DOI:10.1245/s10434-015-5083-1 |
| [12] |
王文静, 刘永瑞, 崔小松, 等. 乳腺外科手术患者切口感染危险因素的调查[J]. 中华医院感染学杂志, 2016, 26(12): 2779-2781. |
| [13] |
Landercasper J, Bailey L, Buras R, et al. The American Socie-ty of Breast Surgeons and quality payment programs: ranking, defining, and benchmarking more than 1 million patient quality measure encounters[J]. Ann Surg Oncol, 2017, 24(10): 3093-3106. DOI:10.1245/s10434-017-5940-1 |
| [14] |
Garland M, Hsu FC, Clark C, et al. The impact of obesity on outcomes for patients undergoing mastectomy using the ACS-NSQIP data set[J]. Breast Cancer Res Treat, 2018, 168(3): 723-726. DOI:10.1007/s10549-017-4651-4 |
| [15] |
Rifkin WJ, Kantar RS, Cammarata MJ, et al. Impact of diabetes on 30-day complications in mastectomy and implant-based breast reconstruction[J]. J Surg Res, 2019, 235: 148-159. DOI:10.1016/j.jss.2018.09.063 |
| [16] |
World Health Organization. Global guidelines for the prevention of surgical site infection[M]. 2nd ed. Geneva: World Health Organization, 2018.
|
| [17] |
Anderson DJ, Podgorny K, Berríos-Torres SI, et al. Strategies to prevent surgical site infections in acute care hospitals: 2014 update[J]. Infect Control Hosp Epidemiol, 2014, 35(6): 605-627. DOI:10.1086/676022 |
| [18] |
Qaseem A, Humphrey LL, Chou R, et al. Use of intensive insulin therapy for the management of glycemic control in hospitalized patients: a clinical practice guideline from the American College of Physicians[J]. Ann Intern Med, 2011, 154(4): 260-267. DOI:10.7326/0003-4819-154-4-201102150-00007 |
| [19] |
Cheng H, Chen BPH, Soleas IM, et al. Prolonged operative duration increases risk of surgical site infections: a systematic review[J]. Surg Infect (Larchmt), 2017, 18(6): 722-735. DOI:10.1089/sur.2017.089 |
| [20] |
Peters RM, van Steenbergen LN, Stewart RE, et al. Patient characteristics influence revision rate of total hip arthroplasty: American Society of Anesthesiologists score and body mass index were the strongest predictors for short-term revision after primary total hip arthroplasty[J]. J Arthroplasty, 2020, 35(1): 188-192.e2. DOI:10.1016/j.arth.2019.08.024 |
| [21] |
Morikane K, Honda H, Yamagishi T, et al. Differences in risk factors associated with surgical site infections following two types of cardiac surgery in Japanese patients[J]. J Hosp Infect, 2015, 90(1): 15-21. DOI:10.1016/j.jhin.2014.11.022 |
| [22] |
Devin CJ, Chotai S, McGirt MJ, et al. Intrawound vancomycin decreases the risk of surgical site infection after posterior spine surgery: a multicenter analysis[J]. Spine (Phila Pa 1976), 2018, 43(1): 65-71. DOI:10.1097/BRS.0000000000001371 |



