2. 青岛市黄岛区西海岸新区人民医院检验科, 山东 青岛 266500;
3. 泰安市中心医院检验科, 山东 泰安 271000
2. Department of Laboratory Medicine, People's Hospital of West Coast New District of Qingdao Huangdao District, Qingdao 266500, China;
3. Department of Laboratory Medicine, Taian City Central Hospital, Taian 271000, China
阴沟肠杆菌是医院内感染重要的病原菌,可引起呼吸道、伤口、泌尿系统感染和脑膜炎等病症[1-2]。碳青霉烯类抗生素是治疗此类菌株感染的最佳药物。但随着碳青霉烯类抗生素应用的增加,近年来临床上耐碳青霉烯类阴沟肠杆菌的检出数也逐年增加,给临床抗感染治疗带来困难[3-5]。对我院2019年4—9月检出的耐碳青霉烯类阴沟肠杆菌分布、耐药性及耐药机制进行分析,为抗感染治疗及医院感染预防控制提供依据。
1 资料与方法 1.1 菌株来源收集本院2019年4—9月住院患者临床分离到的非重复耐碳青霉烯类阴沟肠杆菌(亚胺培南或美罗培南MIC≥2 mg/L),所有菌株进行药敏试验。
1.2 细菌鉴定及药敏试验采用WalkAway 96 PLUS NUC61复合板进行菌种鉴定及药物敏感性检测,用K-B纸片扩散法补充检测头孢哌酮/舒巴坦、头孢吡肟、头孢噻肟、厄他培南、环丙沙星和左氧氟沙星的敏感性,药敏试验执行2018年美国临床实验室标准化协会(CLSI)标准。其中替加环素敏感性试验执行美国食品药品监督管理局(FDA)的标准,头孢哌酮/舒巴坦敏感性试验执行CLSI中头孢哌酮的标准。M-H琼脂和药敏纸片均为英国Oxoid产品。铜绿假单胞菌ATCC 27853、大肠埃希菌ATCC 25922作为质控菌株。
1.3 临床资料收集采用回顾性分析方法,收集耐药菌感染患者的临床资料,包括标本来源、科室分布、基础疾病、抗菌药物应用、是否有创伤性操作、呼吸机的应用情况等。
1.4 碳青霉烯酶检测-改良碳青霉烯酶灭活试验依据CLSI M100S-28th文件的改良碳青霉烯灭活试验mCIM联合eCIM试验筛选碳青霉烯酶产酶菌株。
1.5 碳青霉烯耐药基因检测及测序煮沸法提取细菌DNA模板,采用多聚酶链反应(PCR)方法对碳青霉烯酶类相关耐药基因KPC、IMP、VIM、NDM、SME、IMI、NMC及OXA-23、OXA-24、OXA-48、OXA-51、OXA-58基因进行扩增测序,所用引物参考文献[6-10]报道。PCR反应体系为25 μL,含Taq酶(5 U/μL)0.5 μL, 10×PCR buffer 2.5 μL,MgCl2(25 mmol/L)1 μL,dNTP mixture(5 mmol/L) 0.5 μL,待检菌DNA模板2 μL,引物F、R(10 μmol/L)各1 μL,ddH2O补足至25 μL。退火温度参照文献[6-10]。PCR扩增产物送上海桑尼生物科技有限公司测序,测序结果在GenBank中的BLAST(http://blast.ncbi.nlm.nih.gov/blast.cgi)进行对比, 确定基因型。
1.6 多位点序列分型(MLST)对阴沟肠杆菌7个管家基因片段dnaA-fusA-gyrB-leuS-pyrG-rplB-rpoB通过PCR扩增后直接测序, 测序结果在pubMLST数据库中已有管家基因谱进行比对,确定序列类型(ST)。MLST分析所用引物见表 1。
| 表 1 MLST引物序列 Table 1 Primer sequences of multilocus sequence typing |
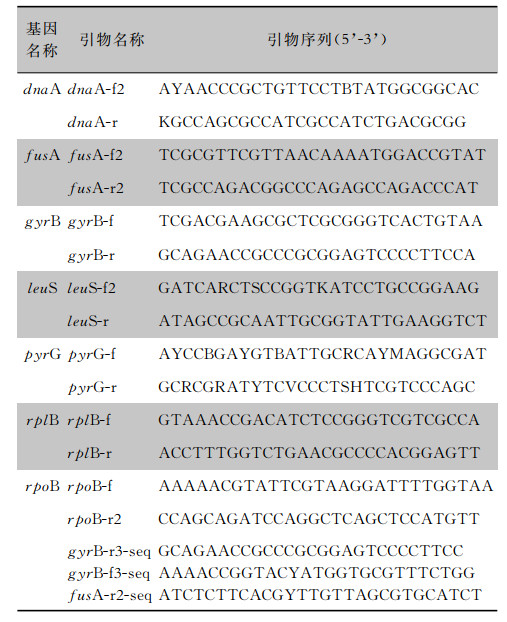
|
使用限制性内切酶XbaI对染色体DNA进行消化,试验参数为:14℃,电压6 V/cm,相对分子质量50~400 kb, 电场夹角120℃, 脉冲4~40 s,电泳时间20 h。溴化乙锭(EB)染色30 min后在紫外灯下观察结果,Bio-Rad凝胶成像系统成像,Bionumeric软件分析,作出进化树分析菌株亲缘性,各菌株间相似性>85%判断为同一克隆株。
1.8 统计分析应用WHONET 5.6软件进行耐药性分析。
2 结果 2.1 临床资料2019年4—9月共检出8株非重复耐碳青霉烯阴沟肠杆菌,5株来自于重症监护病房(ICU);4株来源于痰, 2株来源于穿刺液, 1株来源于血标本, 1株来源于尿标本。见表 2。
| 表 2 8例耐碳青霉烯类阴沟肠杆菌感染患者临床资料 Table 2 Clinical data of 8 patients with CREC infection |
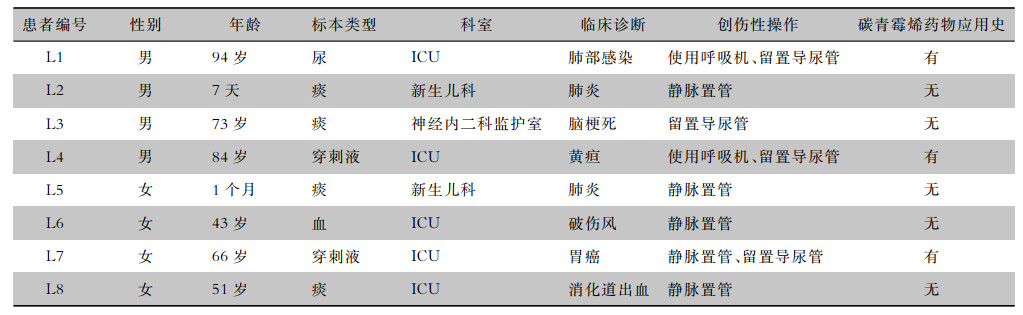
|
8株耐碳青霉烯类阴沟肠杆菌对头孢类药物及加酶抑制剂头孢噻肟、头孢曲松、头孢吡肟、头孢哌酮/舒巴坦、哌拉西林/舒巴坦均100%耐药;对单环内酰胺类药物氨曲南4株耐药, 4株敏感;对喹诺酮类药物左氧氟沙星和环丙沙星3株敏感,5株耐药;对氨基糖苷类药物阿米卡星100%敏感,对庆大霉素2株耐药,6株敏感; 对妥布霉素1株耐药,2株中介,5株敏感;对磺胺类药物复方磺胺甲
| 表 3 抗菌药物对阴沟肠杆菌的MIC值及改良碳青霉烯酶灭活试验结果 Table 3 MIC values of antimicrobial agents to Enterobacter cloacae and mCIM result |
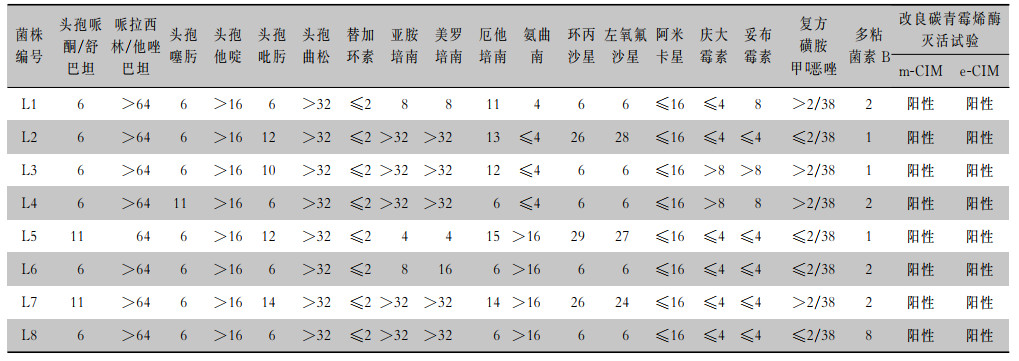
|
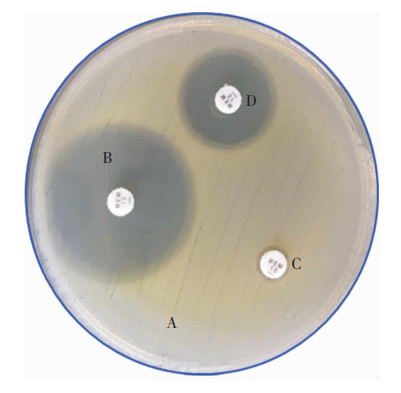 |
| A: 0.5麦氏单位大肠埃希菌(ATCC 5922)标准菌液;B: MEM(10 μg)药敏质控片;C: mCIM阳性结果;D: eCIM阳性结果。 图 1 改良碳青霉烯酶灭活试验结果 Figure 1 Result of mCIM |
8株耐碳青霉烯类阴沟肠杆菌均携带B类碳青霉烯酶,表型筛选和基因检测的符合率为100%。其中7株PCR扩增出NDM基因目标片段(见图 2),经测序分析比对均为NDM-1金属酶基因(见图 3);1株PCR扩增出IPM基因片段(见图 4),经测序分析为IPM-4金属酶基因(见图 5)。
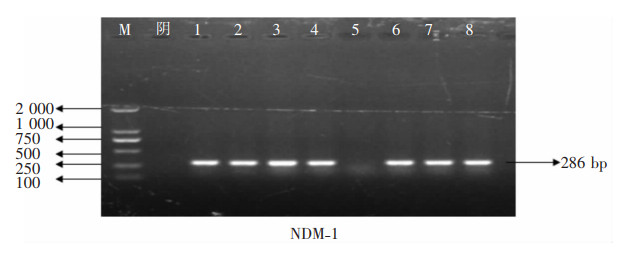 |
| M: 为DNA Marker;阴:为阴性对照;泳道1—4、6—8为临床blaNDM-1基因阳性菌株;泳道5为临床blaNDM-1基因阴性菌株。 图 2 耐碳青霉烯类阴沟肠杆菌NDM基因PCR产物电泳图 Figure 2 Electrophoresis map of PCR products of CREC NDM gene |
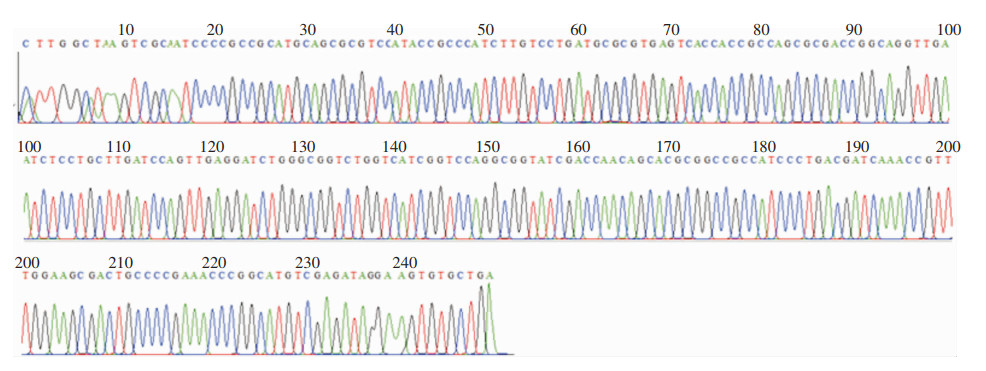 |
| 图 3 耐碳青霉烯类阴沟肠杆菌PCR产物NDM-1金属酶基因测序图 Figure 3 Sequencing map of PCR products of CREC NDM-1 metalloenzyme gene |
 |
| M:为DNA Marker;阴:为阴性对照;泳道5为临床IPM-1基因阳性菌株;泳道1—4、6—8为临床IPM-1基因阴性菌株。 图 4 耐碳青霉烯类阴沟肠杆菌IPM金属酶PCR产物电泳图 Figure 4 Electrophoresis map of PCR products of CREC IPM metalloenzyme gene |
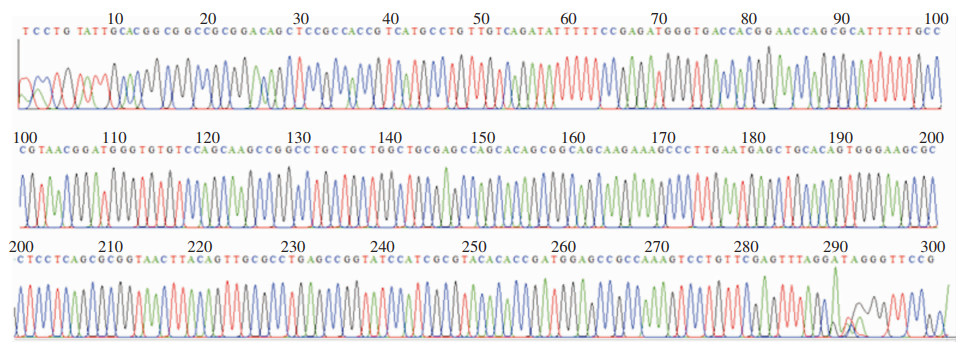 |
| 图 5 耐碳青霉烯类阴沟肠杆菌PCR产物IPM-4金属酶基因测序图 Figure 5 Sequencing map of PCR products of CREC IPM-4 metalloenzyme gene |
8株耐碳青霉烯类阴沟肠杆菌MLST分子分型结果显示,有6个序列类型,依次为ST596(3株)、ST121(1株)、ST993(1株)、ST91(1株)、ST794(1株)、ST88(1株),ST596是主要流行的序列类型,均来源于ICU。PFGE同源性分析共分为6个克隆群,分别为A群(菌株L1、L4、L8)、B群(菌株L6)、C群(菌株L2)、D群(菌株L7)、E群(菌株L5)、F群(菌株L3)。3株A群菌株均为ST596型,均来源于ICU。见图 6。
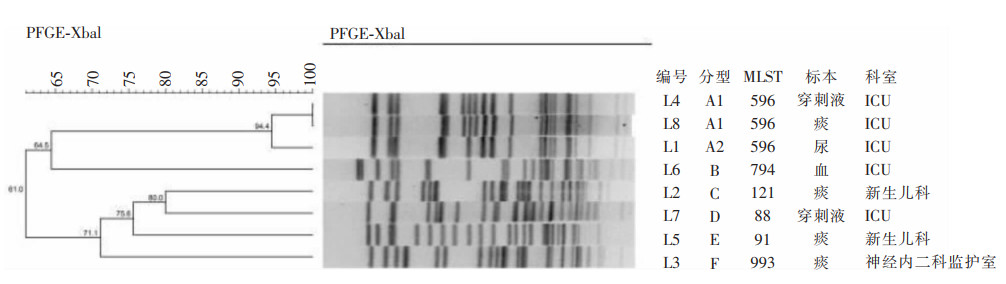 |
| 图 6 8株耐碳青霉烯类阴沟肠杆菌PFGE聚类分析 Figure 6 PFGE cluster analysis of 8 CREC strains |
阴沟肠杆菌已成为医院感染的常见病原菌之一,其耐药机制十分复杂,可同时产Ampc酶、超广谱β-内酰胺酶(ESBLs)及碳青霉烯酶,从而导致多重耐药,引起难治性感染。早期研究表明,产头孢菌素酶并伴有膜蛋白的缺失[11]是阴沟肠杆菌对碳青霉烯类耐药主要原因。但是目前报道阴沟肠杆菌对碳青霉烯类耐药的主要机制是产A类、B类或D类碳青霉烯酶[12]。
2019年4—9月份共检出阴沟肠杆菌55株,其中8株对碳青霉烯类药物耐药,耐药率为14.5%,远高于同阶段本院大肠埃希菌对碳青霉烯类药物的耐药率(2.1%)。8株非重复耐碳青霉烯类阴沟肠杆菌主要的标本来源是痰,均接受过创伤性操作;主要分布于ICU及儿科,其中ICU5株,神经内二科监护室1株,新生儿科2株,其中3例患者有碳青霉烯药物应用史。8例患者均无外院转入史。ICU是耐碳青霉烯类肠杆菌目细菌(CRE)感染最常见的科室,原因可能和科室患者抗菌药物使用量大,侵入性操作多,患者免疫力低有关。8株菌株对临床常用头孢类药物及加酶抑制剂头孢噻肟、头孢曲松、头孢吡肟、头孢哌酮/舒巴坦、哌拉西林/舒巴坦均100%耐药,表现出多重耐药的特征。其中4株对单环内酰胺类药物氨曲南耐药,NDM-1和IPM-4均属于金属β-内酰胺酶并不能水解氨曲南[13],因此被研究的阴沟肠杆菌还存在其他的β-内酰胺酶介导对氨曲南的耐药机制,需要下一步继续研究。对喹诺酮类药物左氧氟沙星和环丙沙星3株耐药,5株敏感;对氨基糖苷类药物阿米卡星100%敏感,对庆大霉素2株耐药,6株敏感; 对妥布霉素1株耐药,2株中介,5株敏感;对磺胺类药物复方磺胺甲
所有菌株mCIM联合eCIM碳青霉烯酶筛选试验结果与PCR结果一致,均检出B类碳青霉烯酶,7株为NDM-1金属酶基因,1株为IPM-4金属酶基因,说明产B类碳青霉烯酶NDM-1是该段时间内阴沟肠杆菌对碳青霉烯类耐药的主要原因。MLST分子分型及PFGE同源性分析有6个ST序列类型,6个克隆群:ST596(3株)均为A群,ST121(1株)为C群,ST993(1株)为F群,ST91(1株)为E群,ST794(1株)为B群,ST88(1株)为D群。其中3株ST596 A群阴沟肠杆菌均来源于ICU,说明5月初至8月底存在此型菌株的播散流行。警示本院感染监控部门应加强ICU多重耐药菌患者的管理,特别是要做好转入转出患者的监管,预防医院感染暴发。短时间内新生儿科出现2例多重耐药阴沟肠杆菌,虽然属于不同的克隆群,但也应分析原因,加强科室医院感染防控措施。
本研究显示,本院ICU存在ST596型A群耐碳青霉烯类阴沟肠杆菌的播散流行。主要的碳青霉烯类耐药机制是产B类金属酶,以NDM-1为主,呈现出多重耐药的趋势,且出现多粘菌素耐药菌株。由于研究标本时间跨度短,例数少,可能存在一定局限性,另本课题是回顾性研究,未对科室人员、医疗设备和周围环境等进行采样检测,未能查找到引起克隆聚集的感染源,需要进一步追踪研究。
| [1] |
赵晓杰, 姜飞, 康海全, 等. 同时携带blaNDM-1和blaKPC-2基因的一株阴沟肠杆菌检测及临床治疗分析[J]. 中华临床感染病杂志, 2017, 10(2): 130-134. |
| [2] |
Derafshi R, Bazargani A, Ghapanchi J, et al. Isolation and identification of nonoral pathogenic bacteria in the oral cavity of patients with removable dentures[J]. J Int Soc Prev Community Dent, 2017, 7(4): 197-201. |
| [3] |
Sheng WH, Badal RE, Hsueh PR, et al. Distribution of extended-spectrum β-lactamases, AmpC β-lactamases, and carbapenemases among Enterobacteriaceae isolates causing intra-abdominal infections in the Asia-Pacific region: results of the study for Monitoring Antimicrobial Resistance Trends (SMART)[J]. Antimicrob Agents Chemother, 2013, 57(7): 2981-2988. DOI:10.1128/AAC.00971-12 |
| [4] |
Hamada Y, Watanabe K, Tada T, et al. Three cases of IMP-type metallo-β-lactamase-producing Enterobacter cloacae bloodstream infection in Japan[J]. J Infect Chemother, 2013, 19(5): 956-958. DOI:10.1007/s10156-012-0520-6 |
| [5] |
Dai W, Sun S, Yang P, et al. Characterization of carbapenemases, extended spectrum β-lactamases and molecular epidemio-logy of carbapenem-non-susceptible Enterobacter cloacae in a Chinese hospital in Chongqing[J]. Infect Genet Evol, 2013, 14: 1-7. DOI:10.1016/j.meegid.2012.10.010 |
| [6] |
Smith Moland E, Hanson ND, Herrera VL, et al. Plasmid-mediated, carbapenem-hydrolysing beta-lactamase, KPC-2, in Klebsiella pneumoniae isolates[J]. J Antimicrob Chemother, 2003, 51(3): 711-714. DOI:10.1093/jac/dkg124 |
| [7] |
郑波, 吕媛, 李耘. 携带blaNDM-1基因泛耐药肠杆菌科细菌的检测方案[J]. 中国临床药理学杂志, 2010, 26(11): 845-848. DOI:10.3969/j.issn.1001-6821.2010.11.012 |
| [8] |
Poirel L, Revathi G, Bernabeu S, et al. Detection of NDM-1-producing Klebsiella pneumoniae in Kenya[J]. Antimicrob Agents Chemother, 2011, 55(2): 934-936. DOI:10.1128/AAC.01247-10 |
| [9] |
Shibata N, Doi Y, Yamane K, et al. PCR typing of genetic determinants for metallo-beta-lactamases and integrases carried by Gram-negative bacteria isolated in Japan, with focus on the class 3 integron[J]. J Clin Microbiol, 2003, 41(12): 5407-5413. DOI:10.1128/JCM.41.12.5407-5413.2003 |
| [10] |
Woodford N, Ellington MJ, Coelho JM, et al. Multiplex PCR for genes encoding prevalent OXA carbapenemases in Acinetobacter spp[J]. Int J Antimicrob Agents, 2006, 27(4): 351-353. DOI:10.1016/j.ijantimicag.2006.01.004 |
| [11] |
Berberian G, Brizuela M, Rosanova MT, et al. Multidrug resistant Gram-negative infections in neonatology[J]. Arch Argent Pediatr, 2019, 117(1): 6-11. |
| [12] |
Jin CM, Zhang JG, Wang Q, et al. Molecular characterization of carbapenem-resistant Enterobacter cloacae in 11 Chinese cities[J]. Front Microbiol, 2018, 9: 1597. DOI:10.3389/fmicb.2018.01597 |
| [13] |
Gruber TM, Göttig S, Mark L, et al. Pathogenicity of pan-drug-resistant Serratia marcescens harbouring blaNDM-1[J]. J Antimicrob Chemother, 2015, 70(4): 1026-1030. |
| [14] |
Deris ZZ, Yu HH, Davis K, et al. The combination of colistin and doripenem is synergistic against Klebsiella pneumoniae at multiple inocula and suppresses colistin resistance in an in vitro pharmacokinetic/pharmacodynamic model[J]. Antimicrob Agents Chemother, 2012, 56(10): 5103-5112. DOI:10.1128/AAC.01064-12 |
| [15] |
Krapp F, Grant JL, Sutton SH, et al. Treating complicated carbapenem-resistant Enterobacteriaceae infections with ceftazi-dime/avibactam: a retrospective study with molecular strain characterisation[J]. Int J Antimicrob Agents, 2017, 49(6): 770-773. DOI:10.1016/j.ijantimicag.2017.01.018 |
| [16] |
董爱英, 陈东科, 李春娟, 等. 30株CRE临床感染特点及blaNDM-1基因检出情况分析[J]. 中国抗生素杂志, 2018, 43(5): 513-518. DOI:10.3969/j.issn.1001-8689.2018.05.004 |



