2. 江苏大学医学院, 江苏 镇江 212013
2. School of Medicine, Jiangsu University, Zhenjiang 212013, China
肝脓肿是由细菌、真菌或寄生虫等病原微生物引起的肝化脓性病变,其中以细菌性肝脓肿(bacterial liver abscess, BLA)最常见,占80%以上[1]。过去认为大肠埃希菌是肝脓肿的主要致病菌,自1986年我国台湾首次报道肺炎克雷伯菌肝脓肿(Klebsiella pneumoniae liver abscess, KPLA)以来,近30年里,肺炎克雷伯菌逐渐取代大肠埃希菌成为东亚地区肝脓肿最主要的致病菌[2]。研究发现引起肝脓肿的肺炎克雷伯菌多为具有高黏液表型的高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae, hvKP)[3],并且由hvKP导致的肝脓肿已被认为是一种新的侵袭性疾病,可引起转移性感染,如眼内炎、脑膜炎、骨髓炎及坏死性筋膜炎等,严重时可危及患者生命[3-4]。为加强对肺炎克雷伯菌肝脓肿的认识,本研究回顾性分析某院34例细菌性肝脓肿患者的临床资料,比较KPLA和非肺炎克雷伯菌肝脓肿(NKPLA)的临床特征差异,并探讨肺炎克雷伯菌毒力基因携带情况,为临床早期诊断及合理治疗提供参考。
1 对象与方法 1.1 研究对象研究对象为江苏大学附属医院2017年7月—2019年8月收治的34例细菌性肝脓肿患者。所有患者均符合以下诊断标准[5]:①具有发热、寒战或腹痛等临床症状;②影像学检查结果(B超或CT)符合肝脓肿影像学特征;③血培养或脓液培养出致病菌;④经皮肝穿刺或外科手术治疗后证实;⑤排除阿米巴、结核性肝脓肿。根据细菌培养结果将细菌性肝脓肿患者分为肺炎克雷伯菌肝脓肿组(KPLA组)与非肺炎克雷伯菌肝脓肿组(NKPLA组)。
1.2 方法 1.2.1 研究方法通过查阅患者病历,对34例细菌性肝脓肿患者的临床资料、实验室资料和影像学资料进行回顾性分析。对从上述患者体内分离的22株肺炎克雷伯菌进行药敏试验、耐药基因检测、黏液丝试验、荚膜血清分型及毒力基因检测。
1.2.2 主要仪器及试剂VITEK 2 Compact全自动微生物鉴定及药敏分析仪(法国生物梅里埃生物公司);PCR扩增仪和凝胶电泳成像分析系统(美国Bio-Rad公司);2×PCR Master Mix预混液(南京诺唯赞生物科技有限公司);DNA标志物(上海捷瑞生物工程有限公司);PCR引物由苏州泓讯生物科技有限公司合成。
1.2.3 细菌鉴定及药敏试验采用VITEK 2 Compact全自动微生物鉴定及药敏系统配套的鉴定卡及药敏卡对细菌进行鉴定和药敏试验,参照美国临床实验室标准化协会(CLSI)2019年标准判读结果。
1.2.4 耐药基因检测采用PCR扩增法检测细菌耐药基因,引物参照文献[6-8]合成,见表 1。从血平板上挑取3~5个菌落于盛有300 μL灭菌ddH2O的EP管中振荡混匀,煮沸10 min以裂解细菌,经12 000 r/min离心10 min后收集上清即为DNA模板。PCR扩增碳青霉烯酶基因(blaKPC、blaNDM-1)、ESBLs基因(blaTEM、blaCTX-M-1)。PCR产物经1.2%琼脂糖凝胶电泳后拍照。
1.2.5 黏液丝试验鉴定高黏液菌株用接种环轻触在血琼脂平板上过夜生长的单个菌落并向外牵拉,同时测定形成的黏液丝长度。重复牵拉2次,若2次形成的黏液丝长度大于5 mm即判为阳性[4]。
1.2.6 荚膜血清分型、毒力基因检测及高毒力肺炎克雷伯菌的确认PCR扩增法检测7种荚膜血清型(K1、K2、K5、K16、K20、K54、K57)及9个毒力基因(rmpA、rmpA2、iucA、iroB、peg-344、terB、iutA、magA、wcaG)。引物参照文献[9-12]合成,见表 1。PCR产物经1.2%琼脂糖凝胶电泳后拍照。参照文献[13],将携带rmpA基因的高黏液肺炎克雷伯菌认定为hvKP。
| 表 1 荚膜血清型、耐药基因及毒力基因引物序列 Table 1 Primer sequences of capsular serotypes, antimicrobial resistance genes and virulence genes |

|
应用GraphPad Prism 8.0软件进行统计分析。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用t检验;非正态分布的计量资料以中位数和四分位数间距[M(P25~P75)]表示,采用Whitney U检验;计数资料以例数(%)表示,组间比较采用χ2检验或Fisher’s确切概率法检验。P≤0.05为差异具有统计学意义。
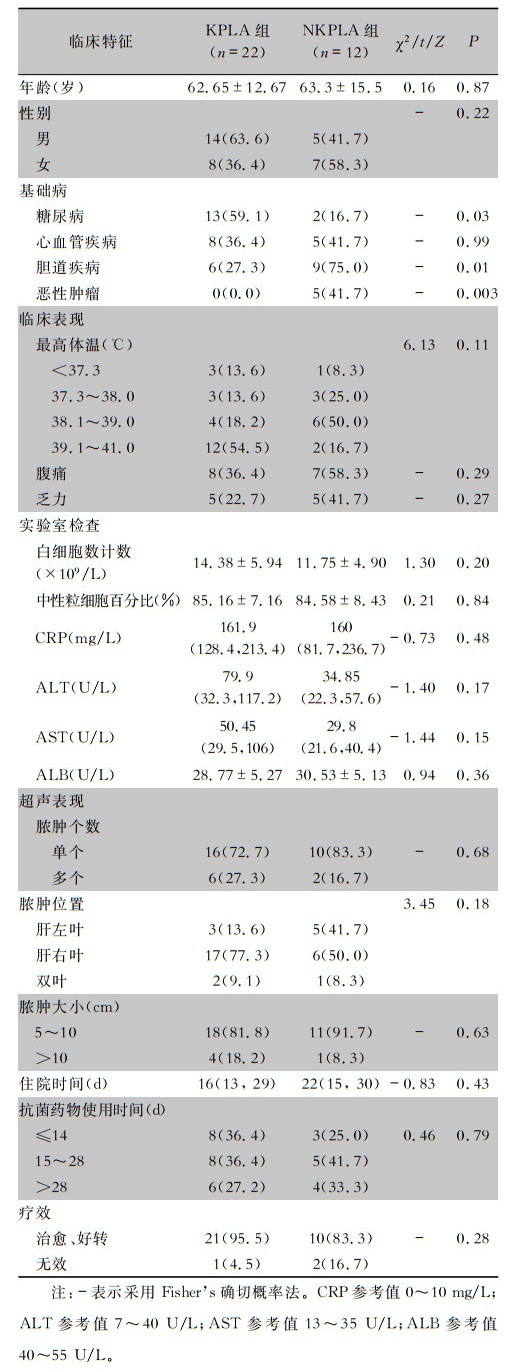
2 结果 2.1 临床特点本研究共收集34份BLA患者的临床资料,其中KPLA组22份,NKPLA组12份。KPLA组患者伴发糖尿病比率(59.1%)较高,而NKPLA组患者伴发胆道疾病比率(75.0%)较高,差异具有统计学意义(P<0.05)。见表 2。
| 表 2 KPLA组与NKPLA组患者临床特征比较 Table 2 Comparison of clinical characteristics between patients in KPLA group and NKPLA group |
|
KPLA组中22株肺炎克雷伯菌,仅有2株对环丙沙星、左旋氧氟沙星和复方磺胺甲口恶唑耐药。其余20株除对氨苄西林耐药外,对其他抗菌药物均敏感。NKPLA组中12株菌株,包括大肠埃希菌6株、咽峡炎链球菌3株、草绿色链球菌2株和屎肠球菌1株。
2.3 耐药基因检测结果22株肺炎克雷伯菌中共检出2种ESBLs基因(blaTEM和blaCTX-M-1),未检出碳青霉烯酶基因(blaKPC和blaNDM-1)。其中8株肺炎克雷伯菌检出blaTEM基因,阳性率为36.4%;6株菌检出blaCTX-M-1基因,阳性率为27.3%。22株肺炎克雷伯菌中有2株菌同时携带blaTEM、blaCTX-M-1基因,见图 1。
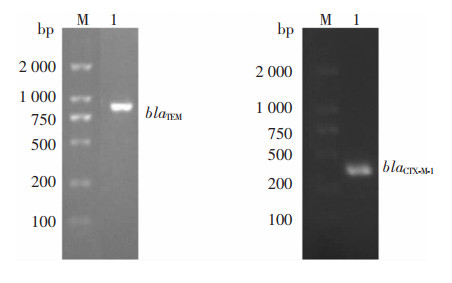 |
| M:DNA分子量标准物;1:肺炎克雷伯菌ESBLs基因PCR产物电泳图。 图 1 肺炎克雷伯菌ESBLs基因PCR检测结果 Figure 1 PCR detection results of ESBLs gene of Klebsiella pneumoniae |
22株肺炎克雷伯菌黏液丝试验结果均为阳性,阳性率达100.0%。
2.5 荚膜血清分型及毒力基因携带结果本研究22株肺炎克雷伯菌共检出5种荚膜血清型,以K1血清型为主,占68.2%(15/22);其次为K2型,占13.6%(3/22);血清型K20、K54、K57检出率均为4.5%(1/22);未发现K5、K16血清型;另有1株未见分型。见图 2。
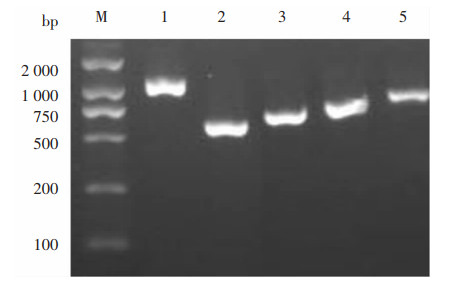 |
| M:DNA分子量标准物;1~5:K1、K2、K20、K54、K57部分阳性结果电泳图。 图 2 肺炎克雷伯菌各种荚膜血清型的PCR检测结果 Figure 2 PCR detection results of different capsule serotypes of Klebsiella pneumoniae |
毒力基因携带结果显示,22株肺炎克雷伯菌均携带rmpA基因,结合黏液丝试验结果,本研究中22株肺炎克雷伯菌均为hvKP。毒力基因以iucA、iroB、iutA和wcaG携带率最高,为100.0%;peg-344、terB、rmpA2和magA的携带率分别为95.5%、86.4%、72.7%、68.2%。见图 3。22株肺炎克雷伯菌均携带有毒力基因rmpA、iucA、iroB、iutA。K1血清型以9种毒力基因同时携带为主;在K2和K57血清型中rmpA+rmpA2+wcaG+iucA+iroB+peg-344+terB+iutA是主要的携带模式;K20、K54和未知血清型均为rmpA+wcaG+iucA+iroB+peg-344+terB+iutA。见表 3。
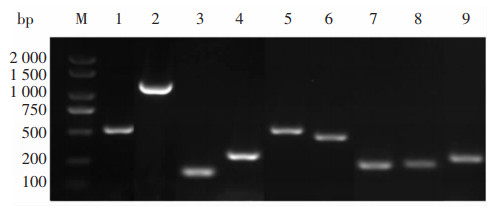 |
| M:DNA分子量标准物;1~9:rmpA、magA、wcaG、iutA、rmpA2、peg-344、iroB、iucA、terB部分阳性结果电泳图。 图 3 肺炎克雷伯菌各种毒力基因的PCR检测结果 Figure 3 PCR detection results of different virulence genes of Klebsiella pneumoniae |
| 表 3 不同荚膜血清型携带毒力基因情况 Table 3 Virulence genes carried by different capsular serotypes |

|
肺炎克雷伯菌属于革兰阴性杆菌,可引起肺炎、尿路感染、血流感染等多种感染性疾病[14]。近年来,肺炎克雷伯菌己经取代了大肠埃希菌,成为BLA的主要致病菌。目前由肺炎克雷伯菌所致的BLA已占肝脓肿的43%~66%[15]。我国是BLA的高发国家之一,本研究结果表明,该院BLA患者多为中老年男性,肺炎克雷伯菌是其主要致病菌,占63.6%。与NKPLA组患者相比,KPLA好发于糖尿病患者,而NKPLA则好发于有胆道疾病或恶性肿瘤基础病的患者,该结果提示不同致病菌引起的BLA可能与患者自身基础疾病有关,而既往研究[16-17]也表明糖尿病是BLA的独立危险因素,并且诱发糖尿病患者BLA的致病菌多为肺炎克雷伯菌。可能是由于糖尿病患者机体免疫力低下,长期的高血糖状态抑制了白细胞的趋化和吞噬功能,有利于细菌的生长繁殖。此外长期的高血糖状态会破坏血管壁,使机体局部循环障碍,导致机体对细菌的清除能力下降[18-19]。而NKPLA则更好发于胆道疾病和恶性肿瘤基础上,除了因为机体免疫力降低,还可能是由于胆道梗阻、炎症、解剖结构的改变,使胆汁排泄受阻,肠道细菌更易于沿胆管进入肝脏所致[20-21]。
随着抗菌药物的广泛使用,肺炎克雷伯菌的耐药性逐年增强,尤其是耐碳青霉烯类肺炎克雷伯菌的检出率逐年上升,给临床抗感染治疗带来严重挑战[22-23]。然而,本研究结果显示引发肝脓肿的肺炎克雷伯菌对临床常用抗菌药物的耐药率较低,仅有2株肺炎克雷伯菌同时对环丙沙星、左旋氧氟沙星和复方磺胺甲口恶唑耐药,对其他多种抗菌药物的敏感率为100.0%。可能与引起肝脓肿的肺炎克雷伯菌多为hvKP,且肺炎克雷伯菌高毒力与耐药性被认为不重叠出现有关[24-25]。因此,目前在因肺炎克雷伯菌所致肝脓肿的治疗中,抗菌药物选择难度较小。但本研究中的hvKP可携带ESBLs耐药基因,存在出现获得耐药性的可能。在临床治疗中需合理使用抗菌药物,延缓hvKP耐药菌株的出现。
肺炎克雷伯菌毒力因子主要有荚膜多糖、脂多糖、黏附素和铁载体这四大类,其中荚膜多糖和铁载体是其主要的毒力因子,也是导致hvKP具有特征性的主要因素。荚膜多糖有助于肺炎克雷伯菌抵抗宿主中性粒细胞吞噬,介导菌体逃避宿主免疫杀伤[26-27]。根据荚膜多糖(K抗原)分型,可将肺炎克雷伯菌分为78种荚膜血清型,其中K1、K2、K5、K16、K20、K54和K57被认为是高毒力血清型,K1型和K2型最为常见且毒力最强[28],其中K1型是亚洲地区最常见的血清型[29]。本研究中共检出5种高毒力荚膜血清型,分别为K1、K2、K20、K54和K57,以K1型为主,占68.2%,与既往相关报道[29]相符,表明K1型是hvKP最常见的血清型。
本试验菌株携带的毒力因子主要为与荚膜多糖相关的毒力基因,如rmpA、rmpA2、magA、wcaG;与铁载体相关的毒力基因,如iucA、iroB、terB、iutA。有研究发现magA与hvKP荚膜合成有关,仅存在于K1型菌中,被认为是高黏液表型的介导因子[30]。Struve等[30]对菌株基因进行分析发现检出的K1型菌株数量与检出携带magA基因的菌株数一致,可提示magA基因是K1型特有基因,与本研究结果一致。本研究中hvKP均携带有4种毒力基因:rmpA、iucA、iroB、iutA。据文献[31]报道,赋予菌株高毒力表型最具特征性的毒力因子由毒力质粒上存在的基因编码,其中包括iuc、iro、peg-344、rmpA和rmpA2。毒力质粒可直接影响hvKP的毒力,在hvKP的致病中发挥重要作用。Ye等[32]研究了从社区获得性肝脓肿患者分离的40株hvKp菌株,所有菌株均具有iuc、iro、rmpA和rmpA2。本研究中hvKP主要携带有5种毒力基因可能是hvKP引起肝脓肿所不可缺少的基因。peg-344是hvKp特异性基因,位于hvKp毒力质粒上,编码内膜转运蛋白。根据作为hvKP标记的性状的优势比,peg-344基因具有最高的准确性、敏感性和特异性[31]。本研究中该基因在hvKP的携带率为95.5%。
综上所述,该院KPLA多发于中老年男性及有糖尿病基础的人群,其分离的肺炎克雷伯菌均为hvKP,以K1血清型为主,并携带多种毒力基因,目前对临床常用抗菌药物耐药率低,但可携带耐药基因。需引起临床医生高度重视,合理使用抗菌药物,减少hvKP耐药菌株的出现。
| [1] |
尹大龙, 刘连新. 细菌性肝脓肿诊治进展[J]. 中国实用外科杂志, 2013, 33(9): 793-795. |
| [2] |
Moore R, O'Shea D, Geoghegan T, et al. Community-acquired Klebsiella pneumoniae liver abscess: an emerging infection in Ireland and Europe[J]. Infection, 2013, 41(3): 681-686. DOI:10.1007/s15010-013-0408-0 |
| [3] |
Shon AS, Bajwa RP, Russo TA. Hypervirulent (hypermucoviscous) Klebsiella pneumoniae: a new and dangerous breed[J]. Virulence, 2013, 4(2): 107-118. DOI:10.4161/viru.22718 |
| [4] |
Siu LK, Yeh KM, Lin JC, et al. Klebsiella pneumoniae liver abscess: a new invasive syndrome[J]. Lancet Infect Dis, 2012, 12(11): 881-887. DOI:10.1016/S1473-3099(12)70205-0 |
| [5] |
Foo NP, Chen KT, Lin HJ, et al. Characteristics of pyogenic liver abscess patients with and without diabetes mellitus[J]. Am J Gastroenterol, 2010, 105(2): 328-335. DOI:10.1038/ajg.2009.586 |
| [6] |
孙恒彪, 陈佑明, 尤旭, 等. 碳青霉烯类耐药肠杆菌科细菌碳青霉烯及头孢菌素类抗生素耐药机制[J]. 中国感染控制杂志, 2017, 16(5): 404-408. DOI:10.3969/j.issn.1671-9638.2017.05.003 |
| [7] |
宫雪, 王勇, 张吉生, 等. 耐碳青霉烯肺炎克雷伯菌耐药机制及同源性分析[J]. 临床检验杂志, 2018, 36(4): 270-273. |
| [8] |
赵晓杰, 康海全, 姜飞, 等. KPC-2基因和外膜蛋白介导的肺炎克雷伯菌对碳青霉烯类药物耐药机制分析[J]. 中国病原生物学杂志, 2015, 10(3): 211-214, 219. |
| [9] |
李花, 王倩. 肝脓肿肺炎克雷伯菌血清分型及毒力基因研究[J]. 临床检验杂志, 2018, 36(7): 493-495. |
| [10] |
Fang CT, Lai SY, Yi WC, et al. Klebsiella pneumoniae genotype K1:an emerging pathogen that causes septic ocular or central nervous system complications from pyogenic liver abscess[J]. Clin Infect Dis, 2007, 45(3): 284-293. DOI:10.1086/519262 |
| [11] |
和晋渝. 肺炎克雷伯菌的血清分型及毒力基因分布的研究[D]. 重庆: 重庆医科大学, 2012.
|
| [12] |
Russo TA, Olson R, Fang CT, et al. Identification of biomarkers for differentiation of hypervirulent Klebsiella pneumoniae from classical K. pneumoniae[J]. J Clin Microbiol, 2018, 56(9): e00776-18. |
| [13] |
Yu WL, Lee MF, Chen CC, et al. Impacts of hypervirulence determinants on clinical features and outcomes of bacteremia caused by extended-spectrum β-lactamase-producing Klebsiella pneumoniae[J]. Microb Drug Resist, 2017, 23(3): 376-383. DOI:10.1089/mdr.2016.0018 |
| [14] |
Pastagia M, Arumugam V. Klebsiella pneumoniae liver abscesses in a public hospital in Queens, New York[J]. Travel Med Infect Dis, 2008, 6(4): 228-233. DOI:10.1016/j.tmaid.2008.02.005 |
| [15] |
Pang TC, Fung T, Samra J, et al. Pyogenic liver abscess: an audit of 10 years' experience[J]. World J Gastroenterol, 2011, 17(12): 1622-1630. DOI:10.3748/wjg.v17.i12.1622 |
| [16] |
Thomsen RW, Jepsen P, Sørensen HT. Diabetes mellitus and pyogenic liver abscess: risk and prognosis[J]. Clin Infect Dis, 2007, 44(9): 1194-1201. DOI:10.1086/513201 |
| [17] |
Kaplan GG, Gregson DB, Laupland KB. Population-based study of the epidemiology of and the risk factors for pyogenic liver abscess[J]. Clin Gastroenterol Hepatol, 2004, 2(11): 1032-1038. DOI:10.1016/S1542-3565(04)00459-8 |
| [18] |
Tsai FC, Huang YT, Chang LY, et al. Pyogenic liver abscess as endemic disease, Taiwan[J]. Emerg Infect Dis, 2008, 14(10): 1592-1600. DOI:10.3201/eid1410.071254 |
| [19] |
Kim JK, Chung DR, Wie SH, et al. Risk factor analysis of invasive liver abscess caused by the K1 serotype Klebsiella pneumoniae[J]. Eur J Clin Microbiol Infect Dis, 2009, 28(1): 109-111. DOI:10.1007/s10096-008-0595-2 |
| [20] |
陈帆, 张艳亭, 乔慧捷, 等. 肺炎克雷伯菌肝脓肿的临床特征分析[J]. 临床肝胆病杂志, 2016, 32(4): 764-768. DOI:10.3969/j.issn.1001-5256.2016.04.034 |
| [21] |
赵小芹, 朱晓巍, 徐湘, 等. 肺炎克雷伯菌肝脓肿临床特征分析[J]. 中华临床感染病杂志, 2011, 4(6): 364-367. DOI:10.3760/cma.j.issn.1674-2397.2011.06.011 |
| [22] |
胡志军, 潘晓龙, 周东升, 等. 肺炎克雷伯菌感染的临床分布及耐药性监测[J]. 中华医院感染学杂志, 2014, 24(12): 2865-2867. |
| [23] |
曾云祥, 胡凯凌, 许建平, 等. 2008-2012年484株肺炎克雷伯菌耐药性分析及耐药机制的初步研究[J]. 中国微生态学杂志, 2014, 26(5): 571-574. |
| [24] |
Hennequin C, Robin F. Correlation between antimicrobial resistance and virulence in Klebsiella pneumoniae[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(3): 333-341. DOI:10.1007/s10096-015-2559-7 |
| [25] |
魏丹丹, 万腊根, 刘洋. 强毒性血清型肺炎克雷伯菌的临床分布及耐药性分析[J]. 重庆医学, 2016, 45(11): 1558-1560. DOI:10.3969/j.issn.1671-8348.2016.11.036 |
| [26] |
Lawlor MS, Hsu J, Rick PD, et al. Identification of Klebsiella pneumoniae virulence determinants using an intranasal infection model[J]. Mol Microbiol, 2005, 58(4): 1054-1073. DOI:10.1111/j.1365-2958.2005.04918.x |
| [27] |
Domenico P, Salo RJ, Cross AS, et al. Polysaccharide capsule-mediated resistance to opsonophagocytosis in Klebsiella pneumoniae[J]. Infect Immun, 1994, 62(10): 4495-4499. DOI:10.1128/iai.62.10.4495-4499.1994 |
| [28] |
Moore PP, McGowan GF, Sandhu SS, et al. Klebsiella pneumoniae liver abscess complicated by endogenous endophthalmitis: the importance of early diagnosis and intervention[J]. Med J Aust, 2015, 203(7): 300-301. DOI:10.5694/mja15.00107 |
| [29] |
徐水宝, 杨思宇, 翁珊珊, 等. 高毒力肺炎克雷伯菌血清型、毒力基因分布及分子标志物探索[J]. 微生物与感染, 2019, 14(6): 338-344. DOI:10.3969/j.issn.1673-6184.2019.06.004 |
| [30] |
Struve C, Bojer M, Nielsen EM, et al. Investigation of the putative virulence gene magA in a worldwide collection of 495Klebsiella isolates: magA is restricted to the gene cluster of Klebsiella pneumoniae capsule serotype K1[J]. J Med Microbiol, 2005, 54(Pt 11): 1111-1113. |
| [31] |
Russo TA, Marr CM. Hypervirulent Klebsiella pneumoniae[J]. Clin Microbiol Rev, 2019, 32(3): e00001-19. |
| [32] |
Ye MP, Tu JF, Jiang JP, et al. Clinical and genomic analysis of liver abscess-causing Klebsiella pneumoniae identifies new liver abscess-associated virulence genes[J]. Front Cell Infect Microbiol, 2016, 6: 165. |



