严重急性呼吸综合征冠状病毒2(SARS-CoV-2)在世界范围内的迅速传播引起了世界各地的关注。随着每日确诊的新型冠状病毒肺炎(新冠肺炎,Corona virus disease 2019,COVID-19)病例数量的急剧增加,世界卫生组织已于2020年3月12日宣布COVID-19为全球大流行。截至2020年4月5日,全球共确诊1 218 991例COVID-19病例,正在影响世界上208个国家和地区和2个国际运输工具[1]。抗体是病毒感染免疫反应的关键成分,在COVID-19患者血清中可检测到特异性免疫球蛋白M(IgM)和免疫球蛋白G(IgG)[2-4]。在国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》中[5]指出,将新型冠状病毒抗体检测作为COVID-19的辅助诊断。对严重急性呼吸综合征(SARS)和中东呼吸综合征(MERS)的研究表明,80%~100%患者在发病后2周可检测到抗体,抗体可持续3个月以上[6-9],但关于SARS-CoV-2感染后患者抗体产生的报道较少。本研究收集某院收治的550例COVID-19患者血清抗体检测结果,分析SARS-CoV-2感染患者抗体产生情况。
1 对象与方法 1.1 研究对象对2020年2月27日—3月5日华中科技大学同济医学院附属同济医院确诊的COVID-19住院患者进行回顾性研究。本研究经医院伦理审查委员审核通过(伦理号:TJ-C20200126)。
1.2 诊断标准SARS-CoV-2感染确诊病例除具有明确的流行病史和符合的临床症状外,且具备以下病原学或血清学证据之一:(1)实时荧光RT-PCR检测SARS-CoV-2核酸阳性;(2)病毒基因测序,与已知的SARS-CoV-2高度同源;(3)血清SARS-CoV-2特异性IgM和IgG抗体阳性;血清SARS-CoV-2特异性IgG抗体由阴性转为阳性或恢复期较急性期4倍及以上升高。
1.3 抗体检测方法采用SARS-CoV-2 IgM和IgG抗体检测试剂盒(化学发光法)及iFlash3000全自动化学发光免疫分析仪(购自深圳市亚辉龙生物科技股份有限公司)对所有研究对象的血清标本进行检测。标本IgM和IgG浓度 < 10.0 AU/mL时,为无反应性(阴性);标本IgM和IgG浓度≥10.0 AU/mL时,为有反应性(阳性),所有阳性标本均经过新型冠状病毒(2019-nCOV)IgM和IgG抗体检测试剂盒(磁微粒化学发光法,购自博奥塞斯生物科技有限公司)进一步验证。
1.4 统计学分析应用SPSS 24.0软件进行统计分析。计量资料进行正态性检验,符合正态性资料以均数±标准差表示,组间比较采用t检验;不符合正态资料以中位数(四分位数)表示,多组间比较采用kruskal-wallis秩和检验,组间两两比较采用Mann-Whitney U检验。计数资料以百分比表示,采用χ2检验。以P≤0.05为差异有统计学意义。
2 结果 2.1 一般情况本研究纳入550例患者,其中男性253例,女性297例,中位年龄61(50,69)岁。抗体阳性506例,抗体阴性44例,IgM和/或IgG总体阳性率为92.00%;IgG总体阳性率为91.45%,IgM总体阳性率为76.18%;IgG与IgM均阳性416例(75.64%),单独IgG阳性87例(15.82%),单独IgM阳性3例(0.55%)。
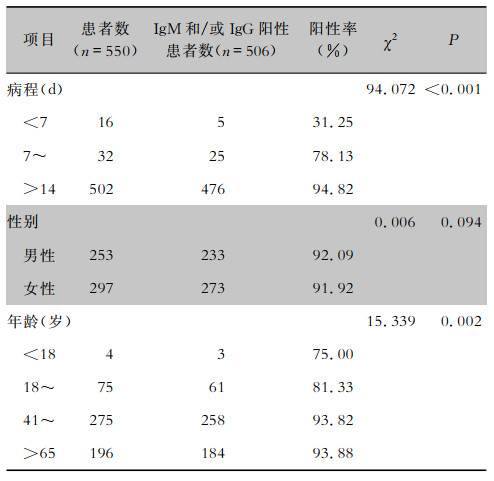
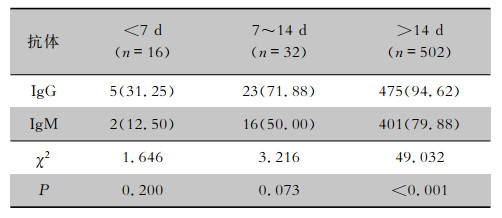
2.2 不同病程、性别及年龄组患者抗体阳性情况不同病程组患者SARS-CoV-2抗体阳性率比较,差异有统计学意义(χ2=94.072,P < 0.001)。IgM或IgG在早期的阳性率相对较低,在疾病进展过程中逐渐升高,阳性率从早期的31.25%上升至94.82%。进一步分析IgG和IgM阳性率发现,病程<14 d组患者IgG与IgM阳性率比较未见明显差异,但>14 d组患者IgG阳性率高于IgM阳性率。单独IgG阳性组患者的病程也长于单独IgM阳性组患者[31(22,35)VS 11(9.5,17.5);Z=-2.126,P=0.034]。对年龄分层比较发现,不同年龄组患者SARS-CoV-2抗体阳性率差异有统计学意义(P=0.002),以41~及>65岁年龄组阳性率较高。而不同性别的患者SARS-CoV-2抗体阳性率比较,差异无统计学意义(P=0.094)。见表 1~2。
| 表 1 不同组别COVID-19患者SARS-CoV-2 IgM和/或IgG阳性情况 Table 1 Positive results of SARS-CoV-2 IgM and/or IgG in COVID-19 patients of different groups |
|
| 表 2 不同病程COVID-19患者SARS-CoV-2 IgG或IgM阳性情况[例(%)] Table 2 Positive results of SARS-CoV-2 IgG or IgM in COVID-19 patients of different disease course (No. of cases [%]) |
|
SARS-CoV-2 IgM在发病后1~2周内产生,2~3周内达到峰值,4周以后逐渐下降。而SARS-CoV-2 IgG在发病后1周左右开始产生,3周左右达到峰值,直到病程50 d仍持续保持在较高的水平。见图 1。
 |
| 图 1 COVID-19患者病程中SARS-CoV-2 IgM及IgG水平变化趋势 Figure 1 Change trend of SARS-CoV-2 IgM and IgG in COVID-19 patients during disease course |
253例男性患者病程为32(24,36)d,297例女性患者病程为31(25.5,35)d,两组患者病程比较,差异无统计学意义(Z=-6.484, P < 0.001)。SARS-CoV-2 IgG抗体水平男性组患者为157.75(110.38,185.92)AU/mL,女性组患者为159.38(107.71,191.53)AU/mL,两组患者IgG抗体水平比较差异无统计学意义(Z=-0.746,P=0.445)。见图 2A。IgM抗体水平男性组患者为35.86(11.85,93.30)AU/mL,女性组患者为42.28(10.72,101.35)AU/mL,两组患者抗体IgM抗体水平比较, 差异无统计学意义(Z=-0.760, P=0.0.447)。见图 2B。
 |
| 图 2 不同性别COVID-19患者SARS-CoV-2 IgG及IgM检测结果 Figure 2 Detection results of SARS-CoV-2 IgG and IgM in COVID-19 patients of different genders |
为尽量减少病程的混杂效应,进行配对病例对照研究。各组病程:< 18岁组为(23.00±7.44)d,18~岁组为(28.55±9.55)d,41~岁组为(30.16±7.78)d,>65岁组为(30.41±7.30)d,各组患者病程比较差异无统计学意义(χ2=5.213,P=0.157)。各年龄组SARS-CoV-2 IgG抗体水平比较,差异无统计学意义(χ2=6.221,P=0.101);各年龄组SARS-CoV-2 IgM抗体水平比较,差异也无统计学意义(χ2=6.751,P=0.080)。见图 3。
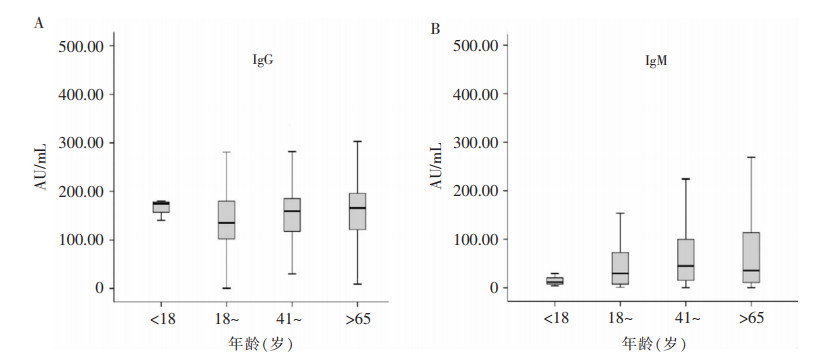 |
| 图 3 不同年龄组COVID-19患者SARS-CoV-2 IgG及IgM抗体水平检测结果 Figure 3 Detection results of SARS-CoV-2 IgG and IgM antibody levels in COVID-19 patients of different age groups |
SARS-CoV-2与严重急性呼吸综合征冠状病毒(SARS-CoV)相比,具有较高的传播趋势和较弱的致病性[10],因此及时、快速诊断有利于疾病的控制和传播。在《新型冠状病毒肺炎诊疗方案(试行第七版)》中[5],强调病原学检测阳性对COVID-19确诊的必要性。虽然SARS-CoV-2核酸检测是病原学检测金标准,但受多种因素影响,假阴性率高[11]。而抗体检测简单、快速、易操作,能够较好地辅助COVID-19的诊断。同时,抗体监测对将来隔离感染患者,以及为最佳抗病毒干预措施提供了依据。
本研究通过对550例确诊的COVID-19患者SARS-CoV-2抗体阳性检测结果统计分析发现,总体阳性率达92.00%,IgG总体阳性率为91.45%,IgM总体阳性率为76.18%,与相关研究[12]结果基本一致。仅有44例患者IgM、IgG检测阴性,但在后续持续研究监测中部分检测出抗体,可能与检测时患者所处病程有关。因此,SARS-CoV-2抗体检测在COVID-19患者中有较高的检出率,是核酸检测漏检的良好互补,能够作为SARS-CoV-2感染的筛查和辅助诊断。
进一步分析SARS-CoV-2抗体阳性率与年龄、性别及病程的关系发现,SARS-CoV-2抗体阳性率与病程和年龄有关,病程>2周抗体阳性率增加,并且抗体IgG阳性率高于抗体IgM,2周后IgG与IgM也均维持在较高水平。研究[13-14]表明,COVID-19与SARS和MERS具有相似的临床遗传和流行病学特征。因此,SARS-CoV-2抗体的产生过程可能与SARS-CoV、中东呼吸综合征病毒(MERS-CoV)抗体产生相似,IgM和IgG抗体的检测可以提供病毒感染的时间过程。在SARS-CoV感染过程中,3~6 d后可检测到IgM,8 d后可检测到IgG[15]。一般情况下,病原微生物刺激机体产生免疫应答的规律通常是感染后IgM先升高,然后很快下降直到消失。而IgG通常在IgM之后出现,并且一直上升且长时间在体内保持很高的水平。本研究发现IgM抗体水平有类似变化,而IgG未观察到在IgM后产生,可能是本研究研究对象病程早期人数较少。患者在发病前有14 d左右的潜伏期[16],因此发病时研究对象已处于感染中期或恢复期,从而造成早期结果偏差。
文献[17]报道,采用核酸检测4 880例有呼吸道感染症状或与COVID-19患者密切接触的病例发现,男性和老年人口的阳性率显著较高。但本研究对COVID-19患者检测发现,不同性别患者抗体阳性率并无区别。为减轻病程对研究结果的影响,经配对研究发现,虽然中老年患者抗体阳性率较高,但是不同年龄段患者产生IgM和IgG抗体水平并无差异,提示中老年患者也能较好的产生免疫应答。
本研究也存在局限性。首先,抗体检测的假阴性和假阳性结果可能影响抗体阳性率的分析。其次,从症状发作到检测抗体的时间可能过长,发病初期IgM及IgG水平检测存在偏差,并且需要对一例患者的持续监测数据。第三,抗体水平与病情的严重程度及病毒拷贝数在同一患者中的关系有待进一步研究。
综上所述,COVID-19患者以中老年患者SARS-CoV-2抗体阳性率最高,IgM或IgG在病程早期的阳性率相对较低,IgM在疾病进展过程中逐渐增加,而IgG一直维持较高水平,但是相同病程情况下不同年龄段SARS-CoV-2抗体水平无明显差异。
| [1] |
Worldometer. COVID-19 coronavirus pandemic[EB/OL]. [2020-04-05]. https://www.worldometers.info/coronavirus/.
|
| [2] |
Dibo M, Battocchio EC, Dos Santos Souza LM, et al. Antibody therapy for the control of viral diseases: an update[J]. Curr Pharm Biotechnol, 2019, 20(13): 1108-1121. DOI:10.2174/1389201020666190809112704 |
| [3] |
Channappanavar R, Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology[J]. Semin Immunopathol, 2017, 39(5): 529-539. DOI:10.1007/s00281-017-0629-x |
| [4] |
Li ZT, Yi YX, Luo XM, et al. Development and clinical application of a rapid IgM-IgG combined antibody test for SARS-CoV-2 infection diagnosis[J]. J Med Virol, 2020, 92(9): 1518-1524. DOI:10.1002/jmv.25727 |
| [5] |
中华人民共和国国家卫生健康委员会医政医管局. 关于印发新型冠状病毒肺炎诊疗方案(试行第七版)的通知-国卫办医函(2020)184号[EB/OL]. (2020-03-04)[2020-04-01]. http://www.nhc.gov.cn/xcs/zhengcwj/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml.
|
| [6] |
Meyer B, Drosten C, Müller MA. Serological assays for emerging coronaviruses: challenges and pitfalls[J]. Virus Res, 2014, 194: 175-183. DOI:10.1016/j.virusres.2014.03.018 |
| [7] |
Corman VM, Albarrak AM, Omrani AS, et al. Viral shedding and antibody response in 37 patients with Middle East respiratory syndrome coronavirus infection[J]. Clin Infect Dis, 2016, 62(4): 477-483. |
| [8] |
Li G, Chen XJ, Xu AL. Profile of specific antibodies to the SARS-associated coronavirus[J]. N Engl J Med, 2003, 349(5): 508-509. DOI:10.1056/NEJM200307313490520 |
| [9] |
Park WB, Perera RA, Choe PG, et al. Kinetics of serologic responses to MERS coronavirus infection in humans, South Korea[J]. Emerg Infect Dis, 2015, 21(12): 2186-2189. DOI:10.3201/eid2112.151421 |
| [10] |
Kucharski AJ, Russell TW, Diamond C, et al. Early dynamics of transmission and control of COVID-19:a mathematical modelling study[J]. Lancet Infect Dis, 2020, 20(5): 553-558. DOI:10.1016/S1473-3099(20)30144-4 |
| [11] |
里进, 叶光明, 陈良君, 等. 新型冠状病毒核酸检测假阴性结果原因分析及对策[J]. 中华检验医学杂志, 2020, 43(3): 221-225. DOI:10.3760/cma.j.issn.1009-9158.2020.03.005 |
| [12] |
徐万洲, 李娟, 何晓云, 等. 血清2019新型冠状病毒IgM和IgG抗体联合检测在新型冠状病毒感染中的诊断价值[J]. 中华检验医学杂志, 2020, 43(3): 230-233. |
| [13] |
Yang XB, Yu Y, Xu JQ, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study[J]. Lancet Respir Med, 2020, 8(5): 475-481. DOI:10.1016/S2213-2600(20)30079-5 |
| [14] |
Chan JF, Kok KH, Zhu Z, et al. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan[J]. Emerg Microbes Infect, 2020, 9(1): 221-236. DOI:10.1080/22221751.2020.1719902 |
| [15] |
Lee HK, Lee BH, Seok SH, et al. Production of specific antibodies against SARS-coronavirus nucleocapsid protein without cross reactivity with human coronaviruses 229E and OC43[J]. J Vet Sci, 2010, 11(2): 165-167. DOI:10.4142/jvs.2010.11.2.165 |
| [16] |
Lauer SA, Grantz KH, Bi QF, et al. The incubation period of coronavirus disease 2019(COVID-19) from publicly reported confirmed cases: estimation and application[J]. Ann Intern Med, 2020, 172(9): 577-582. DOI:10.7326/M20-0504 |
| [17] |
Liu R, Han H, Liu F, et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020[J]. Clin Chim Acta, 2020, 505: 172-175. DOI:10.1016/j.cca.2020.03.009 |



