目前在全世界范围内,新型冠状病毒肺炎(COVID-19)疫情的形势仍旧十分严峻,已经对各国的经济及人民的生命造成不可估量的损失。根据世界卫生组织(WHO)公布的数据,新型冠状病毒已造成超过1.6亿人感染,超过290万人死亡[1]。而近段时间全世界的发病率有所下降,每日死亡人数亦有减少,可归功于各国防疫及治疗水平的提高,其中疫苗的广泛接种起相当重要作用。目前新冠肺炎疫苗主要有灭活疫苗、核酸疫苗、腺病毒载体疫苗、重组亚单位疫苗等4种[2],我国研发的几款灭活疫苗(Vero细胞)已完成Ⅲ期试验并进入临床广泛接种,从各国公布的疫苗有效率数据看,灭活疫苗保护率为55%~80%,能够有效降低新型冠状病毒感染率,对于重症患者的保护率接近100%[3-5]。我国自2020年下半年开始,已陆续对重点人群,如出国人员、空乘人员及一线医务工作者等进行灭活疫苗接种。尽管我国本土COVID-19病例非常少,且我国政府通过如航班熔断等政策限制国外入境人员,但境外输入性COVID-19病例仍日益增加,因此防控压力仍十分巨大。近期广州医科大学附属市八医院陆续收治一批接种灭活疫苗后的境外输入性COVID-19患者,针对此类患者的临床特征及预后情况等,目前国内外研究较少,故本研究总结其临床特点,为临床中此类患者的诊疗等提供参考,现报告如下。
1 对象与方法 1.1 研究对象选取2021年1月4日—4月10日广州医科大学附属市八医院收治的接种灭活疫苗后的境外输入性COVID-19患者(接种疫苗组),及同期来自相同输入国家的未接种新冠疫苗的确诊COVID-19患者(未接种疫苗组)为研究对象。COVID-19疾病确诊、严重程度分型及出院标准均严格按照国家卫生健康委员会办公厅和国家中医药管理局办公室联合印发的《新型冠状病毒肺炎诊疗方案(试行第八版修订版)》[6]执行。
1.2 研究方法回顾性分析接种新冠灭活疫苗后确诊COVID-19的境外输入病例的人口学特征、血常规、肝肾功能、心肌酶学、凝血指标、氧合指标、炎症指标、T淋巴细胞亚群、新型冠状病毒抗体、胸部CT等指标,与未接种灭活疫苗的境外输入性COVID-19患者进行比较,分析两组患者的临床特征及预后情况等。
1.3 统计学方法应用SPSS 19.0软件(SPSS Inc, Chicago, Ⅲ)进行统计分析,定性资料采用率表示,定量资料采用x±s表示,非连续变量采用χ2检验进行组间比较,连续性数据采用t检验进行组间比较,P≤0.05为差异具有统计学意义。
2 结果 2.1 一般资料2021年1月4日—4月10日该院共收治38例接种新冠灭活疫苗后的境外输入性COVID-19患者,选取同期38例来自相同输入国家的未接种新冠疫苗的确诊COVID-19患者进行比较。两组患者均为中国籍,男性58例,女性18例,其中自刚果金入境16例,孟加拉国14例,迪拜10例,尼日利亚8例,尼泊尔、印度尼西亚、伊拉克、土耳其各4例,哈萨克斯坦、芬兰、乍得、柬埔寨、乌克兰、布隆迪各2例。所有患者起病前均有中国境外新冠肺炎疫区国家/地区居住或旅游史,搭乘飞机抵达广州白云机场入境中国,入境后均接受闭环式管理,在机场海关或隔离酒店检测新型冠状病毒核酸阳性后即送该院隔离治疗。
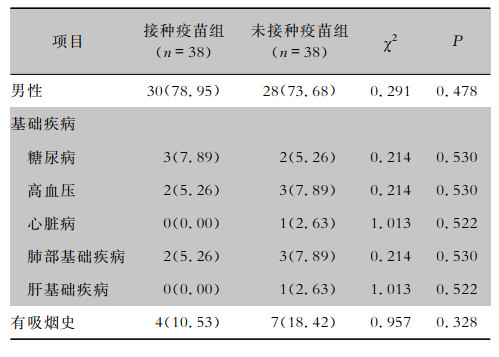
38例接种新冠灭活疫苗的境外输入性COVID-19患者,包括新型冠状病毒感染(核酸检测阳性)者16例(42.11%),核酸检测复阳者5例(13.16%),COVID-19确诊患者17例(44.74%);其中轻型4例(10.53%),普通型13例(34.21%)。38例未接种新冠灭活疫苗的境外输入性COVID-19患者,包括新型冠状病毒感染(核酸检测阳性)者17例(44.74%),核酸检测复阳者2例(5.26%),COVID-19确诊患者19例(50.00%);其中轻型5例(13.16%),普通型14例(36.84%)。接种疫苗组患者中有21例(55.26%)为单次两剂注射(指患者于同一日在左、右前臂各注射一剂新冠灭活疫苗),其余17例(44.74%)为两次单剂注射(患者第一次在左或右前臂注射第一剂新冠灭活疫苗,间隔3~4周后再在另一侧前臂注射第二剂新冠灭活疫苗)。末次疫苗接种至确诊时间间隔为(124.73±64.58)d,其中间隔时间最短的患者为28 d,间隔时间最长为253 d。患者接种疫苗的生产商分别为:国药集团中国生物北京生物制品研究所有限责任公司22例,北京科兴中维生物技术有限公司12例,武汉生物制品研究所有限责任公司4例。患者平均年龄:接种疫苗组(37.14±8.86)岁,未接种疫苗组(39.21±7.66)岁,两组患者在年龄、性别、合并基础疾病及有无吸烟史方面比较,差异均无统计学意义(P>0.05)。见表 1。
| 表 1 两组COVID-19患者的一般资料[例(%)] Table 1 General information of two groups of patients with COVID-19 (No. of cases[%]) |
|
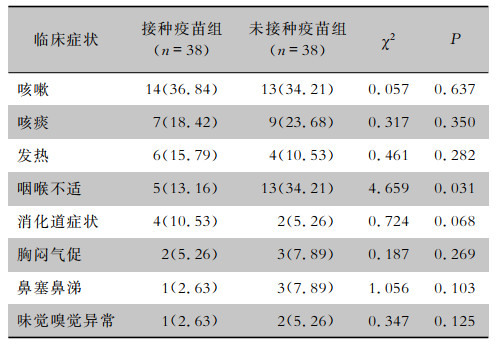
接种疫苗组患者的主要症状有咳嗽、咳痰、发热、咽喉不适、消化道症状;其余较少的症状包括胸闷气促、鼻塞鼻涕、味觉嗅觉异常等,其中发热患者除2例患者体温超过39℃,其余发热患者体温均波动在37.3~38.5℃;接种疫苗组患者咽喉不适症状所占比例低于未接种疫苗组患者,差异有统计学意义(P<0.05),两组患者其余临床症状所占比例比较,差异均无统计学意义(P>0.05)。见表 2。
| 表 2 两组COVID-19患者的临床症状[例(%)] Table 2 Clinical symptoms of two groups of COVID-19 patients (No. of cases[%]) |
|
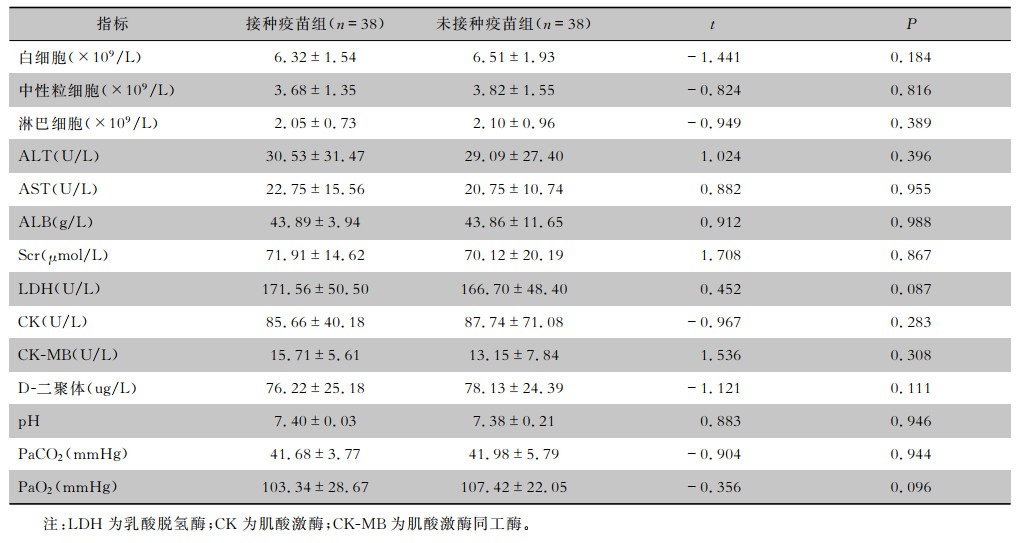
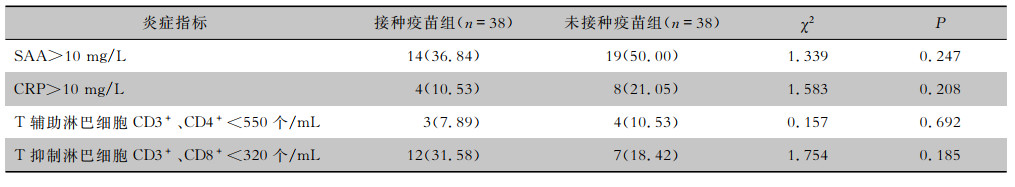
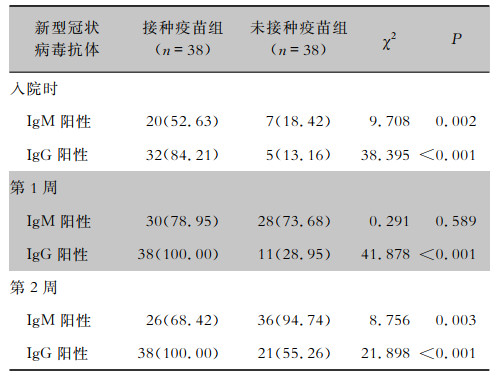
两组患者中各有4例并发轻度肝功能损伤,未接种疫苗组患者有1例合并轻度肾功能损伤,接种疫苗组患者有1例并发轻度心肌损伤,经治疗后以上患者的肝肾功能、心肌酶指标均较治疗前明显好转或恢复正常。两组患者血白细胞、中性粒细胞、淋巴细胞、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、血清清蛋白(ALb)、肌酐(Scr)、心肌酶学、D-二聚体、pH、PaCO2、PaO2、氧合指数等指标比较,差异均无统计学意义(P>0.05)。病程中出现白细胞及淋巴细胞绝对值下降接种疫苗组有7例,未接种疫苗组有9例,两组所占比例比较,差异无统计学意义(P>0.05)。两组患者病程中出现炎症指标如血清淀粉样蛋白(SAA)及C反应蛋白(CRP)升高的比例、T淋巴细胞亚群CD4+、CD8+细胞下降的患者比例比较,差异均无统计学意义(P>0.05)。新型冠状病毒抗体检测结果中,入院时、病程第1周、病程第2周患者新型冠状病毒抗体IgG阳性率接种疫苗组分别为84.21%、100.00%、100.00%,而未接种疫苗组分别为13.16%、28.95%、55.26%,两组比较,接种疫苗组患者在入院时、病程第1、2周的IgG阳性率均高于未接种疫苗组(P<0.05)。见表 3~5。
| 表 3 两组COVID-19患者的部分实验室检查结果(x±s) Table 3 Partial laboratory testing results of two groups of COVID-19 patients(x±s) |
|
| 表 4 两组COVID-19患者的炎症指标及T淋巴细胞亚群结果[例(%)] Table 4 Inflammatory markers and T lymphocyte subsets of two groups of COVID-19 patients (No. of cases[%]) |
|
| 表 5 两组COVID-19患者病程前两周的新型冠状病毒抗体检测结果[例(%)] Table 5 Detection results of SARS-CoV-2 antibodies of two groups of COVID-19 patients within the first two weeks of disease course (No. of cases[%]) |
|
38例接种疫苗的境外输入性COVID-19确诊患者中,有13例(34.21%)胸部影像学出现肺炎病灶,其中有1例患者表现为单侧肺炎,12例患者表现为双侧肺炎;有4例患者的肺部病灶表现为磨玻璃影,4例患者表现为斑片状影,5例表现为磨玻璃合并斑片影,4例患者出现纤维条索影,无患者出现胸腔积液或胸膜增厚。而38例未接种疫苗的境外输入性COVID-19确诊患者中,有14例(36.84%)胸部影像学出现肺炎病灶,其中有1例患者表现为单侧肺炎,13例患者表现双侧肺炎,有6例患者的肺部病灶主要表现为磨玻璃影,3例患者表现为斑片状影,5例表现为磨玻璃合并斑片影,3例患者出现纤维条索影,1例患者出现胸腔积液,无患者出现胸膜增厚。两组患者影像学构成比较,差异均无统计学意义(P>0.05)。
2.5 治疗有70例(92.11%)患者口服该院自主研发的“肺炎1号方”等中药制剂治疗,8例(10.53%)患者使用抗病毒药物(阿比多尔)治疗,有2例接种疫苗组患者及3例未接种疫苗组患者使用经鼻高流量湿化氧疗(HFNC)、糖皮质激素(甲强龙0.5 mg/kg,3~5 d)、胸腺法新及抗菌药物治疗,其余确诊患者予低流量鼻导管给氧,少部分患者据病情予抗菌药物、止咳化痰、护肝、营养心肌、纠正电解质紊乱等对症支持治疗。
2.6 预后患者的新型冠状病毒核酸检测转阴时间(鼻咽拭子PCR检测):接种疫苗组为(19.43±13.79)d,未接种疫苗组为(15.29±10.66)d,接种疫苗组患者核酸转阴时间更长,两组比较差异有统计学意义(t=7.094,P=0.038)。目前所有患者均治愈出院,无一例向重型、危重型转变,预后均良好。
3 讨论本次接种新冠灭活疫苗的COVID-19患者均为中国籍境外输入性病例,接种均为我国自主研发生产的灭活疫苗(Vero细胞),根据国外Ⅲ期临床数据显示,灭活疫苗的有效率为55%~80%,且接种疫苗后并非所有患者均能产生有效的中和性IgG抗体[7],因此仍可存在接种疫苗后感染新型冠状病毒的可能。
本研究结果显示,接种疫苗后感染新型冠状病毒患者,以核酸检测阳性者及普通型患者占多数,临床症状以咳嗽、咳痰、发热、咽喉不适、消化道症状为主,较少数者有鼻塞、流涕、胸闷、气促、嗅觉味觉异常等;其次,两组患者病程中炎症指标升高患者比例及T淋巴细胞下降患者比例比较,差异均无统计学意义,对于临床治疗方案选择及临床结局也无影响,而且其他实验室指标,如白细胞绝对值、淋巴细胞绝对值、肝肾功能、心肌酶学、D-二聚体、氧合指标等,两组患者比较差异均无统计学意义,胸部影像学改变同样以累及单侧或双侧的磨玻璃影及斑片影为主,两组构成比较差异无统计学意义。因此,在消除年龄、病毒来源等因素后,本研究结果提示接种疫苗组患者的临床特征与本研究中的未接种疫苗患者及既往对境外输入性COVID-19的研究报道[8-10]大致相同。
在本研究中,接种疫苗组患者中有2例使用高流量湿化氧疗,11例使用鼻导管给氧;未接种疫苗组患者中有3例使用高流量湿化氧疗,11例使用鼻导管给氧,接种疫苗组有3例患者使用阿比多尔抗病毒治疗,未接种疫苗组有5例使用阿比多尔治疗,92%的患者予该院自主研发的“肺炎1号方”等中药制剂[11]及其他对症支持治疗,两组治疗方案无明显差异,最终所有患者均治愈出院,无一例患者向重型、危重型转变,预后良好。灭活疫苗的研究过程中曾有研究者提出可能存在潜在的抗体依赖增强(ADE)效应问题[12-13],但本研究结果显示,两组患者临床特征及预后情况未见明显差异,因此未见到接种灭活疫苗后的COVID-19患者出现ADE现象。
在抗体变化和核酸转阴时间方面,两组患者结果比较差异有统计学意义。尽管部分接种疫苗组的患者入院时检测IgG抗体阴性,但在病程1周内即可全部检测到IgG抗体呈阳性,考虑与疫苗接种后体内存在免疫记忆有关[14],再次感染新型冠状病毒后,体内记忆淋巴细胞激活,在短时间内迅速产生IgG抗体;而未接种疫苗组患者则与既往各项新型冠状病毒抗体的研究结果相同,在疾病初期出现IgM抗体,病程1~2周后开始出现IgG抗体[15-16]。此外,接种疫苗组患者核酸转阴时间比未接种疫苗组患者转阴时间长,一方面考虑样本量可能对结果有影响,另一方面可能与病毒变异导致免疫逃逸有关[17-18],所接种灭活疫苗产生的抗体不能有效中和病毒,且可能与新产生的特异性IgG抗体产生竞争性结合,进而导致病毒清除减慢有关,有待进行病毒基因测序及病毒抗原抗体亲和力检测等手段进一步明确;其次,接种疫苗组患者的T抑制淋巴细胞CD3+、CD8+有下降趋势,可能与体内病毒的清除较慢有关[19-20],但接种新冠灭活疫苗是否与T抑制淋巴细胞比例下降有直接关系则尚不明确。
综上所述,本次该院诊治的接种新冠灭活疫苗(Vero细胞)后境外输入性COVID-19患者,以青中年男性为主,临床分型以新型冠状病毒感染(核酸检测阳性)者及新型冠状病毒肺炎(普通型)患者居多,确诊患者常见临床症状有咳嗽、咳痰、发热、咽喉不适等,胸部影像学可出现单侧或双侧磨玻璃或斑片渗出影病灶、纤维条索影等,经氧疗、中医中药等常规治疗后所有患者均预后良好。接种灭活疫苗(Vero细胞)后再感染新型冠状病毒患者,较未接种疫苗患者,在病程早期(1周内)即迅速产生IgG抗体,但核酸转阴时间较长。
| [1] |
World Health Organization. WHO Coronavirus (COVID-19) Dashboard[EB/OL]. [2021-04-20]. https://covid19.who.int/.
|
| [2] |
宋全伟, 王华庆. 不同技术路线研发新型冠状病毒疫苗的特性和研究进展[J]. 中华医学杂志, 2020, 100(38): 3030-3040. |
| [3] |
Palacios R, Patiño EG, de Oliveira Piorelli R, et al. Double-blind, randomized, placebo-controlled phase Ⅲ clinical trial to evaluate the efficacy and safety of treating healthcare professionals with the adsorbed COVID-19(inactivated) vaccine manufactured by sinovac-PROFISCOV: a structured summary of a study protocol for a randomised controlled trial[J]. Trials, 2020, 21(1): 853. DOI:10.1186/s13063-020-04775-4 |
| [4] |
World Health Organization. Evidence assessment: Sinopharm/CoronaVac COVID-19 vaccine[EB/OL]. [2021-04-18]. https://cdn.who.int/media/docs/default-source/immunization/sage/2021/april/2_sage29apr2021_critical-evidence_sinopharm.pdf.
|
| [5] |
World Health Organization. Evidence assessment: Sinovac/CoronaVac COVID-19 vaccine[EB/OL]. [2021-04-18]. https://cdn.who.int/media/docs/default-source/immunization/sage/2021/april/5_sage29apr2021_critical-evidence_sinovac.pdf.
|
| [6] |
中华人民共和国国家卫生健康委员会医政医管局. 关于印发新型冠状病毒肺炎诊疗方案(试行第八版修订版)的通知[EB/OL]. (2021-04-15)[2021-04-20]. http://www.nhc.gov.cn/yzygj/s7653p/202104/7de0b3837c8b4606a0594aeb0105232b.shtml.
|
| [7] |
Edara VV, Hudson WH, Xie XP, et al. Neutralizing antibo-dies against SARS-CoV-2 variants after infection and vaccination[J]. JAMA, 2021, 325(18): 1896-1898. DOI:10.1001/jama.2021.4388 |
| [8] |
艾香英, 谢敏, 林路平, 等. 广州29例境外输入型新型冠状病毒肺炎的临床特点分析[J]. 今日药学, 2020, 30(7): 442-445, 452. |
| [9] |
张素娟, 王先堃, 徐艳利, 等. 境外输入性新型冠状病毒肺炎69例的流行病学及临床特征分析[J]. 中华传染病杂志, 2020, 38(11): 690-695. DOI:10.3760/cma.j.cn311365-20200331-00440 |
| [10] |
陈沐, 许俐娴, 彭平, 等. 90例中国境外输入性新型冠状病毒肺炎临床特征分析[J]. 临床肺科杂志, 2021, 26(2): 163-167. DOI:10.3969/j.issn.1009-6663.2021.02.001 |
| [11] |
郑星宇, 林路, 骆杰伟, 等. 肺炎1号方的组方思路及理论创新[J]. 中医杂志, 2021, 62(1): 23-26. |
| [12] |
邓霞, 刘波, 王远征, 等. 抗体依赖性增强作用及对新型冠状病毒疫苗研发的思考[J]. 中国药物警戒, 2021, 18(3): 201-205, 212. |
| [13] |
Karthik K, Senthilkumar TMA, Udhayavel S, et al. Role of antibody-dependent enhancement (ADE) in the virulence of SARS-CoV-2 and its mitigation strategies for the development of vaccines and immunotherapies to counter COVID-19[J]. Hum Vaccin Immunother, 2020, 16(12): 3055-3060. DOI:10.1080/21645515.2020.1796425 |
| [14] |
吴长有. 免疫记忆与疫苗研究开发[J]. 中国免疫学杂志, 2005, 21(1): 4-7. DOI:10.3321/j.issn:1000-484X.2005.01.002 |
| [15] |
Li KN, Huang B, Wu M, et al. Dynamic changes in anti-SARS-CoV-2 antibodies during SARS-CoV-2 infection and recovery from COVID-19[J]. Nat Commun, 2020, 11(1): 6044. DOI:10.1038/s41467-020-19943-y |
| [16] |
Liu CM, Yu XQ, Gao CM, et al. Characterization of antibody responses to SARS-CoV-2 in convalescent COVID-19 patients[J]. J Med Virol, 2021, 93(4): 2227-2233. DOI:10.1002/jmv.26646 |
| [17] |
王荣花, 郑志慧, 张雨茜, 等. 冠状病毒免疫逃逸机制研究进展[J]. 中国药科大学学报, 2021, 52(1): 1-9. |
| [18] |
余萍, 刘欢, 刘晓岚, 等. 新型冠状病毒肺炎出院患者复阳原因及传染性分析[J]. 传染病信息, 2021, 34(2): 181-184. |
| [19] |
伍伟, 黄河颂, 俞桥, 等. 新型冠状病毒肺炎T淋巴细胞亚群变化的临床分析[J]. 河北医学, 2020, 26(6): 905-908. DOI:10.3969/j.issn.1006-6233.2020.06.005 |
| [20] |
屈满英, 孙瑞琳, 刘庆峰, 等. 外周血炎症标志物联合T淋巴细胞亚群检测在新型冠状病毒肺炎的临床价值探讨[J]. 中国现代医学杂志, 2020, 30(15): 61-64. |



