2. 河南省胸科医院心血管外科, 河南 郑州 450008;
3. 河南省胸科医院心外重症监护病房, 河南 郑州 450008;
4. 河南省胸科医院医学检验科, 河南 郑州 450008
2. Department of Cardiovascular Surgery, Henan Provincial Chest Hospital, Zhengzhou 450008, China;
3. Cardiosurgery Intensive Care Unit, Henan Provincial Chest Hospital, Zhengzhou 450008, China;
4. Department of Laboratory Medicine, Henan Provincial Chest Hospital, Zhengzhou 450008, China
Stanford A型主动脉夹层是心血管外科疾病中常见的危重急症,是指夹层仅累及升主动脉或同时累及升、弓、降主动脉的疾病。已有研究[1]表明A型主动脉夹层术后常出现呼吸功能不全、急性肺损伤等,是常见的第二并发症。本研究对2019年1—12月某院行急性A型主动脉夹层手术的患者术后出现呼吸机相关肺炎(ventilator-associated pneumonia, VAP)相关危险因素进行分析,现报告如下。
1 对象与方法 1.1 研究对象回顾性分析2019年1—12月在河南省胸科医院行Stanford A型主动脉夹层手术的患者,其中发生VAP的患者为VAP组,非VAP组以年龄(±5岁)和性别(构成比相同)1∶3进行匹配。纳入标准:手术方式均为孙氏手术的Stanford A型主动脉夹层患者,手术成功,术后仅发生VAP或未发生感染的患者。排除标准:发生VAP以外其他部位感染的病例,除VAP以外混合有其他部位感染的病例和术后自动出院、死亡的患者。
1.2 诊断方法VAP诊断符合《医院感染诊断标准(试行)》《重症监护病房医院感染预防与控制规范》和《急症诊疗机构医院感染监测定义和特定感染类型的标准》,患者的标本包括血、痰、肺泡灌洗液。根据是否发生VAP分为VAP组和非VAP组。
1.3 统计学方法应用SPSS 20.0统计软件对数据进行分析,定量资料采用均数±标准差描述,采用t检验进行比较分析,定性资料采用构成比(%)描述,采用χ2进行比较分析。采用logistic多因素回归分析Stanford A型主动脉夹层患者术后VAP的独立危险因素。P≤0.05为差异具有统计学意义。
2 结果 2.1 一般情况2019年1—12月河南省胸科医院行Stanford A型主动脉夹层手术的患者共161例。161例Stanford A型主动脉夹层患者发生VAP 28例次,感染例次率17.39%;呼吸机使用日数734 d,VAP日感染率38.14‰。按照纳入标准共选取112例患者,分别为28例VAP组和84例非VAP组;其中男性81例,女性31例。
2.2 Stanford A型主动脉夹层手术患者发生VAP的单因素分析112例Stanford A型主动脉夹层手术患者术后重症监护病房(ICU)住院日数为1 246 d,呼吸机使用总日数为551 d(13 224 h),平均每例患者呼吸机使用日数为4.92 d(118 h)。单因素分析结果显示,VAP组患者深低温停循环时间、术后呼吸机使用时间、奥美拉唑使用日数、肌酐水平均高于非VAP组,差异均有统计学意义(均P<0.05);VAP组患者术后重度低氧血症、术后肾功能衰竭比率均高于非VAP组,差异均有统计学意义(均P<0.05)。见表 1。
| 表 1 Stanford A型主动脉夹层手术患者发生VAP的单因素分析 Table 1 Univariate analysis on risk factors for VAP in patients undergoing Stanford type A aortic dissection surgery |

|
Stanford A型主动脉夹层手术患者术后发生VAP的logistic多因素回归分析结果显示,术后呼吸机使用时间、术后重度低氧血症、血肌酐水平和使用连续性肾替代治疗(CRRT)为Stanford A型主动脉夹层患者术后发生VAP的独立危险因素,差异均有统计学意义(均P<0.05)。见表 2。
| 表 2 Stanford A型主动脉夹层手术患者发生VAP的多因素分析 Table 2 Multivariate logistic regression analysis on risk factors for VAP in patients undergoing Stanford type A aortic dissection surgery |

|
对28例术后发生VAP患者的感染相关指标进行ROC曲线分析,血中性粒细胞曲线下面积最低(0.60),诊断价值较低。血白细胞、降钙素原(PCT)和体温ROC曲线下面积>0.7,有一定的诊断价值。当体温为38.5℃时,诊断灵敏度为61.1%,特异度为73.2%。血PCT为4.83时诊断灵敏度为72.2%,特异度为82.1%。血白细胞计数为20.9×109/L时诊断灵敏度为83.3%,特异度为58.9%。见表 3、图 1。
| 表 3 VAP感染相关指标曲线下面积比较 Table 3 Comparison of area under the curve of related indexes of VAP infection |

|
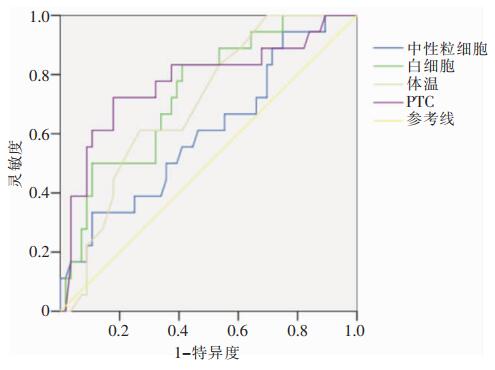 |
| 图 1 VAP组与非VAP组感染相关指标ROC曲线图 Figure 1 ROC curve of infection-related indexes between VAP group and non-VAP group |
28份阳性微生物标本中血标本10份、下呼吸道标本18份。共检出32株病原体,分别为肺炎克雷伯菌23株,铜绿假单胞菌6株,鲍曼不动杆菌1株,曲霉菌2株。肺炎克雷伯菌所占比率最高(71.88%),其中22株为耐碳青霉烯类肺炎克雷伯菌(CRKP);检出1株耐碳青霉烯类铜绿假单胞菌(CRPA);未检出耐碳青霉烯类鲍曼不动杆菌(CRAB)。
3 讨论A型主动脉夹层是目前临床常见的一种极为凶险的主动脉疾病[3],术后VAP发病率达43.1%[4]。本研究Stanford A型主动脉夹层术后VAP发病率17.39%,略高于尚蔚等[5]对本疾病医院感染发病率的研究。在VAP危险因素的单因素分析中,不同BMI、手术时间、术前高血压史患者的VAP发病率比较,差异均无统计学意义(均P>0.05);不同术后呼吸机使用时间、深低温停循环时间、奥美拉唑使用时长、术后重度低氧血症、血肌酐水平、术后肾衰竭患者的VAP发病率比较,差异有统计学意义(均P<0.05)。而logistic多因素回归分析中术后呼吸机使用时间、重度低氧血症、血肌酐与CRRT应用为VAP发生的独立危险因素,与相关文献[6]研究结果一致。
VAP组患者呼吸机使用时间长于非VAP组患者呼吸机使用时间[7]。由于Stanford A型主动脉夹层患者血管病变范围广、手术时间长、深低温停循环时间长,致系统炎症反应程度高,术后急性肺损伤、呼吸功能不全是常见的并发症[1],以上因素将进一步增加呼吸机的使用时间,使术后出现VAP的机会增加。
本研究中161例Stanford A型主动脉夹层患者术后15例(9.31%)发生重度低氧血症,重度低氧血症亦增加气管插管时间[8]、ICU停留时间及住院时间,增加了患者的院内病死率。有报道指出,主动脉夹层患者术后发生低氧血症的概率高达50%[9],对患者其他器官功能及手术效果都将造成不利影响,从而给患者预后带来严重影响[10]。医务人员可通过加强患者术前、术中和术后多种肺保护措施预防低氧血症的发生。
由于应激性溃疡防治药物对胃内酸碱度的影响,因此应激性溃疡防治药物可能对VAP发病的影响也一直是研究人员关注的课题。Herzig等[11]为研究酸抑制剂的使用与HAP的关系,开展了一项大型药物流行病学队列研究,纳入了63 878例患者,总体上看,酸抑制剂的使用可使HAP发病风险增加30%。因此VAP组患者较非VAP组患者奥美拉唑使用时间也显著延长,考虑到VAP的危害性,在应激性溃疡的防治过程中,医生应权衡应激性溃疡与VAP发生的风险,进行综合判断与选择。
研究[9]表明,术前内生肌酐清除率不足是术后重度低氧血症发生的独立危险因素,其机制可能与参与了A型夹层患者体内的全身炎症反应有关。同时急性肾衰竭是急性主动脉夹层术后主要且严重的并发症,孙氏手术的复杂性常导致体外循环时间>180 min,直接导致肾小管功能损伤和急性肾功能下降[12]。肾功能异常患者肾的代谢功能受损,导致血液中肌酐等含氮物质升高,而各种含氮物质参与了全身炎症反应,间接加重了患者肺损伤,导致术后重度低氧血症的出现。
VAP早期诊断及采取治疗措施有利于改善Stanford A型主幼脉夹层患者的预后。血中性粒细胞不建议作为早期诊断参考的指标,血白细胞、PCT和术后体温的升高ROC曲线下面积为0.7~0.8,对术后VAP的诊断有一定的价值。但Stanford A型主动脉夹层患者手术时间长、体外循环时间长等因素对患者的影响较大,全身炎症反应较重,因此还要结合患者的影像学、全身症状等综合判断患者是否诊断为VAP。
在VAP的病原学分布中,以肺炎克雷伯菌所占比例最高(23株,71.88%),且该病原体中有22株为CRKP,患者发生耐碳青霉烯类阴性菌感染后, 可供治疗使用的抗菌药物选择极少,病死率增高[13]。VAP感染病原体多为耐药菌[14],导致临床治疗效果往往不理想,对患者的生命质量造成严重威胁。
综上所述,呼吸机使用时间、重度低氧血症、肌酐与CRRT为Stanford A型主动脉夹层术后发生VAP的独立预测危险因素,对于有以上高危因素的患者,可以采取VAP集束化干预措施[15],降低VAP发生风险。本研究也存在一定的不足,VAP的集束化防控措施执行对VAP发生的影响未在本研究之内,下一步的研究中将对VAP的防控措施,及干预前后VAP的发生进一步研究探讨。
| [1] |
Hsing CH, Hsieh MY, Chen WY, et al. Induction of interleukin-19 and interleukin-22 after cardiac surgery with cardio-pulmonary bypass[J]. Ann Thorac Surg, 2006, 81(6): 2196-2201. DOI:10.1016/j.athoracsur.2006.01.092 |
| [2] |
ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. |
| [3] |
Zafar MA, Pang PYK, Henry GA, et al. Early spontaneous resolution of an iatrogenic acute type A aortic dissection[J]. Aorta (Stamford), 2016, 4(6): 235-239. DOI:10.12945/j.aorta.2016.16.067 |
| [4] |
陈天玲. 综合护理干预预防重症监护室机械通气相关性肺炎的临床观察[J]. 护士进修杂志, 2015, 30(8): 754-756. |
| [5] |
尚蔚, 刘楠, 闫晓蕾, 等. A型主动脉夹层手术后医院感染分析[J]. 中华医院感染学杂志, 2011, 21(11): 2242-2244. |
| [6] |
宋先荣, 程兆云, 刘富荣, 等. 急性A型主动脉夹层术后低氧血症的相关因素分析[J]. 中华胸心血管外科杂志, 2015, 31(5): 286-289. DOI:10.3760/cma.j.issn.1001-4497.2015.05.009 |
| [7] |
林曦, 谢强丽, 陈蓓蓓, 等. 心脏主动脉夹层术后医院感染相关因素分析及预防对策研究[J]. 中华医院感染学杂志, 2018, 28(13): 1975-1978. |
| [8] |
Nakajima T, Kawazoe K, Izumoto H, et al. Risk factors for hypoxemia after surgery for acute type A aortic dissection[J]. Surg Today, 2006, 36(8): 680-685. DOI:10.1007/s00595-006-3226-5 |
| [9] |
林丽珠, 梁蓓薇, 梁东科, 等. Stanford A型主动脉夹层术后低氧血症的围手术期危险因素分析[J]. 中国医师进修杂志, 2018, 41(1): 25-29. DOI:10.3760/cma.j.issn.1673-4904.2018.01.007 |
| [10] |
潘旭东, 鞠帆, 刘楠, 等. Stanford A型主动脉夹层患者术前肾功能不全对术后重度低氧血症发生的影响[J]. 中华外科杂志, 2016, 54(8): 628-631. DOI:10.3760/cma.j.issn.0529-5815.2016.08.016 |
| [11] |
Herzig SJ, Howell MD, Ngo LH, et al. Acid-suppressive medication use and the risk for hospital-acquired pneumonia[J]. JAMA, 2009, 301(20): 2120-2128. DOI:10.1001/jama.2009.722 |
| [12] |
Zheng JY, Xiao YY, Chong M, et al. The effect of cardiopulmonary bypass duration on renal injury after congenital heart surgery in infants and young children[J]. Adv Clin Exp Med, 2013, 22(5): 693-698. |
| [13] |
中华预防医学会医院感染控制分会, 中华医学会感染病学分会, 中国医院协会医院感染管理专业委员会, 等. 中国碳青霉烯耐药革兰阴性杆菌(CRO)感染预防与控制技术指引[J]. 中华医院感染学杂志, 2019, 29(13): 2075-2080. |
| [14] |
么颖, 陈琪, 祝鹏英, 等. 机械通气呼吸机相关性肺炎患者病原菌分析及循证干预对不良事件发生的影响[J]. 中华医院感染学杂志, 2018, 28(7): 994-997. |
| [15] |
冉雪曼, 沈军. 集束化干预预防呼吸机相关性肺炎效果的Meta分析[J]. 重庆医学, 2018, 47(9): 1225-1228, 1232. DOI:10.3969/j.issn.1671-8348.2018.09.024 |



