2. 中南大学湘雅医院医院感染控制中心, 湖南 长沙 410008
2. Center for Healthcare-associated Infection Control, Xiangya Hospital, Central South University, Changsha 410008, China
近年来,以革兰阴性菌(Gram-negative bacteria, GNB)为代表的多重耐药菌检出率日益增加,其耐药性特别是对β-内酰胺类抗生素的耐药性,通常由其产生的β-内酰胺酶驱动,很大程度上限制了GNB严重感染治疗药物的选择[1-4]。随着产β-内酰胺酶GNB感染率的增加,驱使碳青霉烯类药物使用率增加,产碳青霉烯酶GNB的出现和传播随之增加[5],凸显了对新型抗菌药物的迫切需求。
头孢他啶/阿维巴坦(ceftazidime/avibactam,CAZ/AVI)是一种新型头孢菌素与β-内酰胺酶抑制剂复合制剂,被美国食品药品管理局、欧洲食品药品管理局以及我国国家药品监督管理局批准用于包括呼吸机相关肺炎在内的医院获得性肺炎(hospital-acquired pneumonia, HAP)、肾盂肾炎在内的复杂性尿路感染(complicated urinary tract infection, cUTI)、复杂性腹腔感染(complicated intra-abdominal infection, cIAI),以及在治疗选择有限或无其他选择的GNB感染[6-7]。目前已发表数篇关于CAZ/AVI治疗效果与安全性的随机对照试验(randomized controlled trial, RCT),但系统评价仅发表1篇,且只报道了其在腹腔感染的疗效,纳入文献仅4篇[8]。本研究对CAZ/AVI治疗所有部位感染的RCT进行质量评价与定量分析,与其他治疗GNB药物的疗效与安全性进行比较,探讨CAZ/AVI作为替代方案治疗GNB感染的可行性。
1 资料与方法 1.1 文献检索以头孢他啶/阿维巴坦、感染、随机等为自由词检索中国知网、万方数据库、维普、中国生物医学文献数据库已发表的中文文献。以ceftazidime-avibactam、infection、randomized controlled trial等为检索词检索PubMed、Web of Science、EMbase、Cochrane Library数据库已发表的英文文献,以及临床试验注册平台(Clinical Trials.gov)注册试验的数据,以PubMed为例,检索策略见表 1。所有数据库的检索时限均为建库至2020年4月25日。以文献追溯综述类文献和纳入文献的参考文献等其他途径作为补充。
| 表 1 CAZ/AVI治疗GNB感染疗效和安全性Meta分析的PubMed数据库检索策略 Table 1 PubMed retrieval strategy for Meta-analysis on efficacy and safety of CAZ/AVI in treatment of GNB infection |

|
纳入国内外公开发表的CAZ/AVI治疗成年GNB感染患者(>18岁)疗效与安全性的RCT,试验组静脉滴注CAZ/AVI,若为腹腔感染加用甲硝唑,对照组静脉滴注治疗GNB感染的其他药物,抗菌药物种类不作限定。排除重复发表的文献、动物实验,以及偏重于药代动力学或病原菌的体外活性研究等。
1.3 文献筛选与数据提取由2名研究者独立筛选文献,如遇分歧,由第三人裁决。数据提取内容包括:①纳入研究的基本特征,如发表时间、第一作者姓名、试验设计方法等;②纳入文献的偏倚风险评价指标;③研究对象基本情况,如各组患者例数、年龄、性别比、感染部位、各组用药方案、疗程,以及结束治疗(end of treatment,EOT)、检测治愈(test of cure,TOC)、最后随访(last follow-up visit,LFU)时间;④研究结果,主要结局为临床可评价(clinically evaluable,CE)患者和微生物学改良意向治疗(microbiologically modified intention-to-treat,mMITT)患者在不同时间点的临床治愈率(感染症状明显改善或完全消除,无需进一步抗感染治疗),次要结局为mMITT患者在不同时间点的微生物清除率(病原菌检测为阴性),所有纳入患者不良反应发生率、严重不良反应发生率,以及因不良反应停药率、病死率。CE患者是指接受足够药物治疗剂量与次数且在研究期间未使用其他药物的患者,mMITT患者为在研究起始基线时已检出至少一种病原菌的患者。
1.4 偏倚风险评价使用Cochrane协会的RCT偏倚风险工具对纳入文献的方法学质量进行评价,评价内容包括序列生成(选择偏倚)、分配隐藏(选择偏倚)、是否施盲(主观偏倚)、结果的完整性(损耗偏倚)、选择性报告(报告偏倚)、其他偏倚。
1.5 统计分析应用Review Manage 5.3进行Meta分析,二分类变量使用危险比(risk ratio, RR)和95%置信区间(confidence interval,CI)表示,P ≤ 0.05为差异有统计学意义。P>0.10并且I2 < 50%表示各研究之间无异质性,采用固定效应模型,反之采用随机效应模型分析。通过逐一剔除文献的方法对主要结局进行敏感性分析,并使用漏斗图评价结果是否存在发表偏倚。
1.6 注册本文方案已在国际系统评价与荟萃分析方案注册平台(inplasy.com)进行注册,注册号为:INPLASY2020100029。
2 结果 2.1 文献检索结果共获得文献334篇,临床研究21项(均已发表),筛选后7篇RCT纳入质量评价与定量分析,筛选流程及结果见图 1。试验组共纳入1 887例,对照组1 905例。6项研究的对照组为碳青霉烯类药物,1项研究对照组为基于当地指南和细菌耐药情况制定的最适合患者的最佳治疗方案。感染为HAP、cIAI、cUTI的文献分别为1、4、3篇,纳入RCT的基本特征见表 2。
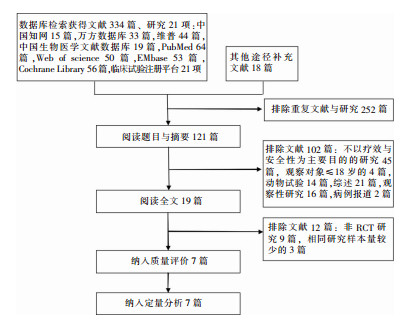 |
| 图 1 CAZ/AVI治疗GNB感染疗效和安全性Meta分析的文献筛选流程及检索结果 Figure 1 Flow chart and retrieval results of literature screening for Meta-analysis on efficacy and safety of CAZ/AVI in treatment of GNB infection |
| 表 2 CAZ/AVI治疗GNB感染疗效和安全性Meta分析纳入RCT的基本特征 Table 2 Basic characteristics of included RCT for Meta-analysis on efficacy and safety of CAZ/AVI in treatment of GNB infection |
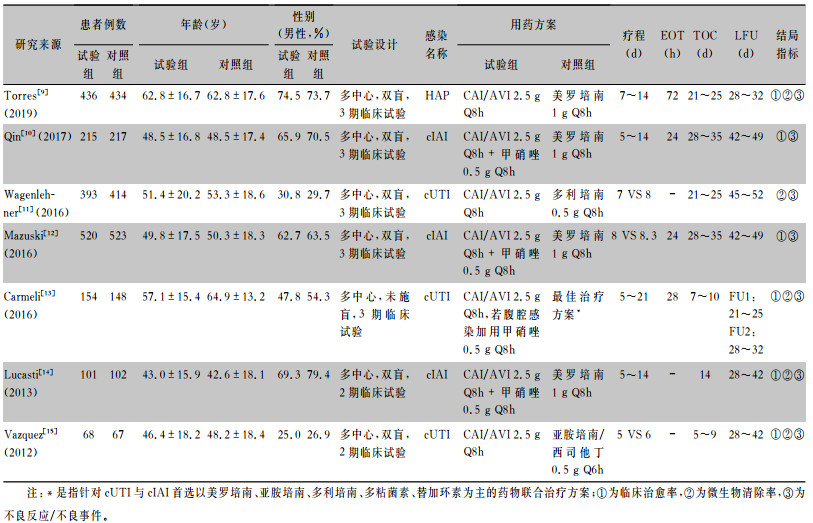
|
7项RCT均使用随机数字表或计算机随机,并进行中心分配,提示这些研究选择偏倚风险较低;所有研究均报道了各阶段退出患者数,且未选择性报道结果,说明损耗偏倚与报告偏倚风险较低;5篇文献[9-12, 14]对研究参与者、患者以及结局评定者均施盲,选择偏倚风险较低,1篇文献[13]未施盲,1篇文献[15]未对结果评定者施盲,具有一定的选择偏倚;7项RCT均为药物临床试验,有药品公司赞助,不清楚是否对研究造成偏倚。见图 2。
 |
| 图 2 CAZ/AVI治疗GNB感染疗效和安全性Meta分析纳入RCT的偏倚风险评价图 Figure 2 Bias risk assessment chart of included RCT for Meta-analysis on efficacy and safety of CAZ/AVI in treatment of GNB infection |
4篇文献[10, 12, 14, 15]报道CE患者分别在EOT、TOC、LFU时的临床治愈率,两组CE患者在EOT[RR=0.99,95%CI(0.96~1.01),P=0.29]、TOC[RR=0.99,95%CI(0.96~1.02),P=0.66]、LFU[RR=1.00,95%CI(0.96~1.03),P=0.84]时,临床治愈率之间差异均无统计学意义。只有1篇文献[12]报道mMITT患者在LFU时的临床治愈率,未进行Meta分析,3篇文献[9, 12-13]报道此类患者在EOT时的临床治愈率,2篇文献[9, 12]报道其在TOC时的临床治愈率。对照组mMITT患者在EOT时的临床治愈率优于试验组,差异有统计学意义[RR=0.95,95%CI(0.92~0.98),P=0.005],两组mMITT患者在TOC时的临床治愈率之间差异均无统计学意义[RR=0.95,95%CI(0.89~1.00),P=0.06]。见图 3。
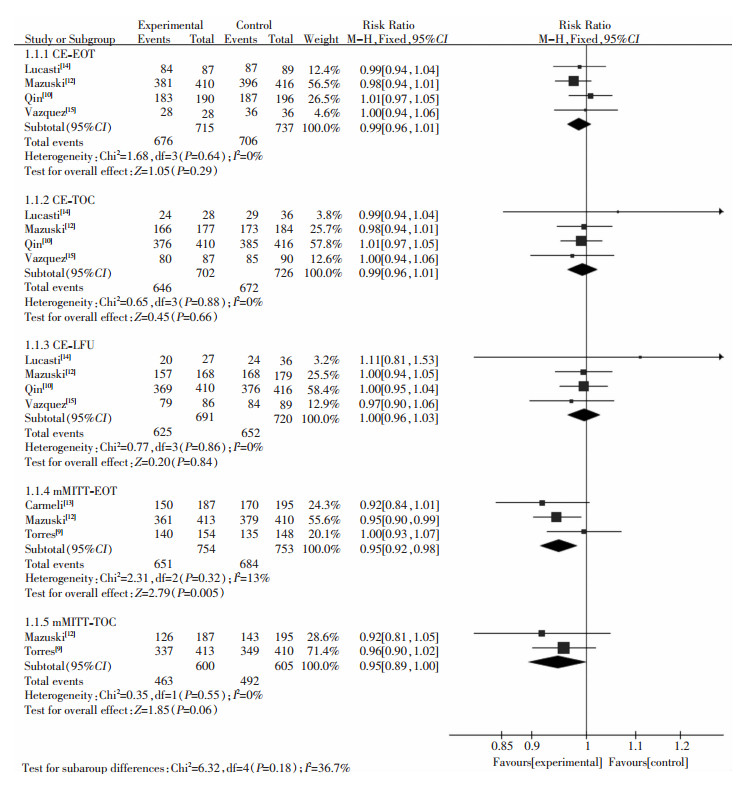 |
| 图 3 两组患者临床治愈率Meta分析森林图 Figure 3 Forest plots of Meta-analysis on clinical cure rate in two groups of patients |
报道mMITT患者在EOT、TOC、LFU时微生物清除率的文献分别有2、3、2篇。报道的目标菌为大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌、铜绿假单胞菌等GNB。两组mMITT患者在EOT[RR=1.00,95%CI (0.97~1.03),P=0.91]、TOC[RR=1.07,95%CI(0.92~1.25),P=0.39]时,微生物清除率差异无统计学意义,LFU时CAI/AVI组微生物清除率优于对照组,差异有统计学意义[RR=1.12,95%CI(1.01~1.23),P=0.03]。见图 4。
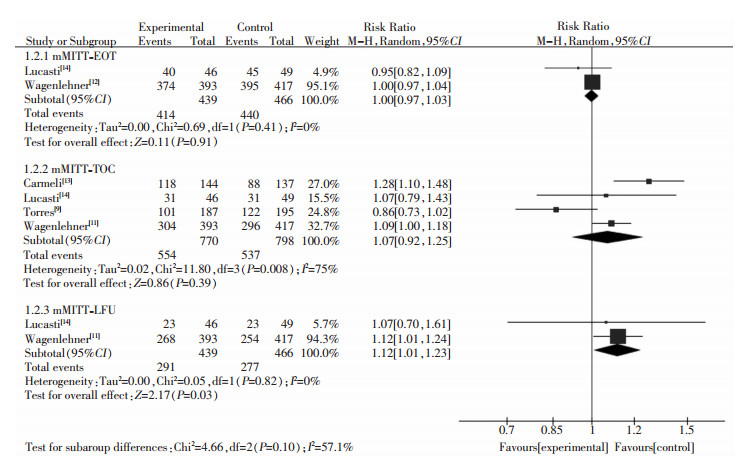 |
| 图 4 两组患者微生物清除率Meta分析森林图 Figure 4 Forest plots of Meta-analysis on microbial clearance rate in two groups of patients |
仅1篇文献[9]报道病死率,未进行Meta分析。7篇文献[9-15]均报道不良反应发生率,5篇文献[9-12, 15]报道严重不良反应发生率,4篇[9-12]报道因不良反应停药发生率。报道的不良反应主要有胃肠道反应(恶心、呕吐等)、过敏反应(皮疹、瘙痒等),以及血液系统疾病(中性粒细胞减少、贫血等)、中枢神经系统疾病(头疼、意识障碍等)、急性肾衰竭、肝损伤等严重不良反应。两组患者不良反应发生率[RR=1.03,95%(CI 0.97~1.10),P=0.31]与因不良反应停药发生率[RR=1.52,95%CI(0.95~2.41),P=0.08]差异无统计学意义。CAI/AVI组严重不良反应发生率高于试验组,差异有统计学意义[RR=1.26,95%CI(1.01~1.57),P=0.04]。见图 5。
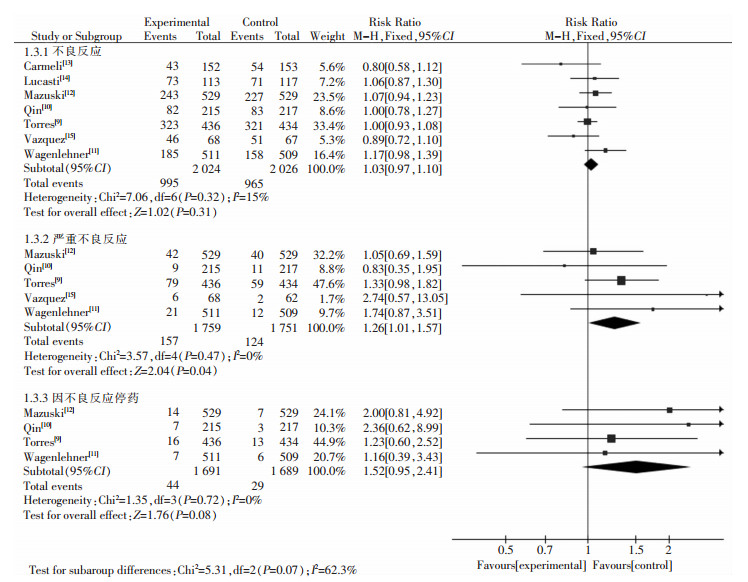 |
| 图 5 两组患者不良反应发生率Meta分析森林图 Figure 5 Forest plots of Meta-analysis on incidence of adverse reaction in two groups of patients |
逐一剔除报道临床治愈率的文献,无论剔除哪个文献,各组间的异质性均无显著改变,提示各研究结果对整体研究结果影响较小,结果较为可信。关于临床治愈率的各研究基本对称分布于漏斗图两侧,发表偏倚较小。见图 6。
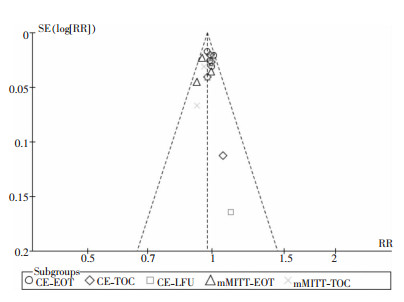 |
| 图 6 临床治愈率发表偏倚分析的漏斗图 Figure 6 Funnel plot of publication bias analysis of clinical cure rate |
CHINET监测数据显示,我国临床分离的多重耐药GNB近年来均有较高的检出率,且对常见抗菌药物的耐药率呈增长趋势[16]。Cassini等[17]研究结果显示,欧洲导致患者因感染而死亡最多的病原菌为对第三代头孢菌素耐药的大肠埃希菌,耐碳青霉烯类肺炎克雷伯菌、大肠埃希菌均为导致病死率上升速度较快的病原菌,β-内酰胺类抗生素已逐渐失去其对多重耐药GNB感染治疗的价值。然而,β-内酰胺类药物与β-内酰胺酶抑制剂复合制剂由于其在结构上的互补优势,使得β-内酰胺类药物在治疗多重耐药GNB感染时在一定程度上有效[18]。为应对GNB耐药性的上升,一种新的策略是重新评估β-内酰胺类药物与β-内酰胺酶抑制剂组合。阿维巴坦是一种新型非β-内酰胺类β-内酰胺酶抑制剂,可恢复头孢他啶对大多数产β-内酰胺酶(金属β-内酰胺酶除外)病原体的活性[18]。CAZ/AVI一经研发即受到广泛关注,但其对GNB感染的治疗效果仍未得到充分探索。本研究共纳入7项RCT共计3 794例患者,比较CAZ/AVI与其他抗菌药物方案治疗GNB感染的疗效和安全性。
比较CAZ/AVI组与对照组GNB感染患者临床治愈率与微生物清除率。Meta分析结果发现,CE患者EOT、TOC、LFU时,两组之间的临床治愈率差异均无统计学意义,mMITT患者EOT时,对照组临床治愈率略优于CAZ/AVI组,TOC时两组之间临床治愈率差异无统计学意义。mMITT患者EOT、TOC时,微生物清除率CAZ/AVI组与对照组差异无统计学意义,LFU时CAZ/AVI组微生物清除率优于对照组。这些结果表明在疗效方面,CAZ/AVI与碳青霉烯类药物及替加环素等广谱抗生素相比,治疗细菌感染的效果相似,甚至在某些时机优于这些药物。
既往研究[19]结果显示,阿维巴坦受药物相互作用的影响较小,在CAZ/AVI研发过程中其安全性和耐受性已得到包括肾功能不全和接受药物联合治疗患者在内的多项临床研究证明。但将各项研究Meta分析后发现,CAZ/AVI组严重不良反应发生率高于对照组。
纳入本研究RCT方法学的质量与结果的可靠性均较高,但均为CAZ/AVI的临床试验,所需药物均由药品公司赞助,可能对结果造成一定的影响。本研究发现尽管CAZ/AVI与其他抗菌药物方案治疗GNB感染的效果相似,但5项研究仅针对所有GNB感染而非多重耐药GNB感染的疗效进行论证,并且CAZ/AVI相对于其他药物的严重不良反应发生率更高。因此,仍需要更多的大样本、多中心的针对多重耐药GNB感染的高质量研究证据进行验证,为临床安全有效的治疗提供循证依据。
| [1] |
World Health Organization. Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. 2017[EB/OL]. (2018-05-16)[2020-06-12]. http:www.who.int/medicines/publications/WHO-PPL-Short_Summary_25Feb-ET_NM_WHO.pdf?ua=1.
|
| [2] |
Tängdén T, Giske CG. Global dissemination of extensively drug-resistant carbapenemase-producing Enterobacteriaceae: clinical perspectives on detection, treatment and infection control[J]. J Intern Med, 2015, 277(5): 501-512. DOI:10.1111/joim.12342 |
| [3] |
Shirley M. Ceftazidime-avibactam: a review in the treatment of serious Gram-negative bacterial infections[J]. Drugs, 2018, 78(6): 675-692. DOI:10.1007/s40265-018-0902-x |
| [4] |
阎颖, 孙渭歌. 抗菌药用药频度对下季度金黄色葡萄球菌耐药率的影响[J]. 药物流行病学杂志, 2018, 27(6): 382-386. |
| [5] |
黄天敏, 杨映霞, 姜赛平, 等. 头孢他啶阿维巴坦的临床应用进展[J]. 中国新药与临床杂志, 2019, 38(3): 129-134. |
| [6] |
European Medicines Agency. Zavicefta: summary of product characteristics[EB/OL]. (2020-03-20)[2020-06-12]. http:www.ema.europa.eu.
|
| [7] |
US Food and Drug Administration. NDA multi-disciplinary review and evaluation-NDA 206494 supplements 005 and 006 AVYCAZ (ceftazidime/avibactam) for injection[EB/OL]. (2019-03-11)[2020-06-12]. http:www.fda.gov/media/124307/download.
|
| [8] |
岑菁, 唐敏, 吕军, 等. 头孢他啶/阿维巴坦与碳青霉烯类治疗复杂腹腔感染疗效和安全性的系统评价[J/OL]. 中国抗生素杂志, 2021, 46(2): 162-169.
|
| [9] |
Torres A, Rank D, Melnick D, et al. Randomized trial of ceftazidime-avibactam vs meropenem for treatment of hospital-acquired and ventilator-associated bacterial pneumonia (REPROVE): analyses per US FDA-specified end points[J]. Open Forum Infect Dis, 2019, 6(4): ofz149. |
| [10] |
Qin XY, Tran BG, Kim MJ, et al. A randomised, double-blind, phase 3 study comparing the efficacy and safety of ceftazidime/avibactam plus metronidazole versus meropenem for complicated intra-abdominal infections in hospitalised adults in Asia[J]. Int J Antimicrob Agents, 2017, 49(5): 579-588. DOI:10.1016/j.ijantimicag.2017.01.010 |
| [11] |
Wagenlehner FM, Sobel JD, Newell P, et al. Ceftazidime-avibactam versus doripenem for the treatment of complicated urinary tract infections, including acute pyelonephritis: RECAPTURE, a phase 3 randomized trial program[J]. Clin Infect Dis, 2016, 63(6): 754-762. DOI:10.1093/cid/ciw378 |
| [12] |
Mazuski JE, Gasink LB, Armstrong J, et al. Efficacy and safety of ceftazidime-avibactam plus metronidazole versus mero-penem in the treatment of complicated intra-abdominal infection: results from a randomized, controlled, double-blind, phase 3 program[J]. Clin Infect Dis, 2016, 62(11): 1380-1389. DOI:10.1093/cid/ciw133 |
| [13] |
Carmeli Y, Armstrong J, Laud PJ, et al. Ceftazidime-avibactam or best available therapy in patients with ceftazidime-resistant Enterobacteriaceae and Pseudomonas aeruginosa complicated urinary tract infections or complicated intra-abdominal infections (REPRISE): a randomised, pathogen-directed, phase 3 study[J]. Lancet Infect Dis, 2016, 16(6): 661-673. DOI:10.1016/S1473-3099(16)30004-4 |
| [14] |
Lucasti C, Popescu I, Ramesh MK, et al. Comparative study of the efficacy and safety of ceftazidime/avibactam plus metronidazole versus meropenem in the treatment of complicated intra-abdominal infections in hospitalized adults: results of a randomized, double-blind, phase Ⅱ trial[J]. J Antimicrob Chemother, 2013, 68(5): 1183-1192. DOI:10.1093/jac/dks523 |
| [15] |
Vazquez JA, González Patzán LD, Stricklin D, et al. Efficacy and safety of ceftazidime-avibactam versus imipenem-cilastatin in the treatment of complicated urinary tract infections, including acute pyelonephritis, in hospitalized adults: results of a prospective, investigator-blinded, randomized study[J]. Curr Med Res Opin, 2012, 28(12): 1921-1931. DOI:10.1185/03007995.2012.748653 |
| [16] |
胡付品, 郭燕, 朱德妹, 等. 2019年CHINET三级医院细菌耐药监测[J]. 中国感染与化疗杂志, 2020, 20(3): 233-243. |
| [17] |
Cassini A, Högberg LD, Plachouras D, et al. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015:a population-level modelling analysis[J]. Lancet Infect Dis, 2019, 19(1): 56-66. DOI:10.1016/S1473-3099(18)30605-4 |
| [18] |
Karaiskos I, Galani I, Souli M, et al. Novel β-lactam-β-lactamase inhibitor combinations: expectations for the treatment of carbapenem-resistant Gram-negative pathogens[J]. Expert Opin Drug Metab Toxicol, 2019, 15(2): 133-149. DOI:10.1080/17425255.2019.1563071 |
| [19] |
Sternbach N, Leibovici Weissman Y, Avni T, et al. Efficacy and safety of ceftazidime/avibactam: a systematic review and Meta-analysis[J]. J Antimicrob Chemother, 2018, 73(8): 2021-2029. DOI:10.1093/jac/dky124 |



