随着社会人口老龄化的日益加剧,慢性疾病患者不断增加,使得呼吸支持的临床应用日益广泛。由于多种因素的影响,接受呼吸机治疗的临床患者往往会继发呼吸机相关肺炎(ventilator-associa-ted pneumoniae,VAP)[1]。VAP是指气管插管或气管切开患者接受机械通气48 h后或撤机拔管48 h内发生的肺炎,是重症患者常见的严重并发症,更是常见医院获得性感染,其临床诊疗较为困难,且患者病死率高[1-2]。耐碳青霉烯类革兰阴性杆菌是VAP的重要病原体,其中耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae,CRKP)是重要组成之一[2-4]。CRKP不仅呈现出多重耐药,近年来更进化出携带pLVPK-like毒力质粒的耐碳青霉烯类高毒力肺炎克雷伯菌(carbapenem-resistance hypervirulent Klebsiella. pneumoniae,CR-hvKP),严重威胁医院感染的防控效果[5]。目前,新型冠状病毒全球蔓延,患者感染后主要受累器官是肺,病情危重时大多需接受机械通气治疗[6]。为提高救治成功率,预防多重耐药菌导致的VAP是临床诊疗及医院感染防控中一项重要工作。因此,收集2019年1—12月某地区省级综合性三甲医院VAP患者下呼吸道标本分离的CRKP菌株,分析其感染与耐药情况、基因分型及毒力因子特征,为其医院感染防控提供实验室循证依据。
1 材料与方法 1.1 菌株来源2019年1—12月某地区某三甲医院VAP患者下呼吸道合格标本分离的非重复肺炎克雷伯菌(KP),共计75株。
1.2 临床资料的收集VAP诊断标准按照《中国成人医院获得性肺炎与呼吸机相关肺炎诊断和治疗指南(2018版)》[2]进行。剔除机械通气之前已发生肺部感染者,机械通气治疗48 h内出院或48 h内死亡以及临床资料不完整患者分离的菌株。最终纳入本研究共计56株KP。收集患者的基本临床资料,包括性别、年龄、基础疾病、机械通气时间、入住ICU时间及临床转归。本研究通过该院伦理委员会审查同意。
1.3 菌株鉴定及药敏试验采用Microflex LT型质谱仪(德国BRUKER公司)进行菌株鉴定。阿米卡星、氨苄西林/舒巴坦、氨曲南、厄他培南、环丙沙星、哌拉西林/他唑巴坦、庆大霉素、头孢曲松、头孢他啶、头孢吡肟、妥布霉素、亚胺培南及左氧氟沙星采用VITEK 2 Compact型分析仪(法国BioMérieux公司)进行药敏检测;美罗培南及头孢哌酮/舒巴坦采用纸片扩散法进行药敏检测,纸片为美国ThermoFisher公司产品。替加环素(美国Pfizer公司)应用微量肉汤稀释法进行药敏检测,结果按EUCAST标准(http://www.eucast.org)判定,其他药敏结果按美国临床实验室标准化协会(CLSI) 2019版标准判定[7]。将对亚胺培南、美罗培南及厄他培南三者任意一种耐药的KP定义为CRKP[7],对上述三种药物均不耐药的KP定义为碳青霉烯非耐药KP(non-carbapenem-resistant KP,nCRKP)。
1.4 碳青霉烯酶表型及耐药基因检测采用改良碳青霉烯灭活试验(mCIM)及EDTA改良灭活试验(eCIM)检测碳青霉烯酶表型[7]。煮沸法提取CRKP菌株DNA模板,聚合酶链反应(PCR)检测常见碳青霉烯酶基因blaKPC-2、blaNDM-1、blaIMP、blaVIM、blaOXA-48,引物序列及扩增条件参照文献[8]。扩增产物用含EB(0.2 μg/mL)1%琼脂糖凝胶电泳后,凝胶成像观察结果。阳性产物送Sangon Biotech公司进行测序,测序结果在GenBank数据库中比对查询。
1.5 荚膜wzi分型及毒力基因检测煮沸法提取待测KP菌株DNA模板,PCR扩增wzi基因,引物序列及扩增条件参考文献[9]。扩增产物送Sangon Biotech公司测序后,登录Web数据库(https://bigsdb.pasteur.fr/klebsiella/)比对wzi型及相应荚膜血清型。扩增9种主要毒力因子(包括rmpA、rmpA2、iucA、iroN、entB、magA、mrkD、Kfu及ybtS),引物序列及扩增条件参考文献[10-11]进行。扩增产物用含EB(0.2 μg/mL)1%琼脂糖凝胶电泳,凝胶成像观察结果。挑选代表性阳性结果送Sangon Biotech公司测序,比对确认后作为阳性对照。
1.6 多位点序列分型参照多位点序列分型(multilocus sequence typing,MLST)网站(https://bigsdb.pasteur.fr/klebsiella/primers_used.html)推荐序列合成7对管家基因检测PCR引物。扩增条件参考文献[8]。PCR产物送Sangon Biotech公司测序,登录Web数据库(https://bigsdb.pasteur.fr/klebsiella/)比对序列,明确待测菌株ST型。按照gapA-infB-mdh-pgi-phoE-rpoB-tonB顺序整理等位基因,并根据等位基因差异,将ST型分为单位点变异型(single-locus variants, SLVs)、双位点变异型(double-locus variants, DLVs)及三位点变异型(triple-locus variants,TLVs)。应用Global optimal eBURST(goeBURST)软件分析各ST间的进化发育关系并构建最小生成树,确定ST型中的group founder及sub-group founder,将group founder及其SLVs(两种及以上)定义为克隆群(clonal complex,CC)[12]。
1.7 脉冲场凝胶电泳(PFGE)待测CRKP菌株接种于2 mL LB肉汤管,37℃震荡培养4 h,离心后用EC液混匀。加入等体积2%低熔点琼脂糖凝胶,混匀后注入模具制成胶块。胶块置蛋白酶K于50℃水浴过夜后,1×TE清洗4~6次。胶块切至5 mm大小后XbaI酶37℃酶切4 h。电泳条件为:0.5×TBE、14℃、6 V/cm、线性梯度5~35 s、22 h。染色成像后使用BioNumerics软件分析。PFGE图谱相似性>90%定义为同一分型(Pulsotype, PT)[13]。
1.8 统计分析药敏检测结果应用WHONET 5.6软件进行分析,其他统计应用SPSS 21.0软件进行。Shapiro-Wilk方法进行正态性检验,正态分布资料以x±s表示。两组定量数据均数比较采用t检验,两组样本率间的比较采用卡方检验,以P ≤ 0.05为差异有统计学意义。
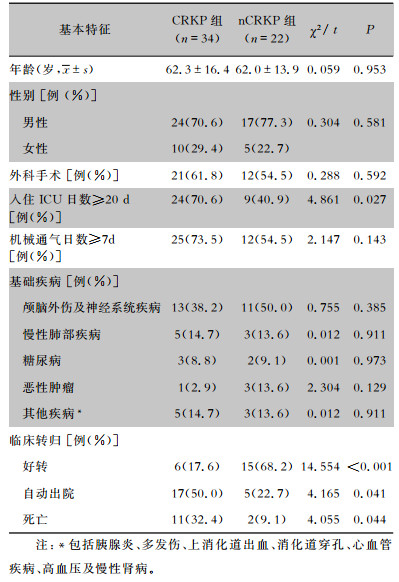
2 结果 2.1 临床基本特征本研究56株KP中,CRKP 34株(60.7%,CRKP组),nCRKP 22株(39.3%,nCRKP组)。CRKP组患者以男性为主(70.6%),平均年龄(62.3±16.4)岁。CRKP组患者所在临床科室包括:综合重症监护病房A(ICU_A,13株,38.2%)、呼吸重症监护病房(ICU_R,8株,23.5%)、综合重症监护病房B(ICU_B,6株,17.6%),神经外科(3株,8.8%)、急诊重症监护病房(ICU_E,2株,5.9%)及呼吸内科和骨科(各1株,2.9%)。与nCRKP组相比,CRKP组患者在年龄、性别、接受外科手术、机械通气时间及基础疾病方面差异均无统计学意义。但CRKP组入住ICU日数≥ 20 d比例高于nCRKP组,同时死亡及自动出院患者的比例高于nCRKP组(均P < 0.05),治疗病情好转比例低于nCRKP组(P < 0.01)。见表 1。
| 表 1 CRKP及nCRKP组VAP患者临床基本特征 Table 1 Basic clinical characteristics of VAP patients in CRKP and nCRKP groups |
|
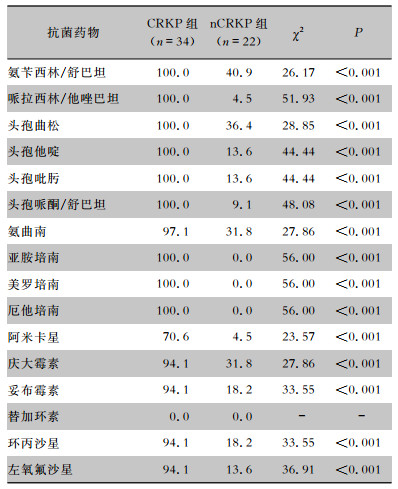
体外药敏试验结果显示,CRKP组菌株对常用抗菌药物耐药率高于nCRKP组(均P < 0.05)。CRKP对头孢菌素类及碳青霉烯类抗生素的耐药率均为100.0%,仅对氨曲南耐药率为97.1%,对环丙沙星及左氧氟沙星耐药率均为94.1%;对阿米卡星、妥布霉素及庆大霉素的耐药率分别为70.6%、94.1%、94.1%。未检出耐替加环素的菌株。见表 2。经mCIM和eCIM检测,97.1%(33株)CRKP菌株mCIM试验为阳性,2.9%(1株)菌株eCIM为阳性。PCR检测表明,mCIM阳性菌株均携带blaKPC-2,eCIM阳性株携带blaNDM-1。
| 表 2 CRKP组及nCRKP组菌株对抗菌药物耐药率(%) Table 2 Resistance rates of CRKP and nCRKP isolates to antimicrobial agents (%) |
|
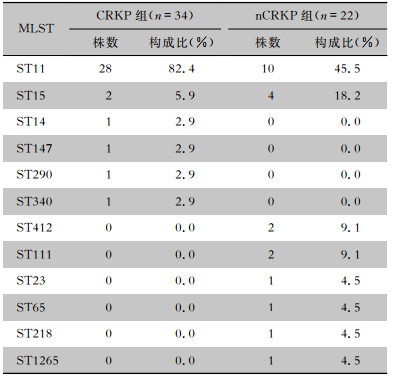
MLST结果显示,34株CRKP菌株共分为6个ST型,主要为ST11(82.4%);22株nCRKP菌株分为8个ST型,主要为ST11(45.4%)。见表 3。GoeBURST分析可见,CRKP菌株中,ST11及ST15均为sub-group founder,ST340为ST11的SLVs,ST14为ST15的SLVs,且ST15为ST11的TLVs;nCRKP菌株中,ST23为group founder,ST218与ST1265均为ST23的SLVs,ST111和ST412均为ST23的TLVs。ST23和ST218、ST1265共同构成CC23。见图 1。进一步通过PFGE分析显示,34株CRKP分为26个PT型,其中PT05、PT15、PT16、PT18和PT20型菌株分别为2、3、4、2、2株,且PT15及PT16型克隆株主要分布在ICU_A病区。见图 2。
| 表 3 CRKP组及nCRKP组菌株MLST结果 Table 3 MLST results of CRKP and nCRKP isolates |
|
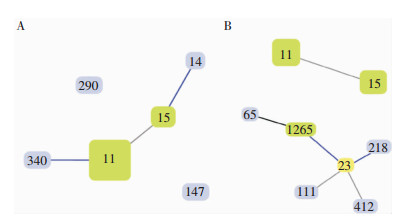 |
| 注:每个节点代表一个ST型,节点大小与该ST型菌株数量成正比。黄色节点为group founder,绿色节点为sub-group founder,紫色节点为common node。节点间蓝色连线提示两ST型为SLVs、黑色连线提示为DLVs、灰色连线提示为TLVs、无连线提示该ST型与其他型差异大于3个位点。 图 1 CRKP菌株(A)及nCRKP菌株(B)ST型的goeBURST分析图 Figure 1 GoeBURST analysis of sequence type of CRKP and nCRKP isolates |
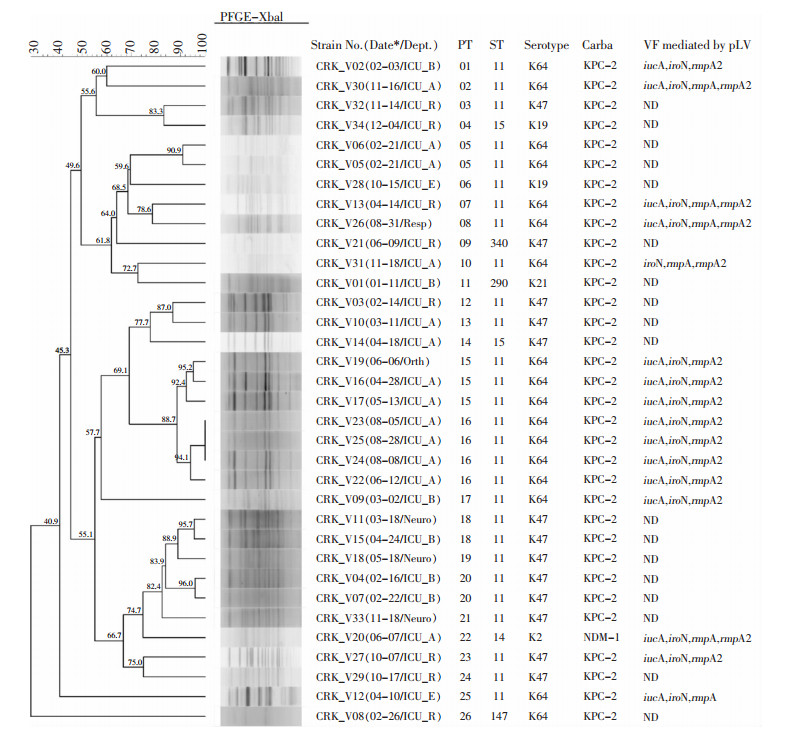 |
| 注:Carba为carbapenemase; ND为no detection; Neuro为neurosurgery; Orth为orthopedics; pLV为pLVPK-like plasmid; PT为pulsotype; Resp为respiratory medicine; ST为sequence type; VF为virulence factor; * Date中日期格式为MM-DD。 图 2 CRKP菌株PFGE聚类分析图 Figure 2 PFGE cluster analysis on CRKP isolates |
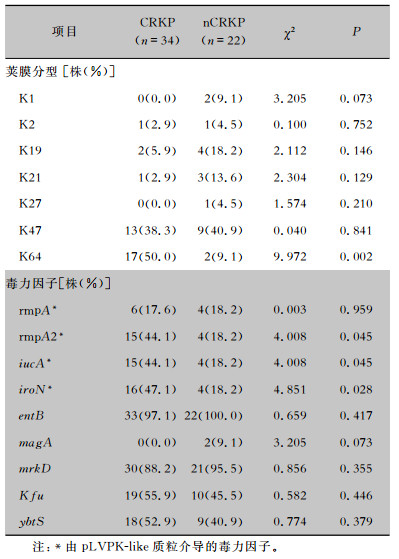
荚膜wzi分型可见,CRKP菌株共分为5种荚膜型,以K64型为主(50.0%),其次为K47型(38.3%);nCRKP菌株则分为7种,以K47为主(40.9%)。K64型菌株在CRKP菌株中的比例高于nCRKP菌株(P < 0.01),且PT05、PT15及PT16型CRKP菌株荚膜均属于K64型。毒力因子检测结果显示,CRKP菌株携带多种毒力因子,其中pLVPK-like质粒介导的毒力因子rmpA、rmpA2、iucA及iroN检出率分别为17.6%、44.1%、44.1%及47.1%,而rmpA2、iucA及iroN的检出率高于nCRKP菌株(均P < 0.05),上述质粒介导的毒力因子主要由K64-ST11型CRKP菌株携带。见表 4、图 2。
| 表 4 CRKP及nCRKP菌株荚膜分型及毒力因子检测结果 Table 4 Capsular serotype and virulence factor analysis on CRKP and nCRKP isolates |
|
作为临床常见条件致病菌,KP易于获得外源耐药基因并出现耐药表型,是医院感染重点防控的多重耐药菌。根据全国细菌耐药监测网统计数据[14]显示,我国CRKP检出率逐年攀升,从2013年的4.9%上升至2018年的10.1%,临床流行趋势十分严峻。本研究56株KP中,CRKP的比率高达60.7%,与感染患者均存在ICU住院史有关。与我国某三甲医院2018年ICU CRKP临床分离率为63.7%,且主要来源于呼吸道标本的研究[15]结果基本一致。本组资料中CRKP组患者入住ICU日数≥ 20 d的比例高于nCRKP组,进一步提示ICU是CRKP流行播散的重点科室。
入住ICU患者大多患有严重基础疾病,一旦继发CRKP感染,往往预后不良。研究[16]表明,感染CRKP患者病死率远高于感染非耐药株患者。本研究中,CRKP组与nCRKP组VAP患者在年龄、性别及基础疾病种类方面差异均无统计学意义,但其死亡及自动出院患者比例远高于nCRKP组。其CRKP菌株呈现多重耐药表型,对除替加环素之外的所有临床常用抗菌药物耐药率均高于70%;所有菌株均产碳青霉烯酶,且以KPC-2为主。KPC-2属于A类丝氨酸β-内酰胺酶,其临床流行范围最广泛,通常由质粒携带在肠杆菌目细菌间水平传播[17]。此类质粒常同时携带多种耐药基因,导致CRKP菌株表现为多重耐药,给临床抗感染治疗带来极大挑战[17]。因此,严格落实医院感染防控措施,预防VAP患者发生CRKP感染更显得尤为重要。
ST11型是中国大陆地区CRKP的主要流行克隆群,占比在60%以上[17]。比较基因组学研究[18]表明,由于包括荚膜多糖合成位点在内的基因组片段发生的重组,导致该型出现不同的进化分支,从而呈现不同的荚膜分型。本研究中,ST11型CRKP菌株共分成K64和K47两种荚膜型,以K64型为主,且K64型CRKP的构成比高于nCRKP组(P < 0.05)。2013—2017年浙江地区一项回顾性研究发现,K64-ST11型CRKP在2016年取代了K47型,成为主要流行亚克隆。通过毒力因子检测发现,CRKP菌株携带的毒力因子比例较高,且其中rmpA2、iucA及iroN检出率高于nCRKP菌株[19]。上述三种毒力因子均由pLVPK-like毒力质粒携带,是CR-hvKP的重要分子标志[5]。而携带pLVPK-like质粒的K64型亚克隆,更易于在医院环境中存活[19]。本研究PFGE分型结果显示,出现3例以上克隆传播的PT15和PT16型,均属于K64型ST11-CRKP,提示该亚克隆在医院环境中具有较强的定植及播撒能力,可能与携带pLVPK-like质粒后毒力增强相关。另一方面,由于本研究纳入研究的菌株及病例数量较少,且菌株来源为单中心,研究结果存在一定的局限性。后续将继续扩充研究中心并增加菌株数量,系统分析携带pLVPK-like质粒与CRKP菌株医院内定植播撒之间的关联性。
综上所述,本研究结果显示,K64-ST11型CRKP是临床VAP患者下呼吸道分离CRKP重要分子亚克隆。不仅表现为多重耐药,而且携带大量由pLVPK-like质粒介导的毒力因子。与对照组相比,CRKP组患者临床预后不佳。应加强临床、实验室及感染管理部门的协作,密切监控K64型ST11-CRKP菌株亚克隆的流行趋势,防控其导致的医院感染事件发生。
| [1] |
李婧闻, 朱仕超, 张慧, 等. 呼吸机相关事件及其预防的研究进展[J]. 中国感染控制杂志, 2019, 18(2): 175-180. |
| [2] |
中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006 |
| [3] |
Gao B, Li XD, Yang FM, et al. Molecular epidemiology and risk factors of ventilator-associated pneumonia infection caused by carbapenem-resistant Enterobacteriaceae[J]. Front Pharmacol, 2019, 10: 262. DOI:10.3389/fphar.2019.00262 |
| [4] |
Huang Y, Jiao Y, Zhang J, et al. Microbial etiology and prognostic factors of ventilator-associated pneumonia: a multicenter retrospective study in Shanghai[J]. Clin Infect Dis, 2018, 67(Suppl 2): S146-S152. |
| [5] |
Zhang YW, Jin LY, Ouyang PW, et al. Evolution of hypervirulence in carbapenem-resistant Klebsiella pneumoniae in China: a multicentre, molecular epidemiological analysis[J]. J Antimicrob Chemother, 2020, 75(2): 327-336. DOI:10.1093/jac/dkz446 |
| [6] |
周娟, 李丹, 龙云铸. 新型冠状病毒(2019-nCoV)相关研究进展[J]. 中国感染控制杂志, 2020, 19(3): 288-292. |
| [7] |
CLSI. Performance standards for antimicrobial susceptibility testing, 29th ed[EB/OL]. [2020-01-20]. https://community.clsi.org/media/2663/m100ed29_sample.pdf.
|
| [8] |
储雯雯, 刘周, 杨凯, 等. 碳青霉烯耐药肺炎克雷伯菌耐药机制及分子流行病学研究[J]. 安徽医科大学学报, 2016, 51(6): 809-813. |
| [9] |
Brisse S, Passet V, Haugaard AB, et al. wzi gene sequencing, a rapid method for determination of capsular type for Klebsiella strains[J]. J Clin Microbiol, 2013, 51(12): 4073-4078. DOI:10.1128/JCM.01924-13 |
| [10] |
Yu FY, Lv JN, Niu SQ, et al. Multiplex PCR analysis for rapid detection of Klebsiella pneumoniae carbapenem-resistant (sequence type 258[ST258] and ST11) and hypervirulent (ST23, ST65, ST86, and ST375) strains[[J]. J Clin Microbiol, 2018, 56(9): e00731-18. |
| [11] |
Zhan LL, Wang SS, Guo YJ, et al. Outbreak by hypermucoviscous Klebsiella pneumoniae ST11 isolates with carbapenem resistance in a tertiary hospital in China[J]. Front Cell Infect Microbiol, 2017, 7: 182. DOI:10.3389/fcimb.2017.00182 |
| [12] |
Francisco AP, Bugalho M, Ramirez M, et al. Global optimal eBURST analysis of multilocus typing data using a graphic matroid approach[J]. BMC Bioinformatics, 2009, 10: 152. DOI:10.1186/1471-2105-10-152 |
| [13] |
Liu Z, Gu Y, Li X, et al. Identification and characterization of NDM-1-producing hypervirulent (hypermucoviscous) Klebsiella pneumoniae in China[J]. Ann Lab Med, 2019, 39(2): 167-175. DOI:10.3343/alm.2019.39.2.167 |
| [14] |
全国细菌耐药监测网. 2018年全国细菌耐药监测报告(简要版)[EB/OL]. (2019-11-19)[2020-01-20]. http://www.carss.cn/Report/Details?aId=648.
|
| [15] |
欧阳娜, 童德军, 王敏, 等. 2009-2018年10075株肺炎克雷伯菌临床分布及其耐药变迁[J]. 中国感染控制杂志, 2019, 18(6): 546-551. |
| [16] |
Xu LF, Sun XX, Ma XL. Systematic review and Meta-analysis of mortality of patients infected with carbapenem-resistant Klebsiella pneumoniae[J]. Ann Clin Microbiol Antimicrob, 2017, 16(1): 18. DOI:10.1186/s12941-017-0191-3 |
| [17] |
Zhang R, Liu LZ, Zhou HW, et al. Nationwide surveillance of clinical carbapenem-resistant Enterobacteriaceae (CRE) strains in China[J]. EBioMedicine, 2017, 19: 98-106. DOI:10.1016/j.ebiom.2017.04.032 |
| [18] |
Dong N, Zhang R, Liu LZ, et al. Genome analysis of clinical multilocus sequence type 11 Klebsiella pneumoniae from China[J]. Microb Genom, 2018, 4(2): e000149. |
| [19] |
Zhou K, Xiao TT, David S, et al. Novel subclone of carbape-nem-resistant Klebsiella pneumoniae sequence type 11 with enhanced virulence and transmissibility, China[J]. Emerg Infect Dis, 2020, 26(2): 289-297. DOI:10.3201/eid2602.190594 |



