遗传物质损伤可分为基因突变、染色体畸变和基因组突变3大类。目前已经建立了200多种遗传毒理学试验,其中最核心的试验是Ames试验和哺乳动物体内染色体损伤试验。除此以外,体外微核(in vitro micronucleus,MNvit)试验和TK基因突变试验(mouse lymphoma assay,MLA)也是较常用的遗传毒理学方法。MNvit试验是一种以检测细胞分裂间期细胞中细胞微核(micronucleus,MN)来判定遗传毒性的测试系统。这项试验可以检测在暴露于受试物期间或者之后的一段时间内染色体损伤的情况[1 – 2]。TK MLA是一项在国际上广泛采用的致突变试验。该方法主要检测TK基因座受化学物影响的程度。正常情况下,没有发生突变的细胞在三氟胸苷的培养基中不能生长,而突变的细胞则不受影响。除MNvit试验之外,使用免疫化学标记的着丝粒,使用细胞分裂阻滞剂,或者与着丝粒和端粒杂交探针也可为染色体损伤和微核形成机制提供信息[3 – 4]。本研究参照经合组织(Organization for Economic Cooperation and Development,OECD)化学品测试指南2016[5 – 6],选择相同细胞系,使用MNvit试验和TK MLA方法,评价方法的敏感性,和染发剂的遗传毒性,为遗传毒性试验方法的合理组合方案提供数据支持。
1 材料与方法 1.1 材料MNvit试验和TK MLA使用的细胞系均为小鼠淋巴瘤细胞L5178Y TK +/– clone,购于北京协和医院。试验所用试剂为1640培养基、马血清、青/链霉素溶液均购自美国Hyclone公司;丙酮酸钠、细胞松弛素B(cytoB)、L – 谷氨酰胺(200 mmol)、环磷酰胺、甲磺酸甲酯(methyl methanesulfonate,MMS)、Giemsa染液均购自美国Sigma公司,丝裂霉素购自日本Kyowa Hakko Kogyo公司。丙酮酸钠、三氟胸苷、胸苷嘧啶、次黄嘌呤、氨甲喋呤、甘氨酸均购自美国Sigma公司。样品1、2、3均为市售的染发剂。
1.2 方法 1.2.1 MNvit试验细胞剂量设计依据OECD操作指南进行[7]。通过预试验来确定细胞的染毒剂量。体外微核试验细胞毒性的确定:当使用cytoB时,使用复制指数(replication index,RI)来确定细胞毒性,细胞毒性的最大浓度为45 ± 5 %,RI的计算公式如下:RI = [(双核细胞数 + 多核细胞数 × 2)/受试物组总细胞数]/[(双核细胞数 + 多核细胞数 × 2)/对照组总细胞数] × 100。
1.2.2 TK MLA剂量设计按照依据OECD操作指南进行[8]。由于L5178Y细胞有着稳定的自发突变,所以首先要进行自发突变的清除。将对数生长的细胞加入1 % THMG(胸腺嘧啶(thymine)、次黄嘌呤(hypoxanthine)、氨甲喋呤(methotrexate)和甘氨酸(glycine))的完全培养基中培养24 h。后转入含1 % THG(胸腺嘧啶、次黄嘌呤和甘氨酸)的完全培养基中培养继续培养48 h。然后在含有10 % 的1640培养基中培养至对数生长期。受试物的最高剂量为细胞相对存活率或相对细胞总生长情况应为10 %~20 %(不应 < 10 %)。
1.2.3 MNvit试验正式试验共设5个受试物组,1个阴性对照及1个阳性对照组。使用处于对数生长期的细胞,受试物用不含血清的1640培养基配制。浓度的设置是根据预实验毒性结果来确定的。样品1、2 和3有S9(经多氯联苯有道后的大鼠肝匀浆上清液提取后与0.4 mol/L的MgCl2,1.65 mol/L的KCl以及葡萄糖 – 6 – 磷酸和辅酶Ⅱ的混合物)存在的情况下最高浓度分别为4 000、400 和 400 μg/mL。样品1、2和3没有S 9存在的情况下最高浓度分别为2 000、100和200 μg/mL。加入受试物后培养4 h后离心用D-hanks液洗细胞,再加入cyto B(终浓度为4 μg/mL)。用含10 %马血清的1640培养2个细胞周期(大约22 h)。有S9存在的情况下阳性对照选用环磷酰胺(cyclophosphamide, ,CP,4 μg/mL),没有S9的情况下阳性对照选MMS(30 μg/mL)。收获细胞,离心后去上清,然后甲醇与冰醋酸液按照3: 1比例进行固定。空气干燥,吉姆萨染液染色。
1.2.4 TK MLA正式试验在整个实验中要保持细胞密度在2 × 105个/mL。受试物的剂量设计根据预试验结果而定。最终选择的试验剂量同MNvit试验。样品1、2和3有S9 存在的情况下最高浓度分别为4 000、400和400 μg/mL。样品1、2和3没有S9 存在的情况下最高浓度分别为2 000、100 和200 μg/mL。加入受试物37 ℃培养4 h,离心去上清。取细胞梯度稀释接种于96孔板,每孔1.6个细胞,培养12 d计数集落形成数即第0 d平板接种效率(plating efficiency,PE0)。接着处理的细胞在第2 d制作PE2测试平板和TFT拮抗测试平板。TFT板接种2 × 103个/孔,终浓度为3 μg/mL。培养液马血清含量均为20 %。培养12 d后计数集落数。计算突变频率(mutant frequency,MF)。
1.2.5 体内微核试验由北京华阜康生物科技股份有限公司提供昆明种小白鼠[许可证号:SCXK(京)2014 – 0004],SPF级,体重 25~30 g。受试样品剂量根据急性经口毒性试验得到的LD 50为5 000 mg/kg体重(雌、雄相同),实验剂量设为1 250、2 500和5 000 mg/kg。分别取样品1 250、2 500和5 000 mg加水20 mL,按0.2 mL/10 g体重计算染毒量,即得剂量为1 250、2 500和5 000 mg/kg体重。采用30 h 2次经口灌胃染毒法。另设阴性对照组(蒸馏水)和CP阳性物对照组。雌、雄动物每组各5只。第2次染毒后6 h脱颈处死动物,取胸骨骨髓用小牛血清稀释涂片,Giemsa染色。在光学显微镜下,每只动物计数1 000个嗜多染红细胞,微核率以含微核的嗜多染红细胞千分率计。
1.3 统计分析MNvit采用SPSS 12.0软件对微核率进行χ2检验,以α = 0.05为检验水准。TK MLA阳性判定结果为受试物组的MF较对照组有2倍增加即可判定为阳性。
2 结 果 2.1 样品的细胞毒性试验结果(图1)
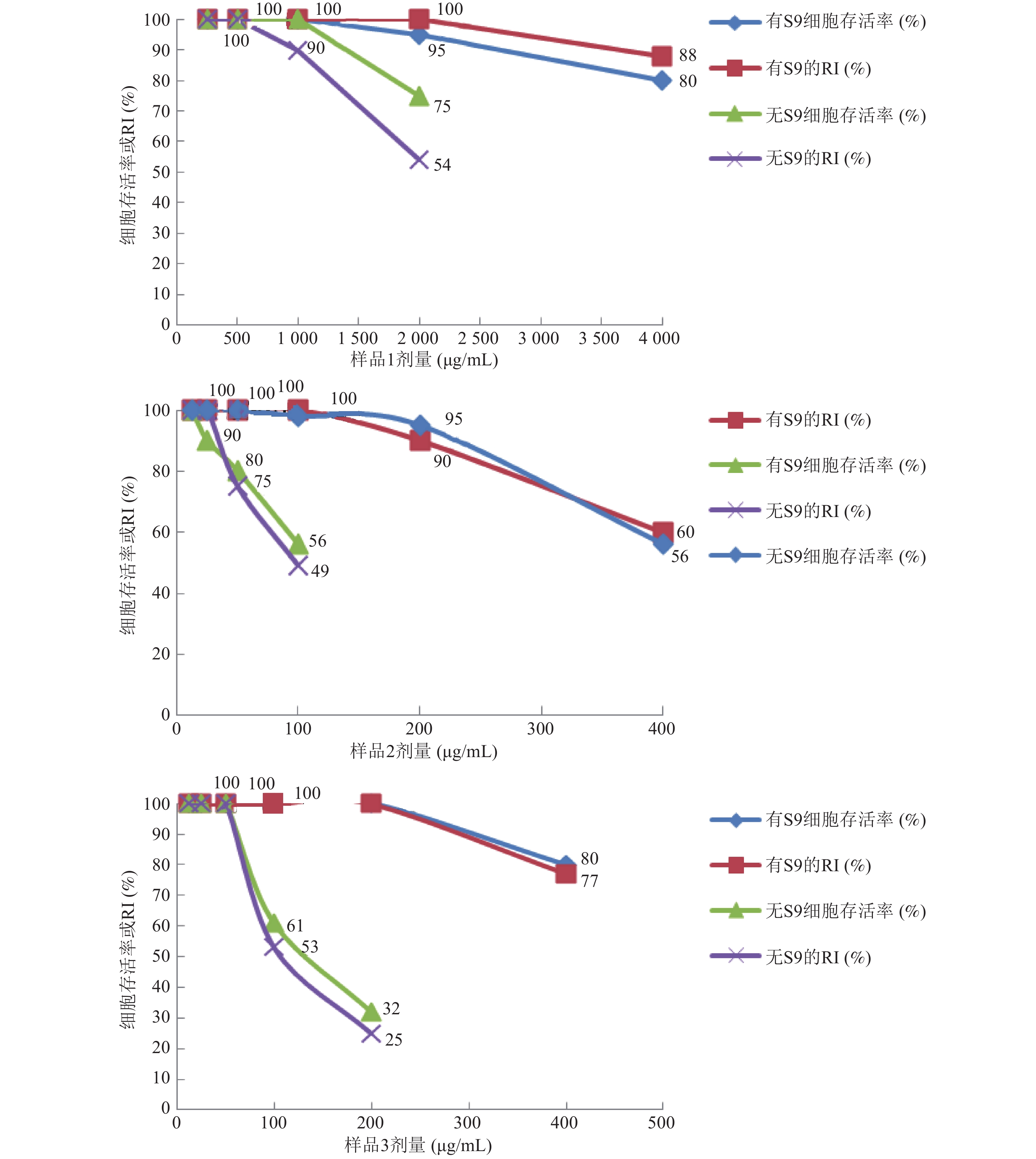
|
注:MNvit试验细胞毒性用RI计算;TK MLA细胞毒性用细胞存活率计算。 图 1 3个样品的细胞毒性结果 |
图1所示,2种试验方法在有代谢活化系统条件下,细胞的存活率或RI均高于无代谢活化系统存在。有代谢活化系统情况下,样品1最高剂量为4 000 μg/mL,样品2最高剂量为400 μg/mL,样品3的最高剂量为400 μg/mL。无代谢活化系统条件下样品1的细胞最高剂量为2 000 μg/mL;样品2的最高剂量为100 μg/mL;样品3的细胞最高剂量为200 μg/mL。
2.2 样品MNvit试验与TK MLA的结果(表1)| 表 1 样品1、2和3 MNvit与TK MLA结果 |
表1所示,样品1在有活化系统存在的情况下,MNvit试验从2 000 μg/mL开始与对照组比较差异显著(P < 0.05),而TK MLA则从最低剂量组1 000 μg/mL开始与对照组比较具有显著性差异( P < 0.05)。在无代谢活化系统存在的条件2种实验方法均从最低剂量足开始与对照组比较差异显著并具有剂量-反应关系。2种方法均判定为样品1为致突变性阳性。样品2在有活化系统存在的情况下,MNvit试验是在最高剂量组400 μg/mL与对照组比较差异显著( P < 0.05),而TK MLA则从最低剂量组100 μg/mL开始与对照组比较差异显著( P < 0.05)。在无代谢活化系统存在的条件下2种方法均是在第2个剂量组25 μg/mL开始与对照组有显著性差异( P < 0.05)。最终2种方法均判定为样品2致突变性阳性。样品3在有活化系统存在的情况下,MNvit试验并没有出现阳性结果,与对照组比较无显著性差异( P > 0.05),而TK MLA则从最低剂量组100 μg/mL开始与对照组比较差异显著( P < 0.05)。在无代谢活化系统存在的条件下, MNvit试验从100 μg/mL开始出现显著性差异,而TK MLA更早一些,在50 μg/mL剂量组开始了与对照组的显著性差异( P < 0.05)。最终2种方法均判定为样品3致突变性阳性。
2.3 样品的体内细胞微核试验(表2)| 表 2 样品3的小鼠体内微核试验结果(n = 5) |
3种样品的体内微核试验均为阴性,与对照组比较无显著性差异,判定为3个样品体内微核试验阴性。
3 讨 论染发剂根据所使用的染料、剂型以及使用方法等可分多种,包括氧化染发剂、非氧化染发剂、脱色脱染剂、酸性染发料、头发着色料等。染发剂除了含有重金属之外,还含有对苯二胺、邻苯二胺等多种有害物质。有报道指出苯胺类衍生物中有较多具有致突变性[9]。评价染发剂的遗传毒性试验除了Ames试验、染色体畸变试验之外,还包括体内外微核试验和TK MLA等。
MNvit试验应用很广,可用于辐射损伤、辐射防护、化学诱变剂、新药试验、食品添加剂的安全评价,以及染色体遗传疾病和癌症前期诊断等各个方面。本研究中的MNvit试验过程中使用了细胞松弛素B,该物质是一种胞质分裂阻断剂,可以使细胞中断在双核细胞阶段,用双核细胞中的微核率评价化学物的遗传损伤作用[10 – 11]。TK MLA主要用于可能的哺乳动物致突变物和致癌物的筛检。很多经过此试验得出阳性结果的物质都是致癌物。很多证据证明TK MLA为阴性的致癌物可能是通过其他途径或非遗传毒性机制发挥作用的[8]。MNvit试验可以使用多种细胞系,其中L5178Y是其中的一种细胞系。OECD指南中指出,应用该细胞系已经得到了验证,试验结果可靠[6]。但是由于CytoB的存在,可能会对细胞生长产生一定影响。在本试验研究中,细胞生长情况良好,对试验的顺利进行未有影响。由于本研究是比较2种方法的一致性,因此选用相同的细胞系和相同的试验剂量,保证试验结果的一致性研究数据可靠。
本研究中选择了相同的细胞系L5178Y细胞,检测相同的受试物,使用2种试验方法,完全按照OECD操作指南规范进行,对最终的实验结果进行比对。结果提示,在实验结果上具有很好的一致性,但试验过程中还是存在着差异。差异主要体现在以下几个方面:(1)由于2种方法的细胞毒性的最高浓度的设定依据不同,因此在试验过程中的受试物的剂量设计稍有不同。在有代谢活化系统存在的情况下,3种样品的最高剂量及各剂量相同;而在无代谢活化系统存在的情况下,TK MLA的最高剂量均高于MNvit试验的剂量。在本试验当中为了比较2种试验方法结果上的差异,因此将试验浓度选择在同一个剂量水平。(2)样品1和2在2种试验方法的结果一致。结果差异较大的体现在样品3中。样品3在MNvit试验中无S9存在的条件下未出现阳性结果,而TK MLA中受试物组与对照组比较具有显著性差异。(3)在有代谢外活化系统S9存在的条件下,2种试验方法在反应敏感性上有差异, TK MLA比MNvit试验敏感性高。本研究中还进行了3种样品的体内微核试验工作,最终的结果显示3种样品的体内微核试验结果均为阴性。本研究结果提示,3种样品的MNvit试验和TK MLA结果为阳性,而体内微核试验结果为阴性,哺乳动物体内外遗传毒性结果完全不同。近年来相关的体内外微核试验结果对比也证实了这点[12]。体外哺乳动物细胞遗传毒性试验假阳性率高的不足引起了毒理学研究者的关注。影响哺乳动物体外遗传毒性试验结果准确性的因素不仅与代谢活化系统、细胞稳定性、培养基、细胞毒性检测方法和评价标准等有关外[13 – 14],p53基因状态对结果判定有着重要的影响。以往的研究中提示了体外哺乳动物细胞遗传毒性试验假阳性率高,可能原因之一是啮齿类动物细胞系的p53基因为突变型,即p53基因功能缺陷。亦有观点认为,p53基因功能不同的细胞系不影响MNvit试验结果的判定[15]。有研究指出,随着细胞传代次数的增加,体外微核率有上升趋势[16]。有研究使用流式细胞仪进行MNvit试验[17],其具有有高效、准确、客观及操作简单等优势。在本试验中出现的MNvit试验呈阳性而体内微核试验为阴性,可能的原因有:(1)p53基因为突变型,即p53基因功能缺陷。L5178Y细胞为突变型,而p53野生型由于基因功能完整,对遗传损伤具有保护作用。因此,本试验MNvit试验出现假阳性率会增加。(2)MNvit试验由于是添加的代谢活化系统,与体内试验比较,代谢能力受到细胞状态,代谢系统活性等方面的影响,MNvit试验往往更灵敏,也增加了MNvit试验的假阳性率。(3)体外试验由于属于离体培养,细胞仅能选择一种,而体内试验是多系统多细胞共同参与的一个代谢过程,因此,体外试验代替体内试验需要多方面优化,排除干扰因素,尽量更完整的模拟体内的过程才能更加接近体内试验结果。(4)本试验中还涉及到MNvit试验的人工阅片,该过程中需要计数双核细胞中的微核率,因此需要1个人阅片以减少人为对结果的影响。因此,任何一种体外试验方法对体内试验方法的替代都需要进行多次验证,严格控制试验过程中的混杂因素,才能保证结果更接近体内试验的结果。化学物的遗传毒性评价过程中需要选择适当的试验组合,控制或排除混杂因素,增加试验方法的可靠性,降低试验的假阳性率,这也是下一步本研究要努力的方向。
| [1] | Kirsch-Volders M. Towards a validation of the micronucleus test[J]. Mutation Res, 1997, 392(1 – 2): 1–4. DOI:10.1016/S0165-1218(97)00039-6 |
| [2] | Parry JM, Sors A. The detection and assessment of the aneugenic potential of environmental chemicals: the European Community Aneuploidy Project[J]. Mutation Res, 1993, 287(1): 3–15. DOI:10.1016/0027-5107(93)90140-B |
| [3] | Fenech M. Cytokinesis-block micronucleus cytome assay[J]. Nature Protocols, 2007, 2(5): 1084–1104. DOI:10.1038/nprot.2007.77 |
| [4] | Marshall RR, Murphy M, Kirkland DJ, et al. Fluorescence in situ hybridisation (FISH) with chromosome-specific centromeric probes: a sensitive method to detect aneuploidy[J]. Mutation Res, 1996, 372(2): 233–245. DOI:10.1016/S0027-5107(96)00143-1 |
| [5] | United States Environmental Protection Agency. OECD guideline for the testing of chemicals. In vitro mammalian cell gene mutation tests using the thymidine kinase gene[S].2016. |
| [6] | United States Environmental Protection Agency. OECD guideline for the testing of chemicals. In vitro mammalian cell micronucleus test[S]. 2016. |
| [7] | United States Environmental Protection Agency. In vitro mammalian cell micronucleus test. Test guideline No.487, OECD guideline for the testing of chemicals[S]. 2010. |
| [8] | United States Environmental Protection Agency. In vitro mammalian cell gene mutation test. Test guideline No.476, OECD guideline for the testing of chemicals[S]. 2010. |
| [9] | 刘清, 郭宝岚, 李立, 等. 染发剂的体外染色体畸变实验[J]. 环境与健康杂志, 2006, 23(3): 233–234. DOI:10.3969/j.issn.1001-5914.2006.03.013 |
| [10] | 王翀, 顾雯, 李立, 等. 市售染发剂的体外微核试验[J]. 毒理学杂志, 2014, 28(2): 131–133. |
| [11] | Aardema M. Report from the In Vitro Micronucleus Assay Working Group [J]. Mutat Res, 2015, 35(3): 167–172. |
| [12] | 徐永俊, 石莹, 王超, 等. 氧化型染发剂遗传毒性的体内外微核试验[J]. 环境与健康杂志, 2016, 33(12): 1079–1081. |
| [13] | Ku WW, Bigger A, Brambilla G, et al. Strategy for genotoxicity testing – metabolic considerations[J]. Mutat Res, 2007, 627(1): 59–77. DOI:10.1016/j.mrgentox.2006.10.004 |
| [14] | KjrkJand D, PfuhJer S, Tweats D, et al. How to reduce faIse positive resuIts when undertaking in vitro genotoxicity testing and thus avoid unnecessary follow-up animal tests: Report of an ECVAM Workshop [J]. Mutat Res, 2007, 628(1): 31–55. DOI:10.1016/j.mrgentox.2006.11.008 |
| [15] | 欧红梅, 周长慧, 涂宏刚, 等. p53基因状态对体外微核试验结果影响的研究进展[J]. 中国药理学与毒理学杂志, 2015, 29(1): 170–173. DOI:10.3867/j.issn.1000-3002.2015.01.027 |
| [16] | 管莹, 高茜. 朱洲海, 等. 体外微核试验重要影响因素研究[J]. 化学与生物工程, 2013, 30(2): 64–66. DOI:10.3969/j.issn.1672-5425.2013.02.016 |
| [17] | 欧红梅, 周长慧, 涂宏刚, 等. 流式细胞术检测体外微核方法的建立[J]. 癌变·畸变·突变, 2015, 27(1): 39–43. DOI:10.3969/j.issn.1004-616x.2015.01.009 |
 2019, Vol. 35
2019, Vol. 35


