2型糖尿病(type 2 diabetes mellitus,T2DM)是糖尿病中最常见的一种形式,2型糖尿病患者约占糖尿病患者总数的90 %~95 %。预计到2030年,全球T2DM患者将增加到4.39亿[1]。遗传、环境以及不合理的饮食和不良生活方式等多重危险因素之间的相互作用,最终导致了T2DM发生发展[2]。治疗T2DM的一线药物虽然有着良好的降糖效果,但可能会引起胃肠道不适、乳酸中毒和维生素B12缺乏等副作用[3],因此,寻找更加安全有效的天然降血糖成分已经成为目前研究热点。表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是绿茶中含量最丰富的儿茶素,约占儿茶素含量的50 %~70 %[4],是一种典型的含8个游离羟基的黄酮 – 3 – 醇酚类化合物 [5]。研究表明,它具有抗氧化、抗癌、抗菌和神经保护功能[6],EGCG能够降血糖、改善胰岛素敏感性及维持稳定的空腹血胰岛素水平,具有一定的治疗糖尿病效果[7 – 8],但其作用机制尚不清楚。胰岛素抵抗是T2DM的主要病理特征,通常被定义为胰岛素作用的靶器官对胰岛素的敏感性和反应性降低,即正常剂量的胰岛素产生低于正常生物学效应的一种状态[9 – 11]。胰岛素抵抗主要发生在肝脏和骨骼肌中,分别表现为肝脏糖异生增加和骨骼肌中葡萄糖转运体4(glucose transporter-4,GLUT4)转运葡萄糖的能力下降[12]。本研究通过观察EGCG对2型糖尿病大鼠胰岛素抵抗的影响及肝脏糖异生关键酶磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)和GLUT4的mRNA和蛋白表达变化,探讨EGCG改善2型糖尿病的机制,旨在为EGCG开发用于糖尿病患者的治疗或辅助治疗提供科学依据。
1 材料与方法 1.1 实验动物雄性SPF级Sprague-Dawley大鼠90只,体重(200 ± 20)g,购自山东省鲁抗制药有限公司,动物生产许可证号:SCXK(鲁)20140007。大鼠饲养于青岛大学公共卫生学院SPF级动物实验室,饲养环境温度(23 ± 2)℃,湿度(55 ± 10)%,12 h/12 h光照黑暗循环,自由摄食饮水。
1.2 主要试剂与仪器普通大鼠颗粒饲料(AIN-93G)、大鼠高脂高糖饲料(山东省鲁抗制药有限公司);链脲佐菌素(streptozotocin,STZ)(上海麦克林生化科技有限公司);柠檬酸缓冲液(北京索莱宝科技有限公司);二甲双胍、EGCG(大连美仑生物技术有限公司);酶联免疫(ELISA)试剂盒(武汉优尔生商贸有限公司)。CX4全自动生化分析仪(美国贝克曼库尔特公司);ELx808酶标仪(西安明克斯检测设备有限公司);DYY-60型电泳仪(北京六一仪器厂);Realplex4型荧光定量PCR仪(美国Eppendorf公司);Nano Photometer Peal P330微量核酸蛋白分析仪(德国Implen公司);UVP凝胶成像系统(美国Thermo公司)。
1.3 动物模型建立及分组处理大鼠适应性喂养1周后随机分为对照组(10只)和造模组(80只)。对照组大鼠食用基础饲料(蛋白质占20 % 以上,脂肪4 %,粗纤维5 %,灰分8 %,水分10 %),造模组大鼠食用在AIN-93G饲料基础上调整的高脂高糖饲料;喂养4周后,2组大鼠隔夜禁食,造模组大鼠经腹腔一次注射剂量为35 mg/kg STZ,对照组大鼠注射等剂量柠檬酸缓冲液;1周后尾静脉取血测定血糖水平,若空腹血糖 > 16.7 mmol/L,则判定T2DM造模成功。剔除未成模和死亡大鼠后,将成模的T2DM大鼠按体重随机分成5组,分别为模型组(蒸馏水)、二甲双胍组(300 mg/kg)、EGCG低、中、高剂量组(25、50、100 mg/kg),每组10只,连续灌胃6周,大鼠自由饮水和进食。6周末,大鼠禁食不禁水12 h,给予3 % 戊巴比妥钠麻醉处死大鼠,腹主动脉取血。室温静置30 min以上,在4 ℃条件下,3 000 r/min离心10 min,留取血清用于生化指标检测;留取肝脏、骨骼肌组织保存于 – 80 ℃冰箱备用。
1.4 指标与方法 1.4.1 大鼠日常行为状况观察及体重测定实验期间每天观察大鼠的皮毛光泽、体型、活动度、反应度、进食和饮水等日常行为状况,每周称重1次,记录大鼠的体重变化情况。
1.4.2 大鼠空腹血糖和胰岛素测定使用全自动生化分析仪测定大鼠空腹葡萄糖水平(FBG),利用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定血清胰岛素(insulin,INS)水平,根据空腹血糖水平和空腹胰岛素水平计算胰岛素敏感性指数(insulin sensitivity index,ISI)和胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)。
1.4.3 大鼠肝脏中PEPCK和骨骼肌中GLUT4 mRNA表达检测采用实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-PCR)法,使用Primer 5.0软件根据各基因的序列信息设计相关引物,使用β-actin作为内参。提取肝脏和骨骼肌中总RNA后,再将RNA逆转录为cDNA。PCR实验扩增条件为:第一步,95 ℃预变性10 min;第二步,95 ℃变性15 s,60 ℃退火并延伸30 s,72 ℃延伸30 s,共40个循环。引物序列为:β-actin,上游引物5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游5′-GACTCATCGTACTCCTGCTTGCTG-3′,扩增长度150 bp;PEPCK,上游引物5′-CCCAGGAAGTGAGGAAGTTTGT-3′,下游5′-GGAGCCGTCGCAGATGTG-3′,扩增长度77 bp;GLUT-4,上游引物5′-CCGGGACACTATACCCTATTCA-3′,下游5′-AGGACCAGTGTCCCAGTCACTC-3,扩增长度138 bp。
1.4.4 大鼠肝脏中PEPCK和骨骼肌中GLUT4蛋白表达检测采用蛋白免疫印迹法(Western blot,WB),取大鼠肝脏和骨骼肌组织,RIPA裂解液提取总蛋白,蛋白变性后使用二喹啉甲酸(bicinchoninic acid, BCA)法测蛋白浓度,取蛋白经十二烷基硫酸钠 – 聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分离后,电转移至聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上,室温下封闭PVDF膜60 min;加入I抗(1 ∶ 1 000)孵育4 ℃过夜;洗膜,加入Ⅱ抗(1 ∶ 10 000)孵育室温1 h。洗膜后电化学发光液(electrogenerated chemiluminescence, ECL)显影,凝胶成像系统成像,用imageJ软件分析蛋白条带灰度值,蛋白表达水平用目的蛋白与内参蛋白灰度比值来表示。
1.5 统计分析采用SPSS 20.0软件进行统计分析,当数据满足正态分布且方差齐时,采用均数 ± 标准差形式进行描述,多组间比较采用单因素方差分析,组间两两比较采用最小显著差法;当数据不满足正态分布或方差不齐时,采用中位数及四分位数间距的形式进行统计描述,采用Kruskal-Wallis检验进行统计推断,以P < 0.05为差异具有统计学意义。
2 结 果 2.1 EGCG对大鼠日常行为状况及体重影响(图1)
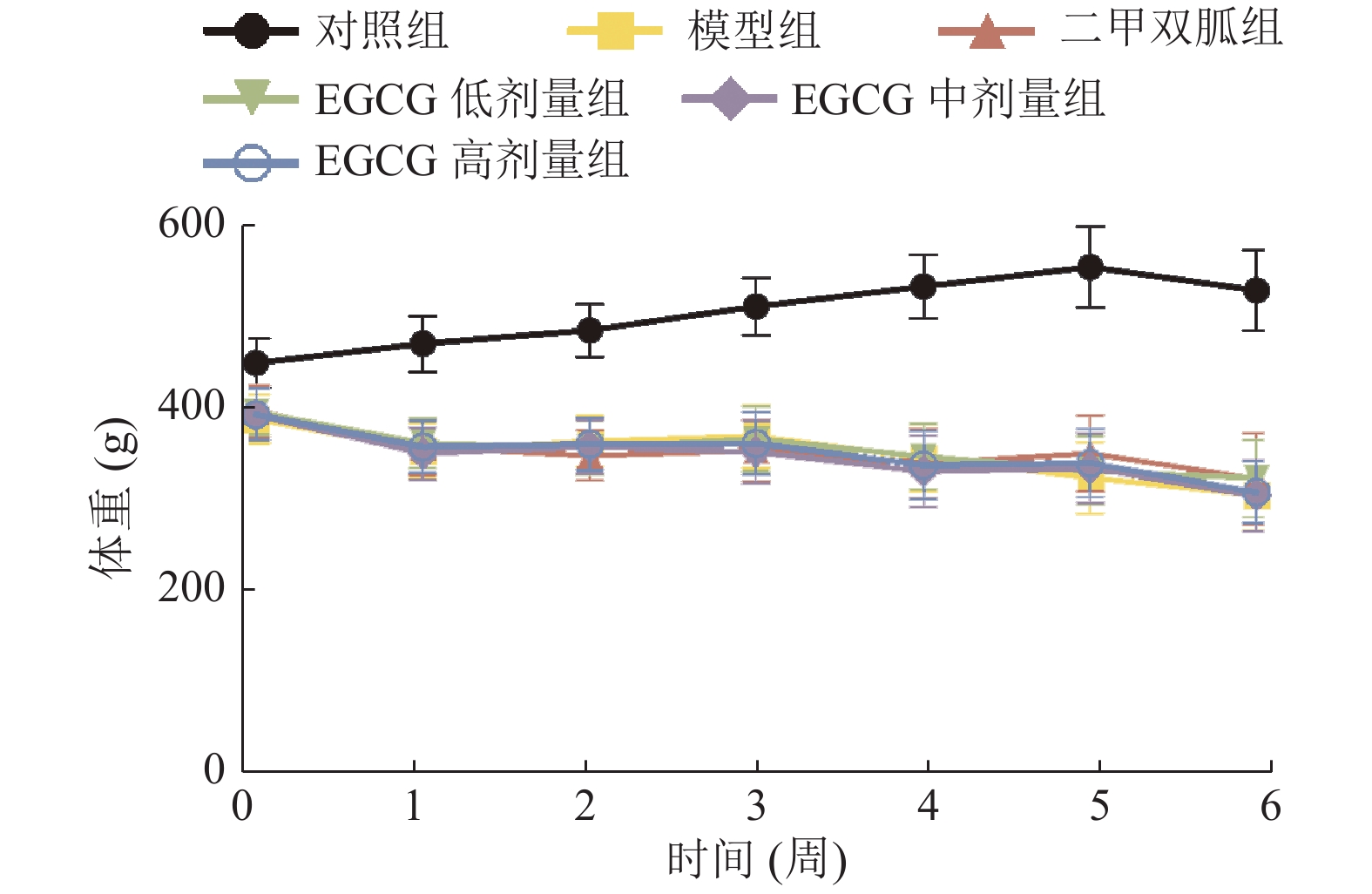
|
图 1 EGCG对大鼠体重影响 |
对照组大鼠皮毛光泽、体型及日常活动正常,反应灵敏;模型组及EGCG低剂量组大鼠皮毛光泽差、体型消瘦、活动度低、反应迟钝;二甲双胍组大鼠皮毛光泽稍差、体型消瘦、活动度稍低、反应稍迟;EGCG中、高剂量组大鼠皮毛光泽较差、体型消瘦,活动度和反应度介于模型组和二甲双胍组之间。与对照组比较,其余各组大鼠体重均明显下降(P < 0.05)。
2.2 EGCG对大鼠血糖、胰岛素、ISI和HOMA-IR影响(表1)|
表 1 EGCG对大鼠空腹血糖、INS、ISI和HOMA-IR影响(n = 10, |
结果显示,与对照组比较,模型组、二甲双胍组、EGCG低、中、高剂量组大鼠空腹血糖、HOMA-IR水平均明显升高,ISI水平明显降低(P < 0.05);与模型组比较,二甲双胍组大鼠空腹血糖、INS、HOMA-IR水平明显下降,ISI水平明显升高( P < 0.05);与模型组比较,EGCG中剂量组大鼠血清INS水平明显下降( P < 0.05);EGCG高剂量组大鼠血清INS、HOMA-IR水平明显下降,ISI水平明显升高( P < 0.05)。
2.3 EGCG对大鼠肝脏PEPCK和骨骼肌GLUT4 mRNA表达影响(表2)|
表 2 EGCG对大鼠肝脏PEPCK和骨骼肌GLUT4 mRNA表达影响(n = 10, |
结果显示,与对照组比较,模型组大鼠肝脏中PEPCK mRNA表达水平明显升高、骨骼肌中mRNA表达水平明显降低(P < 0.05);与模型组比较,EGCG中、高剂量组大鼠肝脏中PEPCK mRNA表达水平均明显降低,EGCG高剂量组大鼠骨骼肌中mRNA表达水平明显升高( P < 0.05)。
2.4 EGCG对大鼠肝脏PEPCK和骨骼肌GLUT4蛋白表达影响(图2,表3)
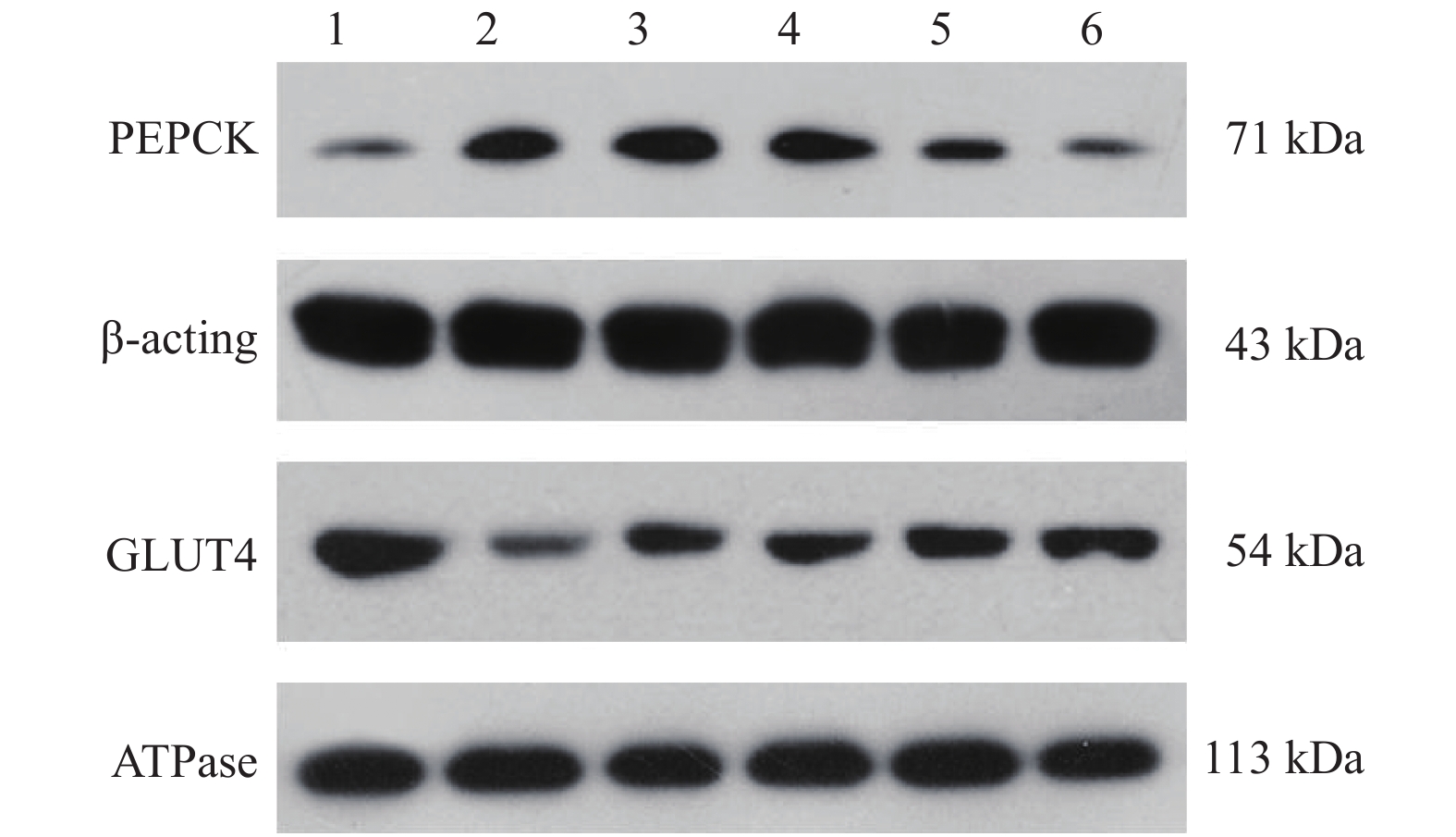
|
注:1 对照组;2 模型组;3 二甲双胍组;4~6 EGCG低、中、高剂量组。 图 2 EGCG对大鼠肝脏PEPCK和骨骼肌GLUT4蛋白表达影响 |
|
表 3 EGCG对大鼠肝脏PEPCK和骨骼肌GLUT4蛋白表达影响(n = 10, |
结果显示,与对照组比较,模型组、EGCG中、低剂量组、二甲双胍组大鼠肝脏中PEPCK蛋白表达均明显升高,骨骼肌中GLUT4蛋白表达均明显降低(P < 0.05);与模型组比较,EGCG中、高剂量组大鼠肝脏PEPCK蛋白表达明显降低,骨骼肌中GLUT4蛋白表达明显升高( P < 0.05)。
3 讨 论2型糖尿病的发展通常与胰腺β细胞功能障碍和各种胰岛素靶组织(如肝脏、肌肉和脂肪细胞)的胰岛素抵抗有关[13]。胰岛素抵抗是指在正常的血浆胰岛素水平下,靶组织不能产生正常的协调降糖反应,包括抑制内源性葡萄糖生成、抑制脂肪分解、阻碍细胞摄取可用的血浆葡萄糖,以及减少净糖原的合成[14]。正常的胰腺β细胞可以通过增加胰岛素分泌或增强β细胞活性来补偿胰岛素抵抗。一旦出现明显的高血糖,胰腺β细胞功能就会逐渐恶化,胰岛素抵抗加剧,形成恶性循环,最终引起多系统损伤[13, 15]。因此,改善糖代谢紊乱、减轻胰岛素抵抗对于2型糖尿病的治疗具有重要意义。
HOMA-IR是流行病学研究中用于评估胰岛素抵抗的常用指标,HOMA-IR数值越高表明个体胰岛素抵抗越严重[16]。ISI可反映机体对胰岛素的敏感性,ISI值越低表明机体胰岛素敏感性越差。本研究采用小剂量STZ腹腔注射结合高脂高糖饮食喂养的方法建立2型糖尿病大鼠模型[17],结果显示,与对照组比较,糖尿病模型组大鼠表现为体重明显减轻,空腹血糖、INS、HOMA-IR水平明显升高,而ISI值明显降低;与模型组比较,EGCG组大鼠空腹血糖、INS、HOMA-IR水平均有不同程度下降,ISI值有所升高。提示,模型组大鼠已经出现胰岛素敏感性下降和胰岛素抵抗现象,而EGCG能够改善胰岛素敏感性、减轻胰岛素抵抗。研究表明,EGCG能够增强机体对胰岛素的敏感性[18]。Anderson等[19]发现茶水提取物中的EGCG使得大鼠附睾的脂肪细胞胰岛素活性上升(17.5 ± 2.3)%。Jang等[20]研究显示,给予小鼠EGCG补充剂(50 mg/kg)10周后,小鼠的胰岛素敏感性有所增强。
PEPCK是糖异生关键酶,胰岛素可以通过磷脂酰肌醇 – 3 – 激酶/丝氨酸蛋白激酶(phosphoinositide 3 kinase/protein kinase B,PI3K/Akt)信号通路下调PEPCK的基因表达,从而减弱糖异生作用,降低血糖 [21]。体外实验显示,EGCG能模拟胰岛素的作用负调控肝癌细胞中PEPCK基因表达,明显减少肝葡萄糖的生成[22 – 24]。GLUT4在调节胰岛素刺激的骨骼肌和脂肪组织的葡萄糖转运中起着关键作用,是预防高血糖的靶分子[25]。研究表明EGCG可以通过PI3K/Akt信号通路增强骨骼肌细胞对葡萄糖的摄取,促进GLUT4转运至细胞膜[26]。也有动物实验显示,单次口服75 mg/kg EGCG可促进大鼠骨骼肌中GLUT4易位[27]。本研究结果显示,与模型组比较,中、高剂量EGCG组大鼠肝脏中PEPCK mRNA和蛋白表达水平明显降低,EGCG高剂量组大鼠骨骼肌中GLUT4 mRNA和蛋白表达水平均明显升高。提示,EGCG可能通过增强PI3K/Akt通路信号传导来减弱肝脏糖异生功能并增加葡萄糖的转运,从而改善胰岛素抵抗。
综上所述,EGCG能够在一定程度上改善2型糖尿病大鼠的胰岛素抵抗,其机制可能与EGCG增强胰岛素敏感性、下调PEPCK的表达抑制肝脏糖异生作用以及上调骨骼肌中GLUT4的表达增加肌肉组织对葡萄糖的摄取有关。
| [1] | Wu Y, Ding Y, Tanaka Y, et al. Risk factors contributing to type 2 diabetes and recent advances in the treatment and prevention[J]. Int J Med Sci, 2014, 11(11): 1185–1200. DOI:10.7150/ijms.10001 |
| [2] | Cuschieri S. Type 2 diabetes – an unresolved disease across centuries contributing to a public health emergency[J]. Diabetes Metab Syndr, 2019, 13(1): 450–453. DOI:10.1016/j.dsx.2018.11.010 |
| [3] | Sanchez-Rangel E, Inzucchi SE. Metformin: clinical use in type 2 diabetes[J]. Diabetologia, 2017, 60(9): 1586–1593. DOI:10.1007/s00125-017-4336-x |
| [4] | Khan N, Mukhtar H. Tea polyphenols in promotion of human health[J]. Nutrients, 2018, 11(1). |
| [5] | Gan RY, Li HB, Sui ZQ, et al. Absorption, metabolism, anti-cancer effect and molecular targets of epigallocatechin gallate (EGCG): an updated review[J]. Crit Rev Food Sci Nutr, 2018, 58(6): 924–941. DOI:10.1080/10408398.2016.1231168 |
| [6] | Chakrawarti L, Agrawal R, Dang S, et al. Therapeutic effects of EGCG: a patent review[J]. Expert Opin Ther Pat, 2016, 26(8): 907–916. DOI:10.1080/13543776.2016.1203419 |
| [7] | Li Y, Wang C, Huai Q, et al. Effects of tea or tea extract on metabolic profiles in patients with type 2 diabetes mellitus: a meta-analysis of ten randomized controlled trials[J]. Diabetes Metab Res Rev, 2016, 32(1): 2–10. DOI:10.1002/dmrr.v32.1 |
| [8] | 张灵枝, 邓旭铭, 潘顺顺, 等. EGCG防治糖尿病作用及机制研究进展[J]. 华南农业大学学报, 2017, 38(5): 50–55. DOI:10.7671/j.issn.1001-411X.2017.05.009 |
| [9] | 曹梅, 韩睿. EGCG与胰岛素抵抗[J]. 医药前沿, 2014(25): 38–39. DOI:10.3969/j.issn.2095-1752.2014.25.023 |
| [10] | Sampath KA, Maiya AG, Shastry BA, et al. Exercise and insulin resistance in type 2 diabetes mellitus: a systematic review and meta-analysis[J]. Ann Phys Rehabil Med, 2019, 62(2): 98–103. DOI:10.1016/j.rehab.2018.11.001 |
| [11] | Chakraborty C, Doss CG, Bandyopadhyay S, et al. Influence of miRNA in insulin signaling pathway and insulin resistance: micro-molecules with a major role in type-2 diabetes[J]. Wiley Interdiscip Rev RNA, 2014, 5(5): 697–712. DOI:10.1002/wrna.1240 |
| [12] | Basu R, Basu A, Johnson CM, et al. Insulin dose-response curves for stimulation of splanchnic glucose uptake and suppression of endogenous glucose production differ in nondiabetic humans and are abnormal in people with type 2 diabetes[J]. Diabetes, 2004, 53(8): 2042–2050. DOI:10.2337/diabetes.53.8.2042 |
| [13] | Kaneto H. Pathophysiology of type 2 diabetes mellitus[J]. Nihon Rinsho, 2015, 73(12): 2003–2007. |
| [14] | Petersen MC, Shulman GI. Mechanisms of insulin action and insulin resistance[J]. Physiol Rev, 2018, 98(4): 2133–2223. DOI:10.1152/physrev.00063.2017 |
| [15] | 万丽梅, 刘赫. 胰岛素抵抗的现代看法及分类探讨[J]. 实用糖尿病杂志, 2014, 10(3): 4–6. |
| [16] | Antunes LC, Elkfury JL, Jornada MN, et al. Validation of HOMA-IR in a model of insulin-resistance induced by a high-fat diet in Wistar rats[J]. Arch Endocrinol Metab, 2016, 60(2): 138–142. DOI:10.1590/2359-3997000000169 |
| [17] | 郭毅炜, 申琪, 管芳圆, 等. 稻谷胚芽对糖尿病大鼠糖代谢紊乱的改善作用[J]. 环境与职业医学, 2019, 36(2): 99–105. DOI:10.13213/j.cnki.jeom.2019.18424 |
| [18] | 高媛圆, 毛立民, 徐平, 等. 茶多酚防治2型糖尿病的分子机理研究进展[J]. 茶叶科学, 2015(3): 239–247. DOI:10.3969/j.issn.1000-369X.2015.03.007 |
| [19] | Anderson RA, Polansky MM. Tea enhances insulin activity[J]. Journal of Agricultural and Food Chemistry, 2002, 50(24): 7182–7186. DOI:10.1021/jf020514c |
| [20] | Jang HJ, Ridgeway SD, Kim JA. Effects of the green tea polyphenol epigallocatechin-3-gallate on high-fat diet-induced insulin resistance and endothelial dysfunction[J]. Am J Physiol Endocrinol Metab, 2013, 305(12): E1444–E1451. DOI:10.1152/ajpendo.00434.2013 |
| [21] | Smith GC, Turner N. FOX01 is the headline Akt regulating hepatic glucose metabolism[J]. Endocrinology, 2017, 158(8): 2436–2438. DOI:10.1210/en.2017-00525 |
| [22] | Wolfram S, Raederstorff D, Preller M, et al. Epigallocatechin gallate supplementation alleviates diabetes in rodents[J]. J Nutr, 2006, 136(10): 2512–2518. DOI:10.1093/jn/136.10.2512 |
| [23] | Waltner-Law ME, Wang XL, Law BK, et al. Epigallocatechin gallate, a constituent of green tea, represses hepatic glucose production[J]. J Biol Chem, 2002, 277(38): 34933–34940. DOI:10.1074/jbc.M204672200 |
| [24] | Collins QF, Liu HY, Pi J, et al. Epigallocatechin-3-gallate (EGCG), a green tea polyphenol, suppresses hepatic gluconeogenesis through 5′-AMP-activated protein kinase[J]. J Biol Chem, 2007, 282(41): 30143–30149. DOI:10.1074/jbc.M702390200 |
| [25] | Ueda-Wakagi M, Hayashibara K, Nagano T, et al. Epigallocatechin gallate induces GLUT4 translocation in skeletal muscle through both PI3K- and AMPK-dependent pathways[J]. Food Funct, 2018, 9(8): 4223–4233. DOI:10.1039/C8FO00807H |
| [26] | Xu L, Li W, Chen Z, et al. Inhibitory effect of epigallocatechin-3-O-gallate on alpha-glucosidase and its hypoglycemic effect via targeting PI3K/AKT signaling pathway in L6 skeletal muscle cells[J]. Int J Biol Macromol, 2019, 125: 605–611. DOI:10.1016/j.ijbiomac.2018.12.064 |
| [27] | Ueda M, Nishiumi S, Nagayasu H, et al. Epigallocatechin gallate promotes GLUT4 translocation in skeletal muscle[J]. Biochem Biophys Res Commun, 2008, 377(1): 286–290. DOI:10.1016/j.bbrc.2008.09.128 |
 2019, Vol. 35
2019, Vol. 35


