2. 南华大学附属第二医院急诊科;
3. 南华大学附属南华医院重症医学科
急性心肌梗死(acute myocardial infarction,AMI)发病率与死亡率逐年升高,是造成心血管疾病患者死亡的重要原因[1]。AMI的发病机制与遗传、炎症、氧化应激、细胞凋亡等相关,多种细胞因子在AMI病理进程中发挥重要作用。研究发现miR-34a与心肌损伤的发生密切相关,能够通过下调靶基因NAD – 依赖性去乙酰化酶sirtuin-1(NAD-dependent deacetylase sirtuin-1,sirt1)诱导心肌细胞凋亡 [2]。p53属于抑癌基因,可与miR-34a形成正反馈调控细胞增殖、凋亡,激活miR-34a/sirt1/p53信号可诱导耳蜗毛细胞凋亡[3]。然而miR-34a/sirt1/p53在心肌细胞凋亡中的作用目前尚不清楚。川芎嗪属于中药川芎有效成分,在心肌缺血再灌注损伤中具有一定的保护作用,能够改善AMI患者术后心功能,缓解心室重构[4],然而其具体保护机制尚不清楚。本研究采用左冠状动脉前降支结扎法复制AMI大鼠模型,观察川芎嗪对AMI大鼠的心肌保护作用,探讨可能作用机制,旨在为川芎嗪临床应用提供理论依据。结果报告如下。
1 材料与方法 1.1 实验动物105只SPF级SD雄性大鼠,8周龄,体重200~220 g,由中国医学科学院医学实验动物研究所提供,动物许可证号:SYXK(京)2018 – 0036,统一在恒温(23~25 ℃),通风良好、昼夜交替12 h光照的环境中饲养。本研究经南华大学附属第二医院动物伦理委员会批准同意。
1.2 主要试剂与仪器川芎嗪注射液(批号20180307)(吉林四长制药公司);阿托伐他汀(atorvastatin calcium tablets,ACT)(批号201502)(北京嘉林药业股份有限公司);原位末端凋亡(TUNEL)检测试剂盒、4′, 6 –二脒基 – 2 – 苯基吲哚(4′, 6-diamidino-2-phenylindole,DAPI)(英国Abcam公司);总RNA提取试剂(total RNA extractor,Trizol)(美国Sigma-Aldrich公司);聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)测定试剂盒、2, 3, 5 – 氯化三苯基四氮唑(triphenyl tetrazolium chloride, TTC)染液(北京Solarbio公司);放射免疫沉淀分析(radio immunoprecipitation assay,RIPA)蛋白裂解液、苏木精 – 伊红(hematoxylin-eosin staining,HE)染色试剂盒(上海碧云天生物技术研究所);肿瘤坏死因子 – α(tumor necrosis factor-α,TNF-α)、单核细胞趋化蛋白 – 1(monocyte chemotactic protein 1,MCP-1)酶联免疫试剂盒(南京建成生物工程研究所);鼠抗沉默信息调节因子2相关酶1(sirtuin 1, sirt1)、p53、B淋巴细胞瘤 – 2基因(B-cell lymphoma-2,Bcl-2)抗体(美国CST公司);鼠抗Bax、cleaved-caspase3、β-actin(英国Abcam公司);免疫球蛋白G(immuno-globulin G,IgG)二抗(美国R&D公司)。CKX41倒置显微镜(日本Olympus公司);凝胶成像系统(美国UVP公司);CM3050S切片机(美国Buffalo Grove公司)。
1.3 动物模型制备随机选取90只大鼠参照文献法[5]制备AMI模型,腹腔内注射40 mg/kg戊巴比妥钠充分麻醉大鼠,仰卧固定于操作台,于左侧第4、5肋间切开胸腔,打开心包,采用0号无菌丝线结扎左冠状动脉前降支根部,当结扎区域左心室颜色由红色变为白色时,心电图显示ST段抬高代表结扎成功。结扎完成后还纳心脏,缝合切口。另选15只大鼠作为假手术组,仅暴露冠状动脉不结扎,其余操作同模型组。造模结束后为预防感染,每只大鼠肌肉注射8万单位青霉素。造模过程中死亡15只,造模成功率为83.33 %。
1.4 分组与处理将75只模型制备成功大鼠随机分为模型组、川芎嗪低、中、高剂量组(120、240、360 mg/kg[6])、阳性对照组(阿托伐他汀8 mg/kg),每组15只。川芎嗪组大鼠造模后24 h腹腔注射川芎嗪注射液,阿托伐他汀组腹腔注射ACT[7],假手术、AMI组大鼠均注射等量生理盐水,连续4周。心室功能测定结束后,采集大鼠1 mL尾静脉血,3 000 r/min离心5 min,于 – 20 ℃保留上清待测。各组随机选取6只大鼠充分麻醉,分离颈总动脉后逆行注射1 mL 3 % 伊文思蓝,处死后取心脏,于 – 80 ℃保存用于TTC染色;处死剩余9只大鼠,摘除心肌组织,一部分用4 % 多聚甲醛中固定,另一部分组织置于液氮中保存。
1.5 指标与方法 1.5.1 大鼠心室功能测定末次给药后,麻醉大鼠后固定于手术台,采用超声检测仪在二维模式下获取左心室长轴图像,检测并记录左心室舒张/收缩末期内径(left ventricular end diastolic dimension/systolic dimension, LVEDD/LVESD)、左室舒张期后壁厚度(left ventricular posterior wall diameter at diastole/systole,LVPWDd/LVPWDs)、左室缩短分数(left ventricular fractional shortening,LVFS)、左室射血分数(left ventricular ejection fraction,LVEF),连续检测3次心脏周期,计算平均值。
1.5.2 大鼠心肌组织病理学观察常规制备心肌组织石蜡切片,烘烤后脱蜡脱水,进行HE染色,封片后置于倒置显微镜下观察组织形态学变化。根据心肌纤维化情况对心肌组织损伤程度进行评定,无心肌纤维化为0分,纤维化比例 < 25 % 记为1分,比例在25 % ~50 % 记为2分,51 % ~75 % 记为3分,> 75 % 记为4分。
1.5.3 心肌细胞凋亡情况检测采用Tunel染色法,心肌组织切片脱蜡、水合后添加20 μg/mL蛋白酶K溶液孵育15 min,清洗后加入TUNEL反应液孵育1 h,荧光显微镜下观察细胞染色情况,拍照保存后利用Image-J软件定量评估心肌细胞凋亡率,细胞凋亡率(%) = 染色细胞数目/总细胞数 × 100 %。
1.5.4 miR-34a mRNA通路表达检测采用实时定量聚合酶链反应(qRT-PCR),采用Trizol法提取组织RNA,根据试剂盒逆转录为cDNA,qRT-PCR反应体系:10 μL SYBR反应液,1 μL cDNA,上下游引物各0.4 μL,补充ddH2O至20 μL。反应程序:95 ℃ 3 min,95 ℃ 45 s,60 ℃ 45 s,72 ℃ 60 s,35个循环。以U6为内参基因,采用2– ΔΔCt法定量分析miR-34a mRNA相对表达量。
1.5.5 心肌组织中凋亡相关蛋白表达检测采用免疫印迹法,取适量心肌组织,用RIPA裂解液裂解后抽提总蛋白,采用BCA试剂盒对蛋白含量进行测定,蛋白变性后用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离目的蛋白,电转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜后,用脱脂奶粉封闭2 h,添加鼠抗sirt1、p53、Bax、Bcl-2、cleaved-caspase3一抗(1 : 300),4 ℃条件下过夜孵育,次日清洗后添加IgG二抗(1 : 3 000),孵育1 h后清洗,采用电化学发光法(electrochemiluminescence,ECL)曝光显色,用Image软件定量分析蛋白相对表达水平。
1.6 统计分析计量资料采用
|
表 1 川芎嗪对大鼠心脏功能影响(
|
与假手术组比较,模型组大鼠LVEDD、LVESD升高,LVPWDs、LVEF、LVFS降低,差异有统计学意义(P < 0.05);与模型组比较,各剂量川芎嗪组、阳性对照组大鼠LVEDD、LVESD降低,LVPWDs、LVEF、LVFS升高( P < 0.05);呈一定剂量效应关系。
2.2 川芎嗪对大鼠血清TNF-α、MCP-1水平影响(表2)|
表 2 川芎嗪对大鼠血清中MCP-1、TNF-α水平影响(pg/mL, |
与假手术组比较,模型组大鼠血清TNF-α、MCP-1水平升高(P < 0.05);与模型组比较,各剂量川芎嗪组、阳性对照组大鼠血清中TNF-α、MCP-1水平降低( P < 0.05)。
2.3 川芎嗪对大鼠心肌组织病理形态学影响(图1)

|
注:A假手术组;B模型组;C、D、E低、中、高剂量川芎嗪组;F阳性对照组。 图 1 川芎嗪对大鼠心肌组织病理形态学影响(HE,× 100) |
结果显示,假手术组大鼠心肌组织结构正常,细胞形态完整,肌原纤维整齐排列(图1A);模型组大鼠心肌细胞出现变性、破裂、坏死,纤维排列紊乱,部分出现断裂,同时伴有炎性细胞浸润(图1B);低、中、高剂量川芎嗪组(图1C、D、E)、阳性对照组(图1F)大鼠心肌细胞破裂、坏死数量明显减少,肌原纤维排列逐渐恢复整齐,心肌损伤程度得到不同程度的缓解。假手术组、模型组、低、中、高剂量川芎嗪组及阳性对照组大鼠病理学评分分别为(0.72 ± 0.16)、(3.66 ± 0.45)、(2.47 ± 0.56)、(2.15 ± 0.43)、(1.86 ± 0.48)及(1.79 ± 0.52)分;与假手术组比较,模型组大鼠心肌组织病理学损伤评分升高,差异有统计学意义(P < 0.05);与模型组比较,低、中、高剂量川芎嗪组及阳性对照组大鼠心肌组织病理学损伤评分降低,差异具有统计学意义( P < 0.05)。
2.4 川芎嗪对大鼠心肌细胞凋亡影响(图2)
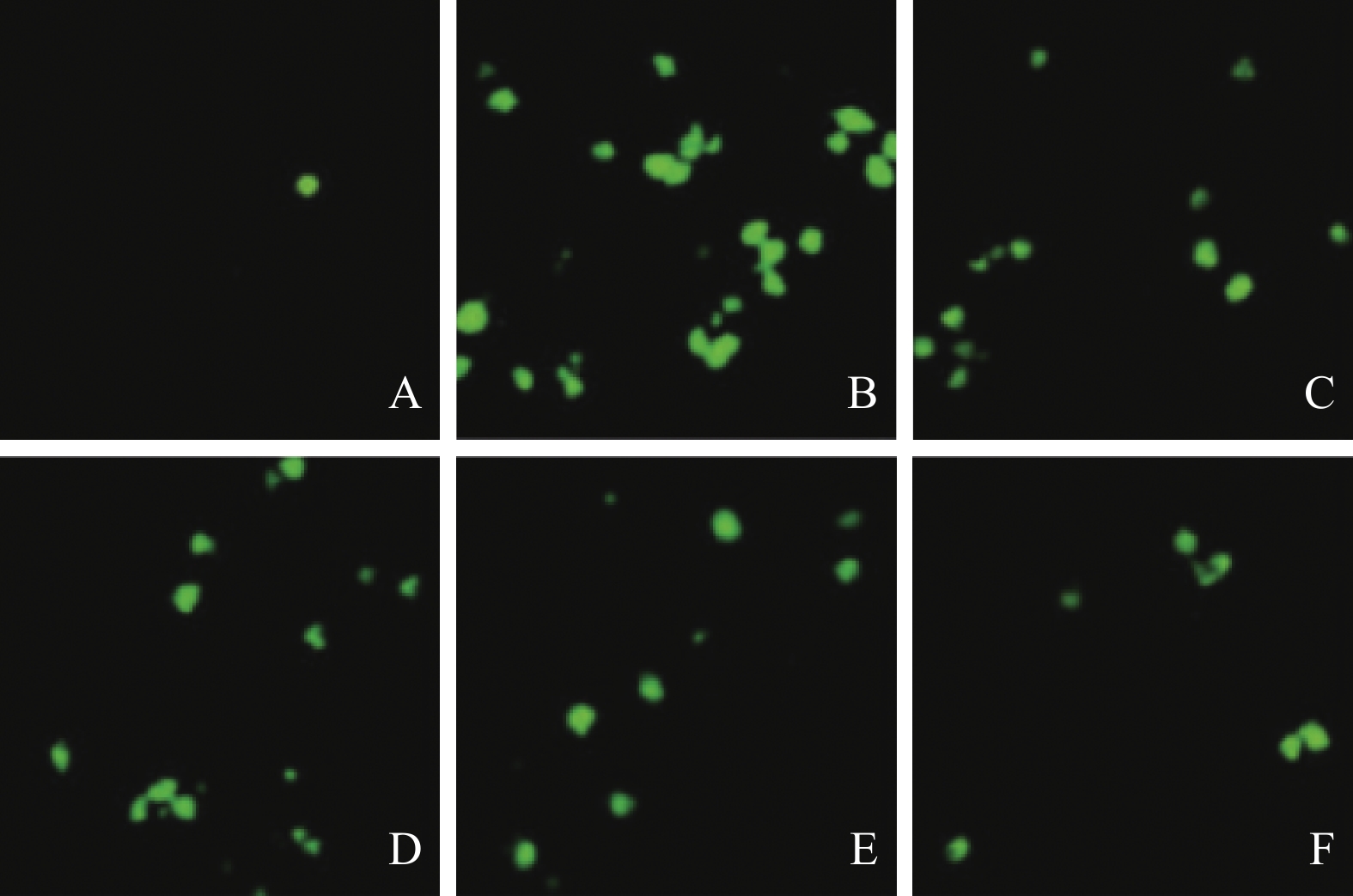
|
注:A假手术组;B模型组;C、D、E低、中、高剂量川芎嗪组;F阳性对照组。 图 2 川芎嗪对大鼠心肌细胞凋亡率影响(Tunel,× 100) |
假手术组、模型组、低、中、高剂量川芎嗪组及阳性对照组大鼠心机细胞凋亡率分别为(4.85 ± 0.57)%、(49.42 ± 6.39)%、(35.31 ± 3.42)%、(22.05 ± 2.63)%、(20.66 ± 2.14)% 及(13.89 ± 1.88)%;与假手术组比较,模型组大鼠心肌细胞凋亡率升高(P < 0.05);与模型组比较,低、中、高剂量川芎嗪组及阳性对照组大鼠心肌细胞凋亡率降低( P < 0.05)。
2.5 川芎嗪对大鼠心肌组织中miR-34a/sirt1/p53通路表达影响(图3、表3)

|
注:1假手术组;2模型组;3~5低、中、高剂量川芎嗪组;6阳性对照组。 图 3 川芎嗪对大鼠心肌组织中sirt1、p53 mRNR表达影响(gRT-PCR,× 100) |
|
表 3 川芎嗪对大鼠心肌组织中miR-34/sirt1/p53通路表达影响(
|
与假手术组比较,模型组大鼠心肌组织中miR-34a、p53 mRNA表达升高,sirt1mRNA表达降低,差异有统计学意义(P < 0.05);与模型组比较,低、中、高剂量川芎嗪组及阳性对照组大鼠心肌组织中miR-34a、p53 mRNA表达降低,sirt1 mRNA表达升高,差异有统计学意义( P < 0.05);呈剂量依赖性。
2.6 川芎嗪对大鼠心肌组织中凋亡相关蛋白表达影响(图4、表4)

|
注:1假手术组;2模型组;3~5低、中、高剂量川芎嗪组;6阳性对照组。 图 4 川芎嗪对大鼠心肌组织中Bax、Bcl-2、cleaved-caspase3表达影响(WB,× 100) |
|
表 4 川芎嗪对大鼠心肌组织中Bax、Bcl-2、cleaved-caspase3表达影响(
|
与假手术组比较,模型组大鼠心肌组织中Bax、cleaved-caspase3蛋白表达升高,Bcl-2蛋白表达降低,差异有统计学意义(P < 0.05);与模型组比较,低、中、高剂量川芎嗪组及阳性对照组大鼠心肌组织中Bax、cleaved-caspase3蛋白表达降低,Bcl-2蛋白表达升高,差异有统计学意义( P < 0.05);呈剂量依赖性。
3 讨 论研究表明AMI患者体内炎症水平较高,且炎症反应会进一步加重心肌损伤[8],心肌组织损伤后会降低心功能,引发心室重构[9]。本研究结果显示,假手术组大鼠心肌组织、心肌细胞结构正常,而模型组大鼠心肌细胞出现破裂、变形、纤维断裂等,伴有大量炎性细胞浸润;与假手术组比较,模型组大鼠LVEDD、LVESD升高,LVPWDs、LVEF、LVFS降低。提示,大鼠心功能受损,模型复制成功。川芎嗪是从川芎中提取的有效生物碱单体成分,药理学研究发现其在降低血粘稠度、抗炎、抗氧化、抵抗心脑血管缺血损伤具有较好的作用[10]。川芎嗪通过MEF2D/PGC-1α途径保护线粒体功能,从而发挥心脏保护作用[11],川芎嗪可通过下调AMI大鼠心肌酶水平,缓解心肌氧化应激损伤[12]。本研究结果表明川芎嗪组大鼠心肌细胞破裂、坏死数量明显减少,炎性细胞浸润程度减轻;TTC染色显示心肌梗死体积显著减少,超声检测发现心脏收缩、舒张能力升高。提示,川芎嗪可能通过抑制心肌组织炎性损伤,提高心室收缩、舒张能力,发挥AMI心肌保护作用。
炎症反应是造成心肌损伤的重要原因。AMI后心肌损伤早期心肌组织中炎症因子和趋化因子含量迅速升高,进一步放大炎症反应,MCP-1为趋化因子之一,可募集炎症因子到达心肌组织炎症反应部位,从而加重心肌梗死、心室重构等心功能损伤[13]。TNF-α作为重要的炎症因子,在心肌损伤后大量表达,心肌组织中TNF-α水平升高后可进一步造成心肌细胞凋亡、心肌肥大等[14]。本研究结果显示,模型组大鼠血清中TNF-α、MCP-1水平明显升高;川芎嗪组大鼠血清中TNF-α和MCP-1水平明显降低。提示,川芎嗪可能通过降低炎症因子和趋化因子的表达,降低心肌炎症反应,从而发挥对AMI大鼠心肌保护作用。
miR-34a在哺乳动物发育早期发挥重要作用,miR-34a表达降低会造成卵巢癌细胞凋亡率减少[15]。研究发现小鼠心脏中miR-34a水平升高可加速心肌细胞凋亡[16],下调miR-34a水平有助于心力衰竭期间的心脏失代偿[17]。本研究结果显示,模型组大鼠心肌组织中miR-34a mRNA表达升高,川芎嗪组大鼠心肌组织miR-34a mRNA表达明显降低。提示,川芎嗪可能通过下调miR-34a缓解AMI心肌损伤。sirt1属于组蛋白去乙酰化酶,sirt1能够调控氧化应激、炎症等参与心血管疾病的发生,激活sirt1则能够延缓衰老、降低心血管疾病的发生率[18]。sirt1为miR-34a靶标基因,下调mir-34a/sirt1信号通路对心肌细胞缺氧损伤具有保护作用[19],激活mir-34a/sirt1信号通路可加剧阿霉素诱导的心脏毒性[20]。p53属于一种抑瘤基因,可调控下游mTOR等靶基因参与心血管疾病的发生,microRNA-34a通过sirt1/p53途径促进柯萨奇病毒B3诱导的心肌细胞凋亡[21]。本研究结果表明模型组大鼠心肌组织中sirt1 mRNA表达降低、p53 mRNA表达升高,川芎嗪组大鼠心肌组织sirt1 mRNA表达升高、p53 mRNA表达降低。提示,川芎嗪可能通过下调miR-34a进而抑制sirt1/p53信号通路,缓解AMI心肌损伤。
研究证实,AMI后心肌细胞凋亡会造成左心室重构,进而引发心衰[22]。Bcl-2、Bax为Bcl-2家族中与凋亡密切相关基因,细胞凋亡会导致Bcl-2/Bax平衡失调,造成Bcl-2表达降低,Bax表达升高,进一步激活caspase级联反应加速细胞凋亡[23]。本研究结果显示,与假手术组比较,模型组大鼠心肌细胞凋亡率明显升高,川芎嗪组大鼠心肌细胞凋亡率明显降低;模型组大鼠心肌组织Bax、cleaved-caspase3蛋白表达升高,Bcl-2蛋白表达降低,川芎嗪组大鼠心肌组织Bax、cleaved-caspase3蛋白表达降低,Bcl-2蛋白表达增加。提示,川芎嗪可能通过下调miR-34a表达,进而抑制sirt1/p53通路降低心肌细胞凋亡,发挥心肌损伤保护作用。
综上所述,川芎嗪对AMI大鼠心肌损伤具有保护作用,其机制可能与下调miR-34a,进而抑制sirt1/p53通路,降低心肌细胞凋亡等有关。
| [1] | Reynolds K, Go AS, Leong TK, et al. Trends in incidence of hospitalized acute myocardial infarction in the Cardiovascular Research Network(CVRN)[J]. Am J Med, 2017, 130(3): 317–327. DOI:10.1016/j.amjmed.2016.09.014 |
| [2] | 唐春梅, 张铭, 胡志琴, 等. MicroRNA-34a靶向SIRT1参与阿霉素诱导的心肌细胞凋亡[J]. 中国病理生理杂志, 2017, 33(3): 385–391. DOI:10.3969/j.issn.1000-4718.2017.03.001 |
| [3] | Xiong H, Pang J, Yang H, et al. Activation of miR-34a/SIRT1/p53 signaling contributes to cochlear hair cell apoptosis: implications for age-related hearing loss[J]. Neurobiol Aging, 2015, 36(4): 1692–1701. DOI:10.1016/j.neurobiolaging.2014.12.034 |
| [4] | 陈浩, 张若青, 郭永霞, 等. 川芎嗪注射液对急性心肌梗死介入手术后抑制心室重塑方面的影响[J]. 辽宁中医杂志, 2017, 44(06): 79–81. |
| [5] | 马晓娟, 郭春雨, 张莹, 等. 活血及活血解毒配伍对急性心肌梗死大鼠心肌损伤的保护作用[J]. 中华老年心脑血管病杂志, 2015, 17(09): 960–963. DOI:10.3969/j.issn.1009-0126.2015.09.019 |
| [6] | 张晓东, 袁权, 林德智, 等. 川芎嗪注射液对急性心肌梗死大鼠心肌损伤标志物及心功能的影响[J]. 中国动脉硬化杂志, 2018, 26(5): 236–239. |
| [7] | 赵洋, 李艳. 阿托伐他汀对心肌梗死大鼠心肌损伤的保护作用及机制[J]. 安徽医药, 2016, 20(2): 240–243. DOI:10.3969/j.issn.1009-6469.2016.02.009 |
| [8] | Oliveira JB, Soares AASM, Sposito AC. Inflammatory response during myocardial infarction[J]. Adv Clin Chem, 2018, 84(2): 39–79. |
| [9] | 林艳, 王琪, 宋少敏, 等. 薤香方湿化氧疗对心肌梗死小鼠心肌损伤标志物和心肺组织病理形态的影响[J]. 南京中医药大学学报, 2018, 34(2): 185–189. |
| [10] | Qian W, Xiong X, Fang Z, et al. Protective effect of tetramethylpyrazine on myocardial ischemia-reperfusion injury[J]. Evid Based Complement Alternat Med, 2014, 2014(4): 107501–107506. |
| [11] | Zhang X, Luo J, Huang Y, et al. A Novel Danshensu-tetramethylpyrazine conjugate DT-018 provides cardioprotection by preserving mitochondrial function through the MEF2D/PGC-1α pathway[J]. Curr Pharm Des, 2018, 23(39): 6062–6070. DOI:10.2174/1381612823666170817125925 |
| [12] | 徐杰, 刘德山. 丹参川芎嗪注射液对急性心肌梗死模型大鼠抗氧化应激实验研究[J]. 临床检验杂志: 电子版, 2017, 6(3): 443–444. |
| [13] | Ahmed SF, Shabayek MI, Abdel Ghany ME, et al. Role of CTRP3, CTRP9 and MCP-1 for the evaluation of T2DM associated coronary artery disease in Egyptian postmenopausal females[J]. PLoS One, 2018, 13(12): e208038. |
| [14] | Huang XW, Pan MD, Du PH, et al. Arginase-2 protects myocardial ischemia-reperfusion injury via NF-κB/TNF-αpathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(19): 6529–6536. |
| [15] | Li R, Shi X, Ling F, et al. MiR-34a suppresses ovarian cancer proliferation and motility by targeting AXL[J]. Tumour Biol, 2015, 36(9): 7277–7783. DOI:10.1007/s13277-015-3445-8 |
| [16] | Piegari E, Russo R, Cappetta D, et al. MicroRNA-34a regulates doxorubicin-induced cardiotoxicity in rat[J]. Oncotarget, 2016, 7(38): 62312–62326. |
| [17] | Hu J, Gao C, Wei C, et al. RBFox2-miR-34a-Jph2 axis contributes to cardiac decompensation during heart failure[J]. Proc Natl Acad Sci USA, 2019, 116(13): 6172–6180. DOI:10.1073/pnas.1822176116 |
| [18] | Yamac AH, Uysal O, Ismailoglu Z, et al. Premature myocardial infarction: genetic variations in SIRT1 affect disease susceptibility[J]. Cardiol Res Pract, 2019, 2019(4): 8921806–8921813. |
| [19] | Fu BC, Lang JL, Zhang DY, et al. Suppression of miR-34a expression in the myocardium protects against ischemia-reperfusion injury through SIRT1 protective pathway[J]. Stem Cells Dev, 2017, 26(17): 1270–1282. DOI:10.1089/scd.2017.0062 |
| [20] | Zhu JN, Fu YH, et al. Activation of miR-34a-5p/Sirt1/p66shc pathway contributes to doxorubicin-induced cardiotoxicity[J]. Sci Rep, 2017, 7(1): 11879–11884. DOI:10.1038/s41598-017-12192-y |
| [21] | Jiang D, Li M, Yu Y, et al. microRNA-34a aggravates coxsackievirus B3-induced apoptosis of cardiomyocytes through the SIRT1-p53 pathway[J]. J Med Virol, 2019, 91(4): 1736–1744. |
| [22] | 张腾, 张艳军, 庄朋伟, 等. 瓜蒌对心梗后心衰大鼠心功能及心肌细胞凋亡的影响[J]. 中国药理学通报, 2016, 32(8): 1183–1184. DOI:10.3969/j.issn.1001-1978.2016.08.031 |
| [23] | Kokawa K, Shikone T, Otani T, et al. Apoptosis and the expression of Bax and Bcl-2 in squamous cell carcinoma and adenocarcinoma of the uterine cervix[J]. Cancer, 2015, 85(8): 1799–1809. |
 2019, Vol. 35
2019, Vol. 35


