2. 中国疾病预防控制中心结核病预防控制中心
结核病持续威胁着全球公共健康[1],仍是全球前10位死因之一;世界卫生组织(World Health Organiza-tion,WHO)报告显示中国的新发患者数和耐多药(multidrug resistant tuberculosis,MDR-TB)/利福平耐药结核病(rifampicin-resistant tuberculosis,RR-TB)发病例数均居全世界第2位[2];中国的结核病负担十分沉重,依然是需关注的主要公共卫生问题。结核分枝杆菌生长缓慢,通过传统药物敏感性试验诊断需2~3个月[3],使用快速液体培养基培养技术需1~2个月[4];诊断延误影响了有效治疗的及时性[5],还可能导致结核病的持续、无任何防护干预下的扩散[6 – 7]。因此,为了改善公众健康,急需快速诊断结核病,特别是MDR/RR-TB。本研究根据《全国结核病防治规划(2011 — 2015年)终期评估报告》(下文简称“评估报告”)数据,及各地实验室设备配备情况,提出4种诊断流程,从其病原性阳性率、诊断利福平耐药时间、诊断每例病原学阳性的成本以及诊断每例利福平耐药的成本4个方面进行阐述。
1 对象与方法 1.1 对象(图1~4)
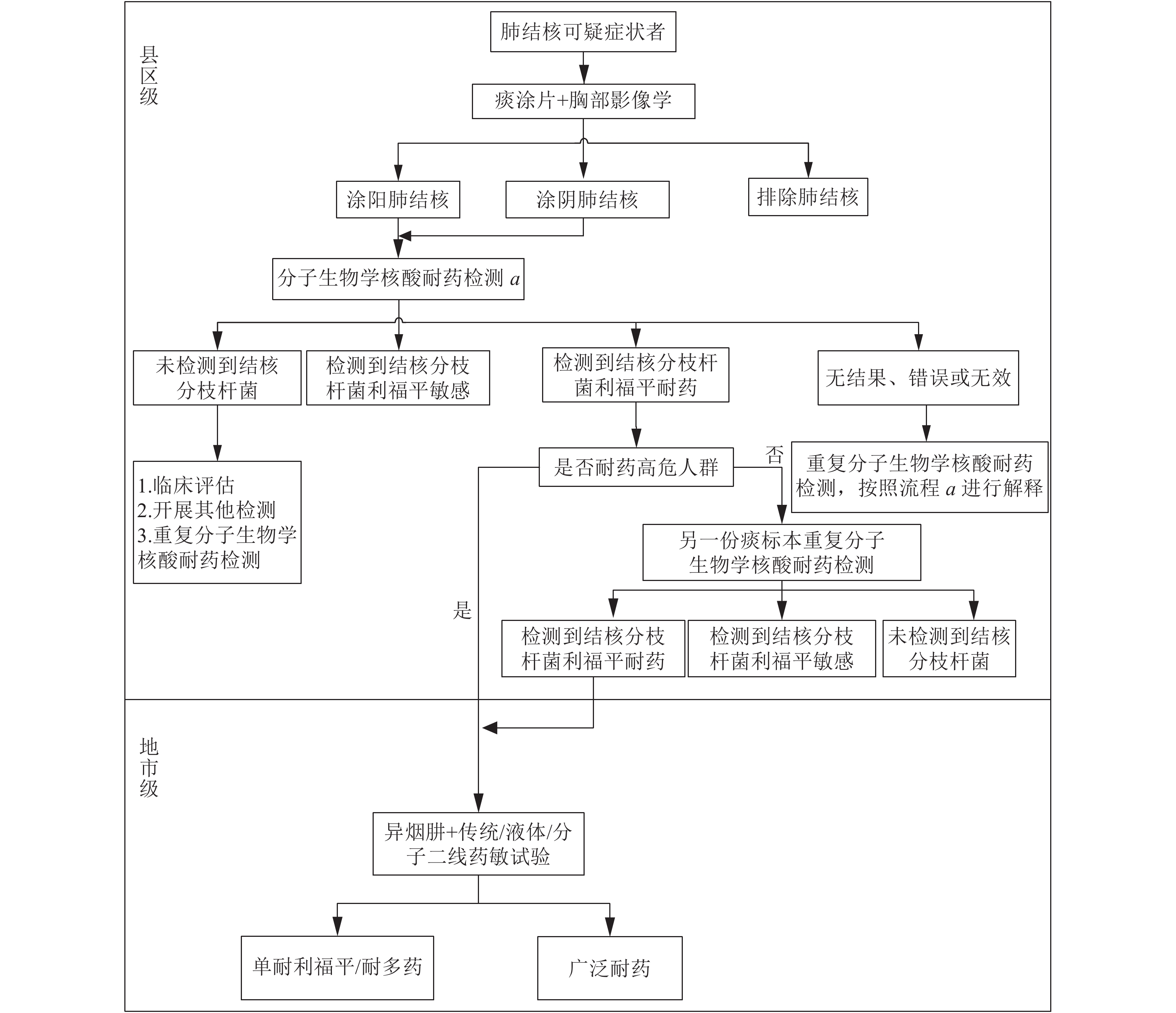
|
图 1 诊断流程1 |
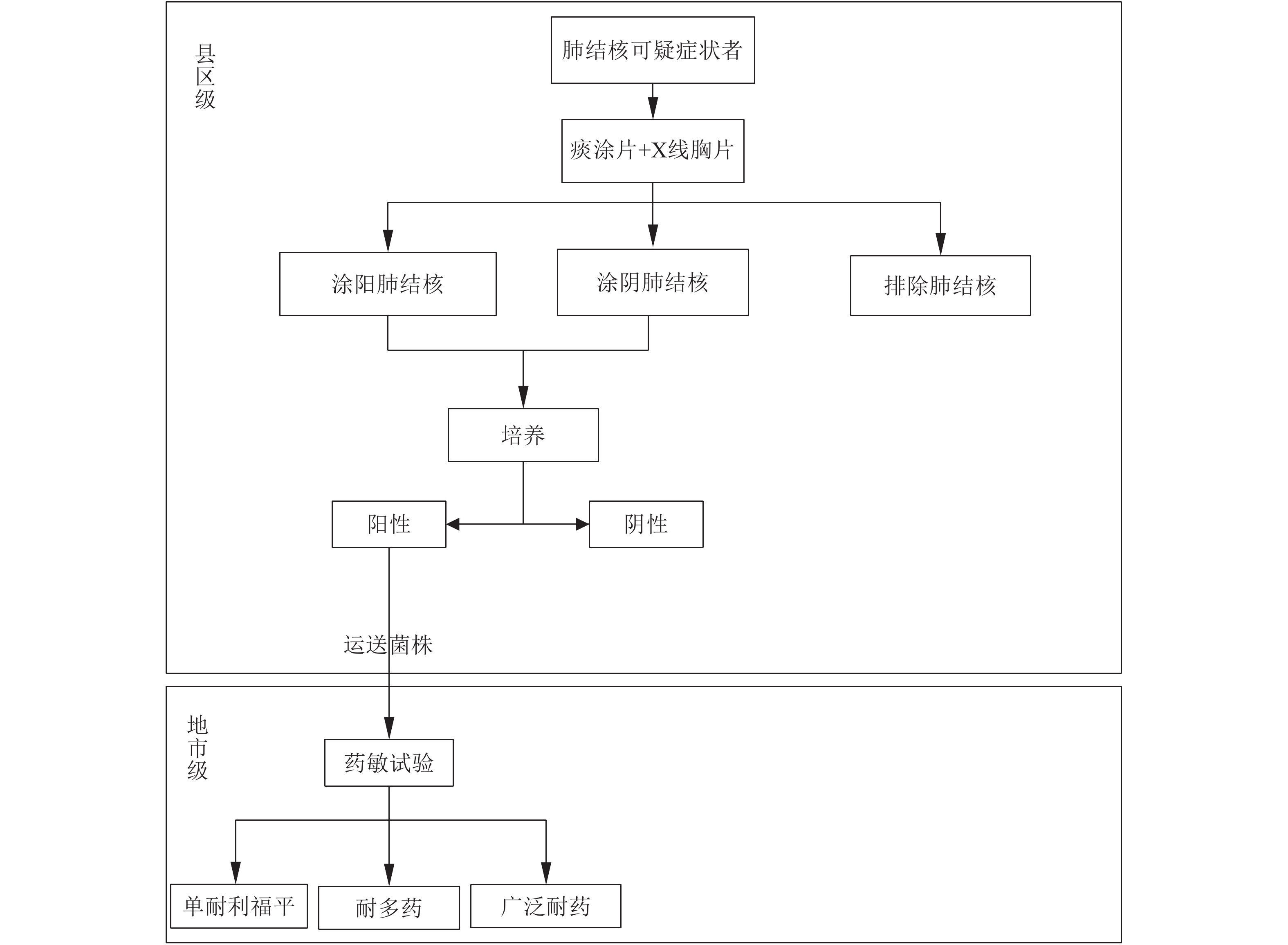
|
图 4 诊断流程4 |
根据评估报告数据,根据各地市具备的条件不同设计了4种不同类型的诊断流程。(1)诊断流程1(图1)适用于县区级实验室具备开展涂片、分子生物学核酸检测和耐药检测能力;地市级实验室具备开展传统药敏能力,具备或不具备分子生物学耐药检测能力均可。(2)诊断流程2(图2)适用于县区级实验室具备开展涂片、分子生物学核酸检测能力地市级实验室开展分子生物学耐药检测。(3)诊断流程3(图3)适用于县区级实验室具备开展涂片、培养能力,但不具备分子生物学核酸和耐药诊断能力,地市级实验室具备分子生物学耐药检测能力。(4)诊断流程4(图4)即结核病防治规划实施工作指南中提到的传统使用的诊断流程。
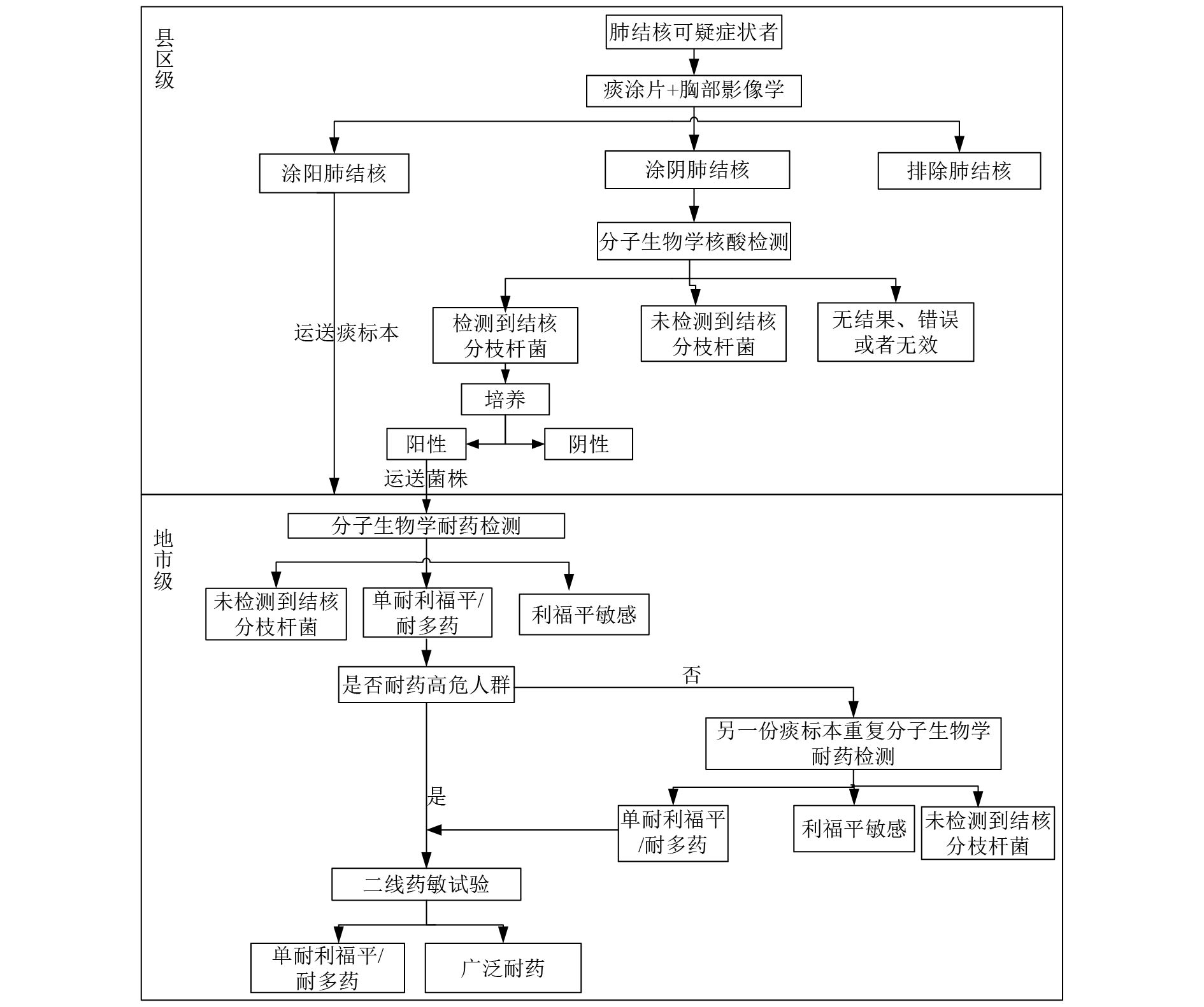
|
图 2 诊断流程2 |
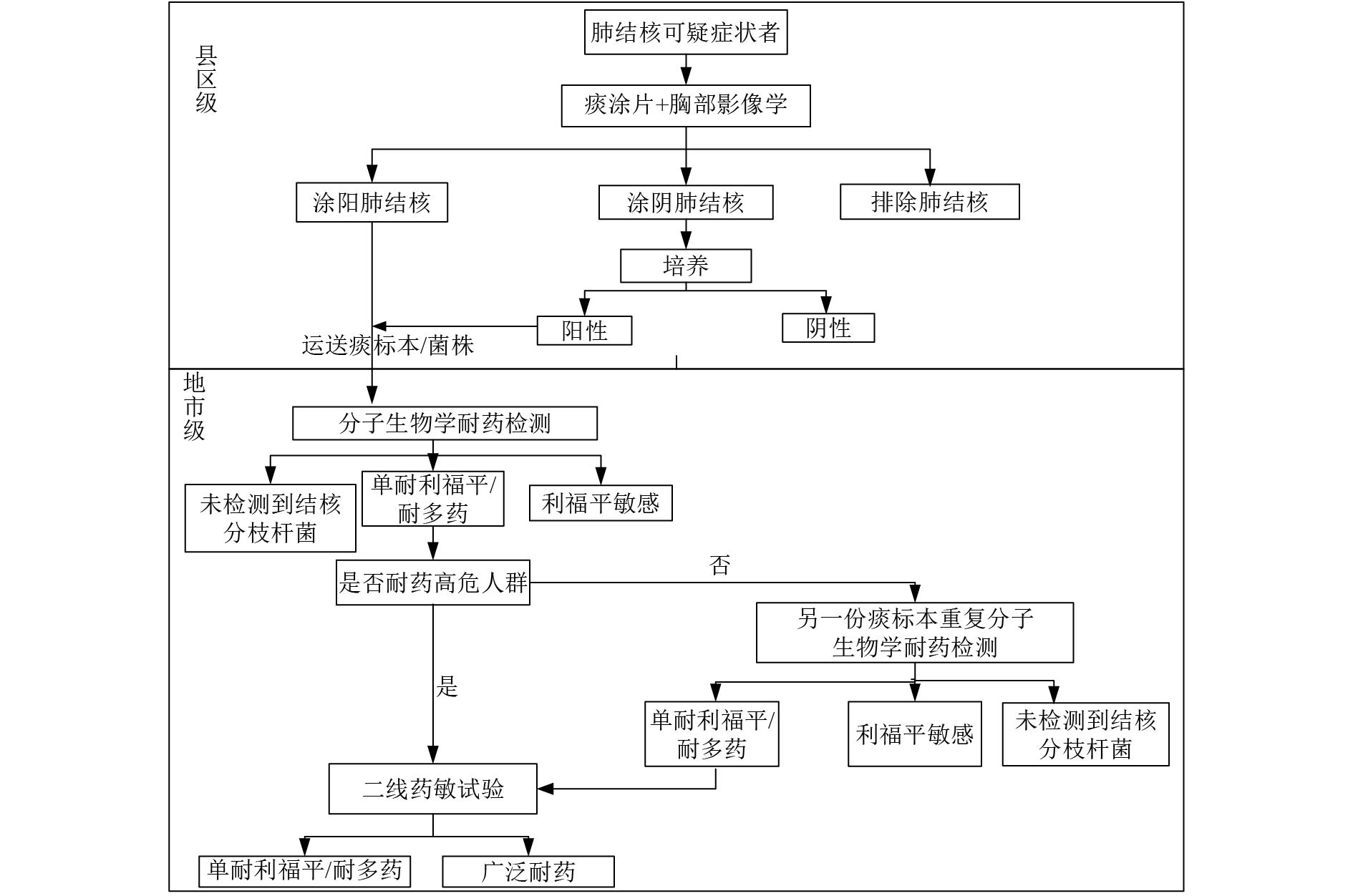
|
图 3 诊断流程3 |
1.2 方法 1.2.1 病原学阳性率
(1)参数 评估报告中提到2015年活动性肺结核患者涂片阳性比例约为30 %,涂片阴性肺结核分子生物学阳性率为15 %,涂阴肺结核培养阳性率为10.6 %。(2)计算公式 涂片阴性病原学阳性率(流程1~2) = 痰涂片阴性率(%) × 涂阴分子生物学阳性率(%);涂阴病原学阳性率(流程3~4) = 痰涂片阴性率(%) × 涂阴培阳率(%);病原学阳性率(%) = 痰涂片阳性率(%) + 涂阴病原学阳性率(%)。
1.2.2 诊断病例利福平耐药所用时间各项检查所需时间 抗酸杆菌涂片检查需要1 d,分子生物学核酸耐药检测需6 h,分子生物学核酸检测需2~3 h,从县区到地市运输痰标本平均时间3 d,结核菌培养(快速培养)需4~8周;检测时间不满1 d的按1 d进行计算。
1.2.3 诊断每例病原学阳性所用成本(表1)| 表 1 2015年某市可疑症状者、不同类别患者数 |
(1)参数 以某市某医院收费标准为例,根据评估报告数据,2015年初诊肺结核可疑症状者14 106例,确诊活动性肺结核患者5 838例,其中涂阳肺结核患者1 818例,复治患者215例,流程1~2病原学阳性患者2 421例,流程3~4病原学阳性患者2 240例。胸片价格为80元,抗酸杆菌涂片15元/张,根据规范对即时痰、夜间痰、晨痰做3次涂片检查,检查价格为45元,结核菌培养为120元,分子生物学检测价格按照400元/例(相当于仅试剂的价格)计算。(2)计算公式 流程1~2病原学阳性患者数(2 421例) = 涂阳肺结核患者数(1 818例)+ 涂阴肺结核患者数(4 020例) × 15.0 %;流程3~4病原学阳性患者数(2 240例)= 涂阳肺结核患者数 + 涂阴肺结核患者数 × 10.5 %。
1.2.4 诊断每例利福平耐药所用成本(1)参数 仍以某市2015年各类患者数及部分收费标准为例;痰标本运输费为500元/次,每周2次,全年共52周,需运输104次;传统的药物敏感性试验为260元;根据WHO发布的2018年报告显示中国初治患者中利福平耐药率为7.1 %,复治患者中为24.0 %[2];经国家参比实验室验证,在县区级使用分子生物学技术检测结核菌利福平耐药的灵敏度为87.1 %[8],在地市级使用分子生物学技术检测利福平耐药的灵敏度为87.6 %[9];根据十三五规划要求,病原学阳性率应达到50 % 以上。(2)计算公式 估算利福平耐药患者数(451例) = 初治患者(5 623例) × 7.1 % + 复治患者(215例) × 24.0 %;初治利福平耐药患者重复分子生物学耐药数(200例) = 初治患者 × 50 % × 7.1 %;流程1诊断利福平耐药患者数(196例) = 估算利福平耐药患者数 × 50 % × 87.1 %;流程2~3诊断利福平耐药患者数(198例) = 估算利福平耐药患者数 × 50 % × 87.6 %;流程4诊断利福平耐药患者数(226例) = 估算利福平耐药患者数 × 50 %;分子生物学阳性培养例数(603例) = 涂阴肺结核患者数 × 15 %。
2 结 果 2.1 病原学阳性率(表2)| 表 2 不同诊断流程病原学阳性率的估算(%) |
根据参数和计算公式得出4种诊断流程的病原学阳性率分别为40.5 %、40.5 %、37.4 %、37.4 %。
2.2 诊断时间(表3)| 表 3 不同诊断流程诊断病例利福平耐药所用时间 |
流程1诊断病例利福平耐药所用时间为1 d,流程2和流程3的涂片阳性病例诊断利福平耐药所用时间皆为5 d,流程4诊断所用时间为60~116 d。
2.3 诊断费用(表4、5)| 表 4 不同流程诊断1例病原学阳性病例所用成本(万元) |
| 表 5 不同流程诊断1例利福平耐药病例所用成本(万元) |
流程1诊断1例病原学阳性患者需要1 392元,流程2需要1 423元,流程3和流程4需要1 003元,详见表4。流程1~4诊断1例利福平耐药病例分别需要21 316、22 409、15 368和12 191元,详见表5。
2.4 不同诊断流程特点(表6)| 表 6 不同诊断流程特点汇总 |
对不同诊断流程特点进行汇总,诊断流程1~2的病原学阳性率均为40.5 %;诊断流程1诊断利福平耐药需要2 d,流程3~4平均发现1例病原性阳性费用1 003元;诊断流程3~4平均发现1例利福平耐药患者费用(元)分别为15 368元和12 191元。
3 讨 论通过本次研究发现,不同的诊断流程有各自的特点,我国幅员辽阔,各地区经济、卫生条件差异较大,在选择结核病的诊断流程时应综合多个方面情况进行考虑,从而避免因诊断延误而造成的结核病传播[7];考虑方面有:现有的或考虑将采用的诊断检测方法,不同检测方法的特点,现有实验室基础设施、能力、人员,样本采集与转运系统的能力,不同检测网点之间的平均周转时间以及进行诊断和治疗的临床服务能力等,还要考虑本地区一段时间以来习惯使用哪些药物治疗结核病,本地区服务人群的特点(包括耐药结核病的比例、HIV阳性的比例、肺外结核病的比例、儿童结核病的比例)等。
县区级使用分子生物学技术检测结核菌灵敏度和特异度都较高,同时也可以作为一种补充的检查方法用于发现既往抗酸杆菌涂片检查结果为阴性的患者[8];对于疑为非耐多药肺结核的患者,其检测结核分枝杆菌的灵敏度和特异度也较高[8];通过本次研究也可以发现,县区级具备分子生物学核酸检测能力的流程1和2,其病原学阳性率(40.5 %)较另外2种诊断流程(37.4 %)高,且检测时间仅需2~3 h,在提高阳性率的同时能够大大缩短耐药的诊断时间;但也有其不足之处,即发现1例病原学阳性的费用(1 392和1 423元)较另外2种诊断流程(1 003元)稍高。流程1~3要求地市级具备分子生物学核酸检测和利福平、异烟肼耐药检测的能力,诊断利福平耐药较传统诊断流程(流程4,60~116 d)用时少,可以更加快速的制定有效的治疗方案[9];费用(21 316、22 409和15 368元)比传统诊断流程高(12 191元)。
总体分析本次研究数据,县区级若具备分子生物学核酸检测能力能够提高病原学阳性率,这与十三五规划提出的要求一致,且不需要送痰/菌株(流程2的涂阴病例标本需要),这对检测网点间交通不畅或距离较远的地方提供了便利;传统诊断流程诊断利福平耐药至少需要2~3个月,地市级若具备分子生物学核酸检测和利福平、异烟肼耐药检测的能力则能大大缩短诊断利福平耐药的时间,尤其能将涂阳患者的耐药诊断时间缩短至2~5 d,这非常有利于减少耐药菌传播的可能性。
综上所述,并结合国家对目前市场上多种实验室新诊断技术进行了验证[8 – 10],建议:县区级应具备能够应用快速诊断技术确定检测样本中是否有结核分枝杆菌的能力,地市级应具备能够应用快速诊断技术确定检测样本中是否有结核分枝杆菌及其是否对利福平和异烟肼耐药,省级应具备以上全部能力。
| [1] | Lönnroth K, Castro KG, Chakaya JM, et al. Tuberculosis control and elimination 2010-50: cure, care, and social development[J]. Lancet, 2010, 375(9728): 1814–1829. DOI:10.1016/S0140-6736(10)60483-7 |
| [2] | World Health Organization. Global tuberculosis report 2018[R]. World Health Organization, 2018. |
| [3] | Boehme CC, Nicol MP, Nabeta P, et al. Feasibility, diagnostic accuracy, and effectiveness of decentralised use of the Xpert MTB/RIF test for diagnosis of tuberculosis and multidrug resistance: a multicentre implementation study[J]. Lancet, 2011, 377(9776): 1495–1505. DOI:10.1016/S0140-6736(11)60438-8 |
| [4] | Rie AV, Page-Shipp L, Scott L, et al. Xpert® MTB/RIF for point-of-care diagnosis of TB in high-HIV burden, resource-limited countries: hype or hope?[J]. Expert Review of Molecular Diagnostics, 2010, 10(7): 937–946. DOI:10.1586/erm.10.67 |
| [5] | Zhao Y, Xu S, Wang L, et al. National survey of drug-resistant tuberculosis in China[J]. The New England Journal of Medicine, 2012, 366(23): 2161–2170. DOI:10.1056/NEJMoa1108789 |
| [6] | Boehme CC, Nabeta P, Hillemann D, et al. Rapid molecular detection of tuberculosis and rifampin resistance[J]. The New England Journal of Medicine, 2010, 363(11): 1005–1015. DOI:10.1056/NEJMoa0907847 |
| [7] | 梁立波, 李玲, 孙宏, 等. 耐多药结核流行及影响因素研究进展[J]. 中国公共卫生, 2014, 30(9): 1221–1225. |
| [8] | Ou X, Xia H, Li Q, et al. A feasibility study of the Xpert MTB/RIF test at the peripheral level laboratory in China[J]. International Journal of Infectious Diseases, 2015, 31: 41–46. DOI:10.1016/j.ijid.2014.09.011 |
| [9] | Pang Y, Xia H, Zhang Z, et al. Multicenter evaluation of genechip for detection of multidrug-resistant Mycobacterium tuberculosis [J]. Journal of Clinical Microbiology, 2013, 51(6): 1707–1713. DOI:10.1128/JCM.03436-12 |
| [10] | Li Q, Ou XC, Pang Y, et al. A novel automatic molecular test for detection of multidrug resistance tuberculosis in sputum specimen: a case-control study[J]. Tuberculosis, 2017, 105: 9–12. DOI:10.1016/j.tube.2017.03.008 |
 2019, Vol. 35
2019, Vol. 35


