我国是肝炎大国,部分自身免疫性肝病和病毒性肝炎患者可能会发展为肝纤维化、肝硬化甚至是肝癌[1]。诸多肝脏疾病的发生发展过程中均伴随着肝脏免疫应答所介导的炎症反应以及肝实质损伤[2]。炎性体(inflammasome)是位于胞内的一类多蛋白复合体,在炎症和免疫反应中起重要作用,其核心成分是核苷酸结合寡聚化结构域样受体(nucleotide-binding and oligomerization domain(NOD)-like receptors,NLRs)家族蛋白或干扰素诱导P200蛋白家族(pyrin and HIN domain family,PYHIN)。现在研究较多的是NLRP3炎性体,它是由NOD样受体NLRP3,凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)及无活性的半胱氨酸天冬氨酸蛋白酶-1(cysteiny aspartate-specific protease,procaspase-1)构成。炎性体NLRP3可以将无活性的procaspase-1转化成活性caspase-1,而活性caspase-1则可使白细胞介素 – 1β(interleukin-1 beta,IL-1β)前体(pro-IL-1β)转化为成熟有活性的IL-1β 和IL-18,引起进一步的炎症反应 [3]。机体内源性大麻系统(endocannabinoid system,ECS)在炎症反应、氧化应激及抗纤维化过程中发挥十分重要的调节作用,ECS中主要发挥作用的是大麻素Ⅰ型受体(cannabinoid receptor 1,CB1)和CB2[4 – 5]。研究显示,CB2受体激动剂可通过减轻氧化应激反应从而保护肝脏缺血再灌注损伤[6],也可通过降低血小板衍生生长因子的表达减轻肝纤维化[7]。然而,CB2受体激动剂对于急性免疫性肝损伤的保护作用及其机制尚未明确,本研究使用Con A诱导小鼠急性免疫性肝损伤,对炎性体NLRP3相关蛋白表达进行检测,并观察小鼠肝功改变情况,探讨CB2受体激动剂AM1241对小鼠急性免疫性肝损伤的影响。
1 材料与方法 1.1 实验动物40只清洁级C57BL/6J雄性小鼠,7~8周龄,体重24 g左右,购于北京斯贝福实验动物技术有限公司,生产许可证号:SCXK(京)2016 – 0002。饲养于贵州医科大学动物实验中心,小鼠自由饮食饮水,于(22 ± 2) ℃恒温清洁环境饲养1周以适应环境,生理状况稳定后进行实验。
1.2 主要试剂大麻素受体2激动剂AMl241(美国Selleck公司),刀豆蛋白A(Con A)(美国sigma公司),NLRP3、ASC抗体(美国CST公司),caspase-1(p20)抗体(武汉博士德公司),甘油醛 – 3 – 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)内参抗体(美国Abcam公司),全蛋白提取试剂盒(沈阳万类生物公司),IL-1β 检测试剂盒(美国R&D公司)。
1.3 分组与处理将40只C57BL/6J雄性小鼠随机分为4组:对照组、模型组、AM1241低、高剂量组(3、12 mg/kg),每组10只;低、高剂量AM1241组小鼠分别腹腔注射AM1241(3、12 mg/kg),对照组同时注射含1 % 二甲基亚砜(dimethyl sulfoxide,DMSO)生理盐水;1 h后,除对照组,其余3组小鼠均尾静脉注射Con A(20 mg/kg),禁食不禁水,造模8 h后摘眼球取血(其中模型组死亡1只),避免溶血,解剖小鼠,取同一部位肝组织用4 %多聚甲醛固定,另取同一部位肝组织保存于 – 80 ℃冰箱。
1.4 指标与方法 1.4.1 血清生化指标检测采用罗氏全自动生化分析仪按试剂盒要求检测小鼠血清丙氨酸转氨酶(ALT)水平。
1.4.2 肝组织中凋亡相关蛋白表达检测采用Western blot法,取100 mg左右肝组织,液氮中研磨,加入含1 %蛋白酶抑制剂-苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的组织裂解液1 mL,冰上裂解30 min后,使用4 ℃高速离心机12 000 r/min离心10 min,取上清。经聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)蛋白定量后,加入5 × 蛋白上样缓冲液,煮沸并分装,置 – 20 ℃冰箱保存备用。以20 μg上样量计算上样体积,电泳并转膜,转膜时间和电流根据分子量大小而定。用含5 %脱脂牛奶的封闭液封闭1 h后,一抗[NLRP3和ASC抗体用TBST 1 : 1 200稀释,caspase-1(p20)抗体1 : 400稀释]于4 ℃冷藏室孵育过夜,洗膜,二抗(1 : 20 000稀释)室温摇床上孵育1 h,洗膜,用化学发光液(electrochemiluminescence,ECL)于曝光仪上自动曝光,结果用Image J软件分析。
1.4.3 肝组织中IL-1β 含量检测采用酶联免疫吸附试验,肝组织匀浆稀释10倍上样,每个标本设复孔,严格按照试剂盒操作,使用Curve Expert 1.4制作logistic模型标准曲线并计算结果。组织匀浆进行蛋白定量,最后计算出肝组织中每毫克蛋白所含IL-1β 的量。
1.5 统计分析实验数据用(
结果显示,对照组、模型组、AM1241低、高剂量组小鼠血清中ALT活力分别为(28.5 ± 7.4)、(6 132.5 ± 1 300.8)、(2 696.5 ± 956.3)、(534.6 ± 128.6)U/L。与对照组比较,模型组小鼠血清ALT活力明显增加(P < 0.05);提示,小鼠免疫肝损伤模型建立成功。与模型组比较,AM1241低、高剂量组小鼠血清中ALT活力均明显降低;呈剂量效应关系。
2.2 AM1241对炎性小体NLRP3相关蛋白表达影响(图1、表1)
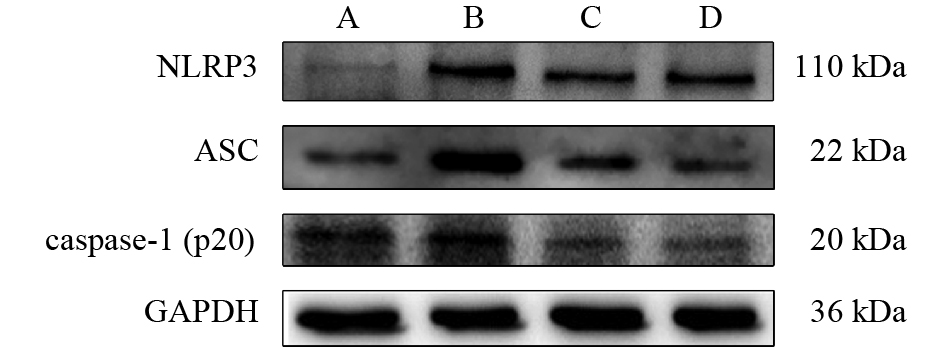
|
注:A对照组;B模型组;C、D AM1241 3、12 mg/kg组。 图 1 AM1241对小鼠肝组织中NLRP3、ASC、caspase-1(p20)表达影响 |
|
表 1 AM1241对小鼠肝组织中NLRP3、ASC、caspase-1(p20)表达影响(
|
与对照组比较,模型组小鼠肝组织中NLRP3、ASC、casepase-1(p20)蛋白表达均明显增加(P < 0.05);与模型组比较,AM1241低、高剂量组小鼠肝组织中NLRP3、ASC、casepase-1(p20)蛋白表达均降低( P < 0.05)。
2.3 AM1241对小鼠肝组织匀浆IL-1β 含量影响结果显示,对照组、模型组、AM1241低、高剂量组小鼠肝组织IL-1β 含量分别为(52.54 ± 29.23)、(1 353 ± 489.4)、(221.4 ± 49.98)、(217.7 ± 69.27)pg/mg。与对照组比较,模型组小鼠肝组织中IL-1β 含量明显升高(P < 0.05);与模型组比较,AM1241低、高剂量组小鼠肝组织IL-1β 水平均明显降低( P均 < 0.05)。
3 讨 论目前免疫反应为自身免疫性肝病和乙型肝炎的基本发病机制的观点已经普遍为人们所接受[8 – 9],而由Con A诱导的小鼠急性免疫性肝损伤中,炎性因子分泌、炎症细胞浸润、单核细胞大量增殖,较好的模拟了这种疾病所致的肝损伤[10],具有造模时间短,病情较稳定的特点。本研究结果显示,与对照组比较,模型组小鼠血清ALT活力明显升高。提示,Con A诱导的急性免疫性肝损伤模型建立成功。本研究结果显示,与模型组比较,AM1241组小鼠血清ALT活力均有所下降,且呈剂量效应关系。提示,AM1241对Con A致小鼠急性免疫性肝损伤有较好的拮抗作用。
肝脏中的CB2主要分布在肝非实质性细胞,与调节免疫反应、炎症介质、能量代谢有关[11]。CB2激动剂对免疫细胞功能的影响主要为抑制炎性细胞因子的分泌,抑制T细胞增殖,调控免疫细胞形态和功能[12]。肝脏中NLRP3也主要表达于非实质细胞,正常肝细胞几乎不表达[13]。NLRP3激活后可募集ASC,再与procaspase-1结合,形成完整的炎性体NLRP3,它可以使无活性procaspase-1变成活性caspase-1,而后者则是IL-1β 和IL-18前体的剪辑者,可促使成熟的IL-1β 和IL-18释放[14],刺激初始CD4+T细胞分别向Th17和Th1亚型转化[15],引起炎症网的扩大,进一步加重肝损伤。本研究结果显示,与对照组比较,模型组小鼠肝组织中NLRP3、ASC、caspase-1(p20)表达和IL-1β 含量均有所增高;与模型组比较,AM1241组小鼠肝组织中NLRP3、ASC、caspase-1(p20)表达和IL-1β 含量均有所降低。提示,AM1241对Con A所致小鼠急性免疫性肝损伤的拮抗作用可能与抑制肝组织NLRP3的表达,从而抑制ASC、caspase-1(p20)和IL-1β 蛋白的表达有关。
综上所述,CB2激动剂AM1241可抑制Con A诱导的急性肝损伤小鼠肝脏炎性体NLRP3表达,减轻Con A所致的免疫炎症。CB2是一种G蛋白偶联受体,该受体激活后可通过丝裂原活化蛋白激酶家族(mitogen-activated protein kinase,MAPKs)的p38 MAPK、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、细胞外调节蛋白激酶1/2(extracellular regulated protein kinases,ERK1/2)信号通路对下游蛋白产生影响,而NLRP3的激活与NF-κB磷酸化密切相关[16],其具体机制值得进一步深入研究。
| [1] | Zhang Y, Hu K. Rethinking the pathogenesis of hepatitis B virus (HBV) infection[J]. Journal of Medical Virology, 2015, 87(12): 1989–1999. DOI:10.1002/jmv.24270 |
| [2] | Dienes HP, Drebber U. Pathology of immune-mediated liver injury[J]. Dig Dis, 2010, 28(1): 57–62. DOI:10.1159/000282065 |
| [3] | Kersse K, Bertrand MJ, Lamkanfi M, et al. NOD-like receptors and the innate immune system: coping with danger, damage and death[J]. Cytokine and Growth Factor Reviews, 2011, 22(5 – 6): 257. DOI:10.1016/j.cytogfr.2011.09.003 |
| [4] | Paolo C, Marco D, Ferdinando G, et al. The role of the endocannabinoid system in liver diseases[J]. Best Practice and Research Clinical Endocrinology and Metabolism, 2009, 23: 65–77. DOI:10.1016/j.beem.2008.10.009 |
| [5] | Pacher P, Gao B. Endocannabinoids and liver disease. III. Endocannabinoid effects on immune cells: implications for inflammatory liver diseases[J]. Am J Physiol Gastrointest Liver Physiol, 2008, 294(4): G850. DOI:10.1152/ajpgi.00523.2007 |
| [6] | Sándor B, Douglas OH, Pan H. et al. Cannabinoid-2 receptor mediates protection against hepatic ischemia/reperfusion injury[J]. FASEB, 2007, 21(8): 1788–1800. DOI:10.1096/fj.06-7451com |
| [7] | 何萍, 吴雅峰, 王豫萍, 等. 大麻素受体-2激动剂AM1241对肝纤维化小鼠肝组织血小板衍生生长因子表达的影响[J]. 中华肝脏病杂志, 2017, 25(11): 841–846. DOI:10.3760/cma.j.issn.1007-3418.2017.11.008 |
| [8] | Manns MP, Czaja AJ, Gorham JD, et al. Diagnosis and management of autoimmune hepatitis[J]. Hepatology, 2010, 19(1): 2193–2213. |
| [9] | Wang QX, Yan L, Ma X. Autoimmune hepatitis in the Asia-Pacific area[J]. Journal of Clinical and Translational Hepatology, 2018, 6(1): 48–56. |
| [10] | Sass G, Heinlein S, Agli A, et al. Cytokine expression in three mouse models of experimental hepatitis[J]. Cytokine, 2002, 19(3): 115–120. DOI:10.1006/cyto.2002.1948 |
| [11] | Malfitano AM, Basu S, Maresz K, et al. What we know and do not know about the cannabinoid receptor 2(CB2)[J]. Seminars in Immunology, 2014, 26(5): 369–379. DOI:10.1016/j.smim.2014.04.002 |
| [12] | Leleuchavain N, Desreumaux P, Chavatte P, et al. Therapeutical potential of CB2 receptors in immune-related diseases [J]. Current Molecular Pharmacology, 2013, 6(3): 183. |
| [13] | Georgiana BS, Erawan BK, Lidia T, et al. Expression analysis of inflammasomes in experimental models of inflammatory and fibrotic liver disease[J]. Journal of Inflammation (London, England), 2012, 9(1): 49. DOI:10.1186/1476-9255-9-49 |
| [14] | 张向颖, 任锋, 段钟平. 炎症小体在肝脏疾病致病机制中作用的研究进展[J]. 中华肝脏病杂志, 2014, 22(6): 478–480. DOI:10.3760/cma.j.issn.1007-3418.2014.06.020 |
| [15] | Zielinski CE, Mele F, Aschenbrenner D, et al. Pathogen-induced human TH17 cells produce IFN-γ or IL-10 and are regulated by IL-1β[J]. Nature, 2012, 484(7395): 514. DOI:10.1038/nature10957 |
| [16] | García JA, Volt H, Venegas C, et al. Disruption of the NF-κB/NLRP3 connection by melatonin requires retinoid-related orphan receptor-α and blocks the septic response in mice[J]. Faseb Journal, 2015, 29(9): 3863–3875. DOI:10.1096/fj.15-273656 |
 2019, Vol. 35
2019, Vol. 35


