2. 牡丹江医学院药学院;
3. 齐齐哈尔医学院基础医学院
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病的主要并发症之一,近年来,随着糖尿病发病率的不断上升,糖尿病心肌病的发病率也迅速上升。研究表明,心肌细胞异常凋亡是导致心功能发生障碍的主要原因[1]。内质网应激(endoplasmic reticulum stress,ERS)介导的细胞凋亡是近年来发现的一种凋亡途径,ERS状态下激活的环磷酸腺苷反应元件结合转录因子(CCAAT/enhancer-binding proteins,C/EBP)同源蛋白(C/EBP homologous protein,CHOP)/半胱氨酸天冬氨酸蛋白酶12(cysteinyl aspartate specific proteinase 12,caspase 12)凋亡信号转导通路可能起到重要的中介作用[2 – 3]。但当内质网应激时间过长或强度过大时则会影响内质网的正常生理功可诱发炎症反应[4]。柚皮苷(naringin,Nar)是一种双氢黄酮类化合物,具有降压调脂、抗炎、抗氧化、抗细胞凋亡[5 – 7]等多种药理作用,柚皮苷可通过抑制ERS和氧化应激[8]及转录活化因子3(signal transducers and activators of transcription 3,STAT3)通路[9]降低心肌组织细胞凋亡,改善糖尿病引起的心肌纤维化和心功能障碍,达到心肌保护作用。本研究应用高糖处理H9c2心肌细胞建立高糖损伤心肌细胞模型,探讨高糖处理心肌细胞对ERS应激标志性蛋白及炎症因子表达的影响,旨在为阐明高糖的心肌细胞损伤机制及柚皮苷的心肌保护机制提供依据。
1 材料与方法 1.1 主要试剂与仪器H9c2细胞株(赛百慷生物科技股份有限公司);柚皮苷、D –(+)glucose solution(美国Sigma公司);胎牛血清(德国PAN公司);改良杜氏伊戈尔培养基(DMEM)(美国Hyclone公司);胰酶(美国Gibco公司);噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2。5-diphenyl-2-H-tetrazolium bromide,MTT](北京中生瑞泰科技有限公司);RNA提取试剂盒(美国Omega公司);逆转录试剂盒(美国Roche公司);原位末端标记技术(terminal-deoxynucleotidyl transferase mediated nick end labeling,TUNEL)细胞凋亡检测试剂盒(美国Beyotime公司)、抗白细胞介素 – 6(interleukin-6,IL-6)、真核细胞转录因子( nuclear factor-kappa B,NF-кB)、葡萄糖调节蛋白78(glucose-related protein,GRP78)、半胱氨酸天冬氨酸蛋白酶12(Caspase12)、转录调节因子C/EBP家族同源蛋白(CHOP)、β-Actin兔多克隆抗体(美国Abcam公司)。CO 2细胞培养箱(上海力申科学仪器有限公司);生物显微镜(日本Olympus公司);酶标仪(美国Molecular Devices公司);NanoDrop 2000(美国Thermo公司);低温高速离心机(美国Sigma公司);凝胶成像系统(美国BioRad公司)。
1.2 细胞培养H9c2心肌细胞培养于含10 %胎牛血清的DMEM培养基,置于5 % CO2,37 ℃的温箱中培养。当心肌细胞生长占培养瓶面积80 %~90 %时,进行传代培养。选择生长状态良好的对数期细胞进行实验。
1.3 指标与方法 1.3.1 H9c2心肌细胞存活率测定采用MTT法,实验设置对照组、模型组、柚皮苷低、中、高剂量组(5、10、20 μmol/L),以每孔4 × 103个细胞接种于96孔培养板中,用柚皮苷分别预处理4 h,再加入高糖处理48 h,加入终浓度为0.5 mg/mL MTT,37 ℃孵育4 h,加入150 μL二甲基亚砜,震荡10 min,用酶标仪570 nm处测各孔吸光度(A)值,检测各组细胞存活率。各组设置6个复孔。
1.3.2 细胞凋亡率检测采用TUNEL染色法,将心肌细胞以8 × 104个/孔的密度接种于6孔板中(实验分组与处理同1.3.1),细胞爬片,处理后弃去培养基,用磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤3次,然后用4 %多聚甲醛4 ℃环境下固定细胞30 min,用PBS洗涤3次,每孔加入100 μL TUNEL染色液,室温避光染色10 min,吸除染色液,再用PBS洗涤3次,每次3~5 min,用4′,6 – 二脒基 – 2 – 苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染核5 min,PBS洗涤3次,用抗荧光淬灭封片液封片,每组选择4个视野(× 200)在荧光倒置显微镜下观察,带有绿色荧光标记的抗体为凋亡细胞,细胞凋亡率 = 凋亡细胞总数/总细胞数 × 100 %。
1.3.3 H9c2心肌细胞中炎症因子及ERS相关蛋白表达检测采用Western blot法,实验分组与处理同1.3.1,提取待测细胞,用预冷的PBS清洗3次,加入裂解液冰上或4 ℃裂解细胞30 min,4 ℃、12 000 r/min离心15 min后取上清,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒测定蛋白浓度。将提取的蛋白加入上样缓冲液,开水煮沸变性10 min,冰上冷却10 min,离心。总蛋白经十二烷基硫酸钠 – 聚丙烯酰胺凝胶电泳(sodium dodecyl-polyacryl gradient gel electrophoresis,SDS-PAGE)(80 V),30 min电压转变为120 V。在150 mA电流下转膜到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5 %牛血清蛋白(bovine serum albumin,BSA)封闭1 h,分别加入抗体GRP78、Caspase12、CHOP、IL-6、NF-кB(1 : 1 000稀释),4 ℃环境下孵育过夜,用含0.1 %吐温的Tris缓冲生理盐水(Tris buffered saline/0.05 % Tween-20,TBST)洗涤3次,每次10 min,与一抗相对应二抗(1 : 10 000稀释)1 h后再用TBST洗膜,将PVDF膜用发光试剂ECL显色,照相并用Image J软件进行灰度值分析。
1.4 统计分析数据用
H9c2心肌细胞于35 mmol/L葡萄糖培养液作用24和48 h后,细胞活力分别为(87.88 ± 7.66)%、(78.32 ± 6.78)%;与对照组(100 %)比较,模型(高糖)组细胞活力明显下降,差异有统计学意义(P < 0.01)。与对照组比较,高糖处理24 h后,模型组H9c2心肌细胞ERS标志性蛋白GRP78表达明显升高( P < 0.05);高糖处理48 h后,H9c2心肌细胞GRP78表达明显升高,CHOP及Caspase 12表达也明显升高,差异有统计学意义( P < 0.05)。提示,高糖诱导H9c2心肌细胞损伤模型建立成功。
2.2 柚皮苷对高糖诱导的H9c2心肌细胞存活率影响结果显示,对照组、模型组、5、10、20 μmol/L柚皮苷组细胞存活率分别为100 %、(70.36 ± 6.31)%、(84.52 ± 6.17)%、(88.18 ± 11.08)%、(92.33 ± 5.64)%;与对照组比较,模型组细胞存活率明显降低(P < 0.01);与模型组比较,各剂量柚皮苷组细胞存活率增加( P < 0.05或 P < 0.01)。提示,柚皮苷对高糖环境下H9c2心肌细胞具有保护作用。
2.3 柚皮苷对高糖诱导的H9c2心肌细胞凋亡影响(图1)
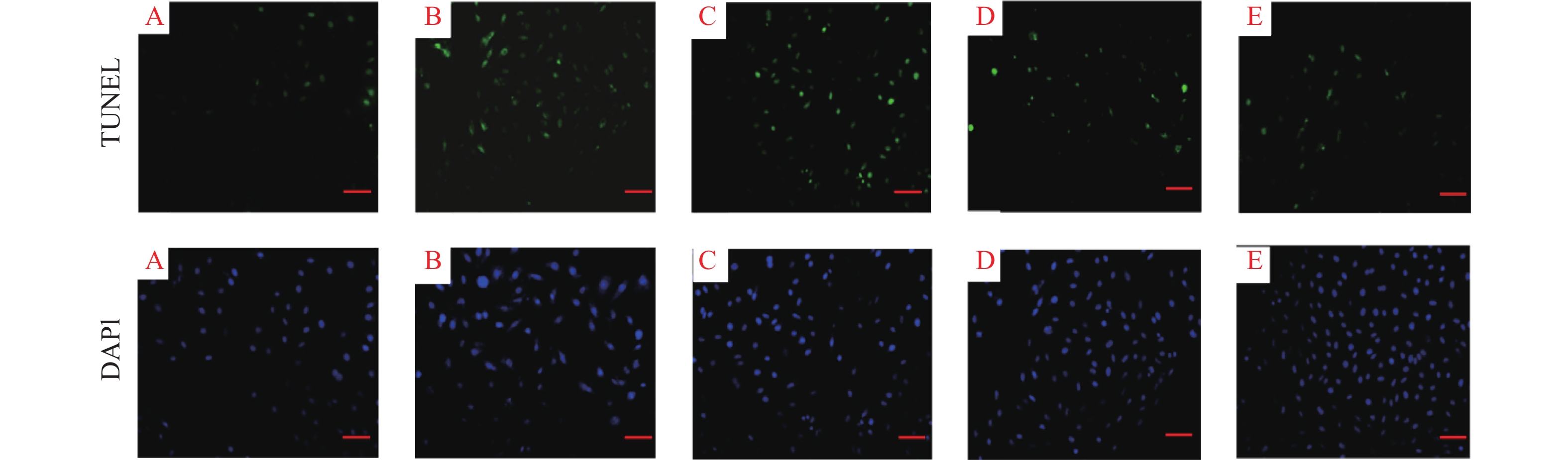
|
注:A对照组;B模型组;C、D、E柚皮苷5、10、20 μmol/L组。 图 1 柚皮苷对高糖诱导H9c2心肌细胞凋亡影响 |
结果显示,对照组、模型组、5、10、20 μmol/L柚皮苷组细胞凋亡率分别为(20.75 ± 3.04)%、(41.25 ± 7.44)%、(35.2 ± 5.79)%、(28.0 ± 5.98)%、(25.0 ± 4.82)%;与对照组比较,模型组H9c2心肌细胞凋亡率明显增加(P < 0.01);与模型组比较,柚皮苷中、高剂量组H9c2心肌细胞凋亡率均明显下降( P < 0.05或 P < 0.01)。
2.4 柚皮苷对高糖诱导H9c2心肌细胞ERS相关蛋白表达影响(图2、表1)
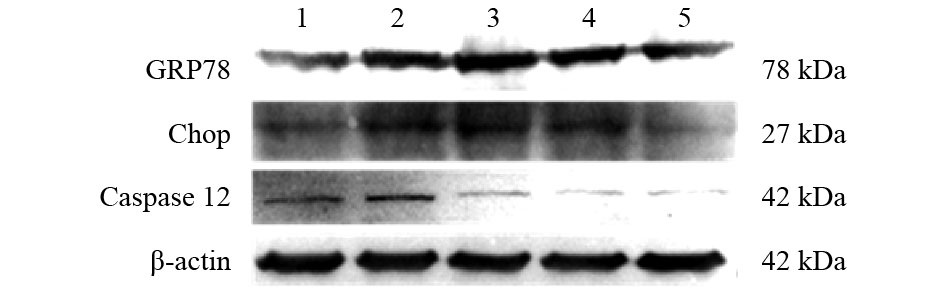
|
注:1 对照组;2 模型组;3~5 柚皮苷5、10、20 μmol/L组。 图 2 柚皮苷对H9c2心肌细胞ERS相关蛋白表达影响 |
| 表 1 柚皮苷对H9c2心肌细胞ERS相关蛋白表达影响 |
与对照组比较,模型组H9c2心肌细胞中GRP78、CHOP、Caspase12蛋白表达均升高(P < 0.01);与模型组比较,中、低剂量柚皮苷组H9c2心肌细胞中GRP78表达、高剂量柚皮苷组心肌细胞中CHOP表达、各剂量柚皮苷组心肌细胞中Caspase12蛋白表达均下降( P < 0.05)。
2.5 柚皮苷对高糖诱导的H9c2心肌细胞炎症因子表达影响(图3、表2)
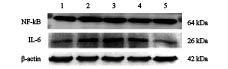
|
注:1 对照组;2 模型组;3~5 柚皮苷5、10、20 μmol/L组。 图 3 柚皮苷对H9c2心肌细胞炎症因子表达影响 |
| 表 2 柚皮苷对H9c2心肌细胞炎症因子表达影响 |
与对照组比较,模型组H9c2心肌细胞中炎症因子NF-кB、IL-6蛋白表达均升高(P < 0.01);与模型组比较,中、高剂量柚皮苷组H9c2心肌细胞中IL-6、NF-кB蛋白表达均下降( P < 0.05)。
3 讨 论糖尿病是一种常见的代谢障碍疾病,严重地威胁着人类健康,其中高血糖是糖尿病的主要临床表现之一,也是导致糖尿病并发症的高危因素之一,如糖尿病心肌病[10]。研究表明高血糖引起的心肌细胞凋亡在糖尿病心肌病的病理进程中发挥着重要作用,在DCM早期阶段就能观察到凋亡现象发生,而且是以进行性加重的形式贯穿DCM整个发病过程[11]。高葡萄糖血症(hyperglycemia)作为独立危险因素与DCM密切相关,其导致的心脏损害在1型和2型糖尿病中均存在,并且糖尿病患者发生心肌细胞凋亡的可能性大于非糖尿病患者[12]。ERS则是细胞正常生理状态及病理状态下常会遭遇到的重要负性事件,与细胞的损伤凋亡密切相关,已被广泛认为是诱导细胞凋亡的重要内源性信号途径之一[13]。
高糖可诱导体外培养的心肌细胞发生ERS反应,上调标志性蛋白GRP78表达,下游的凋亡相关蛋白CHOP、Caspase12表达也显著增加,表明高糖可诱导ERS反应,激活ERS反应介导心肌细胞凋亡[14]。本研究采用35 mmol/L葡萄糖[15]培养心肌细胞48 h,观察对H9c2心肌细胞存活率及凋亡的影响,结果显示,35 mmol/L葡萄糖处理H9c2心肌细胞48 h后能够诱发ERS发生,细胞发生凋亡,且存活率下降。提示,高糖诱导H9c2心肌细胞损伤模型建立成功。研究表明,在病理状态下,较其他的细胞器而言内质网对外界的刺激十分敏感、更早的受累,因此,内质网被广泛认为是细胞凋亡始动靶点,是诱导细胞凋亡的一类重要内源性信号途径[2]。Lakshmanan等[16]研究表明具有明显高糖血症且最终合并DCM并发症的患者心肌细胞均表现出强烈的ERS。通过缓解心肌细胞的ERS状态可以改善高糖血症及其引发的不良并发症[17 – 18]。
ERS指的是细胞在外界刺激下内质网稳态被破坏、功能发生紊乱,使大量错误折叠、未折叠蛋白在内质网腔内累积及钙平衡紊乱的过程[4],内质网应激诱导的细胞凋亡是糖尿病心肌病发病机制之一[12]。GRP78是内质网分子伴侣蛋白,平时处于无活性状态,表达上调是内质网应激的标志。早期内质网应激时,GRP78结合未折叠或错误折叠蛋白,通过减少蛋白合成、增加促进蛋白正确折叠的分子伴侣的表达和内质网相关降解来减轻ERS、恢复内质网稳态[13]。当内质网应激非常严重或持续时间长,ERS介导的未折叠蛋白反应(unfolded protein response,UPR)不能及时有效得到缓解时,凋亡就会发生,CHOP与Caspase12过度激活可促使细胞发生凋亡,二者作为ERS相关性凋亡信号通路中重要的关键性因子,用于ERS相关性凋亡强度的标志物已得到广泛认可。本研究结果显示,模型组H9c2细胞GRP78、CHOP和Caspase12蛋白表达均明显增高;柚皮苷干预后,H9c2细胞存活率升高,凋亡率降低,细胞内GRP78和CHOP蛋白表达水平明显下降。提示,ERS介导的Caspase 12/CHOP凋亡信号通路参与了高糖致H9c2细胞凋亡过程;柚皮苷可抑制高糖诱发的ERS反应介导的细胞凋亡。
近年研究显示,糖尿病患者处于慢性炎症状态,表现为炎症因子产生异常和炎症信号通路激活;而ERS应激在糖尿病的炎症反应中起着重要作用。内质网应激时,细胞启动UPR以恢复内质网稳态,但是当内质网应激时间过长或强度过大时,可以诱发炎性反应[2]。高糖诱导H9c2细胞损伤表现为细胞凋亡和炎症反应,包括IL-6释放增多以及心肌组织中NF-кB的激活。NF-κB是细胞内一种重要转录因子,在炎症反应中起着重要作用。它的激活可引起一些前炎症细胞因子,如白细胞介素 β(IL-1β)、IL-6和肿瘤坏死因子 α(tumor necrosis factor - alpha,TNF-α)等释放增多。本研究结果显示,高糖能够明显促进炎症因子IL-6的释放及NF-кB的激活;而加入柚皮苷干预后可明显抑制高糖诱导的炎症因子分泌。这与已有的研究结果一致[19]。严君等[20]研究表明ERS-UPR – 炎症反应在特定的细胞发生偶联是许多炎症疾病的发病机制。
综上所述,柚皮苷对高糖诱导的心肌细胞损伤具有一定抑制作用,其机制可能与下调ERS水平,抑制ERS介导的CHOP/Caspase12凋亡信号通路,从而抑制炎症因子IL-6和NF-κB释放有关。
| [1] | Bugger H, Abel ED. Molecular mechanisms of diabetic cardiomyopathy[J]. Diabetologia, 2014, 57(4): 660–671. DOI:10.1007/s00125-014-3171-6 |
| [2] | Li Z, Zhang T, Dai H, et al. Involvement of endoplasmic reticulum stress in myocardial apoptosis of streptozocin-induced diabetic rats[J]. J Clin Biochem Nutr, 2007, 41(1): 58–67. DOI:10.3164/jcbn.2007008 |
| [3] | Hong J, Kim K, Kim JH, et al. The role of endoplasmic reticulum stress in cardiovascular disease and exercise[J]. Int J Vasc Med, 2017, 2017: 1–9. |
| [4] | 冯利杰, 沈玉先, 李俊. 内质网应激与炎症[J]. 中国药理学通报, 2013, 29(6): 756–760. DOI:10.3969/j.issn.1001-1978.2013.06.005 |
| [5] | Alam MA, Subhan N, Rahman MM, et al. Effect of citrus flavonoids, naringin and naringenin, on metabolic syndrome and their mechanisms of action[J]. Adv Nutr, 2014, 5(4): 404–417. DOI:10.3945/an.113.005603 |
| [6] | Singh N, Bansal Y, Bhandari R, et al. Naringin reverses neurobehavioral and biochemical alterations in intracerebroventricular collagenase-induced intracerebral hemorrhage in rats[J]. Pharmacology, 2017, 100(3 – 4): 172–187. DOI:10.1159/000453580 |
| [7] | 孟娜娜, 白里雪, 李鑫鑫, 等. 柚皮苷对糖尿病及其并发症作用机制的研究进展[J]. 药物评价研究, 2017, 40(4): 560–565. |
| [8] | 张羽飞, 孟娜娜, 李厚忠, 等. 柚皮苷对糖尿病大鼠心肌病氧化应激及内质网应激的影响[J]. 中国中药杂志, 2018, 43(03): 596–602. |
| [9] | 张羽飞, 孟娜娜, 李厚忠, 等. 柚皮苷对糖尿病大鼠心肌纤维化及STAT3磷酸化水平的影响[J]. 药物评价研究, 2018, 41(01): 48–54. |
| [10] | Volpe CMO, Villar-Delfino PH, Dos Anjos PMF, et al. Cellular death, reactive oxygen species (ROS) and diabetic complications[J]. Cell Death Dis, 2018, 9(2): 119. DOI:10.1038/s41419-017-0135-z |
| [11] | Hu X, Bai T, Xu Z, et al. Pathophysiological fundamentals of diabetic cardiomyopathy[J]. Compr Physiol, 2017, 7(2): 693–711. |
| [12] | Huynh K, Bernardo BC, McMullen JR, et al. Diabetic cardiomyopathy: mechanisms and new treatment strategies targeting antioxidant signaling pathways[J]. Pharmacol Ther, 2014, 142(3): 375–415. DOI:10.1016/j.pharmthera.2014.01.003 |
| [13] | Toth A, Nickson P, Mandl A, et al. Endoplasmic reticulum stress as a novel therapeutic target in heart diseases[J]. Cardiovasc Hematol Disord Drug Targets, 2007, 7(3): 205–218. DOI:10.2174/187152907781745260 |
| [14] | Wang XM, Wang YC, Liu XJ, et al. BRD7 mediates hyperglycaemia-induced myocardial apoptosis via endoplasmic reticulum stress signalling pathway[J]. J Cell Mol Med, 2017, 21(6): 1094–1105. DOI:10.1111/jcmm.2017.21.issue-6 |
| [15] | Liang W, Chen M, Zheng D, et al. The opening of ATP-sensitive K+ channels protects H9c2 cardiac cells against the high glucose-induced injury and inflammation by inhibiting the ROS-TLR4-necroptosis pathway[J]. Cell Physiol Biochem, 2017, 41(3): 1020–1034. DOI:10.1159/000461391 |
| [16] | Lakshmanan AP, Harima M, Suzuki K, et al. The hyperglycemia stimulated myocardial endoplasmic reticulum (ER) stress contributes to diabetic cardiomyopathy in the transgenic non-obese type 2 diabetic rats: a differential role of unfolded protein response (UPR) signaling proteins[J]. Int J Biochem Cell Biol, 2013, 45(2): 438–447. DOI:10.1016/j.biocel.2012.09.017 |
| [17] | Yu H, Zhen J, Yang Y, et al. Ginsenoside Rg1 ameliorates diabetic cardiomyopathy by inhibiting endoplasmic reticulum stress-induced apoptosis in a streptozotocin-induced diabetes rat model[J]. J Cell Mol Med, 2016, 20(4): 623–631. DOI:10.1111/jcmm.2016.20.issue-4 |
| [18] | Xiong FY, Tang ST, Su H, et al. Melatonin ameliorates myocardial apoptosis by suppressing endoplasmic reticulum stress in rats with longterm diabetic cardiomyopathy[J]. Mol Med Rep, 2018, 17(1): 374–381. |
| [19] | 游琼, 郭润民, 刘畅, 等. 柚皮苷通过调控NF-κB通路抑制高糖引起的心肌细胞炎症与凋亡[J]. 广东医学院学报, 2015, 33(03): 251–254. DOI:10.3969/j.issn.1005-4057.2015.03.002 |
| [20] | 严君, 胡卓伟. 内质网应激偶联炎症反应与慢性病发病机制[J]. 生理科学进展, 2010, 41(04): 261–266. |
 2019, Vol. 35
2019, Vol. 35


