百日咳(whooping cough)是由百日咳鲍特菌(Bordetella pertussis,Bp)引起的急性呼吸道传染病。近年来,中国乃至全球百日咳发病率明显上升[1],红霉素是治疗百日咳的首选抗生素,Bp对红霉素的耐药性受到人们越来越多的关注[2]。大量研究证实百日咳鲍特菌23S rRNA基因的A2047G突变与其对红霉素的耐药性有关[3 – 4],即野生型菌株(敏感株)为A2047位点,突变型菌株(耐药株)为2047G位点。基因序列测定技术可直接检测耐药位点是否突变,也是行业内公认的金标准,但该技术费用相对昂贵且耗时较长,不适用于普通微生物实验室,尤其是经济不发达地区[5];此外,贴E-test药敏条方法可检测菌株对抗生素的耐药性,但该方法依旧昂贵且百日咳鲍特菌培养条件苛刻,临床分离培养率极低,导致其抗生素敏感试验常无法开展[6]。因此,本研究基于allele-specific PCR(AS-PCR)原理,建立一种简单、快速检测百日咳鲍特菌23S rRNA位点变异的方法,旨在为普通微生物实验室方便快速判断百日咳鲍特菌的红霉素耐药性提供技术支持。结果报告如下。
1 材料与方法 1.1 菌株西安市儿童医院2016年送检临床疑似百日咳儿童鼻咽拭子497份,经核酸提取,检测鲍特菌属特异性基因IS481和百日咳毒素基因PTX-Pr,得到IS481阳性核酸210例(42.2 %),在IS481阳性核酸中,PTX-Pr阳性168例(80.2 %),即送检疑似样本中确诊感染百日咳鲍特菌168例,为本研究样本,随机选取IS481、PTX-Pr基因检测均阴性标本100例为验证样本。百日咳鲍特菌标准株ATCC9797(野生株,也称为敏感株)、百日咳鲍特菌bp13068(突变株,也称为耐药株)、副百日咳鲍特菌ATCC 15311、支气管百日咳鲍特菌ATCC 4613、肺炎克雷伯菌ATCC 70060、大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 29213(西安市疾病预防控制中心实验室保存)。
1.2 主要仪器与试剂NP968核酸提取仪(西安天隆科技有限公司);PathoMPS S1000 Thermal Cycler PCR仪(美国BIO-RAD公司);QIAxcel Advanced超快速毛细管电泳仪(德国Qiagen公司);Hotstar TaqmasterMix、Size Marker(50~800 kb)、Alignment Marker(15~1 kb)(德国Qiagen公司);23S-F/23S-R/23S-M/23S-W引物合成(上海Invitrogen公司);基因序列测定(西安擎科生物有限责任公司)。
1.3 引物设计与评价 1.3.1 引物设计根据Genbank中发布的百日咳鲍特菌疫苗株CS全序列(CP002695.1),设计4条引物扩增23S rRNA基因的A2047G位点,其中23S-F(5'-GTGATGGGGTGCAAGCTCTT-3')与23S-R(5'-TCTGGCGACTCGAGTTCTGC-3')作为目标片段上下游引物,分别互补于23S rRNA基因的第1 842~1 861和2 109~2 128位碱基,扩增片段大小286 bp。23S-M(5'-ATCTACCCGCGGCTAGACAGG-3')与23S-W(5'-ATCTACCCGCGGCTAGACAGA-3')作为在3' 末端包含A2047G变异位点(3' 端第1个碱基)和特异性错配碱基A(3' 端第3个碱基)的上游引物,序列相同,位于23S rRNA基因的第2 027~2 047碱基,分别互补于百日咳鲍特菌突变型2047G位点和野生型A2047位点,与23S-R扩增目的片段大小112 bp。
1.3.2 引物有效性及特异性评价设置6孔反应体系,每孔包括HotstarTaqmaster Mix 10 μL,5 mol/L Betaine 4 μL,20 μmol/L的23S-F、23S-R各0.5 μL,加入引物与核酸,4种组合如下(20 μmol/L引物0.5 μL + 核酸2 μL):23S-W引物 + 敏感型核酸;23S-M引物 + 敏感型核酸;23S-M引物 + 耐药型核酸;23S-W引物 + 耐药型核酸。各孔ddH2O补足至20 μL;PCR产物经超快速毛细管电泳,观察能否扩增出特异性条带。
1.4 AS-PCR方法建立 1.4.1 第一阶段以样本核酸和验证核酸为模板配置20 μL反应体系,包括HotstarTaqmaster Mix 10 μL,5 mol/L Betaine 4 μL,20 μmol/L的23S-F、23S-R、23S-M各0.5 μL,模板2 μL,ddH2O 2.5 μL。经反应条件优化,设置热循环条件为95 ℃ 15 min,94 ℃ 1 min,61 ℃ 30 s,72 ℃ 30 s,循环35次,72 ℃ 10 min。产物经毛细管电泳,QIAxcel ScreenGel Software观察扩增条带与峰图。
1.4.2 第二阶段选取第一阶段只出一条目的片段的菌株核酸为模板配置20 μL反应体系,将23S-M替换为23S-W,经梯度PCR优化,设置退火温度为64℃,其余体系及热循环参数同1.4.1。产物经毛细管电泳,QIAxcel ScreenGel Software观察扩增条带与峰图。
1.4.3 最低检出限与特异性提取百日咳鲍特菌标准菌株ATCC9797及红霉素耐药株bp13068的DNA并定量后,倍比稀释核酸含量为100、10、1 pg/μL、100、10、1 fg/μL,采用1.4.1方法检测其最低检出限。提取百日咳鲍特菌标准菌株ATCC9797、副百日咳鲍特菌ATCC 15311、支气管百日咳鲍特菌ATCC 4613、肺炎克雷伯菌ATCC 70060、大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 29213核酸,作为模板,采用1.4.2方法检测其特异性。
1.4.4 方法应用评价以168例样本(核酸)和100例验证样本(核酸)为模板配置20 μL反应体系,进行AS-PCR第一阶段实验,产物经毛细管电泳,观察扩增条带与峰图。选取只出一条目的片段的样本核酸和所有验证核酸为模板配置20 μL反应体系,进行AS-PCR第二阶段实验,产物经毛细管电泳,QIAxcel ScreenGel Software观察扩增条带与峰图。
1.5 基因序列测定对百日咳鲍特菌标准株ATCC9797(野生株)核酸、bp13068(变异株)核酸、168例样本核酸和100例验证核酸A2047G位点进行基因序列测定,并将序列测定结果与AS-PCR方法检测结果比较。
1.6 统计分析采用SPSS 19.0软件进行数据处理,AS-PCR方法与金标准检测结果的一致性评价采用kappa值检验,检验水准为 α = 0.05。
2 结 果 2.1 引物有效性评价(图1)结果显示,观察到预期且明亮的1或2个片段,阴性对照(未加引物或未加模板)无条带出现,表明所设计引物能与敏感型核酸或突变型核酸的预期位置互补退火,有效性良好。
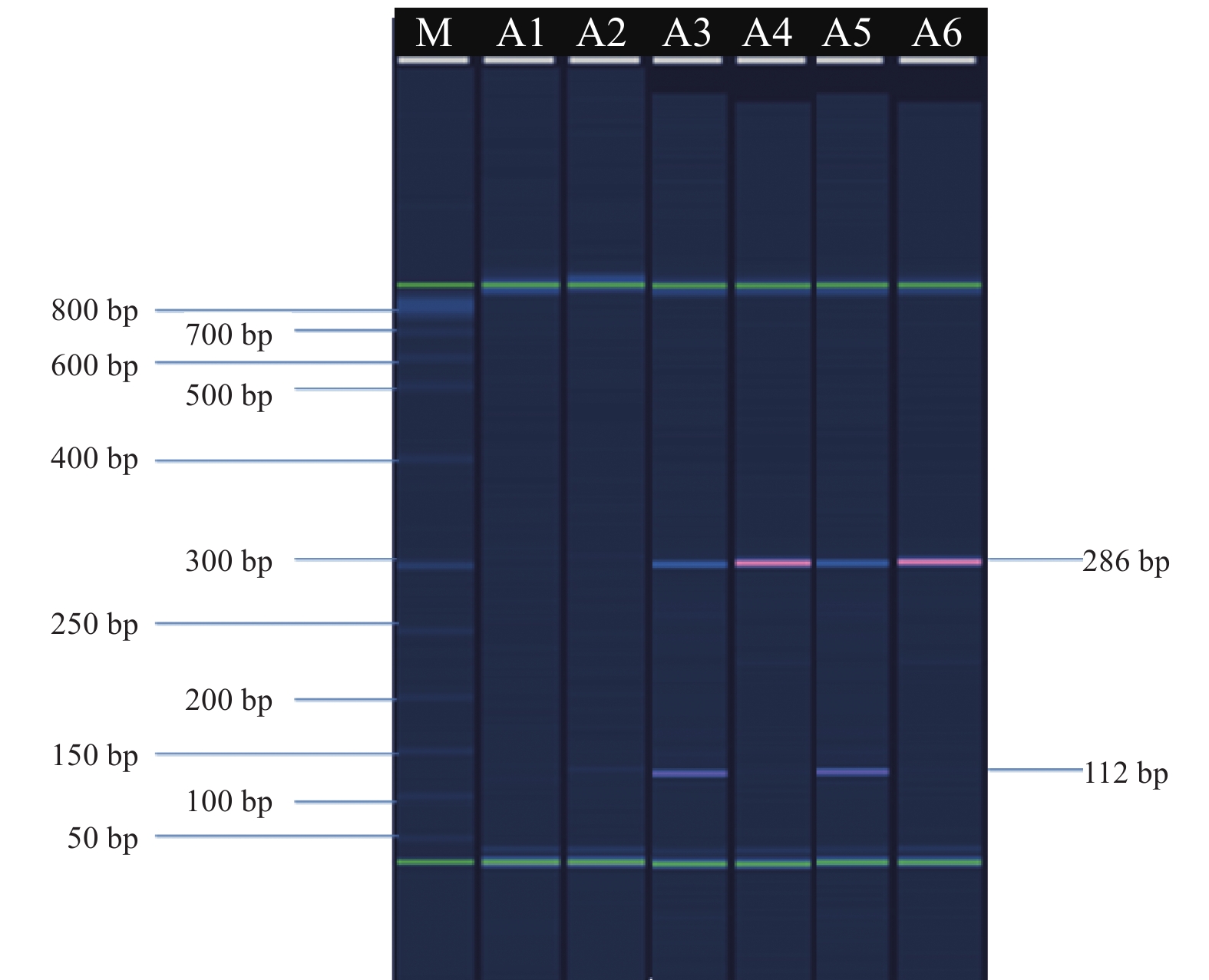
|
注:M:Size Marker;A1:阴性对照(无引物);A2:阴性对照(无模板);A3:23S-W引物+敏感型核酸;A4:23S-M引物+敏感型核酸;A5:23S-M引物+耐药型核酸;A6:23S-W引物+耐药型核酸。 图 1 引物有效性评价 |
2.2 最低检出限及特异性(图2、3)
核酸含量为100 pg/μL~10 fg/μL的耐药株及敏感株均可见清晰的目标条带,所建方法的最低检出限为核酸含量10 fg/μL(图2)。特异性检测中,除百日咳鲍特菌ATCC9797外,副百日咳鲍特菌ATCC15311及支气管百日咳鲍特菌ATCC4613也可见286 bp及112 bp 2个条带,其它种属细菌未见明显条带,表明方法特异性良好(图3)。
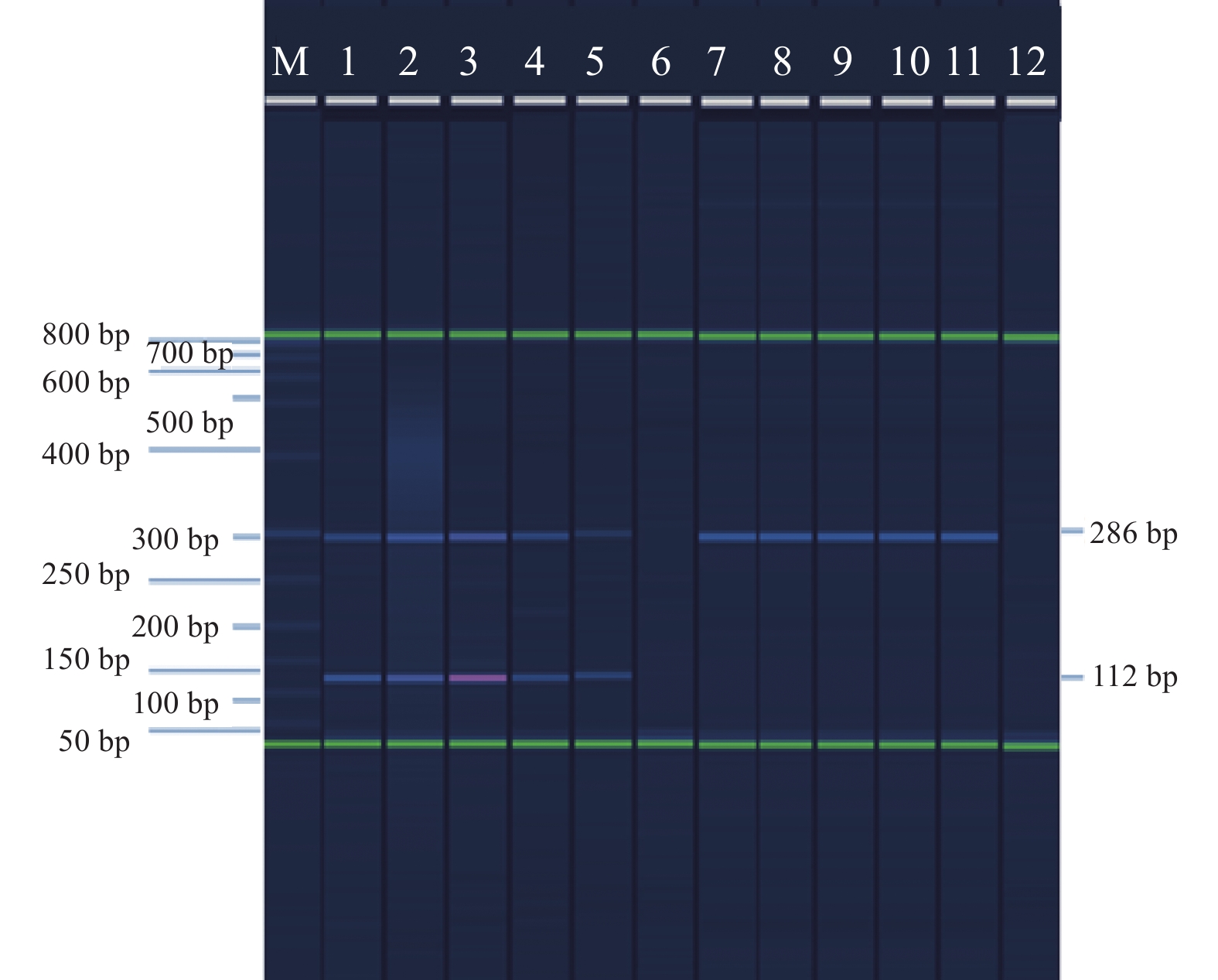
|
注:M:Size Marker;1~6:突变株bp13068,核酸含量依次为100、10、1 pg/mL、100、10、1 fg/mL;7~12:野生株ATCC9797,核酸含量依次为100、10、1 pg/mL、100、10、1 fg/mL。 图 2 不同含量核酸扩增产物毛细管电泳结果 |
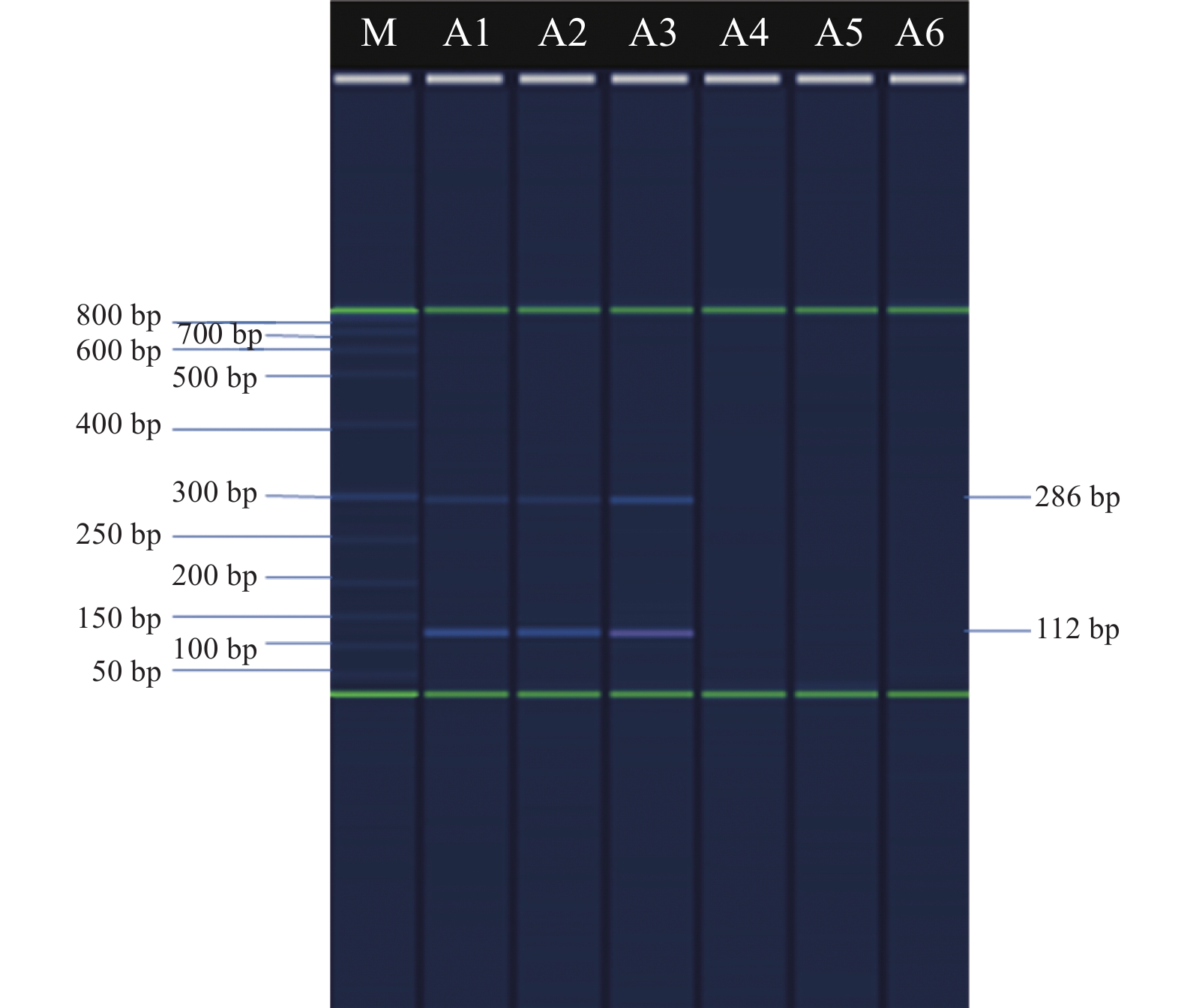
|
注:M:Size Marker;A1~A6:百日咳鲍特菌标准株ATCC9797;副百日咳鲍特菌ATCC 15311、支气管百日咳鲍特菌ATCC 4613、肺炎克雷伯菌ATCC 70060、大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 29213。 图 3 不同种属细菌AS-PCR检测结果 |
2.3 AS-PCR方法与金标准比较
以目前医学界公认的基因序列测定方法为金标准,评价AS-PCR方法的灵敏度与特异性。结果显示,150株突变型菌株核酸检测的灵敏度为96 %(144/150),特异度为100 %(100/100),假阴性率为4 %(6/150),假阳性率为0 %(0/100),kappa = 0.95(P < 0.01);对18株野生型菌株核酸检测的灵敏度为100 %(18/18),特异度为100 %(100/100),假阴性率0 %(0/18),假阳性率0 %(0/100),kappa = 1( P < 0.01)。表明AS-PCR方法对百日咳鲍特菌23S rRNA突变型和野生型的检测结果与金标准一致性良好。
3 讨 论近年来,百日咳发病率持续上升现象已引起中国学者的广泛关注[7 – 8]。红霉素是治疗百日咳首选抗生素,但相关研究发现,近年来百日咳对红霉素的耐药率持续增高[2]。23S rRNA基因的A2047G突变与其耐药性相关,目前尚未发现其它耐药机制。作为位点突变检测的基因序列测定法成本较高,有学者建立了限制性片段长度多态性聚合酶链反应(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)[3]及高分辨率溶解曲线的快速检测方法[2],但这2种方法与贴E-test药敏条法均需建立在成功的病原菌分离培养基础上,因临床上百日咳鲍特菌分离培养率极低,这些方法可行性较差。本研究基于allele-specific PCR原理建立的方法可通过PCR后电泳观察结果即可迅速发现百日咳鲍特菌A2047G位点突变与否,从而快速判定其对红霉素是否有耐药性。
在PCR反应中,引物3' 端最后几个碱基对扩增产物的特异性至关重要,本研究使用的突变引物23S-M的3' 端按照突变型而设计,即最后1个碱基为突变型百日咳鲍特菌2047位点G,突变型核酸可在此引物进行延伸,并最终出现2条扩增产物(23S-M和23S-F分别与23S-R引物所形成,长度112和286 bp),而野生型核酸由于该引物最后1个位点为A,则无法延伸,并最终只能出现一条扩增产物(23S-F和23S-R引物所形成,长度286 bp)。此外,为避免突变型核酸在23S-M和23S-R引物间发生低效率非特异性扩增,在23S-M引物3′端倒数第3个位点将原有碱基G设计为A,以达到最佳抑制突变型,而不影响野生型扩增效果;野生型引物23S-W的设计同理[9]。
本研究结果显示,AS-PCR方法检测150例突变型样本核酸,灵敏度为96 %,特异度为100 %,假阴性率4 %,假阳性率0 %;检测18例野生型样本核酸,灵敏度为100 %,特异度为100 %,假阴性率与假阳性率均为0 %,与金标准检测结果一致性良好。因此,AS-PCR方法基本可以替代基因序列测定方法,作为百日咳鲍特菌对红霉素耐药性的快速、简单测定方法,并适合在普通微生物实验室推广使用。
AS-PCR方法尚存在以下缺陷:(1)与测序技术比较,AS-PCR方法无法发现可能存在的其它突变;(2)由于鲍特菌属的23S rRNA基因相当保守[10],无法区分百日咳鲍特菌与副百日咳鲍特菌、支气管百日咳鲍特菌。
| [1] | Wang CQ, Zhu QR. Seroprevalence of Bordetella pertussis antibody in children and adolescents in China [J]. Pediatr Infect Dis J, 2011, 30(7): 593–596. DOI:10.1097/INF.0b013e31820eaf88 |
| [2] | Hang Q, Li M, Wang L, et al. High-resolution melting analysis for the detection of two erythromycin-resistant Bordetella pertussis strains carried by healthy school children in China [J]. Clin Microbiol Infect, 2013, 19(6): E260–E262. DOI:10.1111/1469-0691.12161 |
| [3] | Bartkus JM, Juni BA, Ehresmann K, et al. Identification of a mutation associated with erythromycin resistance inBordetella pertussis: implications for surveillance of antimicrobial resistance [J]. J Clin Microbiol, 2003, 41(3): 1167–1172. DOI:10.1128/JCM.41.3.1167-1172.2003 |
| [4] | Wang Z, Li Y, Hou T, et al. Appearance of macrolide-resistant Bordetella pertussis strains in China [J]. Antimicrob Agents Chemother, 2013, 57(10): 5193–5194. DOI:10.1128/AAC.01081-13 |
| [5] | 张国成, 孙新, 许东亮, 等. 我国人细小病毒B19VP1和VP2部分基因序列测定及变异分析[J]. 第四军医大学学报, 2002, 23(4): 298–303. |
| [6] | 黄海涛, 刘勇, 高志刚, 等. 不同病程百日咳病例各种实验室检测方法的对比研究[J]. 中国疫苗和免疫, 2014, 20(4): 330–334. |
| [7] | Cherry JD. Epidemic pertussis in 2012–the resurgence of a vaccine-preventable disease[J]. N Engl J Med, 2012, 367(9): 785–787. DOI:10.1056/NEJMp1209051 |
| [8] | Hozbor D, Mooi F, Flores D, et al. Pertussis epidemiology in Argentina: trends over 2004 – 2007[J]. J Infect, 2009, 59(4): 225–231. DOI:10.1016/j.jinf.2009.07.014 |
| [9] | Wang Z, Han R, Liu Y, et al. Direct detection of erythromycin-resistant Bordetella pertussisin clinical specimens by PCR [J]. Journal of Clinical Microbiology, 2015, 53(11): 3418–3422. DOI:10.1128/JCM.01499-15 |
| [10] | Muller M, Hildebrandt A. Nucleotide sequences of the 23S rRNA genes from Bordetella pertussis, B. parapertussis, B. bronchiseptica and B. avium, and their implications for phylogenetic analysis [J]. Nucleic Acids Res, 1993, 21(14): 3320–3324. DOI:10.1093/nar/21.14.3320 |
 2018, Vol. 34
2018, Vol. 34


