2. 美国疾病预防控制中心全球艾滋病项目中国办公室
随着艾滋病治疗越来越普及,T淋巴细胞亚群计数是评价艾滋病抗病毒治疗主要的免疫学指标[1],临床治疗方案的确定有赖于实验室的CD4检测结果[2],故CD4检测实验室的室内质量监测与评估是不可或缺[3]。目前国内各CD4检测实验室的室内质量控制主要依赖于采购进口的外部全血质控品,但不少CD4检测实验室处于松散甚至缺乏检测室内质控的状态。本研究在广西现场使用Cyto-Chex BCT管收集艾滋病病人的全血标本冷藏保存,通过不同时间的T淋巴细胞亚群计数检测验证其稳定性和细胞数衰减情况。
1 材料与方法 1.1 主要试剂与仪器抗体Multitest CD3 FITC/CD8 PE/CD45 PerCP/CD4 APC(美国,BD公司,批号52755,有效期至2016年11月30日);BD Trucount计数管(美国,BD公司,批号6050944,有效期至2017年12月31日),辅助试剂溶血素/FACS Lysing Solution (美国,BD公司,批号5054925,有效期至2017年3月31日)。Cyto-Chex BCT管(美国,Strec公司,k批号41970309,有效期至2016年7月16日)。流式细胞仪(美国,BD公司,FACSC- alibur)。
1.2 样本来源研究对象为2016年2月23 — 26日在广西壮族自治区疾病预防控制中心艾滋病抗病毒治疗门诊进行常规CD4+T淋巴细胞检测的艾滋病病毒感染者/病人,所有研究对象均经知情同意后,用美国BD公司的乙二胺四乙酸三钾抗凝真空采血管采集研究对象静脉血标本5 mL。
1.3 方法 1.3.1 样本量计算采用模拟方法,估计线性生长曲线模型检测变化率的把握度[4]。在经过5 000次模拟重复后,结果表示如果起始时细胞数平均值在350 个/μL时,至少需要15个样本,才可以有80 % 的把握检测到CD标记物在50 d的变化率为–3个细胞的差别。
1.3.2 质控品制备实验室在24 h内完成首次T淋巴细胞亚群检测后,将剩余全血样本轻柔地上下颠倒混匀8次,全部转移到Cyto-Chex BCT管中,再轻柔地上下颠倒混匀8次,从而完成质控品的制备,再置4℃(变化范围在2~8℃)冰箱保存备用。
1.3.3 分组根据首次CD4检测结果进行分组,若CD4细胞数 > 500个/μL的样本分为高值组,而 < 500 个/μL的样本分为低值组。高值组Cyto-Chex BCT管编号分别为“HL1, 2, 3…”,低值组Cyto-Chex BCT管编号分别为“LL1, 2, 3…”。
1.3.4 检测与检测间隔按照全国艾滋病检测技术规范[5] 和艾滋病病毒感染者及艾滋病患CD4+T淋巴细胞检测及质量保证指南[6]用绝对计数管和四色免疫荧光抗体染色法对自制质控品进行T淋巴细胞亚群检测,每管依次进行如下操作:加入CD3 FITC/CD8 PE/CD45 PerCP/CD4 APC抗体20 μL、质控品50 μL,混匀后室温避光反应15 min;加入450 μL溶血素,混匀后室温避光溶解15 min,用BD FACSCalibur流式细胞仪检测,Multiset自动分析软件进行CD3、CD4和CD8细胞绝对数分析,记录检测结果。每隔4 d检测1次,观察到第56 d,每份质控品共检测15次,每次检测后剩余标本存放于4℃(变化范围在2~8℃)冰箱,供下次检测使用。
1.3.5 不同水平模型的选择在不同水平模型的选择上,使用2水平(水平2为样本,水平1为各样本在不同时间的测量结果)和3水平模型(水平3为细胞类型,水平2为样本,水平1为各样本不同时间的测量结果)的最基本模型(即不包含预测因子,仅包含截距的随机效应)来分析选择哪种模型更为合理。2水平模型基本模型分析结果显示样本的截距项的检验统计量Z值为4.65,有统计学显著意义(P < 0.000 1),样本间组内相关系数值为41.90 %,说明41.90 % 变异可归因于样本间的差异。3水平模型基本模型分析结果显示,细胞类型组内相关系数为41.12 %,但细胞类型截距检验统计量 Z值为0.19,说明细胞类型不是细胞数量变化的主要影响因素(P = 0.117 0),固选择2水平模型。
1.3.6 模型5拟合分析的选择为分析不同因素对细胞数量变化的影响,基于2水平生长模型,本次分析构建了7种不同的模型,模型1为2水平生长模型基础模型,仅包含样本的随机效应。模型2在模型1的基础上,增加了时间(天数)固定效应,检验统计量t值为 – 2.04,在统计学上具有显著意义(P < 0.05)。模型3在模型2的基础上,增加的时间(天数)随机效应,协方差参数检验结果显示,不同样本细胞数量变化速度没有显著差别。模型4在模型3的基础上,增加了细胞类型固定效应,结果显示,与CD8细胞比较,CD3( t = 45.20,P < 0.000 1)和CD4( t = – 31.64,P < 0.01)细胞在数量上有显著性差异。模型5在模型4的基础上,增加了细胞水平固定效应,结果显示高值组细胞数量显著高于低值组细胞数量( t = 2.84,P < 0.01)。模型6在模型5的基础上,增加了时间与细胞水平交互作用固定效应,结果显示时间变量与细胞水平分组之间无显著交互作用( t = –1.75,P = 0.08),说明无论细胞水平高与低,样本保存期间细胞数量变化速度趋于一致。模型7在模型6的基础上,增加了时间与细胞类型交互作用固定效应,结果显示,细胞类型与时间之间无显著交互作用(F = 0.05,P = 0.95),说明细胞数量变化速度与细胞类型无关。综合以上因素本次研究选择模型5进行拟合分析。
1.4 统计分析各检测结果录入到Excel 2007中,用IBM SPSS 20.0软件计算各份全血质控品CD3+、CD4+、CD8+T淋巴细胞的均数(
本研究共制备了46份全血质控品,它们首次CD3+、CD4+、CD8+T淋巴细胞绝对数的均数分别为1 921、668、1 206个/μL。根据首次CD4+T淋巴细胞绝对数进行分组,高值组有25份,低值组有21份。
2.2 CD3+、CD4+、CD8+T淋巴细胞绝对数变化情况(表1)46份自备全血质控品在不同保存时间CD3+、CD4+、CD8+T淋巴细胞绝对数的变化情况见表1。CD3和CD4检测结果的变异系数各有3个值 > 15 %,CD8检测结果的变异系数有4个值 > 15 %,其余标本T淋巴细胞亚群计数检测结果的变异系数均 < 15 %。
| 表 1 不同保存时间CD3+、CD4+、CD8+T淋巴细胞变化情况(个/μL) |
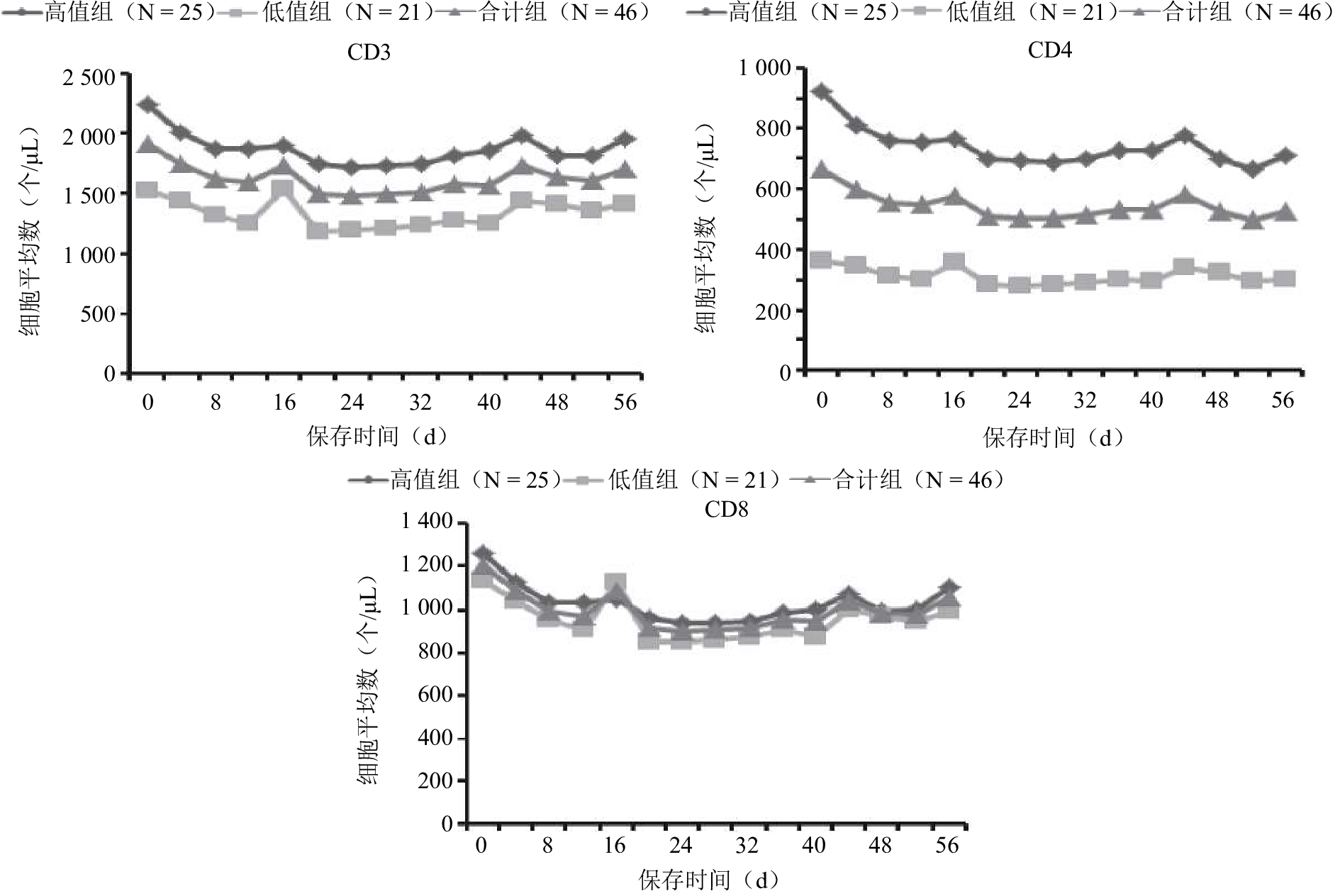
2.3 均值的变化趋势(图1)
随着时间推移T淋巴细胞亚群计数结果均值呈下降趋势。
|
图 1 不同保存时间CD3+、CD4+、CD8+T淋巴细胞检测均值的变化 |
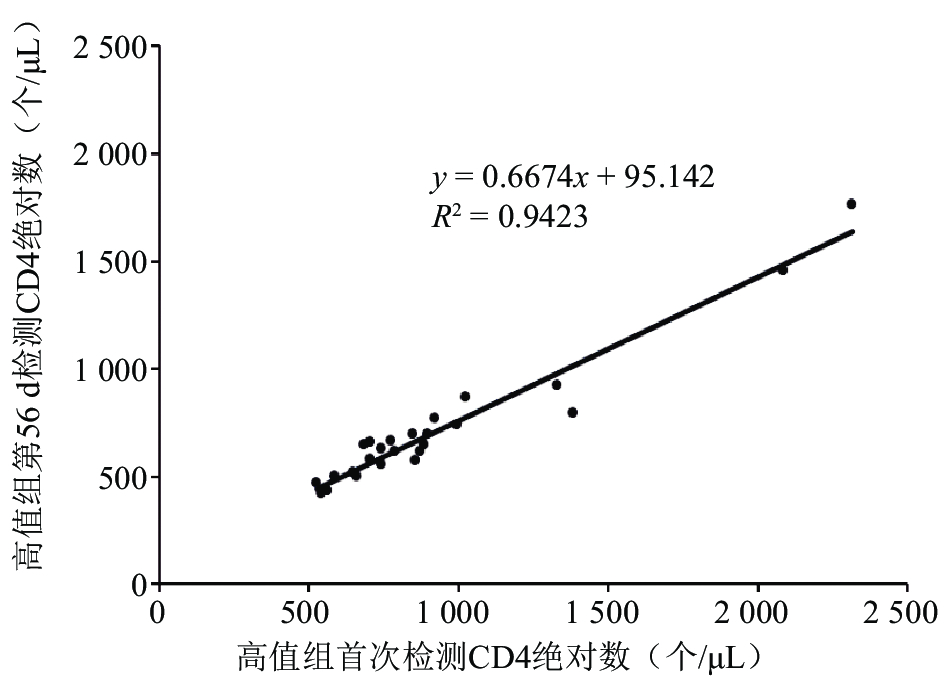
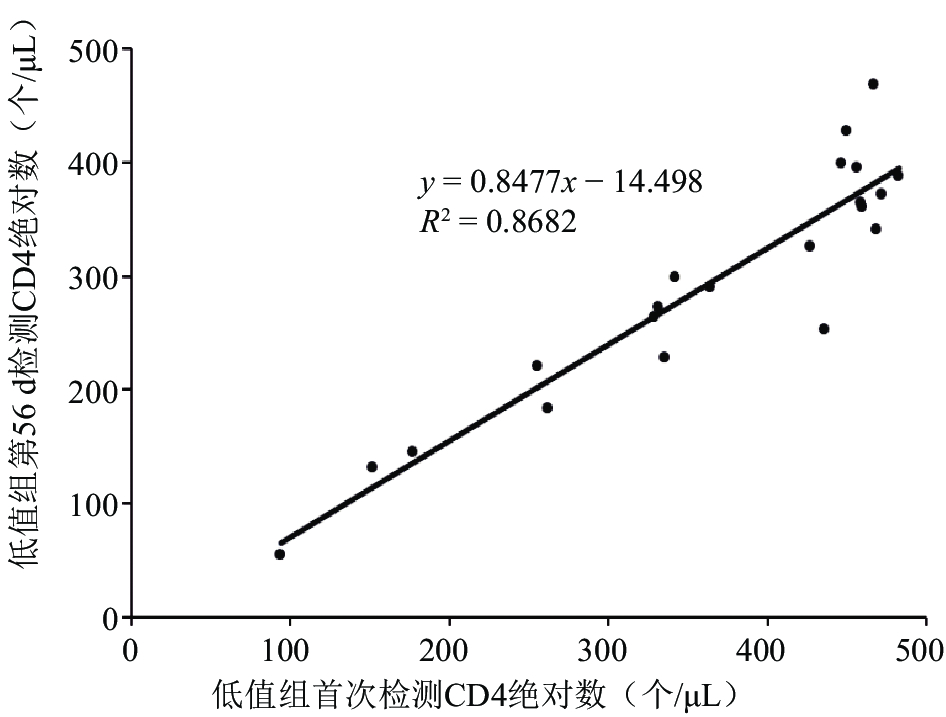
2.4 不同保存时间的检测结果与首次检测结果之间的相关性(图2、3)
46份自制全血质控品不同保存时间高、低值组CD3+、CD4+、CD8+T淋巴细胞绝对数与首次检测结果的相关系数均 > 0.9,其中第56 d高、低值组CD4计数与首次检测结果相关性见 图2、图3。
|
图 2 第56 d高值组CD4计数与首次检测结果相关性 |
|
图 3 第56 d低值组CD4计数与首次检测结果相关性 |
2.5 保存时间、细胞类型和基线细胞水平与细胞数量变化之间关系 2.5.1 不同模型结果比较(表2)
本次7种不同模型分析结果见表2,模型5和模型6的赤池信息准则(Akaike information criterion,AIC)结果分别为29 170.2和29 169.1,贝叶斯信息准则(Bayesian information criterion,BIC)结果分别为29 183和29 183.8,最终选择BIC结果小的模型5进行分析,可以有效防止模型精度过高造成的模型复杂度过高。
| 表 2 7种不同模型分析结果 |
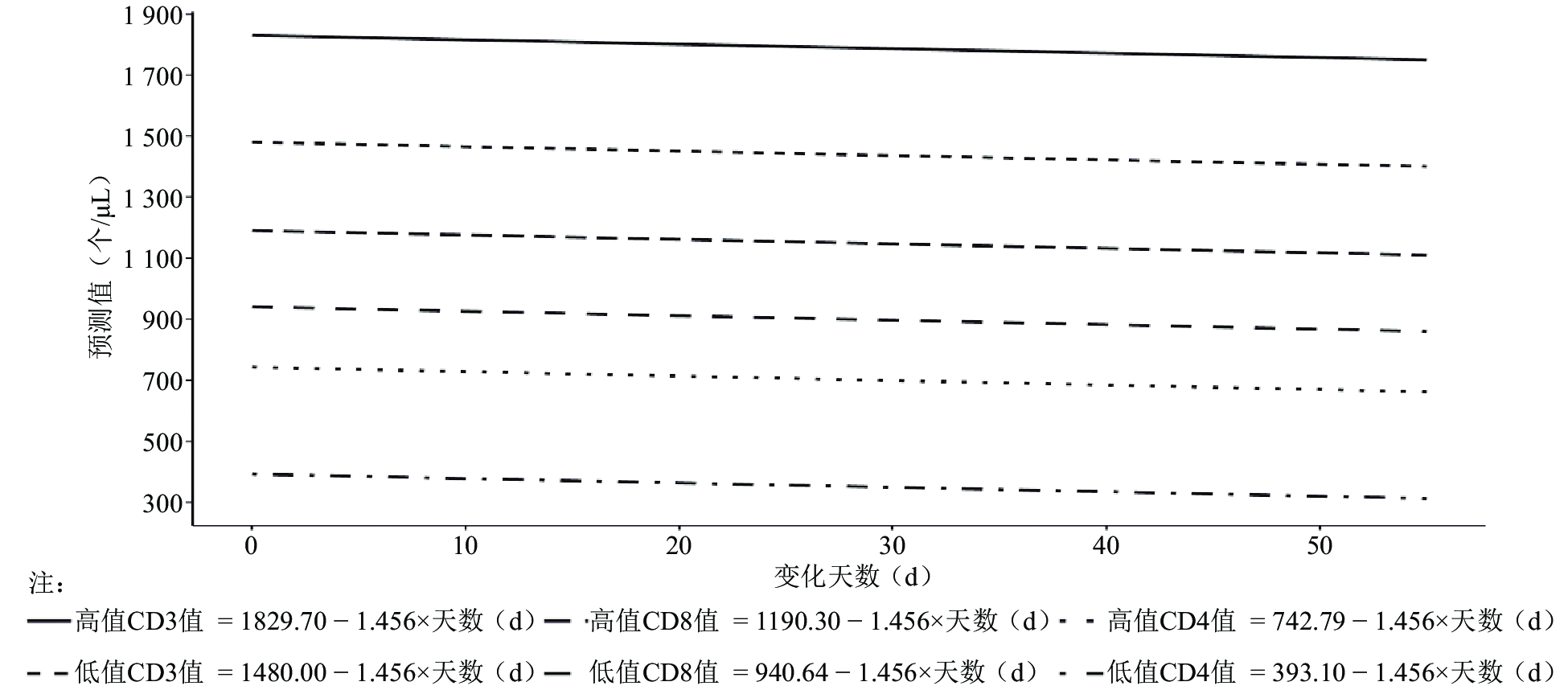
2.5.2 细胞数量的变化(图4)
研究分析期间自制的全血质控品CD3、CD4和CD8细胞数量平均每天衰减,每天的衰减量通过模型5拟合分析。T淋巴细胞亚群检测处理的自制全血质控品在观察期内的细胞数量变化速度与细胞水平(高值和低值)和细胞类型(CD3、CD4和CD8)无关,平均细胞数量减少速度为每天1.46个/μL。本研究中低值血样标本的3种细胞类型CD3、CD4和CD8的细胞数为1 480、393和841个/μL,按照检测技术指南建议的误差10 % 为可接受范围[6],则根据这个平均的细胞数量减少速度预测,低值的3种细胞类型CD3、CD4和CD8中检测均在10 % 允许误差范围的时间分别为148/1.46 = 101.4 d、39.3/1.46 = 26.9 d和84.1/1.46 = 57.6 d,即低值标本平均存放时间可以达到27 d;高值血样标本的3种细胞类型CD3、CD4和CD8的细胞数为1 830、743和1 190,允许误差范围的时间分别为183/1.46 = 125.3 d、74.3/1.46 = 50.9 d、119/1.46 = 81.5 d,即高值标本平均存放时间可以达到51 d。
|
图 4 模型5拟合分析结果 |
3 讨 论
全血质控品的使用是在T淋巴细胞亚群检测的实验过程中进行质量控制的有效手段,进口的全血质控品能较好的对实验进行质量控制,但其有效期短、价格昂贵、采购周期长等因素,实际上难以满足多数T淋巴细胞亚群检测实验室的质量控制需求。关于T淋巴细胞亚群计数样本的保存,在T淋巴细胞检测技术指南中规定样本应在采集后48 h内完成检测,若采用CD45设门可在72 h内完成检测,常规检测的标本保存时间短暂,实际工作中无法将其作为质控品监测每次试验的结果是否准确。因此,研制能在国内实验室应用的全血质控品,对CD4检测实验室开展T淋巴细胞亚群计数的质量控制具有实用价值,能提高检验质量,保证检测结果的准确性。
Cyto-Chex BCT管是一种添加了白细胞表面抗原稳定剂的真空采血管,有研究显示Cyto-Chex BCT管内稳定剂与新鲜全血混合后,全血的保存时间延长且淋巴细胞各表型百分比和绝对数目不受影响[7 – 8]。国内关于Cyto-Chex BCT管应用于实验室室内质量控制标本的制备及其可行性评估鲜有数据报道,保存剂自制T淋巴细胞亚群检测的全血质控品研究报道中,王建中等[9] 研究报道自制的全血质控品60 d内保持稳定,但其研究分析只是T淋巴细胞亚群百分比的稳定性,并未研究其绝对数的稳定性,不能用于定量分析的质量控制。本次研究对T淋巴细胞亚群的绝对数进行分析,经Cyto-chex BCT保存管制备后的全血质控品其T淋巴细胞亚群计数每个时间间隔的检测结果与首次检测结果相关系数均 > 0.9,相关性较好。CD3、CD4和CD8连续检测15次的结果中,90 % 以上的结果变异系数均 < 15 %,符合国内诊断要求的在15 % 以内标准 [10]。经模型分析,CD3、CD4和CD8细胞计数平均每天降低1.46个细胞/μL,每天降低细胞数较少,从而能有效的延长标本的存放时间,这就为Cyto-Chex BCT管制备的全血质控品用于T淋巴细胞亚群计数质量控制的可行性提供了理论依据。国外有研究发现经Cyto-chex BCT保存管制备的全血标本冷藏保存,9 d后磁珠分离检测CD4仍可获得可靠的结果[11]。而本次研究,新鲜全血标本及时处理并完成质控品的制备,分析得出低值平均最短有效期27 d,高值51 d,最短有效期也较国外研究用磁珠分离法检测CD4细胞延长近20 d,实际工作中只需每个月制备1次质控品,即可全程监控当月的T淋巴细胞亚群检测质量。
综上所述,Cyto-chex BCT保存管制备的全血质控品具有操作简便、价格便宜、稳定性好等优点,本质控品可用于流式细胞仪计数血液淋巴细胞亚群的室内质量控制,在27 d内使用稳定。但在进一步应用推广到室间质控前,还需对其他可影响质控品细胞稳定性因素进行评估,其中包括运输过程中的包装质量、温度、颠簸程度以及成本等。
| [1] | 郝连正, 朱晓艳, 胡军, 等. 山东省2001-2012年艾滋病抗病毒治疗效果分析[J]. 中国公共卫生, 2015, 31(12): 1555–1558. DOI:10.11847/zgggws2015-31-12-10 |
| [2] | 张福杰, 文毅, 于兰, 等. 艾滋病的抗病毒治疗与我国的免费治疗现状[J]. 科学导报, 2005, 23(7): 24–28. |
| [3] | 乔恩发, 陈会超, 杨莉, 等. CD4+T淋巴细胞检测内部质量控制[J]. 检验医学与临床, 2009, 6(2): 235–236. |
| [4] | Duncan TE, Duncan SC, Alpert A, et al. Latent variable modeling of longitudinal and multilevel substance use data[J]. Multivariate Behav Res, 1997, 32(3): 275–318. DOI:10.1207/s15327906mbr3203_3 |
| [5] | 中国疾病预防控制中心. 全国艾滋病检测技术规范[M]. 北京: 中国疾病预防控制中心, 2015: 53-56. |
| [6] | 中国疾病预防控制中心. 艾滋病病毒感染者及艾滋病患CD4+T淋巴细胞检测及质量保证指南[M]. 北京: 中国疾病预防控制中心, 2013: 18-21. |
| [7] | Warrino DE. Cyto-Chex BCT, not Cyto-Chex, should be used for preservation of CD4 cell counts[J]. JAIDS, 2006, 43(10): 503–504. |
| [8] | Warrino DE, DeGennaro LJ, Hanson M, et al. Stabilization of white blood cells and immunologic markers for extended analysis using flow cytometry[J]. Journal of Immunological Methods, 2005, 305(2): 107–109. DOI:10.1016/j.jim.2005.01.021 |
| [9] | 王建中, 汪润, 袁家颖, 等. 流式细胞术计数淋巴细胞亚群的全血质控品的研究[J]. 中华检验医学杂志, 2005, 28(9): 897–901. |
| [10] | 项凤梅, 王永梅, 符林春. 艾滋病病人生存质量的调查与分析[J]. 国外医学: 流行病学, 2005, 32(3): 138–139. |
| [11] | Truett AA, Letizia A, Malyangu E, et al. Efficacy of Cyto-Chex blood preservative for delayed manual CD4 testing using Dynal T4 Quant CD4 test among HIV-infected persons in Zambia[J]. J Acquir Immune Defic Syndr, 2006, 41(2): 168–174. DOI:10.1097/01.qai.0000191282.77954.fc |
 2018, Vol. 34
2018, Vol. 34


