2. 江苏省疾病预防控制中心;
3. 江苏省血吸虫病防治研究所
猩红热是中国重点防治的法定乙类传染病,是由A组溶血性链球菌感染引起的急性呼吸道传染病[1]。猩红热的发病人群主要集中在 < 15岁儿童,以发热、咽痛和红色皮疹为主要临床症状 [2 – 3]。近几年,中国各地区报告的猩红热较以往呈上升趋势,江苏省2015年上半年猩红热发病数较2014年同期增长46 %,猩红热逐渐成为重要的公共卫生问题[4 – 5]。迄今为止,仍然没有有效的猩红热疫苗供人们使用,因此探索该病流行的影响因素是有效预防和控制猩红热的关键。有研究表明,温度、日照时间和湿度等气象因素均会影响猩红热的流行,而这些研究并未考虑气象因素健康效应的非线性和滞后性[6 – 8],存在一定的局限性。为探讨江苏省气象因素对猩红热发病的影响,为猩红热的防制工作提供理论依据,本研究以江苏省2010年1月1日 — 2015年12月31日猩红热日发病数据及同期气象数据为基础,采用分布滞后非线性模型(distributed lag non-liner model,DLNM)分析气象因素对猩红热发病的影响。
1 资料与方法 1.1 资料来源江苏省2010年1月1日 — 2015年12月31日猩红热发病数据来源于中国疾病预防控制信息系统[9];2010 — 2015年人口学资料来源于江苏省统计局;同期日气象数据来自江苏省气象局,包括平均风速(m/s)、平均气温(℃)、平均气压(hPa)、最高气温(℃)、最低气温(℃)和相对湿度(%)等指标,本研究气温变化指标采用温差(温差 = 最高气温 – 最低气温)进行分析。
1.2 统计分析气象因素对疾病发病的影响不仅存在即时效应,且有一定的滞后效应,因此本研究采用DLNM分析气象因素对猩红热发病的影响。DLNM是在广义相加模型与分布滞后线性模型等传统模型的思想基础上结合而成,其核心思想是通过交叉基函数向暴露–反应关系添加滞后维度,从而同时描述效应在自变量维度和滞后维度的变化分布[10 – 11]。本研究首先通过Spearman相关分析探索猩红热与气象因素之间的相关关系,筛选出与猩红热流行相关的气象因素;其次,为了克服多重共线性,计算气象因素之间的Spearman相关系数(rs);当|rs| > 0.7时认为高度相关,则取与猩红热相关系数高的气象因素进入最终的DLNM [12]。为了克服过度离散的影响,采用quasi-Poisson分布作为DLNM的连接函数[11, 13],以拟合气象因素与猩红热流行的关系,模型表达式如下:Log[E(Yt)] = α + Σcb(xi,df1i,lagi,df2i)+ NS(timet)。式中,Yt:t日猩红热发病数;α:截距;cb():交叉基矩阵,用于拟合气象因素非线性与滞后关系;xi:不同的自变量;df1i:自变量平滑的自由度;lagi:最大滞后天数;df2i:滞后变量的自由度;NS():自然立方样条函数;timet:时间变量,用以控制长期趋势和季节性趋势。猩红热的潜伏期为1~7 d(一般为2~3 d)[1],因此本研究将最大滞后时间设为10 d。通过查阅既往DLNM相关文献[14 – 15],结合最小赤池信息准则(Akaike information criterion,AIC)选择模型自由度,最终确定平均温度、温差和相对湿度的自由度为3,滞后维度均采用多项式回归样条进行基函数的变换,自由度均为3,AIC为9 161.818。本研究应用R 3.3.0软件进行统计分析,通过“cor.test()”函数进行Spearman相关分析和DLNM分析,使用“dlnm”包拟合DLNM。检验水准为双侧检验 α = 0.05。
2 结 果 2.1 江苏省2010 — 2015年猩红热发病和气象因素基本情况(表1、图1)江苏省2010 — 2015年共报告新发猩红热病例10 886例,年均发病率为2.29/10万;其中男性新发病例6 748例,女性4 138例,男女性别比为1.63 : 1。由猩红热发病的时间序列图(图1)可见,猩红热发病具有季节性,且呈双峰,第一高峰出现在3 — 7月,第二高峰出现在11月 — 次年1月。同期每日气象因素的基本情况见表1。
| 表 1 江苏省2010 — 2015年每日气象因素基本情况 |

|
图 1 猩红热发病数与气象因素的时间序列图 |
2.2 猩红热与气象因素关系的相关分析(表2)
相关分析结果显示,平均气温和相对湿度与猩红热发病均呈负相关(rs = – 0.140、– 0.132,均P < 0.05);平均气压和温差与猩红热发病均呈正相关( rs = 0.051、0.172,均P < 0.05)。由于日平均气温与平均气压呈高度相关( rs = –0.890,P < 0.05),因此最终纳入DLNM模型的变量为平均气温、温差和相对湿度。
| 表 2 猩红热与气象因素关系的相关分析(rs) |
2.3 江苏省气象因素对猩红热发病影响DLNM分析 2.3.1 平均气温对猩红热发病影响(图2)
以0 ℃作为参照值,计算平均气温对猩红热发病的相对危险度,结果见图2。不同气温在不同滞后时间下对猩红热的发病呈不同效应,温度较低时会导致猩红热发病增多,且对猩红热发病的影响时间较长,其效应在滞后10 d时,依然呈正效应;而后随着温度的升高,猩红热发病风险降低;当气温达到15~30 ℃时猩红热发病风险再次增加。但与低温不同,此效应为即时效应,随着滞后时间的延长,相对危险度迅速下降。

|
图 2 猩红热发病相对危险度随平均气温与滞后时间变化图 |
2.3.2 温差对猩红热发病影响(图3)
以最小温差1.74 ℃作为参照值,计算温差对猩红热发病相对危险度,结果见图3。当气温变化较小时,猩红热发病风险相对较小,呈持续时间较长的保护效应;但随着气温变化加大,猩红热的发病数也不断增加,且温差越大,猩红热发病风险持续时间越长。
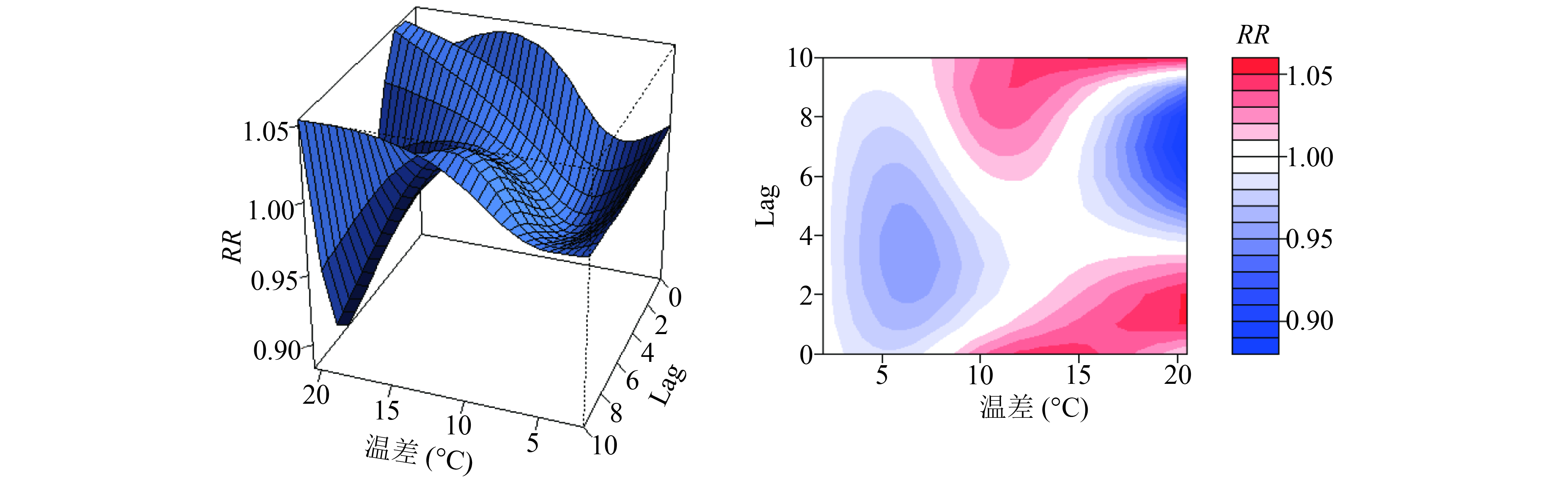
|
图 3 猩红热发病相对危险度随温差与滞后时间变化图 |
2.3.3 相对湿度对猩红热发病影响(图4)
以相对湿度中位数74.26 %作为参照值,计算不同湿度不同滞后时间对猩红热发病的相对危险度,结果见图4。干燥的气象条件下,猩红热的发病风险较高,且此影响时间较长;当相对湿度较为舒适时,猩红热的发病数则减少;在环境非常潮湿时,相对湿度对猩红热发病呈保护效应,且在滞后5 d时仍存在。

|
图 4 猩红热发病相对危险度随相对湿度与滞后时间变化图 |
3 讨 论
猩红热流行趋势的上升不仅给中国公共卫生带来严峻的挑战,同时也成为其他国家日益严重的公共卫生问题[5, 16]。本研究探讨了江苏省2010 — 2015年气象因素对猩红热发病的影响,为提高猩红热预防控制措施的时效性、降低猩红热发病率提供科学依据。
本研究结果显示,当平均气温达到15~30 ℃时,猩红热发病数不断增加,与吴昊澄等[17]利用广义相加模型发现猩红热流行较为适宜的温度范围为10~25 ℃的结果相近。其原因可能是在此温度范围的自然环境条件下,A组溶血性链球菌大量繁殖[6],同时人们外出活动开始增加,使得易感人群暴露感染的机会增加,从而引起猩红热发病率的升高。但低温条件对猩红热发病的影响则与吴昊澄等[17]研究中低温时猩红热发病风险较低的结果相反,这与猩红热第二发病高峰出现在11月—次年1月相吻合,与Duan等[6]研究结果一致。这主要与生活习惯有关,当气温较低时,人们(尤其在校学生)为了保暖,通常将门窗紧闭,从而导致室内空气不流通,增加暴露机会,导致猩红热患病风险和暴发疫情风险增加[6, 18]。同时鉴于低温效应持续时间较长,应坚持每天定时开窗通风,保持良好的室内空气质量,以降低呼吸道传染病的患病和暴发风险。
本研究引入温差指标,用以反映每天气温变化情况,结果显示随着气温变化幅度的增加,猩红热发病率也有所上升,且持续时间较长。Duan等[8]在北京和香港两地的猩红热研究中也发现猩红热发病率和温差呈正相关。有研究表明,气温的突然变化可能导致呼吸道上皮细胞产生病理生理反应,如支气管痉挛和炎症变化,进而影响呼吸道防御效果,尤其对于免疫系统尚未完善的儿童,更易导致病原体进入机体引发疾病;同时,温差增大有利于病毒/细菌等病原体吸附于灰尘、花粉等悬浮物,可增加暴露危险性,导致猩红热发病率的上升[19]。为此,社区公共卫生部门应根据天气变化,及时提醒当地居民注意抗寒保暖,预防猩红热等呼吸道传染病的发生。
本研究结果还显示,在干燥的条件下,猩红热发病风险增加,而后随相对湿度的增加发病风险降低,与文献[6 – 7, 20]的研究结果相似。其原因可能是病原体在干燥的空气中沉降速度慢,且已沉降病原体容易重新漂浮回到空气中,导致病原体在空气中的暴露时间变长,增加人群的感染机会[6, 21]。因此,可通过增加室内的空气湿度(如使用加湿器)加快病原体的沉降速度来预防猩红热等呼吸道传染病,建议人们在外出活动时尽量佩戴口罩,减少与致病菌的接触。
本研究根据江苏省2010 — 2015年猩红热日发病数据和同期气象数据,采用DLNM分析气象因素与猩红热发病的非线性关系以及其滞后效应。结果显示,平均温度、温差和相对湿度在不同数值不同滞后时间对猩红热发病存在不同的效应。猩红热疫情的防制工作应根据各地区气候条件进行开展,提高防制效率。由于数据限制,本研究无法充分考虑其他影响因素(如降雨量、空气污染、社会经济等因素),可能存在一定缺陷,因此对于猩红热疫情的其他关键影响因素尚有待于进一步深入研究。
| [1] | 刘贞艳, 毕振强. A群链球菌病原学与流行病学研究进展[J]. 中华流行病学杂志, 2014, 35(6): 752–754. |
| [2] | 李雷雷, 蒋希宏, 隋霞, 等. 中国2005 — 2011年猩红热疫情流行病学分析[J]. 中国公共卫生, 2012, 28(6): 826–827. DOI:10.11847/zgggws-2012-28-06-41 |
| [3] | 刘展, 王本旭, 汪水城. 全国2003 — 2008年猩红热流行动态分析[J]. 公共卫生与预防医学, 2009, 20(5): 21–22, 25. |
| [4] | 秦颖, 冯录召, 余宏杰. 2015年春夏季全国猩红热疫情流行病学特征分析[J]. 疾病监测, 2015, 30(12): 1002–1007. DOI:10.3784/j.issn.1003-9961.2015.12.005 |
| [5] | Mahara G, Chhetri JK, Guo X. Increasing prevalence of scarlet fever in China[J]. BMJ, 2016, 353: i2689. |
| [6] | Duan Y, Huang XL, Wang YJ, et al. Impact of meteorological changes on the incidence of scarlet fever in Hefei city, China[J]. Int J Biometeorol, 2016, 60(10): 1543–1550. DOI:10.1007/s00484-016-1145-8 |
| [7] | Mahara G, Wang C, Yang K, et al. The association between environmental factors and scarlet fever incidence in Beijing region: using GIS and spatial regression models[J]. Int J Environ Res Public Health, 2016, 13(11): 1083–1098. DOI:10.3390/ijerph13111083 |
| [8] | Duan Y, Yang LJ, Zhang YJ, et al. Effects of meteorological factors on incidence of scarlet fever during different periods in different districts of China[J]. Sci Total Environ, 2017, 581 – 582: 19–24. |
| [9] | Wang L, Wang Y, Jin S, et al. Emergence and control of infectious diseases in China[J]. Lancet, 2008, 372(9649): 1598–1605. DOI:10.1016/S0140-6736(08)61365-3 |
| [10] | Gasparrini A, Armstrong B, Kenward MG. Distributed lag non-linear models[J]. Stat Med, 2010, 29(21): 2224–2234. DOI:10.1002/sim.v29:21 |
| [11] | 杨军, 欧春泉, 丁研, 等. 分布滞后非线性模型[J]. 中国卫生统计, 2012, 29(5): 772–773, 777. |
| [12] | Hjort J, Suomi J, Käyhkö J. Extreme urban-rural temperatures in the coastal city of Turku, Finland: quantification and visualization based on a generalized additive model[J]. Science of the Total Environment, 2016, 569 – 570: 507–517. |
| [13] | 潘洁, 杨军, 李萌萌, 等. 分布滞后非线性模型在气象因素对手足口病发病影响研究中的应用[J]. 环境与健康杂志, 2016, 33(5): 377–380, 封3. |
| [14] | Wang C, Zhang Z, Zhou M, et al. Nonlinear relationship between extreme temperature and mortality in different temperature zones: a systematic study of 122 communities across the mainland of China[J]. Science of the Total Environment, 2017, 586: 96–106. DOI:10.1016/j.scitotenv.2017.01.218 |
| [15] | Huang R, Bian G, He T, et al. Effects of meteorological parameters and PM10 on the incidence of hand, foot, and mouth disease in children in China [J]. International Journal of Environmental Research and Public Health, 2016, 13: 481. DOI:10.3390/ijerph13050481 |
| [16] | Wong SS, Yuen KY. Streptococcus pyogenes and re-emergence of scarlet fever as a public health problem[J]. Emerg Microbes Infect, 2012, 1(7): e2. DOI:10.1038/emi.2012.9 |
| [17] | 吴昊澄, 林君芬, 徐校平, 等. 广义相加模型拟合气象因素与猩红热发病的关联性[J]. 浙江预防医学, 2016, 28(1): 5–8. |
| [18] | Choo CP, Jalaludin J. An overview of indoor air quality and its impact on respiratory health among Malaysian school-aged children[J]. Rev Environ Health, 2015, 30(1): 9–18. |
| [19] | Cheng J, Xu Z, Zhu R, et al. Impact of diurnal temperature range on human health: a systematic review[J]. Int J Biometeorol, 2014, 58(9): 2011–2024. DOI:10.1007/s00484-014-0797-5 |
| [20] | 王炳翔, 朋文佳, 闫军伟, 等. 猩红热的发病率与气象因素的负二项回归分析[J]. 中华疾病控制杂志, 2014, 18(2): 166–168. |
| [21] | Lowen AC, Mubareka S, Steel J, et al. Influenza virus transmission is dependent on relative humidity and temperature[J]. PLoS Pathog, 2007, 3(10): 1470–1476. |
 2018, Vol. 34
2018, Vol. 34


