心肌梗死(myocardial infarction, MI)是冠心病患者严重的心脏事件,其后的心室重构可导致心力衰竭、心跳骤停、恶性室性心律失常甚至心源性猝死,严重威胁人类健康。据世界卫生组织报道,全球每年有1 600万人死于心血管疾病,其中29%的人死于MI及其并发症[1]。多年来人们一直尝试各种治疗方法以期逆转心室重构、改善MI预后,但效果却不尽人意。MI后心室重构的发生、发展是一个涉及多阶段、多因素异常积累的复杂过程。心肌成纤维细胞的异常增殖、迁移和胶原纤维的异常分泌是影响心室重构发生、发展的关键因素,任何能够影响心肌成纤维细胞上述生物学行为的因素均有可能影响心室重构。
Syndecan-1(Sdc1)是一种由硫酸乙酰肝素链和硫酸软骨素链修饰的Ⅰ型跨膜蛋白多糖,主要表达于上皮细胞表面,以共受体方式参与细胞-细胞、细胞-基质间黏附以及细胞的迁移[2]。近年来有研究发现,Sdc1与肿瘤细胞的多种生物学行为密切相关[3],但Sdc1是否参与了心肌成纤维细胞生物学行为的调控尚不清楚。研究发现,Sdc1在MI后表达上调[4];Sdc1过表达能够改善MI后心室重构[5],具体机制尚不明确。本研究通过将Sdc1小干扰RNA(siRNA)及Sdc1高表达质粒转染体外培养的心肌成纤维细胞,观察改变Sdc1表达后心肌成纤维细胞的增殖、活力、胶原分泌和迁移能力等生物学行为变化,旨在明确Sdc1在MI后心室重构中的作用。
1 材料与方法 1.1 主要试剂带有目的片段大鼠Sdc1 cDNA质粒pCMV-Sport6.1-Sdc1(美国ATCC公司);Sdc1高表达质粒由诺赛基因组研究中心有限公司构建。空载质粒pEGFP-C2(美国Clontech公司)。Sdc1 siRNA干扰序列由广州永诺生物科技有限公司化学合成,上游:5′-AGG AGG AAU UCU AUG CCU GAT T-3′,下游:5′-UCA GGC AUA GAA UUC CUC CUT T-3′;无关序列上游:5′-UUC UCC GAA CGU GUC ACG UTT-3′,下游:5′-ACG UGA CAC GUU CGG AGA ATT-3′。Sdc1兔多克隆抗体(zymed)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔多克隆抗体、辣根过氧化物酶标记羊抗兔IgG(美国Affinity BioReagents公司);增强型化学发光(enhanced chemiluminescence,ECL)试剂盒(美国Pierce公司);Bradford蛋白定量试剂(上海碧云天生物技术研究所),胎牛血清(美国Hyclone公司),细胞计数试剂盒(cell counting kit-8,CCK-8)(日本同仁化学研究所),Transwell 24孔板(美国Corning公司)。
1.2 心肌成纤维细胞分离培养与基因转染胰酶消化和差速贴壁法分离Sprague-Dawley(SD)大鼠乳鼠心肌成纤维细胞[6],37 ℃,5% CO2条件下,用含10%胎牛血清的细胞培养基(Dulbecco′s modified Eagle medium,DMEM)进行体外培养。细胞融合90%时进行传代,按1.5~2.0×105个/孔密度接种至6孔板中,待细胞长至对数生长期70%融合后,予以更换含0.5%胎牛血清的正糖培养基饥饿24 h,使细胞进入同步化状态。饥饿后更换含10%胎牛血清的培养基,进行分组转染。实验设空白对照组(0.9% NaCl)、NC siRNA组(转染无关序列)、Sdc1 siRNA组(转染Sdc1 siRNA序列)、空载质粒组(转染空载质粒)、Sdc1组(转染Sdc1高表达质粒),每组5孔。
1.3 指标与方法 1.3.1 心肌成纤维细胞中Sdc1蛋白表达检测采用蛋白质印迹法,收集各组细胞,提取总蛋白,Bradford法行蛋白定量后取40 μg蛋白上样,通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离后,湿法电转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜;5%脱脂奶粉封闭1 h,加入Sdc1兔多克隆抗体(1:100)、GAPDH兔多克隆抗体(1: 100),4 ℃过夜;用磷酸盐缓冲液(phosphate buffer solution,PBS)与Tween-20的混合液(PBST)洗膜后加入辣根过氧化物酶标记的羊抗兔IgG(1: 2 000)室温孵育2 h;ECL发光液发光,胶片显色。扫描胶片,用BandScan 5.0软件分析,结果以样品光密度与GAPDH光密度比值表示。
1.3.2 细胞增殖能力检测采用流式细胞术,收集各组细胞培养液至流式专用管,加1 mL PBS洗涤细胞1次,用不含乙二胺四乙酸的胰酶消化细胞,1 mL PBS洗涤剩余细胞1次(所有清洗液和细胞消化液均收集入上述专用管中),800 g离心6 min,去上清,PBS清洗1次;以1 mL PBS重悬细胞,取300 μL细胞悬液,将细胞逐滴加入700 μL预冷的无水乙醇中,4 ℃避光固定过夜;800 g离心10 min,去上清;PBS清洗2次,重悬细胞于500 μL含100 U/mL的RNase A的PBS中37 ℃避光孵育30 min,加2 mg/mL溴化乙锭(PI)至终浓度为50 μg/mL,避光孵育30 min。上流式细胞仪以标准程序检测细胞生长周期,并计算S期比率和增殖指数。S期比率=S/(G0/G1+S+G2/M);增殖指数=(S+G2/M)/(G0/G1+S+G2/M)。
1.3.3 心肌成纤维细胞活力检测采用CCK-8法,按2.0~3.0×103个/孔密度接种细胞至96孔板。在干净的Eppendorf管中将CCK-8与培养基按每孔10 μL:100 μL的比例预混合;吸干96孔板中需要检测的实验孔,用PBS洗涤1次;加入预混好的CCK-8和培养基的混合液;37 ℃孵育0.5~1 h,待开始显色后于酶标仪下读取450 nm处吸光度(A)值。
1.3.4 细胞胶原(羟脯氨酸)分泌能力[7-8]检测采用ELISA(enzyme-linked immunosorbent assay)法,收集各组细胞培养上清液,采用双抗体夹心法检测羟脯氨酸表达,严格按说明书操作。将10 000 pg/mL标准品配制成0~5 000 pg/mL系列浓度的标准液用于制备标准曲线。各待测蛋白样品取100 μL加入酶标板,37 ℃覆膜孵育90 min;弃去孔内液体,用洗涤液洗板2次;每孔加入生物素抗体工作液100 μL,37 ℃覆膜孵育60 min;弃去孔内液体,反复洗板3次,每次浸泡1 min;每孔加入A、B、C 3种工作液各100 μL,37 ℃反应30 min;弃去孔内液体,反复洗板5次,每次浸泡1~2 min;每孔加入已在37 ℃平衡30 min的底物溶液100 μL,37 ℃避光反应,当标准孔前3~4孔出现明显的梯度蓝色时,每孔加入终止液100 μL,终止反应(显色时间不超过30 min),在酶标仪上读取每孔450 nm吸光度(A)值,在标准曲线上查出相应浓度。
1.3.5 细胞迁移能力检测采用Transwell法,对数生长期细胞常规消化后用含0.5%胎牛血清(fetal bovine serum,FBS)的目的培养基制成细胞悬液,调整密度为1.0×105个/mL,取100 μL细胞悬液加入transwell上室,在下室内加含10%FBS的目的培养基500 μL,继续培养16 h,取出transwell上室,PBS洗3次,并用棉签轻轻拭去微孔膜上层细胞,4%多聚甲醛固定30 min,结晶紫染色15 min,随机选取4个视野(×200)在倒置显微镜下计数移至微孔膜下面的细胞数,取其平均值。
1.4 统计分析计量资料以均数±标准差表示,应用SPSS 23.0软件进行统计分析,多组间均数的比较采用单因素方差分析,多组间两两比较采用最小显著差法;P<0.05为差异有统计学意义。
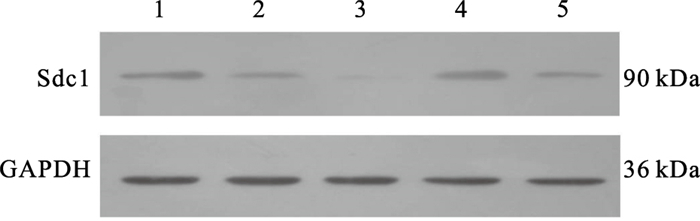
2 结果 2.1 转染Sdc1 siRNA和Sdc1高表达质粒对细胞Sdc1蛋白表达影响(图 1)
|
注:1:空白对照组;2:NC siRNA组;3:Sdc1 siRNA组;4:Sdc1组;5:空载质粒组。 图 1 转染Sdc1 siRNA对心肌成纤维细胞中Sdc1蛋白表达影响 |
蛋白印迹结果显示,与空白对照组和NC siRNA组比较,Sdc1 siRNA组心肌成纤维细胞中Sdc1蛋白表达明显下降,其反应条带的校正灰度值分别为空白对照组和NC siRNA组的19.6%和25.3%。与空白对照组和空载质粒组比较,Sdc1组心肌成纤维细胞中Sdc1蛋白表达明显上升,其反应条带的校正灰度值分别为空白对照组和空载质粒组的1.98倍和2.33倍。
2.2 Sdc1对心肌成纤维细胞增殖及活力影响(表 1)| 表 1 Sdc1对心肌成纤维细胞增殖及活力影响(n=5,x±s) |
与空白对照组和NC siRNA组比较,Sdc1 siRNA组心肌成纤维细胞S期比例、增殖指数和细胞活力均明显升高(P<0.01);与空白对照组和空载质粒组比较,Sdc1组心肌成纤维细胞S期比例减少,增殖指数和细胞活力减低(P<0.01)。与空白对照组比较,空载质粒组细胞S期比例、增殖指数和细胞活力差异无统计学意义(P>0.05)。
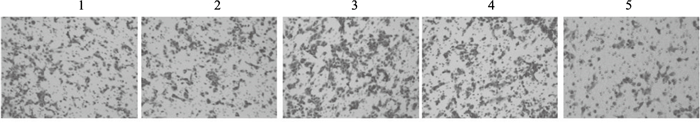
2.3 Sdc1对细胞迁移影响(图 2)
|
注:1:空白对照组;2:NC siRNA组;3:Sdc1 siRNA组;4:空载质粒组;5:Sdc1组。 图 2 Sdc1对心肌成纤维细胞迁移能力影响(结晶紫染色,×200) |
Transwell细胞迁移实验结果显示,空白对照组、NC siRNA组、Sdc1 siRNA组、空载质粒组、Sdc1组心肌成纤维细胞迁移能力分别为(110±18)、(100±20)、(170±26)、(120±20)、(50±10)个/孔;与空白对照组和NC siRNA组比较,Sdc1 siRNA组心肌成纤维细胞的迁移能力明显增强(P<0.01);与空白对照组和空载质粒组比较,Sdc1组心肌成纤维细胞迁移能力明显减弱(P<0.01)。
2.4 Sdc1对心肌成纤维细胞胶原分泌能力影响空白对照组、NC siRNA组、Sdc1 siRNA组、空载质粒组、Sdc1组心肌成纤维细胞胶原(羟脯氨酸)分泌量分别为(802.3±51.9)、(786.6±55.9)、(1 162.3±60.4)、(821.1±56.2)、(346.8±52.1)pg/mL;与空白对照组和NC siRNA组比较,Sdc1 siRNA组心肌成纤维细胞胶原分泌能力明显升高(P<0.01);NC siRNA组与空白对照组比较差异无统计学意义(P>0.05);与空白对照组和空载质粒组比较,Sdc1组心肌成纤维细胞胶原分泌能力下降(P<0.01);空载质粒组与空白对照组相比差异无统计学意义(P>0.05)。
3 讨论MI后心室重构包括心肌细胞的重构和心肌间质的重构。心肌细胞的重构指的是心肌细胞的坏死、凋亡、溶解、吸收和增生不良性肥大等。心肌间质的重构则主要表现为胶原的沉积和纤维化。近年来,MI后心肌间质的重构受到学者们的广泛重视,被认为是导致MI后心室重构并进展为心力衰竭和心律失常的一个重要原因[9]。研究显示,国内每年有350万人死于心血管疾病,其中死于MI及其并发症的人数超过100万[10]。心血管疾病已经成为21世纪最大的公共卫生问题之一[11]。
心肌间质的体积虽然仅占心肌组织的2.5%,但其所含的细胞数却是心肌细胞的2倍,是构成心肌细胞支架、维持心脏几何构型和协调心腔舒张充盈的基础。心肌成纤维细胞是心肌间质内的数量优势细胞,其主要的生物学行为有增殖、迁移和分泌胶原等。心肌成纤维细胞参与了MI后心室重构的全过程,是MI后心室重构的主要效应细胞。任何能够影响心肌成纤维细胞生物学行为的因素最终均将影响心室重构。
Sdc1是体内上皮细胞表达的一种硫酸乙酰肝素蛋白聚糖,可结合一系列配体如黏附分子、胞外基质成分、生长因子、细胞因子等,以共受体方式参与细胞与细胞、细胞与细胞外基质之间的相互作用,调节细胞黏附、组织分化、血管形成等诸多生理病理过程[12]。研究发现,Sdc1在MI后表达上调,在体转染携带Sdc1的重组腺病毒使Sdc1过表达,能够抑制胶原蛋白的过度分泌,优化Ⅰ型和Ⅲ型胶原的比例,改善MI后心室重构[5]。本研究将Sdc1 siRNA及高表达Sdc1的质粒转染体外培养的大鼠心肌成纤维细胞,结果显示,体外沉默Sdc1表达后心肌成纤维细胞的增殖、活力、迁移和胶原(羟脯氨酸)分泌能力均明显升高;上调Sdc1表达后心肌成纤维细胞的增殖、活力、迁移和胶原(羟脯氨酸)分泌能力明显降低。提示,Sdc1参与了心肌成纤维细胞生物学行为的调控,高水平的Sdc1能够抑制心肌成纤维细胞的增殖、活力和迁移能力,减少胶原蛋白的过度分泌;调控心肌成纤维细胞的生物学行为很可能是Sdc1改善MI后心室重构的机制之一。
| [1] | Celermajer DS, Chow CK, Marijon E, et al. Cardiovascular disease in the developing world:prevalences, patterns, and the potential of early disease detection[J]. J Am Coll Cardiol, 2012, 60(14): 1207–1216. DOI:10.1016/j.jacc.2012.03.074 |
| [2] | Tkachenko E, Rhodes JM, Simons M. Syndecans:new kids on the signaling block[J]. Circ Res, 2005, 96(5): 488–500. DOI:10.1161/01.RES.0000159708.71142.c8 |
| [3] | Couchman JR, Gopal S, Lim HC, et al. Syndecans:from peripheral coreceptors to mainstream regulators of cell behaviour[J]. Int J Exp Pathol, 2015, 96(1): 1–10. DOI:10.1111/iep.12112 |
| [4] | Lei J, Xue SN, Wu W, et al. Increased level of soluble syndecan-1 in serum correlates with myocardial expression in a rat model of myocardial infarction[J]. Mol Cell Biochem, 2012, 359(1): 177–182. |
| [5] | Lei J, Xue SN, Wu W, et al. Sdcl overexpression inhibits the p38 MAPK pathway and lessens fibrotic ventricular remodeling in MI rats[J]. Inflammation, 2013, 36(3): 603–615. DOI:10.1007/s10753-012-9582-y |
| [6] | McManus MC, Boland ED, Simpson DG, et al. Electrospun fibrinogen:feasibility as a tissue engineering scaffold in a rat cell culture model[J]. J Biomed Mater Res A, 2007, 81(2): 299–309. |
| [7] | Bradshaw AD, Baicu CF, Rentz TJ, et al. Pressure overload-induced alterations in fibrillar collagen content and myocardial diastolic function:role of secreted protein acidic and rich in cysteine(SPARC)in post-synthetic procollagen processing[J]. Circulation, 2009, 119(2): 269–280. DOI:10.1161/CIRCULATIONAHA.108.773424 |
| [8] | 解辉, 潘晓黎, 吴伟. 糖尿病心肌病心肌细胞纤维化的病理改变[J]. 中华老年心脑血管疾病杂志, 2008, 10(5): 374–376. |
| [9] | Sun Y. Myocardial repair/remodelling following infarction:roles of local factors[J]. Cardiovasc Res, 2009, 81(3): 482–490. |
| [10] | Hua Wei, Zhang LF, Wu YF, et al. Incidence of sudden cardiac death in China:analysis of 4 regional populations[J]. J Am Coll Cardiol, 2009, 54(12): 1110–1118. DOI:10.1016/j.jacc.2009.06.016 |
| [11] | 刘奕婷, 王巍, 时景璞. PCI术后急性心肌梗死患者再发影响因素分析[J]. 中国公共卫生, 2016, 32(4): 558–562. DOI:10.11847/zgggws2016-32-04-39 |
| [12] | Bishop JR, Schuksz M, Esko JD. Heparan sulphate proteoglycans fine-tune mammalian physiology[J]. Nature, 2007, 446(7139): 1030–1037. DOI:10.1038/nature05817 |
 2017, Vol. 33
2017, Vol. 33
