邻苯二甲酸二乙基己酯[di-(2-ethylhexyl)phthalate, DEHP]属于邻苯二甲酸酯类(phthalate esters, PAEs)化合物,是使用最广和产量最大的塑化剂,以增加塑料的可塑性和韧性,提高塑料强度。广泛用于油漆、橡胶管、血袋、化妆品、包装食物的材料及小孩玩具等。DEHP与塑料之间是氢键或范德华力结合,易于扩散至周围环境中[1],造成空气、水源和食物等污染。DEHP可通过饮食、呼吸、皮肤接触等途径进入人体,长期接触可引起血液系统、生殖系统及肾脏、肺脏等器官损害[2]。DEHP对雄性生殖系统的损害最为显著,其主要靶器官是睾丸,可影响性腺和生殖器官的发育,损害生殖功能[3]。DEHP是一种典型的环境内分泌干扰物(environmental endocrine disruptors,EEDs),具有拟雌激素或抗雄激素作用。DEHP可引起男/雄性动物生殖内分泌激素紊乱、睾丸萎缩、生精障碍等[4-5],DEHP暴露与血清中黄体生成素(luteinizing hormone,LH)、睾酮、雌二醇水平呈负相关[6-7]。研究表明DEHP暴露的孕期大鼠,其雄性子代下丘脑-垂体-睾丸轴(hypothalamic-pituitary-thyroid, HPT)平衡态受到破坏,血清中LH和睾酮水平呈不同程度下降[8];DEHP能降低灵敏调节蛋白(steroidogenic acute regulatory protein, StAR)表达,从而限制睾丸间质细胞中胆固醇转运入线粒体[9]。然而,对于5α-还原酶在DEHP生殖毒性中的作用研究较少,且结论尚不一致。因此,本研究采用DEHP染毒青春期雄性Sprague-Dawley (SD)大鼠,观察大鼠睾丸组织形态学及血清性激素水平变化,旨在探讨DEHP对雄性大鼠睾丸和血清睾酮的影响及潜在机制。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器DEHP(美国Sigma-Aldrich公司),纯度99.5%,溶剂为玉米油;大鼠睾酮(testosterone, T)、黄体生成素(luteinizing hormone, LH)、卵泡刺激素(follicle-stimulating hormone,FSH)、促性腺激素释放激素(gonadotropin releasing hormone,GnRH)、5α-二氢睾酮(5α-dihydrotestosterone,5α-DHT)、5α-还原酶1、2[5 alpha-reductase 1 (5α-R1)、5 alpha-reductase 2 (5α-R2)]测定试剂盒(武汉伊艾博科技有限公司);谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成科技有限公司)。TS-12D生物组织自动脱水机、BM-VⅡ生物组织包埋机(孝感市宏业医用仪器有限公司),美康石蜡切片机(福建省医疗器械公司),CX31生物显微镜、OLYSIA-BioReport图像拍摄系统(日本奥林巴斯公司),Synergy H1全功能酶标仪(美国伯腾仪器有限公司)。
1.2 实验动物雄性清洁级SD大鼠(第三军医大大坪医院动物实验中心)24只,18日龄,体重(41.7±6.4) g,许可证号码:SCXK(渝)2012-0005,分笼饲养于标准动物房,以国家标准啮齿类动物饲料饲养,自由饮食,给予规律光照(12 h/12 h),室温20~25 ℃,室内相对湿度50%~70%。适应性喂养5 d后进行实验。
1.3 分组与处理将大鼠按体重随机分为4组,对照组、低、中、高剂量DEHP组,每组6只。以玉米油作为溶剂,灌胃剂量分别为0(对照组)、250、500和750 mg/kg,连续染毒30 d。于末次染毒次日,颈部脱臼处死大鼠。全血标本于室温放置2 h,1 000 r/min离心20 min,取上清待测。分离睾丸和附睾,除去其表面血渍并称重,计算脏器系数。脏器系数(%)=[器官湿重(g)/体重(g)]×100%。仔细分离摘取双侧睾丸组织,一侧睾丸组织部分放入4%的多聚甲醛液中固定,室温下固定24 h;另一侧睾丸组织分装,-80 ℃分装冻存。动物处理严格遵守实验动物操作的相关规定,并经重庆市人口和计划生育科学技术研究伦理委员会批准。
1.4 指标与方法 1.4.1 大鼠睾丸组织形态学观察采用苏木素-伊红染色法(hematoxylin-eosin, HE),大鼠睾丸石蜡切片4 μm厚,投入二甲苯中脱蜡至水;苏木素染色5 min后,蒸馏水冲洗,再用伊红液染色5 min后,蒸馏水冲洗;梯度酒精脱水;中性塑胶封片,显微镜(×200)下观察。
1.4.2 大鼠睾丸组织氧化应激水平测定取睾丸组织30 mg,加入300 μL组织细胞裂解液,充分匀浆,置冰上裂解2 h,12 000 r/min离心10 min,取上清液。GSH-Px活力以催化GSH的反应速度表示,1 mmol/L GSH与10%睾丸组织匀浆酶促反应5 min,3 500 r/min离心10 min,取上清液1 mL,显色反应15 min,412 nm处测吸光度(A)值;SOD活力通过黄嘌呤氧化酶法测定,10%睾丸组织匀浆与试剂37 ℃恒温水浴40 min,加入显色剂室温放置10 min,550 nm处比色;丙二醛含量通过硫代巴比妥酸法(TBA)测定,10%睾丸组织匀浆与试剂95 ℃水浴40 min,3 500 r/min离心10 min,取上清液532 nm处测吸光度(A)值。
1.4.3 大鼠血清中性激素水平和睾丸裂解液5α-R活性检测采用酶联免疫吸附试验(enzyme-linked immunosobent assay, ELISA),往预先包被待测样品抗体的包被微孔中,依次加入样品、标准品、辣根过氧化物酶(horseradish peroxidase, HRP)标记的检测抗体,经过温育并彻底洗涤。用底物3, 3′, 5, 5′-四甲基联苯胺(tetramethyl benzidine, TMB)显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色,样品活性与颜色深浅呈正相关。用酶标仪在450 nm波长下测定吸光度(absorbance, A)值,计算样品浓度。
1.5 统计分析数据用x±s表示,采用SPSS 12.0软件进行统计分析,组间比较采用单因素方差分析,两两比较采用最小显著差法,以P < 0.05为差异有统计学意义。
2 结果 2.1 DEHP对大鼠体重和脏器系数影响(表 1)| 表 1 DEHP对大鼠体重和脏器系数影响(x±s,n=6) |
实验过程中,所有大鼠均未出现明显的中毒迹象或死亡,大鼠均能正常进食与活动。DEHP暴露后,各组大鼠体重、体重增量差异均无统计学意义(P>0.05);与对照组比较,DEHP组大鼠睾丸明显萎缩,睾丸和附睾系数明显降低(P < 0.05)。
2.2 DEHP对大鼠睾丸组织形态学影响(图 1)
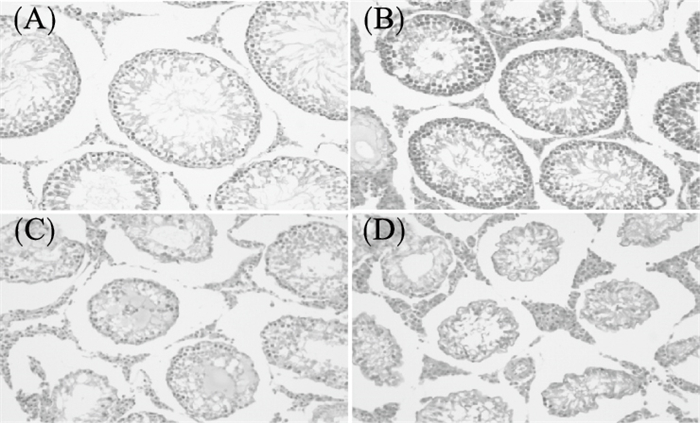
|
图 1 DEHP对大鼠睾丸组织形态学影响(HE,×200) |
结果显示,对照组大鼠睾丸组织可观察到正常的精子发生,曲精小管里可见精原细胞、精母细胞、精细胞(图 1A);DEHP染毒后,与对照组比较,低剂量组睾丸组织形态学变化不明显(图 1B);中、高剂量组睾丸组织中,曲精小管管腔缩小,结构坍塌,部分细胞膜破裂,细胞排列紊乱(图 1C、D)。
2.3 DEHP对大鼠血清性激素水平影响(表 2)| 表 2 DEHP对大鼠血清性激素水平影响(x±s,n=6) |
与对照组比较,中、高剂量DEHP组大鼠血清睾酮和LH、FSH水平明显下降,差异有统计学意义(P < 0.05);与对照组比较,各剂量DEHP组大鼠血清中促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)和5α-二氢睾酮(dihydrotestosterone,5α-DHT)水平无明显变化。
2.4 DEHP对大鼠睾丸氧化应激状态影响(表 3)| 表 3 DEHP对大鼠睾丸氧化应激状态影响(x±s,n=6) |
与对照组比较,高剂量DEHP组大鼠睾丸组织中GSH-Px和SOD活力明显下降(P < 0.05),中、高剂量DEHP组大鼠睾丸组织中丙二醛含量明显升高(P < 0.05);与对照组比较,中、高剂量DEHP组大鼠睾丸组织中5α-R2活性明显升高(P < 0.05),而5α-R1活性无明显改变。
3 讨论本研究结果显示,用DEHP染毒青春期的大鼠导致睾丸萎缩,睾丸和附睾相对重量减轻;睾丸曲精小管管腔缩小,结构坍塌,部分细胞膜破裂,细胞排列紊乱。Kasahara等[10]研究发现,经口给予大鼠DEHP可增加睾丸活性氧(reactive oxygen species, ROS)的产生,并伴有谷胱甘肽和维生素C浓度下降;同时,选择性诱导精母细胞凋亡,从而引起睾丸萎缩。氧化应激是由于体内ROS产生与抗氧化剂清除失衡所致。当ROS产生水平超过细胞的抗氧化能力,便发生氧化应激。GSH-Px和SOD共同清除机体内的活性氧,减轻和阻止活性氧的过氧化作用。丙二醛不仅反映自由基产生的数量,还可以衡量机体脂质过氧化和氧化应激的能力[11]。本研究结果显示,DEHP暴露后,与对照组比较,高剂量DEHP组大鼠睾丸组织中GSH-Px和SOD活性明显下降,而中、高剂量DEHP组大鼠睾丸组织中丙二醛含量明显升高。与已有研究结果一致[12-14]。提示,DEHP诱导氧化应激,使睾丸发生脂质过氧化作用,可能是导致睾丸损伤的潜在机制。
睾酮由睾丸间质细胞合成,在肝脏中通过5α还原酶代谢和转化。5α还原酶是睾酮生物合成转化的一种限速酶。存在2种功能不同的还原酶即5α-R1和5α-R2[15]。应用现代分子生物学技术,发现5α-R1在雄激素靶组织和非靶组织均有表达,其活性呈组织广泛分布的特点,如肝脏和肌肉;5α-R2在雄激素靶组织中高表达,其活性主要分布在前列腺和附睾;2种5α-R同功酶均会介导睾酮转化为二氢睾酮,但在雄激素靶组织中起主要作用的是5α-R2[16]。因此,大鼠睾丸中5α-R2活性越高,将睾酮转化为二氢睾酮能力越强,从而导致血清中睾酮水平下降,二氢睾酮水平提高。本研究结果显示,DEHP染毒后,大鼠睾丸5α-R2活性明显升高,5α-R1活性无明显改变,血清中睾酮水平下降,但5α-二氢睾酮(5α-DHT)水平无明显改变。推测血清睾酮水平降低,一方面与5α-R2活性升高加速睾酮清除与代谢有关,另一方面还可能与睾酮的生物合成受抑制有关。
睾酮的分泌与生物合成主要受HPT轴调节。正常生理情况下,下丘脑通过分泌性腺激素释放激素(GnRH)调节垂体中卵泡刺激素(FSH)和黄体生成素(LH)的分泌,LH随血流到达睾丸,与特定受体结合,从而促进睾酮分泌。当睾酮生物合成受到明显抑制,血清睾酮通过负反馈调节系统刺激下丘脑中GnRH,垂体中LH分泌增加,GnRH、LH水平升高则刺激睾丸间质细胞分泌更多睾酮,从而恢复血清中睾酮正常水平,最终维持HPT轴调控的性激素水平动态平衡。研究表明,21日龄大鼠经口DEHP连续染毒30 d,血清中LH和睾酮水平相继降低[17];35日龄大鼠经口染毒DEHP,每周2次,连续26周后发现,血清中FSH和LT水平明显下降,睾酮水平也降低[18]。也有研究报道,3周龄大鼠经口染毒DEHP,每周5次,连续6周后发现,高剂量DEHP组大鼠血清中FSH水平明显升高[19]。本研究结果显示,DEHP处理组大鼠的FSH、LH和睾酮水平均降低,而GnRH水平无明显改变,表明HPT轴的正常反馈调节受到DEHP干扰。
综上所述,DEHP暴露可引起大鼠睾丸组织氧化应激,并通过诱导睾丸5α-R2活性和干扰HPT轴降低血清睾酮水平。
| [1] | 赵文华, 王永凤, 赵冬梅. 邻苯二甲酸酯环境行为和毒性研究[J]. 福建分析测试, 2010, 19(2): 22–25. |
| [2] | 王珥梅, 常兵. 邻苯二甲酸二乙基己酯对雄性生殖系统的毒性作用[J]. 现代预防医学, 2008, 35(3): 401–403. |
| [3] | 于涛, 逯晓波, 潘亮. 邻苯二甲酸二(2-乙基己基)酯宫内暴露所致子代雄性大鼠睾丸氧化应激及维生素C的干预作用[J]. 环境与健康杂志, 2011, 28(9): 775–778. |
| [4] | Grande SW, Andrade AJ, Talsness CE, et al. A dose response study following in utero and lactational exposure to di-(2-ethylhexyl) phthalate (DEHP):reproductive effects on adult male offspring rats[J]. Toxicology, 2006, 228(1): 85–97. DOI:10.1016/j.tox.2006.08.020 |
| [5] | Pan G, Hanaoka T, Yoshimura M, et al. Decreased serum free testosterone in workers exposed to high levels of di-n-butyl phthalate (DBP) and di-2-ethylhexyl phthalate (DEHP):a cross-sectional study in China[J]. Environ Health Perspect, 2006, 114(11): 1643–1648. |
| [6] | Meeker JD, Calafat AM, Hauser R. Urinary metabolites of di(2-ethylhexyl) phthalate are associated with decreased steroid hormone levels in adult men[J]. J Androl, 2009, 30(3): 287–297. DOI:10.2164/jandrol.108.006403 |
| [7] | Jönsson BA, Richthoff J, Rylander L, et al. Urinary phthalate metabolites and biomarkers of reproductive function in young men[J]. Epidemiology, 2005, 16(4): 487–493. DOI:10.1097/01.ede.0000164555.19041.01 |
| [8] | Akingbemi BT, Youker RT, Sottas CM, et al. Modulation of rat Leydig cell steroidogenic function by di(2-Ethylhexyl)Phthalate[J]. Biol Reprod, 2001, 65(4): 1252–1259. DOI:10.1095/biolreprod65.4.1252 |
| [9] | Svechnikov K, Svechnikova I, Söder O. Inhibitory effects of mono-ethylhexyl phthalate on steroidogenesis in immature and adult rat Leydig cells in vitro[J]. Reprod Toxicol, 2008, 25(4): 485–490. DOI:10.1016/j.reprotox.2008.05.057 |
| [10] | Kasahara E, Sato EF, Miyoshi M, et al. Role of oxidative stress in germ cell apoptosis induced by di (2-ethylhexyl) phthalate[J]. Biochem J, 2002, 365(3): 849–856. DOI:10.1042/bj20020254 |
| [11] | Kulkarni R, Deshpande A, Saxena R, et al. A study of serum malondialdehyde and cytokine in tuberculosis patients[J]. Clin Diagn Res, 2013, 7(10): 2140–2142. |
| [12] | 王蕊, 李厚勇, 郭启明, 等. DEHP对大鼠脂质过氧化反应的影响[J]. 中国公共卫生, 2001, 17(11): 1011–1012. DOI:10.3321/j.issn:1001-0580.2001.11.024 |
| [13] | Chen T, Yang W, Li Y, et al. Mono-(2-ethylhexyl) phthalate impairs neurodevelopment:inhibition of proliferation of differentiation in PC 12 cells[J]. Toxicol Letters, 2011, 201(1): 34–41. DOI:10.1016/j.toxlet.2010.12.002 |
| [14] | Barelay DC, Hallbergson AF, Montague JR, et al. Reversal of ethanol toxicity in embryonic neurons with growth factors and estrogen[J]. Brain Res Bull, 2005, 67(6): 459–465. DOI:10.1016/j.brainresbull.2005.07.016 |
| [15] | Sánchez P, Torres JM, Castro B, et al. Expression of steroid 5α-reductase isozymes in prostate of adult rats after environmental stress[J]. FEBS J, 2013, 280(1): 93–101. DOI:10.1111/febs.12052 |
| [16] | Vilchis F, Mendez JP, Can to P, et al. Identification of missense mutations in the SRD5A2 gene from patients with steroid 5 alpha-reductase 2 deficiency[J]. Clin Endocrinol (Oxf), 2000, 52(3): 383–387. DOI:10.1046/j.1365-2265.2000.00941.x |
| [17] | Botelho GG, Golin M, Bufalo AC, et al. Reproductive effects of di(2-ethylhexyl)phthalate in immature male rats and its relation to cholesterol, testosterone, and thyroxin levels[J]. Arch Environ Contam Toxicol, 2009, 57(4): 777–784. DOI:10.1007/s00244-009-9317-8 |
| [18] | Hirosawa N, Yano K, Suzuki Y, et al. Endocrine disrupting effect of di-(2-ethylhexyl)phthalate on female rats and proteome analyses of their pituitaries[J]. Proteomics, 2006, 6(3): 958–971. DOI:10.1002/(ISSN)1615-9861 |
| [19] | 刘瑾, 蔡军, 张晓霓, 等. 邻苯二甲酸二乙基已酯对未成年小鼠卵巢发育影响[J]. 中国公共卫生, 2013, 29(7): 1010–1011. DOI:10.11847/zgggws2013-29-07-22 |
 2017, Vol. 33
2017, Vol. 33


