灵芝为多孔菌科真菌赤芝或紫芝的干燥子实体,具有补中益气、滋补强壮、扶正固本、延年益寿之功效,在中国已有千年药用和食用历史[1-2]。灵芝多糖(Ganoderma lucidum polysaccharide,GLP),存在于灵芝属真菌的菌丝体和子实体中,是灵芝的主要功效成分之一,由肽多糖、葡聚糖、杂多糖等组成,具有增强机体免疫力、抗肿瘤、抗病毒、消除自由基、抗辐射、提高肝脏解毒功能等作用[3-4]。天然来源的多糖虽然具有毒性低、副作用小等优势,但同样存在很多劣势,如天然多糖不具备药理活性、一些多糖活性较弱等,使得多糖的使用和推广受到限制。在天然多糖分子中引入某种离子基团,不仅能够显著改善多糖在水溶液中的溶解度,还可使多糖在水溶液中的链构象发生改变,从而使其具有某种特定的结构而提高生物活性。目前,改变多糖结构应用最为广泛且效果较好的方法是硫酸酯化法[5],其修饰结果是将硫酸基团加到多糖的糖基上,使其生物活性发生改变。常用的硫酸酯化修饰方法有氯磺酸-吡啶法,三氧化硫-吡啶法,浓硫酸法等[6]。国内外对灵芝多糖硫酸酯(Ganoderma lucidum polysaccharide sulfate, GLPS)生理功能的相关研究大多集中在抗肿瘤、抗癌等方面[7],而对学习记忆能力研究较少。本研究采用东莨菪碱诱导小鼠学习障碍模型,硫酸酯化修饰灵芝多糖,探讨灵芝多糖硫酸酯对小鼠学习记忆障碍的改善作用及机制。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器灵芝干燥子实体(吉林市中药材市场),按参考文献[8]方法,获得灵芝多糖;吡拉西坦(东北制药集团沈阳第一制药有限公司);氢溴酸东莨菪碱注射液(上海禾丰制药有限公司);乙酰胆碱酯酶(acetylcholinesterase, AChE)测定试剂盒(南京建成生物工程研究所);核因子-κB(nuclear factor-κB,NF-κB)p65、活化半胱天冬酶-3(cleaved caspase-3)抗体(美国Santa Cruza公司)。UV-4802型紫外可见分光光度计(上海UNICO仪器有限公司);傅立叶变换红外光谱仪(美国Perkin Elmer公司);OLYMPUS光学显微镜[日本奥利巴斯(中国)有限公司];MTN-658自动生化分析仪(长春市曼特诺医疗器械有限公司);DT-200型小鼠跳台测试仪(成都泰盟科技有限公司)。
1.2 实验动物选取健康成年昆明种小鼠60只,雄性,体重18~22 g,购于吉林大学基础医学院医学实验动物中心,动物合格证号:SCXK(吉)2013-000 1。动物适应性喂养1周后开始实验,室温20~22 ℃,相对湿度40%~60%。
1.3 灵芝多糖硫酸酯制备[8]精确称取适量一步醇沉的灵芝多糖,80 ℃干燥过夜后,置于500 mL平底烧瓶中,加入一定量的吡啶,搅拌溶解,水浴锅中加热升至反应温度后加入酯化剂氨基磺酸,与酯化试剂充分混合,一定温度下磁力搅拌反应;冰浴中冷却至室温,反应液加入预冷的50 mL冰水中,用预冷的(饱和)2.5 mol/L氢氧化钠(sodium hydroxide,NaOH)中和至pH 7.5,45 ℃减压浓缩后,自来水透析2 d,蒸馏水透析1 d,透析液加3倍体积无水乙醇醇沉,静置过夜,3 000 r/min离心15 min,沉淀物用蒸馏水溶解,水浴锅80 ℃将乙醇彻底挥尽,最后冷冻干燥,得到硫酸酯化灵芝多糖。采用红外光谱检测硫酸酯化成功与否。
1.4 动物分组与学习记忆障碍模型建立[9-10]经跳台试验筛选小鼠,将小鼠置于跳台装置,施以24 V电压,筛选出活跃、对电击反应敏感、逃避反应迅速的小鼠50只;随机分为5组(每组10只):对照组、模型组、阳性对照组(灌胃给予吡拉西坦100 mg/kg),GLP组(灌胃给予灵芝多糖100 mg/kg)、GLPS组(灌胃给予灵芝多糖硫酸酯100 mg/kg),对照组和模型组小鼠灌胃给予等体积生理盐水,连续14 d;从第15 d开始,灌胃30 min后,除对照组(生理盐水)外,其余各组小鼠腹腔注射东莨菪碱2 mg/kg,2 h后进行跳台试验,每天记录小鼠体重变化。
1.5 指标与方法 1.5.1 跳台实验末次给药2 h后,对小鼠进行跳台试验。先将小鼠放入跳台箱适应3 min,随后开始试验,将小鼠放于安全平台上,同时通以24 V交流电,记录各组小鼠5 min内跳下平台受电击的次数(即错误次数)和第一次跳下平台的潜伏期;24 h后重复测试,直接将小鼠放于安全台上并通电,记录小鼠5 min内出现的错误次数和首次跳下平台的潜伏期。
1.5.2 小鼠脑组织中乙酰胆碱酯酶(AChE)活性测定跳台试验结束后,麻醉小鼠,断头处死小鼠,置于冰上迅速分离脑组织,于冰冷生理盐水中匀浆,制成10%脑组织匀浆液,并用冷冻离心机在4 ℃条件下3 000 r/min离心15 min,吸取上清液,-80 ℃保存备用;根据试剂盒说明书检测AChE活性。
1.5.3 小鼠脑海马NF-κB p65和cleaved caspase-3蛋白表达检测采用免疫印迹法。跳台试验结束后,断头处死小鼠,置于冰上迅速分离海马,0.25%胰酶消化,离心收集细胞1 000 r/min离心10 min,以磷酸盐缓冲液洗2次,用放射免疫沉淀测定(radioimmunoprecipitation assay,RIPA),细胞裂解液置冰浴裂解,4 ℃条件下12 000 r/min离心5 min,收集上清;经二喹啉甲酸(bicinchoninic acid,BCA)法进行蛋白定量后,取等量样品以12%十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecylsulphate polyacrylamide gel electrophoresis, SDS-PAGE)进行电泳;电泳后将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭1 h后,NF-κB p65、casepase-3和β-actin抗体(浓度1:1 000)孵育过夜,再以过氧化酶标记的二抗封闭液孵育1 h,用化学发光法显影,凝胶成像系统检测。
1.6 统计分析计量资料以x±s表示,采用SPSS 13.0软件进行统计分析,组间比较采用单因素方差分析,两两比较采用最小显著差法,以P<0.05为差异有统计学意义。
2 结果 2.1 GLPS红外光谱鉴定(图 1)
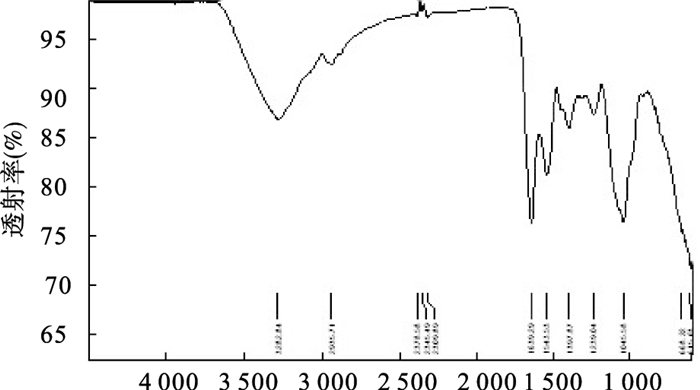
|
图 1 灵芝多糖硫酸酯红外光谱图 |
红外光谱图可见,硫酸酯化多糖光谱中保留了灵芝多糖的特征吸收峰,而且新出现的1 207 cm-1左右的S=O伸缩振动和813 cm-1左右的C-O-S伸缩振动的特征吸收峰,表明硫酸基团以酯键的形式已经连接在灵芝多糖分子上。
2.2 GLPS对小鼠体重影响结果显示,观察期间各组小鼠体重均有增加;与对照组比较,模型组、阳性对照组、GLP、GLPS组小鼠体重无明显变化。表明灵芝多糖和灵芝多糖硫酸酯对小鼠生长发育无明显影响。
2.3 GLPS对记忆障碍小鼠学习能力影响(表 1)| 表 1 灵芝多糖硫酸酯对记忆障碍小鼠学习能力影响(x±s,n=10) |
与对照组比较,模型组小鼠跳台潜伏期明显缩短,5 min内错误次数明显升高,差异有统计学意义(P < 0.01);与模型组比较,GLP、GLPS组小鼠跳台潜伏期明显延长,错误次数明显减少,差异有统计学意义(P < 0.05);与GLP组比较,GLPS组小鼠跳台潜伏期延长,错误次数减少,差异有统计学意义(P < 0.05)。
2.4 GLPS对记忆障碍小鼠脑组织中AChE活性影响结果表明,对照组、模型组、阳性对照组、GLP、GLPS组小鼠脑组织中AChE活性分别为(11.6±0.7)、(18.9±1.1)、(12.3±0.4)、(17.1±0.8)和(15.0±0.6) nmol/L。与对照组比较,模型组小鼠脑组织AChE活性明显升高,差异有统计学意义(P<0.01);与模型组比较,GLP、GLPS组小鼠脑组织中AChE活性明显下降,差异有统计学意义(P<0.05);与GLP组比较,GLPS组小鼠脑组织中AChE活性下降,差异有统计学意义(P < 0.05)。
2.5 GLPS对记忆障碍小鼠脑组织中NF-κB通路影响(图 2、表 2)
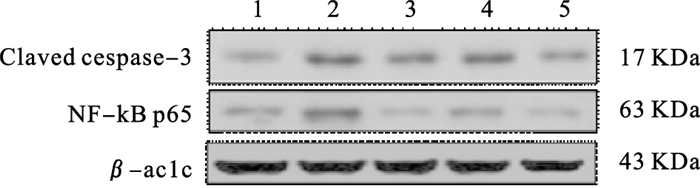
|
注:1:对照组;2:模型组;3:阳性对照组;4:灵芝多糖组;5:灵芝多糖硫酸酯组。 图 2 灵芝多糖硫酸酯对记忆障碍小鼠脑组织中NF-κB通路因子表达影响 |
| 表 2 灵芝多糖硫酸酯对记忆障碍小鼠脑组织中NF-κB通路因子表达影响(x±s,n=10) |
免疫印迹结果显示,与对照组比较,模型组小鼠海马组织中NF-κB p65和cleaved caspase-3表达升高,差异有统计学意义(P < 0.01);与模型组比较,GLPS组小鼠脑海马组织中NF-κB p65和cleaved caspase-3蛋白表达明显下降,差异有统计学意义(P < 0.05)。
3 讨论阿尔茨海默病(Alzheimers disease,AD),常被称为老年性痴呆,是严重影响老年人身心健康的主要疾病之一[11],目前临床仍无良好的防治药物。多糖硫酸酯化是一种非常重要的多糖结构性能设计手段,经硫酸酯化修饰的天然多糖会因SO2-基团取代分子中的OH-,使其理化性质改变,进而改变其活性甚至出现新的活性。本研究采用东莨菪碱诱导小鼠学习障碍模型,观察硫酸酯化修饰GLP(GLPS)对小鼠学习记忆障碍的改善作用。跳台实验是一种常见的测试小型动物学习记忆能力的行为学检测方法[12]。本研究结果表明小鼠腹腔注射东莨菪碱后,表现出明显的记忆障碍;与模型组比较,GLP、GLPS组小鼠跳台错误次数明显减少、潜伏期明显延长;与GLP组比较,GLPS组小鼠跳台错误次数进一步减少、潜伏期进一步延长。提示,GLP与GLPS均可改善AD模型小鼠的学习记忆能力,但GLPS效果更好。
AD的发病机制目前尚未完全阐明,“胆碱能学说”是目前国内外普遍较为公认的发病学说。胆碱能学说认为,AD患者体内的AChE活性较正常人显著升高,可大量水解乙酰胆碱(ACh),导致中枢ACh含量明显下降,从而影响神经递质的传递,出现学习记忆障碍[13]。本研究结果显示,与对照组比较,模型组小鼠脑组织中AChE活性明显升高;与模型组比较,GLP和GLPS组小鼠脑组织中AChE活性均明显下降。提示,GLP、GLPS可能通过调节AchE活性发挥改善学习记忆的作用,且GLPS效果更明显。
近年研究发现,自由基损伤所造成的神经元凋亡也是AD发生的重要原因之一[14-15]。凋亡是中枢神经系统正常发育、再生、增殖及病理变性的细胞死亡的主要方式[16]。而NF-κB参与多种趋化因子、炎性细胞因子和成纤维细胞因子的合成过程,是诱导细胞凋亡的关键性转录因子。研究证实NF-κB具有促进中枢神经系统神经细胞凋亡的作用,在创伤、脑缺血、阿尔茨海默病、帕金森病等的神经凋亡细胞组织内可观察到NF-κB的激活[17]。Cleaved caspases家族则是近年发现的在细胞凋亡过程中发挥关键作用的执行蛋白酶,其中caspase-3是参与凋亡的caspase级链反应最终效应子,在蛋白酶级联切割过程中处于核心位置, 不同的蛋白酶切割caspase-3酶原,从而激活caspase-3,活化的caspase-3又进一步切割不同的底物,导致蛋白酶级联切割放大,最终使细胞死亡。因此,caspase-3是细胞凋亡的关键蛋白酶,在各种因素启动的凋亡程序中起最后枢纽作用,它的激活标志着凋亡进入不可逆阶段[18]。本研究结果显示,与对照组比较,模型组小鼠脑海马组织中NF-κB p65和cleaved caspase-3表达升高;与模型组比较,GLPS组小鼠脑海马组织中NF-κB p65和cleaved caspase-3蛋白表达明显下降。提示,GLPS改善小鼠学习记忆障碍的作用机制可能与调控NF-kB信号转导通路有关。
| [1] | Giner-Larza EM, Manez S, Giner-Pons RM, et al. On the anti-inflammatory and anti-phospholipase A2 activity of extracts from lanostane-rich species[J]. Journal of Ethnopbarmacology, 2000, 73: 61–69. DOI:10.1016/S0378-8741(00)00276-2 |
| [2] | Kim YS, Eo SK, Oh KW, et al. Anti-herpetic activities of acidic protein bound polysaccharide isolated from Ganoderma lucidum alone and in combinations with interferons[J]. Journal of Ethnopharmacology, 2000, 72: 451–458. DOI:10.1016/S0378-8741(00)00263-4 |
| [3] | Liu G, Wang X. Structure activity relationship and anticancer mechanisms of Ganoderma lucidum polysaccharides[J]. Mycosystema, 2006, 25(3): 430–438. |
| [4] | 马礼金. 灵芝的药用及食用研究[J]. 食品与发酵工业, 2000, 4: 62–65. DOI:10.3321/j.issn:0253-990X.2000.05.014 |
| [5] | 黄小燕, 孔祥峰, 王德云, 等. 多糖硫酸化修饰和多糖硫酸酯的研究进展[J]. 天然产物研究与开发, 2007, 19(2): 328. |
| [6] | Wang CY, Guan HS. Advances of researches on antiviral activity of polysaccharide Ⅱ antiviral activity of sulfated polysaccharide[J]. Advances of Biological Project, 2000(2): 3–8. |
| [7] | 张珏. 灵芝多糖的硫酸化修饰及其衍生物抗肿瘤活性的初步研究[D]. 无锡: 江南大学博士论文, 2005. |
| [8] | 张萍, 李静, 吕兴萍, 等. 赤灵芝多糖硫酸酯化初步研究[J]. 江苏农业科学, 2013, 41(1): 211–213. |
| [9] | 王红利, 薛莉君, 万东, 等. 梓醇改善东莨菪碱诱导的学习记忆障碍及机制研究[J]. 中国药理学通报, 2011, 27(9): 1272–1275. |
| [10] | Zhu L, Zhang L, Zhang L, et al. The effects of Zibu Piyin Recipe components on scopolamine-induced learning and memory impairment in the mouse[J]. J Ethnopharmacol, 2014, 151(1): 576–582. DOI:10.1016/j.jep.2013.11.018 |
| [11] | 黄忠仕, 黄仁彬, 李江, 等. 龙眼参多糖对不同模型拟痴呆小鼠的益智作用[J]. 右江民族医学院学报, 2004, 26(4): 463–465. |
| [12] | Kunisawa K, Nakashima N, Nagao M, et al. Betaine prevents homocysteine-induced memory impairment via matrix metalloproteinase-9 in the frontal cortex[J]. Behav Brain Res, 2015, 292: 36–43. DOI:10.1016/j.bbr.2015.06.004 |
| [13] | Chiapinotto Spiazzi C, Bucco Soares M, PintoIzaguirry A, et al. Selenofuranoside ameliorates memory loss in Alzheimer-like sporadic dementia:AChE activity oxidative stress and inflammation involvement[J]. Oxid Med Cell Longev, 2015. DOI:10.1155/2015/976908 |
| [14] | Van der Linden M. The myth of Alzheimer disease[J]. Rev Med Suisse, 2013, 9(371): 244–245. |
| [15] | 张笑天, 郑晓瑛. 氧化自由基清除剂超氧化物歧化酶与疾病[J]. 中国公共卫生, 2014, 30(10): 1349–1352. DOI:10.11847/zgggws2014-30-10-38 |
| [16] | Orrenius S. Mitochondrial regulation of apoptotic cell death[J]. Toxicol Lett, 2004, 149(1-3): 19–23. DOI:10.1016/j.toxlet.2003.12.017 |
| [17] | 顾洁莹, 戴晖. 黄芩苷解热过程中TLR4/NF-κB信号通路作用[J]. 中国公共卫生, 2015, 31(10): 1286–1288. DOI:10.11847/zgggws2015-31-10-15 |
| [18] | Akira S, Takeda K. Toll-like receptor signaling[J]. Nat Rev Immunol, 2004, 4(7): 499–511. DOI:10.1038/nri1391 |
 2017, Vol. 33
2017, Vol. 33


