亚硝胺类化合物(N-nitrosamines, NAs)是一类典型持久性有机污染物,在环境和机体内广泛存在,且致癌作用明确[1-3]。近年来,由于氯化消毒而引发的饮用水中亚硝胺类化合物污染问题备受关注。而建立高回收率、低检出限、简便易行的检测水中亚硝胺技术方法也成为研究者关注的热点,应用固相微萃取-气相色谱质谱(solid phase microextraction-gas chromatography-mass spectrometry, SPME-GC-MS)[4]、固相萃取-超高效液相色谱-串联质谱(solid phase extraction-ultra performance liquid chromatography-gas chromatography-mass spectrometry, SPE-UPLC-MS/MS)[5]等技术构建多种物质的检测已成为趋势。本研究通过优化相关技术条件构建固相萃取-气相色谱质谱法(solid phase extraction-gas chromatography-mass spectrometry, SPE-GC-MS),用于检测饮用水中9种亚硝胺,为提高水中亚硝胺的检测效率奠定技术基础。
1 材料与方法 1.1 主要仪器与试剂气相色谱-质谱联用仪(gas chromatography-mass spectrometry, GC-MS)(美国Agilent公司);VF-WAXms色谱柱(30 m×0.25 mm×0.25 μm)(美国Agilent公司);24位固相萃取装置(美国Supelco公司);椰壳活性炭(2 g/6 mL,美国Supelco公司);HLB(200 mg/6 mL,美国Supelco公司);C18小柱(2 g/6 mL,美国Supelco公司);氮吹仪(天津奥特赛恩斯公司);亚硝基二甲胺(nitrosodimethylamine, NDMA)、亚硝基甲基乙基胺(nitrosomethylethylamine, NMEA)、亚硝基二乙胺(nitrosodiethylamine NDEA)、亚硝基二丙胺(nitrosomethylethylamine, NDPA)、亚硝基二丁胺(nitrosodibutylamine, NDBA)、亚硝基哌啶(nitrosopiperidine, NPip)、亚硝基吡咯烷(nitrosopyrrolidine, NPyr)、亚硝基吗啉(nitrosomorpholine, NMor)、亚硝基二苯胺(nitrosodiphenylamine, NDphA)混合标准品(美国Sigma-Aldrich公司);氚代同位素内标NDPA-d14、NDMA-d6(美国CIL公司),二氯甲烷(dichloromethane,HPLC级,美国ACS公司);甲醇(methanol,HPLC级,美国Tedia公司);正己烷(hexane,HPLC级,美国Tedia公司);无水硫酸钠(sodium sulfate,纯度≥99%,美国Sigma-Aldrich公司)。
1.2 标准溶液配制取3个10 mL棕色容量瓶,分别加入10 μL 2 000 mg/L亚硝胺混合标准溶液、20 μL NDPA-d14、20 μL NDMA-d6标准溶液,二氯甲烷定容至10 mL,配制成2 mg/L 9种亚硝胺混合标准溶液、2 mg/L NDPA-d14和2 mg/L NDMA-d6标准溶液,-20 ℃下避光保存。另取2个10 mL棕色容量瓶,分别配制2 mg/L 9种亚硝胺混合标准水溶液和2 mg/L NDMA-d6标准水溶液。同时采用逐级稀释法,配制1 000、500、200、100、50、20、10 μg/L的9种亚硝胺的混合二氯甲烷溶液,其中NDPA-d14均为200 μg/L,NDMA-d6与亚硝胺浓度相同。
1.3 气相色谱质谱条件优化分别选择Agilent DB-5(30 m×0.25 mm×0.5 μm)、Agilent DB-35ms(30 m×0.25 mm×0.5 μm)及Agilent VF-WAXms(30 m×0.25 mm×0.25 μm)3种极性不同的色谱柱,同时比较进样口温度(200、230、250 ℃),离子源温度(230、250、280 ℃)和传输线温度(200、230、250 ℃),并通过优化程序升温条件,以得到最大响应值、良好峰型和分离度为选择条件,从而确定最佳仪器分析方法。
1.4 前处理条件优化 1.4.1 固相萃取柱的选择分别选择椰壳活性炭、C18、HLB 3种填料的固相萃取柱,通过比较3种不同填料萃取柱对目标物萃取效率,最终选择萃取效率最佳,目标物损失最少的萃取柱。
1.4.2 上样速率和洗脱体积的影响选择二氯甲烷作为其洗脱溶剂。同时考察3种上样速率( < 5、5~10、> 10 mL/min)与洗脱体积(10、12、15 mL)对目标物回收率的影响。
1.5 质量控制与数据分析本实验使用的玻璃器皿经甲醇和超纯水分别超声清洗20 min,高压2 h,后于65 ℃烘箱中烘干48 h,且在使用前用二氯甲烷润洗3次。测定溶剂空白值,同时以超纯水作空白样,检测9种目标物的含量,作为空白本底扣除。每日进样前,取标准曲线中间浓度检查仪器性能、灵敏度,满足内标峰面积在±20%以内,保留时间有±0.02 min的偏差,同时实测离子对相对离子强度与理论值偏差在±20%内[6]。目标分析物以保留时间、特征离子作定性依据。
1.6 统计分析采用Agilent MSD Chemstation工作站软件和Excel 2016计算方法回收率、精密度、方法检出限(method detection limit, MDL)和相对标准偏差(relative standard deviation, RSD)。
2 结果 2.1 9种亚硝胺色谱图和特征离子(图 1、表 1)
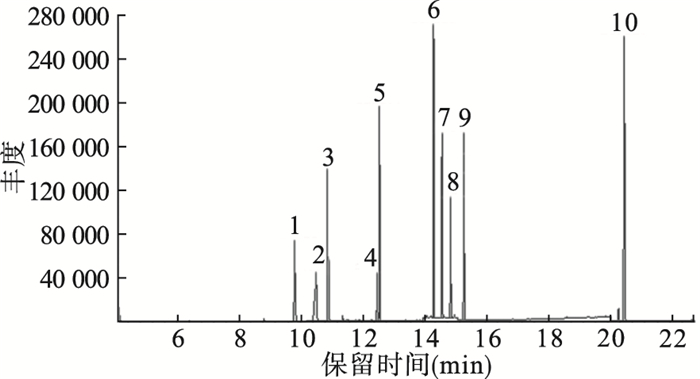
|
1:NDMA、NDMA-d6;2:NMEA;3:NDEA;4:NDPA-d14;5:NDPA;6:NDBA;7:NPip;8:NPyr;9:NMor;10:NDphA。 图 1 9种亚硝胺、NDPA-d14及NDMA-d6标准色谱图 |
| 表 1 9种亚硝胺、NDPA-d14及NDMA-d6特征离子 |
根据1.3优化条件,最终确定如下气相色谱质谱方法:色谱柱为Agilent VF-WAXms(30 m×0.25 mm×0.25 μm);进样口:250 ℃;传输线:250 ℃;载气流速:1 mL/min;进样方式:不分流进样;进样量:1 μL。
升温程序:40 ℃(3 min) 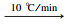
|
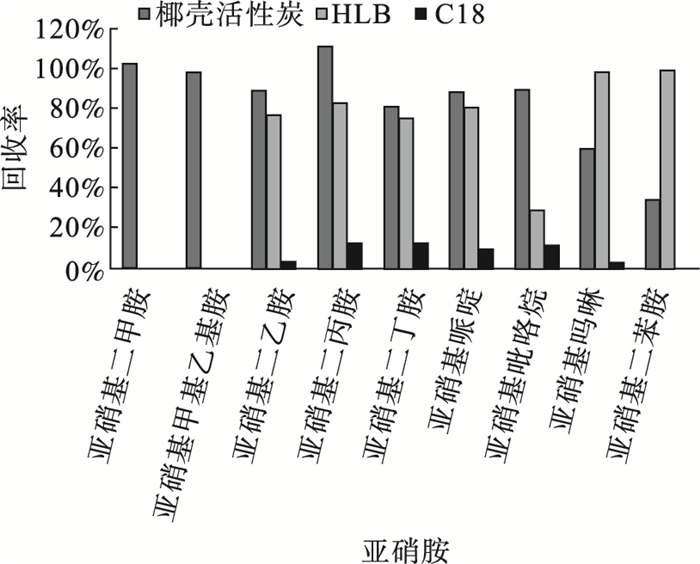
图 2 不同固相萃取小柱对目标物萃取效率比较 |
结果显示椰壳活性炭萃取小柱对9种目标物萃取效率均较好,但对NDphA的萃取最差,平均回收率为20%~40%,而HLB小柱对其的萃取效率最好,平均回收率可达80%~100%,C18小柱对目标物的萃取效率最差。因此选择椰壳活性炭和HLB小柱。
2.2.2 上样速率的选择(图 3)
|
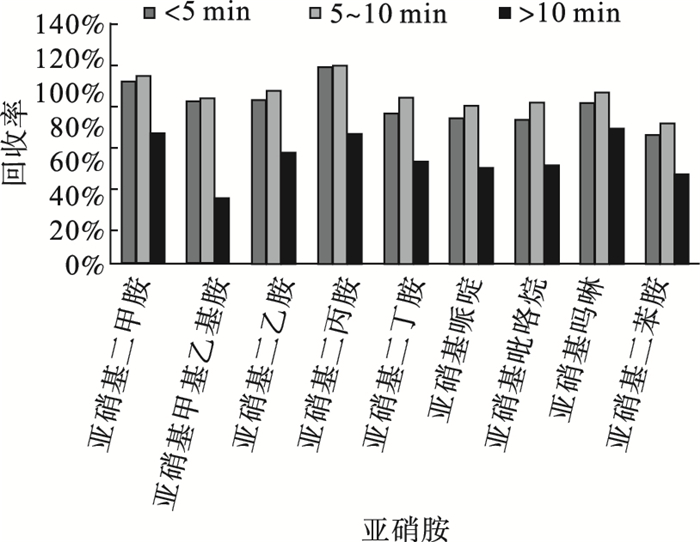
图 3 上样速率对目标物回收率的影响 |
结果显示,上样速率≤10 mL/min时,目标物质回收率满足要求。因水样体积为1 L,富集时间冗长对目标物回收率有一定影响,因此本次实验水样富集速率选择5~10 mL/min。
2.2.3 洗脱体积的选择(图 4)
|
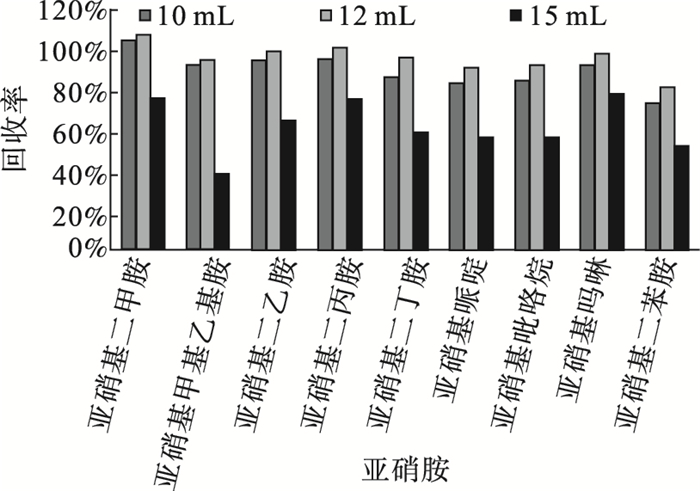
图 4 洗脱体积对目标物回收率的影响 |
结果显示,二氯甲烷洗脱体积为12 mL时,洗脱能力最强,9种目标物的回收率最大。
2.2.4 前处理方法结果按照上述前处理优化条件,最终确定前处理方法如下:分别用8 mL二氯甲烷、12 mL甲醇、16 mL超纯水活化椰壳活性炭小柱和HLB小柱。将椰壳活性炭小柱和HLB小柱串联,用大容量取样器连接小柱与水样,以5~10 mL/min的速度过水样。过完水样后,全真空抽干30~40 min。在重力作用下,分别用12 mL二氯甲烷洗脱活性炭和HLB小柱。合并洗脱液,并用装有6~8 g的无水硫酸钠小柱干燥除水。在 < 0.05 kPa的氮气压力下,氮吹浓缩至0.6 mL左右。浓缩液加入100 μL 2 mg/L NDPA-d14,二氯甲烷定容至1 mL。注意全程避光。最后用PTFE滤头将萃取液转移至2 mL棕色进样瓶中,于-20 ℃冰箱密封、避光保存,28 d内检测。
2.3 方法验证 2.3.1 线性范围(表 2)| 表 2 目标物、NDMA-d6线性方程、相关系数和线性范围(μg/L) |
配制10~1 000 μg/L的9种亚硝胺混合标准溶液,其中NDMA-d6与9种亚硝胺标准溶液浓度相同,NDPA-d14浓度为200 μg/L,按照上述确定的气相色谱质谱条件,采用内标法和选择离子监测模式进行测定。以目标物与内标质量浓度(μg/L)比为横坐标,目标物与内标峰面积比为纵坐标绘制标准曲线。9种亚硝胺和NDMA-d6在10~1 000 μg/L范围内线性关系良好,相关系数R2 > 0.999。
2.3.2 方法检出限和检出下限(表 3)| 表 3 目标物方法检出限和检出下限(ng/L) |
配制50 ng/L的超纯水加标样,根据公式MDL=t(n-1, 0.99)×S[7],重复测定10次,计算方法检出限,以4倍的检出限作方法测定下限。
2.3.3 回收率和精密度(表 4)| 表 4 目标物低、中、高浓度水平加标回收率(%) |
分别配制50、100、200 ng/L 3种浓度的超纯水加标,每个浓度平行测定5次,计算目标物回收率。9种目标物低浓度加标回收率为62.32%~89.71%,中、高浓度均为73.43%~109.66%。同时,根据测定结果计算RSD,以RSD作方法精密度,结果显示低、中、高浓度的RSD均 < 10,满足EPA 521[6]的要求。
2.3.4 自来水加标验证(表 5)| 表 5 目标物自来水加标回收率(%) |
按照上述SPE-GC-MS方法分别配制50、100、200 ng/L 3种自来水加标,平行测定3次,平均回收率为74.62%~102.74%。因此本实验建立的SPE-GC-MS的方法适宜检测饮用水中亚硝胺类化合物。
3 讨论EPA 521中亚硝胺低浓度加标回收率为50%~150%,中、高浓度加标回收率为70%~130%,本研究的低、中、高浓度加标回收率满足标准。EPA 521的方法中只检测除NMor、NDphA以外的其他7种亚硝胺[18],随着饮用水中新型亚硝胺不断被发现,该方法已不能满足环境有机物污染区域饮用水中亚硝胺的监测。因此本实验加入NMor、NDphA 2种有机物,方法检出限低于NMor在饮用水中10 ng/L的限值。在前处理方法条件优化过程中发现反相吸附材料小柱C18和HLB可去除水体中非极性干扰物,对水样净化效果较好。因环境水样基质复杂、亚硝胺属小分子化合物等因素,在仪器分析过程中对仪器灵敏度、检出限、性能等要求较高。气相色谱质谱具有灵敏度高、检出限低、有亚硝胺标准化质谱数据库等特点,是目前分析亚硝胺最广泛的检测器。
亚硝胺作为一类饮用水消毒副产物,成为人体亚硝胺暴露不容忽视的重要来源之一[8],美国国家环保局(United States Environment Protection Agency, US EPA)已将其列入饮用水水质监测非限定污染物[9],加拿大安大略省环境部规定临时最大可接受饮用水中NDMA的含量为9 ng/L[10];德国也规定饮用水中的NDMA和NMor应在 < 10 ng/L水平[11];“中国环境优先监测研究”已将NDEA和NDPA列入“中国环境优先污染物黑名单”[12]。由此可见亚硝胺类化合物已成为世界各国引以重视并密切关注的环境有机污染物。本研究在已有检测方法基础上进行优化、改良,建立一种回收率、检出限、灵敏度符合相关标准,简便易操作,重现性好,成本低,可普遍应用的检测方法。通过对实际环境水样的验证,证实本实验建立的检测方法可行,因此可为亚硝胺类化合物在水环境中的来源、分布、转归及对人体健康潜在危害的暴露水平研究提供技术支持,同时为促进其被列入国家水质监测指标的发展提供依据。
| [1] | 楚文海, 高乃云, DengY. 饮用水新型N-DBPs类别及毒理学评价[J]. 现代化工, 2009, 29(2): 86–89. |
| [2] | World Health Organization, International Agency for Research on Cancer.IARC monographs on the evaluation of carcinogenic risks to humans:some N-nitrosocompounds, Volume17[M/OL].Lyon:IARC, 1977[1977-10-15].http://monographs.iarc.fr/ENG/Monographs/vol17/volume17.pdf.1978. |
| [3] | 李克, 俞顺章. 橡胶职业暴露与肠癌和胰腺癌关系的病例-队列研究[J]. 中国公共卫生, 1998, 14(6): 330–332. |
| [4] | Choi NR, Kim YP, Ji WH, et al. Identification and quantification of seven volatile n-nitrosamines in cosmetics using gas chromatography/chemical ionization-mass spectrometry coupled with head space-solid phase microextraction[J]. Talanta, 2016, 148: 69–74. DOI:10.1016/j.talanta.2015.10.045 |
| [5] | Liao XB, Er B, Li SX, et al. Applying the polarity rapid assessment method to characterize nitrosamine precursors and to understand their removal by drinking water treatment processes[J]. Water Research, 2015, 87: 292–298. DOI:10.1016/j.watres.2015.09.040 |
| [6] | Environment Protection Agency.Method 521 Detemination of nitrosamines in drinking water by solid phase extraction and capiliary column gas chromatography with large volume injection and chemical ionization tandem mass spectrometry(MS/MS)[S].Washington:Environment Pretection Agency, 2004. |
| [7] | 中华人民共和国环境保护部. 环境检测分析方法标准制修订技术导则HJ 168-2010[S]. 北京: 中国环境科学出版社, 2010. |
| [8] | 吕佳, 岳银玲, 张岚, 等. 国内外饮用水消毒技术应用与优化研究进展[J]. 中国公共卫生, 2017, 33(3): 428–432. DOI:10.11847/zgggws2017-33-03-23 |
| [9] | United States Environment Protection Agency.Unregulated Contaminant Monitoring Regulation(UCMR)for public water systems revisions[M].Fed.Regi, 2007, January 4, 72(2):367-398. http://www.zgggws.com/CN/abstract/abstract29743.shtml |
| [10] | Government of Ontario.Safe Drinking Water Act[S].Ontario Regulation169/03, Schedule 2, 2002. |
| [11] | Jurado SB, Ballesteros E, Gallego M. Screening of N-nitrosamines in tap and swimming pool waters using fast gas chromatography[J]. Journal of Separation Sciene, 2010, 33(4-5): 610–616. DOI:10.1002/jssc.v33:4/5 |
| [12] | 周文敏. 水中优先控制污染物黑名单[J]. 中国环境监测, 1990, 6(4): 1–3. |
 2017, Vol. 33
2017, Vol. 33


