2. 中国医科大学公共卫生学院卫生毒理学教研室
镧是轻稀土元素的代表,可经呼吸道、消化道等途径进入机体,并在脑组织中蓄积,包括大脑皮质、海马和小脑,可引起学习与记忆能力缺陷[1-3]。海马是学习记忆的关键脑区,近期研究发现海马在阿尔茨海默病早期即受到影响,出现年龄相关的血脑屏障破坏,且随轻度认知障碍而加重[4]。研究表明,镧所致学习记忆能力下降可能与海马神经细胞核转录因子-κB活性降低[5],脑源性神经营养因子蛋白表达下调[6]有关。而关于镧对海马血脑屏障完整性或功能影响的研究较少。本研究通过建立大鼠出生至断乳后1个月氯化镧暴露动物模型,观察仔鼠海马紧密连接蛋白表达和基因转录水平的变化,旨在探讨镧对仔鼠海马血脑屏障通透性的影响。结果报告如下。
1 材料与方法 1.1 实验动物60只清洁级Wistar大鼠,雌雄比例2:1,由中国医科大学实验动物中心提供,实验动物生产许可证号:SYXK(辽)2013-0001,体重(240±10) g;实验动物室温度(23 ± 1)℃,相对湿度(50 ± 5)%,照明周期12 h:12 h;动物适应性喂养1周后开始实验。
1.2 主要仪器与试剂JY96-ⅡN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司),Sigma 3k15型低温高速离心机(德国Sigma公司),Mini P-4小型垂直电泳槽、Mini P-4小型Trans-Blot转印槽、Power BC高电流电泳电源(北京凯元信瑞仪器有限公司),Tanon 5200全自动化学发光成像分析系统(上海天能科技有限公司),Roche LightCycler® 480实时荧光定量PCR系统(德国Roche公司)。LaCl3(分析纯,中国国药集团化学试剂有限公司),Trizol(分析纯)、引物、TaKaRa反转录试剂盒(RR047A)、TaKaRa荧光定量PCR试剂盒(DRR081A)(中国大连宝生物工程有限公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、超敏增强化学发光试剂盒(南通碧云天生物技术有限公司),兔抗claudin-5一抗(美国Abcam公司),兔抗occludin一抗、兔抗紧密连接蛋白-1(zonula occludens-1,ZO-1) 一抗(美国Zymed公司),小鼠抗磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)一抗(美国Proteintech公司),辣根过氧化物酶(horseradish peroxidase, HRP)标记二抗(北京鼎国昌盛生物技术有限责任公司)。
1.3 分组与处理40只雌性大鼠随机分为对照组和低、中、高剂量氯化镧组,按照雌雄比例2:1进行交配,次日晨发现阴栓或阴道分泌物镜检有精子者视为受孕成功,记为妊娠0 d。动物自由进食饮水,分娩后,各组孕鼠分别饮用蒸馏水,0.25%、0.5%、1.0% LaCl3溶液,仔鼠断乳前经由吸吮母乳染镧,断乳后则继续饮用原浓度LaCl3溶液,至断乳后1个月结束。每组随机选择3只母鼠,8只仔鼠雌雄各半进行各项指标测定。
1.4 指标与方法 1.4.1 仔鼠体重、脑重称量染毒结束后,各组仔鼠称量体重,10%水合氯醛腹腔注射(4 mL/kg)麻醉,迅速断头取脑,称取全脑重,冰上迅速分离海马组织并称重,由海马重/体重计算得海马系数。
1.4.2 海马中claudin-5、occludin、ZO-1蛋白表达测定采用Western blot法,提取海马组织总蛋白,BCA试剂盒进行蛋白含量测定;将样品调至相同浓度,95 ℃煮沸5 min变性,冰上冷却;取总量相同蛋白经10%(>200 kDa)十二烷基磺酸钠-聚丙烯酰胺凝胶电泳中分离,湿转至聚偏氟乙烯膜(millipore,0.45μm),5%脱脂奶粉封闭1 h,加入一抗4 ℃孵育过夜,兔抗claudin-5(1:1 000)、兔抗occludin(1:250)、兔抗ZO-1(1:250)、小鼠抗GAPDH(1:5 000)。洗膜缓冲液(Tris buffered saline tween,TBST)洗膜10 min × 3次,加入山羊抗兔或抗小鼠IgG(1:3 000),室温孵育1 h,TBST洗膜10 min×3次,增强化学发光法显影。采用ImageJ软件分析,记录灰度值,进行定量分析。
1.4.3 海马中Cldn5、Ocln、tight junction protein 1 (Tjp1) mRNA表达测定采用real-time PCR法,Trizol法提取海马组织总RNA,定量并调浓度至500 ng/μL;参照试剂盒说明书进行反转录和real-time PCR;所用引物序列如表 1。以GAPDH基因作为内参,mRNA表达水平采用2-ΔΔCT法表示。
| 表 1 Real-time PCR所用引物序列 |
1.5 统计分析
实验数据以x±s表示。采用SPSS 17.0软件进行统计分析,应用单因素方差分析(analysis of variance, ANOVA)进行组间差异检验,两两比较采用SNK-q和Dunnet-t检验,P<0.05为差异有统计学意义。
2 结果 2.1 染镧对仔鼠体重和海马系数影响(表 2)与对照组比较,各剂量氯化镧组仔鼠体重均明显下降,差异有统计学意义(P<0.05);呈剂量-效应关系(P<0.05)。与对照组比较,各剂量氯化镧组仔鼠海马系数无明显变化。
| 表 2 染镧对仔鼠体重和海马系数影响(x±s,n=8) |
2.2 染镧对仔鼠海马紧密连接蛋白表达影响(图 1、表 3)
随LaCl3剂量升高,claudin-5和occludin蛋白表达逐渐降低;与对照组比较,0.50%和1.00%氯化镧组仔鼠海马中claudin-5和occludin蛋白表达明显下降,差异有统计学意义(P<0.05);且1.00%氯化镧组仔鼠海马中claudin-5蛋白表达明显低于0.25%氯化镧组(P<0.05)。
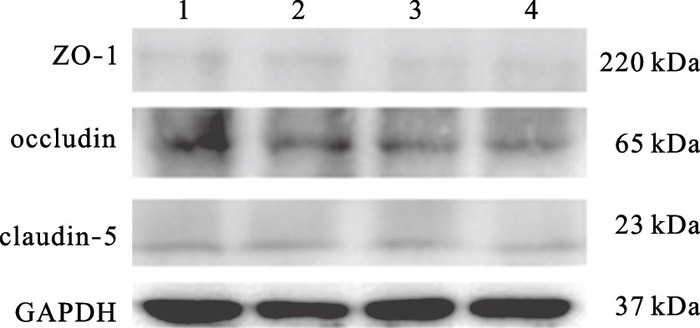
|
注:1:对照组;2~4:0.25%、0.50%、1.00%氯化镧组。 图 1 染镧对仔鼠海马紧密连接蛋白表达影响 |
| 表 3 染镧对仔鼠海马紧密连接蛋白表达影响(x±s,n=4) |
2.3 染镧对仔鼠海马紧密连接蛋白mRNA表达影响(表 4)
与对照组比较,1.00%氯化镧组仔鼠海马中Cldn5 mRNA表达水平明显下降,差异有统计学意义(P<0.05)。
| 表 4 染镧对仔鼠海马Cldn5、Ocln和Tjp1 mRNA表达影响(x±s,n=4) |
3 讨论
血脑屏障(blood-brain barrier,BBB)是存在于大脑实质和系统循环之间的界面,调控营养物质、离子和其他分子进入脑,保护脑组织免受毒物损伤,对正常脑功能的维持至关重要。无窗孔的脑微血管内皮细胞层是BBB的首要结构,并通过紧密连接(tight junctions,TJs)复合体调控BBB细胞旁通透性[7]。TJs由跨膜分子(claudins,occludin和JAMs)间的同型或异型相互作用形成,跨膜分子通过胞浆内zona occludin(ZO)受体分子结合于肌动蛋白细胞骨架[8]。Claudin-5、occludin和ZO-1被认为是BBB正常和功能紊乱状态的敏感标识物[9]。许多信号介质和药物通过调节TJ蛋白或TJ相关蛋白表达引起BBB功能障碍,尤其是claudin-5、occludin和/或ZO-1。研究表明claudins为细胞旁屏障形成所必需,缺失claudin-5的小鼠出现小分子物质选择性BBB渗漏;occludin对屏障的高阻抗维持十分重要;TJ相关胞浆蛋白ZO-1表达减少或从连接复合体分离与屏障通透性增高密切相关[9]。血脑屏障功能障碍可导致离子失调、信号稳态改变,以及分子和免疫细胞进入中枢神经系统,引起神经系统功能紊乱和退行性变[8]。
通常认为,稀土离子不能跨越完整且功能正常的BBB。放射性同位素示踪研究发现,静脉注射169YbCl3和153SmCl3后,稀土离子可进入脑组织,并以海马区浓度最高[10-11],因渗透系数很低(0.005 0%~0.000 3%),通过血脑屏障细胞间隙的扩散(细胞间连接)是其主要途径[12]。然而,BBB易受多种环境或病理因素的影响,导致TJs受损,分子渗透性增加,如在大鼠脑出血损伤或细胞氧化应激状态下,钆(Gd)通过血脑屏障的量明显增加[13]。发育中的脑组织更易受重金属等外源性化学物影响,因为胎儿期和幼儿早期,对于化学物进入中枢神经系统,BBB只提供部分保护[14]。且生命早期神经毒性化学物的暴露,可对脑发育和成熟产生广泛的不良影响,自婴儿期到衰老的整个生命期均可表现出功能障碍或疾病[15]。
研究表明生长发育期LaCl3暴露可致仔鼠海马镧含量显著升高,学习记忆能力下降[2]。本研究结果显示,出生至断乳后1个月LaCl3饮水暴露可使仔鼠体重下降,影响仔鼠生长发育,但海马系数并未出现明显改变,这与以往研究结果一致[3]。本研究结果还显示,生后早期LaCl3暴露可下调仔鼠海马claudin-5和occludin蛋白水平,且减少Cldn5 mRNA表达。提示,生长发育期LaCl3暴露可破坏仔鼠血脑屏障紧密连接,这可能促进镧的神经发育毒性;镧对仔鼠海马血脑屏障紧密连接蛋白的下调作用,很可能是认知障碍的早期事件。
| [1] | Feng L, Xiao H, He X, et al. Neurotoxicological consequence of long-term exposure to lanthanum[J]. Toxicol Lett, 2006, 165(2): 112–120. DOI:10.1016/j.toxlet.2006.02.003 |
| [2] | Yang J, Liu Q, Zhang L, et al. Lanthanum chloride impairs memory, decreases pCaMK IV, pMAPK and pCREB expression of hippocampus in rats[J]. Toxicol Lett, 2009, 190(2): 208–214. DOI:10.1016/j.toxlet.2009.07.016 |
| [3] | Zheng L, Yang J, Liu Q, et al. Lanthanum chloride impairs spatial learning and memory and downregulates NF-kappa B signalling pathway in rats[J]. Arch Toxicol, 2013, 87(12): 2105–2117. DOI:10.1007/s00204-013-1076-7 |
| [4] | Montagne A, Barnes SR, Sweeney MD, et al. Blood-brain barrier breakdown in the aging human hippocampus[J]. Neuron, 2015, 85(2): 296–302. DOI:10.1016/j.neuron.2014.12.032 |
| [5] | 郑琳琳, 蔡原, 于飞, 等. 镧对仔鼠海马核转录因子-κB表达影响[J]. 中国公共卫生, 2015, 31(1): 82–84. DOI:10.11847/zgggws2015-31-01-25 |
| [6] | 庞妍, 杨敬华, 刘秋芳, 等. 出生前后染镧对大鼠海马CREB和BDNF影响[J]. 中国公共卫生, 2014, 30(2): 204–206. DOI:10.11847/zgggws2014-30-02-23 |
| [7] | Obermeier B, Daneman R, Ransohoff RM. Development, maintenance and disruption of the blood-brain barrier[J]. Nat Med, 2013, 19(12): 1584–1596. DOI:10.1038/nm.3407 |
| [8] | Daneman R, Prat A. The blood-brain barrier[J]. Cold Spring Harb Perspect Biol, 2015, 7(1): a020412. DOI:10.1101/cshperspect.a020412 |
| [9] | Almutairi MM, Gong C, Xu YG, et al. Factors controlling permeability of the blood-brain barrier[J]. Cell Mol Life Sci, 2016, 73(1): 57–77. DOI:10.1007/s00018-015-2050-8 |
| [10] | Xiao H, Li F, Zhang Z, et al. Distribution of ytterbium-169 in rat brain after intravenous injection[J]. Toxicol Lett, 2005, 155(2): 247–252. DOI:10.1016/j.toxlet.2004.09.021 |
| [11] | Xiao H, Zhang Z, Li F, et al. Accumulation and distribution of samarium-153 in rat brain after intraperitoneal injection[J]. Biol Trace Elem Res, 2005, 104(1): 33–40. DOI:10.1385/BTER:104:1 |
| [12] | 夏青, 刘会雪, 杨晓达, 等. 稀土神经毒性研究[J]. 中国科学, 2012, 42(9): 1308–1314. |
| [13] | Estevez AY, Pritchard S, Harper K, et al. Neuroprotective mechanisms of cerium oxide nanoparticles in a mouse hippocampal brain slice model of ischemia[J]. Free Radic Biol Med, 2011, 51(6): 1155–1163. DOI:10.1016/j.freeradbiomed.2011.06.006 |
| [14] | Zheng W, Aschner M, Ghersi-Egea JF. Brain barrier systems:a new frontier in metal neurotoxicological research[J]. Toxicol Appl Pharmacol, 2003, 192(1): 1–11. DOI:10.1016/S0041-008X(03)00251-5 |
| [15] | Grandjean P, Landrigan PJ. Neurobehavioural effects of developmental toxicity[J]. Lancet Neurol, 2014, 13(3): 330–338. DOI:10.1016/S1474-4422(13)70278-3 |
 2017, Vol. 33
2017, Vol. 33


