2. 贵州医科大学公共卫生学院劳动卫生与环境卫生学教研室;
3. 贵州医科大学基础医学院免疫学教研室
登革病毒(dengue virus,DENV)是黄病毒科黄病毒属的单链RNA病毒,根据病毒抗原特异性分为登革Ⅰ~Ⅳ 4个血清亚型[1]。主要通过埃及伊蚊传播到人群, 所致疾病主要有登革热(dengue fever,DF)、登革出血热(dengue hemorrhagic fever,DHF)和登革休克综合征(dengue shock syndrome,DSS),是全球最严重的虫媒传染病之一。全球每年约发生5 000万~1亿例DENV感染(大多数为儿童)[2-3]。DENV的任何一种亚型都能引起DF、DHF和DSS,再次感染其他型别的DENV是导致DHF和DSS的重要原因[4]。因此,建立一种既能快速检测DENV又能准确分型的检测方法,对于临床诊断及治疗、登革病毒的变化动态及登革传播媒介监测具有重要意义。本研究针对DENV-2设计建立一步法TaqMan荧光定量逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)检测方法,现将结果报告如下。
1 材料与方法 1.1 主要试剂与仪器病毒细胞DENV-2 NGC株(2012年9月引自北京军事医学科学院,贵州医科大学基础医学院现代病原生物学实验室保种)、乙型脑炎病毒SA14-14-2(武汉生物制品研究所生产的减毒活疫苗)。Vero细胞(非洲绿猴肾细胞)为贵州医科大学基础医学院现代病原生物学实验室保存。除DENV-2、乙型脑炎毒株外,其余的墨累谷脑炎病毒、西尼罗病毒、蜱传脑炎病毒、DENV-1、DENV-3、DENV-4、黄热病毒、科萨努尔森林病毒共8种病毒由生工生物工程(上海)股份有限公司提供含有部分靶基因的pBluescript Ⅱ SK(+)质粒。87份染病毒蚊虫样本由中山大学-密歇根州立大学热带病虫媒控制联合研究中心提供。体外转录试剂盒T7 RiboMAXTMExpress Large Scale RNA Production System(美国promega公司);Trizol试剂(美国invitrogen公司);逆转录试剂盒PrimeScript®RT reagent Kit with gDNA Eraser(Perfect Real ⅠTime)、One Step PrimeScriptTMRT-PCR Kit(Perfect Real Time)、ExTaq、Easy Dilution等[日本(大连)TaKaRa公司],RNA纯化试剂盒(北京全式金生物公司)。胎牛血清(杭州四季青生物工程有限公司),青-链霉素双抗生素、1640基础培养基(美国Hyclone公司)。用于PCR扩增体外转录模板的引物(引物由北京博迈德科技发展有限公司合成)。TaqMan探针引物由生工生物工程(上海)股份有限公司合成并标记,探针5′端、3′端分别标记CY5荧光报告基团和BHQ-3荧光淬灭基团。二氧化碳细胞培养箱为香港力康公司产品;台式低温离心机为美国贝克曼库尔特公司产品;PCR仪、实时荧光定量PCR仪均为美国伯乐公司产品;核酸电泳仪为上海谱振公司产品;凝胶成像系统为美国Amersham Pharmacia公司产品;核酸定量仪为美国BioTek产品。
1.2 方法 1.2.1 引物与探针设计与合成(表 1、2)从GenBank共检索到105株DENV-2病毒的全基因序列。利用生物信息学分析软件Bio Edit对下载毒株全基因组进行保守性分析;以GenBank中NC_001474.2为参考株,首先设计涵盖保守区域并带有T7启动子的引物序列,再根据文献[5-7]提供的TaqMan PCR引物探针的设计原则,利用DNASTAR辅助在其3′-UTR的保守区域进行引物、探针设计筛选,然后通过Blast在线分析初步验证其特异性。
| 表 1 用于PCR扩增体外转录模板的引物序列 |
| 表 2 DENV-2 TaqMan探针荧光定量RT-PCR检测法引物探针序列 |
1.2.2 建立标准曲线 1.2.2.1 DENV-2型病毒培养
Vero细胞培养使用1640生长液(含10%胎牛血清,1%青-链霉素双抗生素),于37 ℃,5% CO2孵箱中培养;待细胞长成单层时,先用磷酸缓冲液(phosphate buffer solution,PBS)清洗2遍,再用1640维持液(含2%胎牛血清,1%青-链霉素双抗生素)清洗1遍,然后接种DENV-2型病毒,静置吸附l h(期间每隔15 min取出振荡), 补充1640维持液;继续培养5~7 d。待细胞病变后反复冻融收获病毒上清-80 ℃保存备用。
1.2.2.2 DENV-2型病毒RT-PCR用TRIzol法提取核酸后逆转录为cDNA,逆转录按照试剂盒说明书进行。-20 ℃保存备用。以DENV-2型病毒cDNA为模板,利用PCR的方法将T7启动子引入DENV-2型病毒阅读框的上游,以达到经过体外转录后,获得与病毒基因组序列一致的RNA。扩增反应体系为DENV-2型病毒cDNA模板4 μL;DENV-2F-T7/DENV-2R-T7(10 μmol/L)各2 μL;ExTaq 25 μL;DEPC水[焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理过并经高温高压灭菌不含RNA酶、DNA酶和蛋白酶的水]17 μL, 总体积50 μL。反应条件:94 ℃ 10 min;94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s, 40个循环;72 ℃ 10 min。利用胶回收试剂盒对PCR产物进行回收纯化。
1.2.2.3 体外转录制备DENV-2 RNA标准品利用T7 RiboMAXTMExpress Large Scale RNA Production System试剂盒,室温配制20 μL反应体系:RiboMAXTMExpress T7 2× Buffer 10 μL,线性DNA模板(0.1~0.15 μg/μL)5 μL,无RNA酶纯水3 μL,Enzyme Mix T7 Express 2 μL。反应条件为37 ℃ 30 min。转录产物加DNase Ⅰ(2U/μL)3 μL继续反应20 min除去DNA模板。用RNA纯化试剂盒进行纯化后用核酸测定仪进行浓度测定。体外转录产物稀释到100~300 ng/μL后将稀释后浓度换算为拷贝/μL。拷贝数=浓度×阿伏加德罗常数/(340×总长度),阿伏加德罗常数为6.02×1023。10倍梯度稀释,制备浓度为101~108拷贝/μL的标准品。
1.2.2.4 TaqMan荧光定量RT-PCR扩增将DENV-2 101~108 copies/μL的标准品作为模板,运用实时荧光定量PCR仪进行扩增。反应体系为25 μL:2×One Step RT-PCR Buffer Ⅲ 12.5 μL,TaKaRa Ex Taq HS(5 U/μL)0.5 μL,PrimeScript RT Enzyme Ⅱ Mix 0.5 μL,DENV-2F(10 μmol/L)0.5 μL,DENV-2R(10 μmol/L)0.5 μL,DENV-2P(10 μmol/L)0.5 μL,总RNA 2 μL,无RNA酶纯水8 μL。反应条件为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。
1.2.2.5 建立标准曲线利用相对应的Bio-Rad CFX Manager(version 1.5,Bio-Rad,USA)进行分析,标准曲线方程为:y=-3.67x + 43.50(y代表CT值,x代表模板浓度的对数值,计算相关系数R2(按积差方法计算)和扩增效率E(E=10-1/斜率-1)。
1.2.3 TaqMan荧光定量RT-PCR方法建立 1.2.3.1 TaqMan荧光定量RT-PCR灵敏性检测用体外转录所得的RNA进行10倍系列稀释,以制备的108 ~101 copies/μL DENV-2标准品进行荧光定量RT-PCR检测,以结果阳性的最高稀释度作为评价敏感性的指标。
1.2.3.2 TaqMan荧光定量RT-PCR特异性检测为验证本实验设计的特异性,本实验同时以墨累谷脑炎病毒、西尼罗病毒、蜱传脑炎病毒、DENV-1、DENV-3、DENV-4、黄热病毒、科萨努尔森林病毒及乙型脑炎病毒共9种黄病毒属黄病毒科的病毒RNA标准品为模板,无RNA酶纯水为阴性对照进行检测。其中乙型脑炎病毒与DENV-2型病毒采用相同的方法获得RNA标准品。其余病毒模板运用人工合成方法获得病毒株部分片段基因并克隆到含有T7启动子的pBluescript Ⅱ SK(+)质粒上, 通过对质粒测序确认合成DNA序列的准确性后,运用PCR方法获取体外转录模板并进行体外转录获取RNA标准品。分别以这10种病毒的105 copies/μL RNA标准品进行TaqMan荧光定量RT-PCR检测,以评价该检测方法的特异性。
1.2.3.3 TaqMan荧光定量RT-PCR方法的重复性检测选取3个不同浓度(107、106、105 copies/μL)的DENV-2 RNA标准品进行TaqMan荧光定量RT-PCR检测,每个浓度分别进行3个平行重复,不同时间点重复试验3次。
1.2.4 蚊虫样本检测(1) RNA提取:将蚊虫样本1只转入1只1.5 mL去酶的离心管中, 先加入50 μL Trizol,用小型电动组织研磨器将蚊虫磨匀,再补加450 μL Trizol混匀后进行RNA提取。(2) 运用传统RT-PCR检测方法(DENV-2F:CAT GCC ATC CAT GAA AAG ATT CAG A;DENV-2R:TTG TTG CTG CGA TTT GTA AGG GAG)与本研究建立的TaqMan荧光定量RT-PCR检测方法进行对照检测。
1.3 统计分析采用SPSS 17.0软件进行分析,计算变异系数(coefficient of variation,CV),率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果 2.1 TaqMan荧光定量RT-PCR标准曲线(图 1)以DENV-2型101~108 copies/μL RNA标准品为模板。荧光定量PCR在101~108 copies/μL具有良好的线性关系,标准曲线方程为:y=-3.67x + 43.50,相关系数R2=0.998,扩增效率为87.20%。根据DENV-2型RT-PCR检测体系的标准曲线,以CT值≤35作为阳性标准。
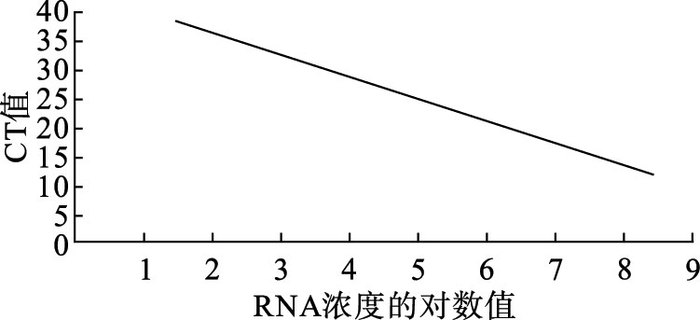
|
图 1 DENV-2 TaqMan荧光定量RT-PCR方法标准曲线 |
2.2 TaqMan荧光定量RT-PCR检测方法的灵敏性(图 2)
将DENV-2 108~101 copies/μL的8个浓度RNA标准品进行TaqMan荧光定量RT-PCR扩增,根据CT值≤35的阳性标准界限,灵敏性结果显示:TaqMan荧光定量RT-PCR最低浓度为102 copies/μL。
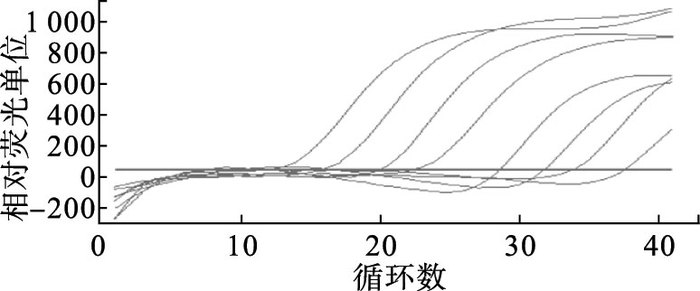
|
图 2 DENV-2 TaqMan荧光定量RT-PCR方法灵敏性 |
2.3 TaqMan荧光定量RT-PCR检测方法的特异性(图 3)
对墨累谷脑炎病毒、西尼罗病毒、蜱传脑炎病毒、DENV-1~4、科萨努尔森林病毒及乙型脑炎病毒检测结果表明,只有DENV-2型病毒出现阳性扩增曲线,其他病毒及阴性对照检测结果均为阴性。
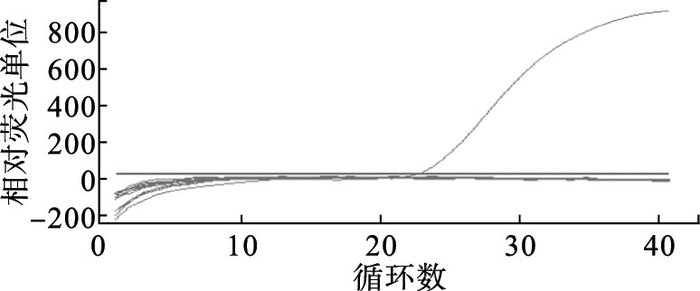
|
图 3 DENV-2 TaqMan荧光定量RT-PCR方法特异性 |
2.4 TaqMan荧光定量RT-PCR检测方法的重复性(表 3、4)
将DENV-2 RNA标准品(107、106、105 copies/μL)进行TaqMan荧光定量RT-PCR, 各浓度分别进行3次重复,每次试验每个浓度设3个重复。结果显示组内和组间的变异系数(variation coefficient, CV)均<2%。
| 表 3 TaqMan荧光定量RT-PCR组内重复实验结果(n=3) |
| 表 4 TaqMan荧光定量RT-PCR组间重复实验结果(n=3) |
2.5 样本检测
运用本研究建立的DENV-2一步法实时荧光RT-PCR检测方法对87份DENV-2感染的蚊虫样本进行检测, 检出56份阳性样本,同时运用常规RT-PCR方法对87份样本进行检测, 共检测出16份阳性样本。将2种方法的检出率作χ2检验,差异有统计学意义(χ2=37.908,P=0.000)。
3 讨论登革热在中国的流行区域主要分布在广东、广西、福建、浙江和海南等地。自1978年广东佛山暴发流行后疫情不断出现。DENV的4种血清型都曾在我国流行。DENV-2作为DENV的重要成员之一,引起的感染最为严重。DENV-2 1985年9月在海南岛引起高强度大流行[8],随后又在台湾岛、福州、湛江等地区引起严重的暴发流行[9-11];1993年在佛山、1999和2007年在福建省、2001年在澳门与广东省中山市发生的流行均由DENV-2引起[12-15];2014年在广州暴发的登革热也是由DENV-2及DENV-1两种血清型感染所引起, 这次疫情的发病人数创了历史新高,并出现了死亡病例[16]。综上可知,DENV-2在登革热流行中扮演了重要角色。因此,建立一种能对DENV-2引起的登革热进行早期快速诊断的方法显得尤为重要。目前,DENV的检测主要包括病毒分离培养法,血清学检测法,分子生物学检测方法。能够对DENV血清型分型鉴定的方法主要有以下几种:(1) 根据扩增片断的长度进行分型;(2) 采用型特异探针进行杂交;(3) 酶切分型法[17]。TaqMan PCR技术是实时荧光定量RT-PCR技术中被广泛应用的一种技术,近年来该技术因其敏感性高、特异性强、能够实时定量等优点已被广泛应用病毒的快速检测及分型鉴定:Kong等[18]针对DENV NS5建立的TaqMan实时荧光RT-PCR方法不仅能快速检测DENV,同时还能对DENV进行分型;Gurukumar等[19]运用针对DENV的3′UTR设计的4种血清型的通用引物对临床血清样本进行了检测;Cecilia等[20]建立了既能检测及鉴定DENV的血清型,还能同时检测出基孔肯尼雅病毒的TaqMan实时荧光方法。这些研究都表明TaqMan实时荧光RT-PCR方法与传统RT-PCR方法相比, 其敏感性高、特异性好、操作简便迅速。但是Kong等[18]在研究中用来设计引物探针的毒株只包括DENV-1(AF513110)、DENV-2(AF489932)、DENV-3(AY099336) 和DENV-4(AF326573) 各1株;而Gurukumar等[19]研究中涉及到毒株主要在印度分离。本研究在前人研究的基础上,通过美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)检索到105条地理位置覆盖古巴、泰国、越南等主要流行区域和基因型别的DENV-2全基因序列。通过比对找到高度保守区域后经生物信息学分析和考虑引物探针设计的原则后将扩增区段定位于高度保守的3′UTR,采用TaqMan探针法建立了一种能检测DENV-2病毒的荧光定量PCR方法。本研究中经过大量序列比对后设计的特异性引物探针,通过NCBI的Blast组件进行在线虚拟比对,结果表明与其他虫媒病毒基因无任何交叉反应可能,比Kong等[18]和Gurukumar等[19]研究中的引物探针更保守,特异性更高。进一步试验结果表明,建立的检测方法循环阈值与RNA拷贝数的对数呈良好的线性关系扩增效率达87.2%。其重复性结果显示组内和组间CV均<2%。敏感性试验结果表明该方法能检测出3.0×102 copies/μL RNA标准品,具有较高的灵敏性。运用包括DENV-2在内的黄病毒科黄病毒属中的10种较重要的病毒RNA标准品对建立的方法进行特异性验证,RT-PCR扩增结果表明,仅DENV-2病毒呈现阳性,阴性对照及其他病毒均无扩增,与Blast比对结果相符。同时,运用建立的方法及传统RT-PCR方法对蚊虫样本中DENV-2的感染率进行检测, 结果显示该方法的阳性率是传统RT-PCR的3倍多。从荧光结果分析发现:本研究能检测出感染RNA拷贝数较低的样本, 而传统RT-PCR只能检测到感染RNA拷贝数较高的样本。
综上所述, 本研究建立的方法实现了对DENV-2快速、简便、敏感、特异的定量检测及血清型鉴定, 可应用于急性期登革热的临床诊断及对蚊媒监测, 对监控登革热流行和预防控制疾病发展具有非常重要的意义。
| [1] | Rico-Hesse R. Molecular evolution and distribution of dengue viruses type 1 and 2 in nature[J]. Virology, 1990, 74(2): 479–493. |
| [2] | Halsetced SB. Dengue hemorhagic fever-a public health problem and a field for research[J]. Bull World Health Organ, 1980, 58(1): 1–22. |
| [3] | Pinheiro FP, Corber SJ. Global situation of dengue and dengue hemorrhagic fever[J]. World Health Stat, 1997, 50(1): 3. |
| [4] | 董瑞玲, 甄胜西, 孙杰, 等. 登革病毒TaqMan双重荧光PCR分型研究[J]. 中国热带医学, 2011, 11(12): 1438–1439. |
| [5] | Templeton KE, Scheltinga SA, Beersma MF. Rapid and sensitive method using multiplex real-time PCR for diagnosis of infections by influenza A and influenza B viruses, respiratory syncytial virus, and parainfluenza virus l, 2, 3 and 4[J]. J Clin Microbiol, 2004, 42(4): 1564–1569. DOI:10.1128/JCM.42.4.1564-1569.2004 |
| [6] | Stone B, Burrows J, Schepetiuk S. Rapid detection and simultaneous subtype differentiation of influenza A viruses by real Time PCR[J]. J Virol Meth, 2004, 117(2): 103–112. DOI:10.1016/j.jviromet.2003.12.005 |
| [7] | Bustin SA. Absolute quantification of mRNA using real-time reverse transcription PCR assays[J]. J Mol Endocrinol, 2000, 25(2): 169–193. DOI:10.1677/jme.0.0250169 |
| [8] | 王传滋, 陈文洲. 海南省登革热历年流行概况[J]. 海南医学, 1992, 3(3): 1–4. |
| [9] | 许龙善. 台湾登革热的流行与控制[J]. 海峡预防医学杂志, 2000, 6(1): 21–23. |
| [10] | 郑能雄, 许龙善, 王宗汉, 等. 福州市仓山区登革热流行及预防效果的调查研究[J]. 海峡预防医学杂志, 2000, 6(1): 4–6. |
| [11] | 杨芬, 何剑锋, 蔡松武, 等. 2007年广东省湛江雷州市登革热流行病学分析[J]. 疾病监测, 2008, 23(7): 409–411. |
| [12] | 廖育煌, 罗惠容, 伍颂民, 等. 登革热病人2/4型登革热病毒的双重感染[J]. 中华实验和临床病毒学杂志, 1996, 10(4): 361–363. |
| [13] | 翁育伟, 洪荣涛, 张山鹰, 等. 福建省莆田市2007年登革热暴发的流行病学调查分析[J]. 中国人兽共患病学报, 2009, 25(4): 330–333. |
| [14] | 陈耀球, 董绮红, 朱雪茵, 等. 澳门登革热989例[J]. 中华传染病杂志, 2005, 23: 43–45. DOI:10.3760/j.issn:1000-6680.2005.01.013 |
| [15] | 杜建伟, 潘先海. 中国登革热流行概况与流行特征[J]. 中华流行病学杂志, 2010, 31(12): 1429–1433. DOI:10.3760/cma.j.issn.0254-6450.2010.12.025 |
| [16] | 应若素, 王建, 洪文昕, 等. 广东省2014年登革热暴发流行的临床和实验室特点[J]. 中华传染病杂志, 2014, 32(12): 719–723. DOI:10.3760/cma.j.issn.1000-6680.2014.12.004 |
| [17] | 但妍, 郑建, 黄爱龙. 登革病毒的分子生物学检测技术研究进展[J]. 国际病毒学杂志, 2007, 14(6): 181–185. |
| [18] | Kong YY, Thay CH, Tin TC. Rapid detection, serotyping and quantitation of dengue viruses by TaqMan real-time one-step RT-PCR[J]. J Virol Meth, 2006, 138(1): 123–130. |
| [19] | Gurukumar KR, Priyadarshini D, Patil JA. Development of real time PCR for detection and quantitation of dengue viruses[J]. J VIROL, 2009, 6(10): 1–8. |
| [20] | Cecilia D, Kakade M, Alagarasu K. Development of a multiplex real-time RT-PCR assay for simultaneous detection of dengue and chikungunya viruses[J]. Arch Virol, 2015, 160(1): 323–327. DOI:10.1007/s00705-014-2217-x |
 2017, Vol. 33
2017, Vol. 33


