2. 贵州医科大学附属医院;
3. 贵州省骨科医院;
4. 贵州省人民医院
氟中毒可影响学习记忆能力,这与氟离子可通过血脑屏障造成中枢神经系统损伤密切相关。研究表明给大鼠过量氟摄入其学习记忆能力下降、脑组织受损[1-2]。贵州省是中国燃煤型氟中毒重灾区,其防治研究一直备受人们关注。对于地方性氟中毒的防治祖国医学有独到之处,利用补肾壮骨、活血化淤及利尿排氟的机制,起到减轻机体氟含量作用。百合科植物天门冬具有养阴清热、润肺滋肾的功效,治阴虚、抗氧化[3]。本研究通过饲料中添加氟化钠方法构建氟中毒SD(Sprague-Dawley)大鼠模型,观察天门冬对氟中毒所致大鼠学习记忆障碍的改善作用,旨在为中医药在氟中毒治疗领域的应用提供依据。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器氟化钠,分析纯(无锡市展望化工试剂有限公司);天门冬(贵阳仁济堂),天门冬水煎剂的制备:用天平称取天门冬50 g,加10倍量水,称重回流提取2次,1 h /次,过滤再用水准确补足减少的重量,药液经过减压浓缩,得浓度为1 g /mL天门冬水提取液(主要成分为天门冬多糖和总皂苷)。PXJ-1B型数字式离子计(江苏江分店精密分析仪器有限公司);pF-1型氟离子选择性电极(上海精密科学仪器有限公司);T5000Y型电子天平(常熟双杰测试仪器厂);Morris水迷宫图像自动采集和处理系统(中科院药物研究所);YTS-3TB跳台机(北京众实迪创科技发展有限责任公司)。
1.2 实验动物60只清洁级SD大鼠,雌雄各半,体重90~100 g,由贵州省动物实验中心提供,许可证号:SCXK(黔)2012-0001,饲养环境:室温22~25 ℃,湿度45% ~70%,动物中心提供饲料。
1.3 分组与处理大鼠1周适应性饲养后,随机分为对照组、染氟组、天门冬低、中、高剂量组(3、6、12 g/kg),每组12只,雌雄各半。对照组给予基础饲料,染氟组与天门冬各剂量组大鼠饲料中添加氟化钠,含氟量为50 mg/kg,各剂量天门冬组大鼠灌胃给予天门冬水煎剂,1次/d,连续3个月,染氟组给予等量蒸馏水。
1.4 指标与方法 1.4.1 氟斑牙观察每天观察各组大鼠牙齿变化情况,判定大鼠牙齿的损伤程度并记录;处死大鼠前对各大鼠的牙齿进行拍照,氟斑牙分度参考国家标准进行[4]。
1.4.2 尿氟和骨氟含量检测在处死大鼠之前用代谢笼收集24 h尿样,使用氟离子选择电极法测定尿氟含量。在处死大鼠后,取长骨,将附着的筋肉和脂肪剔除干净,105 ℃烘箱内烘干;捣碎,在电炉上炭化至无烟,灰化呈白色粉末状;采用高温灰化-氟离子选择电极法检测骨氟含量。
1.4.3 Morris水迷宫实验采用Morris水迷宫图像自动采集和处理系统,实验分为定位航行及空间探索2部分;实验过程中保持安静及光线一致,定位航行试验时将大鼠从不同象限入水点面向池壁放入水中,观察大鼠自入水点找到平台所需时间(逃避潜伏期)和航行轨迹。大鼠在60 s内若未找到平台,人为将大鼠引到平台上并停留10 s,此时潜伏期计为60 s,电脑记录大鼠成绩,连续4 d。第5天进行空间探索实验(测试大鼠对原平台的记忆),撤除平台,将各组大鼠从平台对侧象限放入水中,记录其在60 s内跨越平台的次数与在平台所在象限停留时间。
1.4.4 跳台实验将各组大鼠放入跳台箱内熟悉箱内环境3 min,随后立即通以100 V 3 mA交流电。当通电后大鼠受到电击的正常反应是跳回平台躲避电击,开始计时并观察5 min内大鼠首次受电击后跳上平台所需时间(反应时间),大鼠5 min内跳下平台受电击的次数(即错误次数)作为学习成绩。24 h后测试其记忆能力:把已训练过的大鼠安静地置于跳台上,接通电源即开始记录时间,观察通电开始至大鼠走下平台时间(即潜伏期),并记录在5 min内大鼠走下平台遭受电击的次数(即错误次数),作为记忆成绩。
1.5 统计分析数据采用x±s表示,使用SPSS 22.0软件对数据进行正态性检验和方差齐性检验,符合正态分布且方差齐的数据,用单因素方差分析进行组间比较,两两比较采用最小显著差法,P<0.05为差异有统计学意义。
2 结果 2.1 染氟对大鼠氟斑牙发生率影响结果显示,对照组大鼠未出现氟斑牙;染氟组大鼠氟斑牙发生率为100%,主要为中、重度氟斑牙,占75.0%(9/12);天门冬各剂量组大鼠氟斑牙发生率也为100%,但中、重度比例明显减少,其中低、中、高剂量天门冬组大鼠中、重度比例分别为33.3%(4/12)、33.3%(4/12)、16.7%(2/12)。
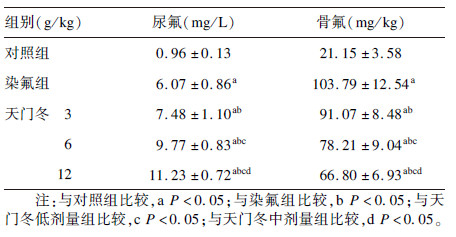
2.2 天门冬对氟中毒大鼠尿氟和骨氟含量影响(表 1)| 表 1 天门冬对氟中毒大鼠尿氟和骨氟含量影响(x±s,n=12) |
与对照组比较,染氟组大鼠尿氟与骨氟含量明显升高,差异有统计学意义(P<0.05);与染氟组比较,各剂量天门冬组大鼠尿氟含量明显升高,骨氟含量明显下降,差异均有统计学意义(P<0.05);呈剂量效应关系。
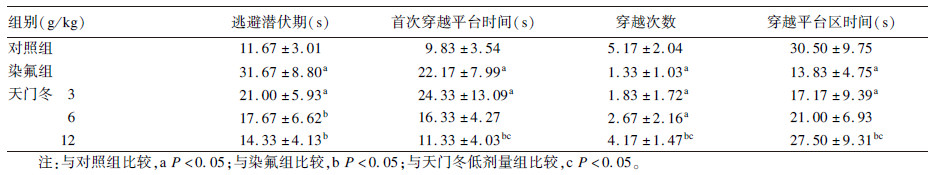
2.3 天门冬对氟中毒大鼠学习记忆能力影响 2.3.1 大鼠水迷宫实验(表 2)| 表 2 天门冬对氟中毒大鼠学习记忆能力影响(水迷宫试验,x±s,n=12) |
定位航行试验结果显示,与对照组比较,染氟组大鼠逃避潜伏期明显延长,差异有统计学意义(P<0.05);与染氟组比较,中、高剂量天门冬组大鼠逃避潜伏期明显缩短,差异有统计学意义(P<0.05)。空间探索实验结果显示,与对照组比较,染氟组大鼠首次穿越平台时间明显延长、穿越次数减少、穿越平台区时间缩短,差异有统计学意义(P<0.05);与染氟组比较,高剂量天门冬组大鼠首次穿越平台时间明显缩短、穿越次数增加、穿越平台区时间延长,差异有统计学意义(P<0.05);与低剂量天门冬组比较,高剂量天门冬组大鼠首次穿越平台时间缩短、穿越次数增加、穿越平台区时间延长,差异有统计学意义(P<0.05)。
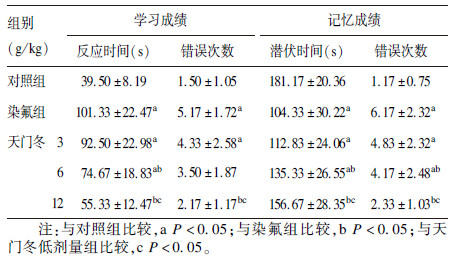
2.3.2 大鼠跳台实验(表 3)| 表 3 天门冬对氟中毒大鼠学习记忆能力影响(跳台试验,x±s,n=12) |
学习成绩测试结果显示,与对照组比较,染氟组大鼠反应时间明显延长、错误次数明显增加,差异有统计学意义(P<0.05);与染氟组比较,中、高剂量天门冬组大鼠反应时间缩短,高剂量天门冬组大鼠错误次数减少,差异有统计学意义(P<0.05)。记忆成绩测试结果显示,与对照组比较,染氟组大鼠潜伏时间明显缩短、错误次数明显增加,差异有统计学意义(P<0.05);与染氟组比较,中、高剂量天门冬组大鼠潜伏时间明显延长、错误次数明显减少,差异有统计学意义(P<0.05);与低剂量天门冬组比较,高剂量天门冬组大鼠潜伏时间延长、错误次数减少,差异有统计学意义(P<0.05)。
3 讨论氟中毒是全球分布地方病,贵州省是中国特有的燃煤型氟中毒重灾区,氟中毒对机体损害主要表现在牙齿与骨骼[5-6],并对软组织脏器、脑等均存在明显的毒性损伤[7]。氟中毒致脑损伤已引起研究者们广泛关注。氟可导致机体出现骨痹阳虚、血虚、血瘀、促氧化等症状,天门冬则具有养阴清热、润肺滋肾的功效,治阴虚、抗氧化,可达到活血补肾壮骨、促进尿氟排出作用[3]。本研究结果显示,染氟组大鼠氟斑牙程度、尿氟和骨氟含量均明显高于对照组;高剂量天门冬组大鼠氟斑牙程度、骨氟含量明显低于染氟组,尿氟含量则明显高于染氟组。提示,天门冬可通过促进肾对尿氟的排泄,降低机体氟含量,降低氟在骨骼中沉积,起到氟中毒的防治作用。
脑部是氟中毒损伤重要的软组织器官,学习记忆等认知功能是脑的高级神经活动,机体长期过多蓄积氟化物会引起中枢神经系统的损伤[8-9]。研究显示,学习记忆认知行为紊乱是氟中毒损伤脑组织的主要临床表现[10-11]。氟中毒致软组织损伤过程中,自由基、脂质过氧化是主要机制[12-13]。研究发现,贵州产中草药天门冬具有抗氧化、抗衰老、抗凋亡等作用[14-16]。本研究结果显示,水迷宫定位航行实验中染氟组大鼠平均逃避潜伏期明显长于对照组,中、高剂量天门冬组大鼠逃避潜伏期明显短于染氟组;空间探索实验中染氟组大鼠首次穿越平台时间明显长于对照组、穿越平台次数和平台区时间明显低于对照组,高剂量天门冬组大鼠首次穿越平台时间短于染氟组,穿越平台次数、穿越平台区时间多于染氟组;学习能力测试结果显示,染氟组大鼠反应时间明显长于对照组、错误次数多于对照组,高剂量天门冬组大鼠反应时间短于染氟组、错误次数少于染氟组;记忆测试结果显示,染氟组大鼠潜伏时间明显短于对照组、错误次数多于对照组,中、高剂量天门冬组大鼠潜伏时间长于染氟组,错误次数少于染氟组。提示,氟中毒可明显影响大鼠学习记忆能力,天门冬对氟中毒所致大鼠学习记忆障碍具有改善作用。
| [1] | Liu YJ, Guan ZZ, Gao Q, et al. Increased level of apoptosis in rat brains and SH-SY5Y cells exposed to excessive fluoride-a mechanism connected with activating JNK phosphorylation[J]. Toxicol Lett, 2011, 204(2-3): 183–189. DOI:10.1016/j.toxlet.2011.04.030 |
| [2] | 冉龙艳, 桂传枝, 吴昌学, 等. 燃煤型氟中毒大鼠智力与脑ERK1/2表达关系[J]. 中国公共卫生, 2010, 26(10): 1228–1229. DOI:10.11847/zgggws2010-26-10-07 |
| [3] | 欧立军, 危革, 周红灿, 等. 不同产地天门冬水提液抗氧化能力比较[J]. 中国老年学杂志, 2013, 33(23): 5897–5899. |
| [4] | 中华人民共和国卫生部. WS-T氟斑牙诊断标准[S]. 北京: 国家标准出版社, 2011. |
| [5] | Mandinic Z, Curcic M, Antonijevic B, et al. Relationship between fluoride intake in Serbian children living in two areas with different natural levels of fluorides and occurrence of dental fluorosis[J]. Food and Chemical Toxicology, 2009, 47(6): 1080–1084. DOI:10.1016/j.fct.2009.01.038 |
| [6] | Tamer MN, Kroglu BK, Arslan C, et al. Osteosclerosis due to endemic fluorosis[J]. Sci Total Environ, 2007, 373(1): 43–48. DOI:10.1016/j.scitotenv.2006.10.051 |
| [7] | Niu RY, Sun ZL, Cheng ZT, et al. Decreased learning ability and low hippocampus glutamate in offspring rats exposed to fluoride and lead[J]. Environmental Toxicology and Pharmacology, 2009, 28(2): 254–258. DOI:10.1016/j.etap.2009.04.012 |
| [8] | 桂传枝, 冉龙艳, 官志忠. 燃煤型氟中毒脑组织神经型尼古丁受体mRNA及蛋白表达水平改变[J]. 中国地方病学杂志, 2011(3): 239–242. |
| [9] | 桂传枝, 冉龙艳, 官志忠. 燃煤型氟中毒大鼠海马区组织病理学分析[J]. 中国公共卫生, 2011, 27(9): 1147–1148. DOI:10.11847/zgggws2011-27-09-33 |
| [10] | Bhatnagar M, Rao P, Sushma J, et al. Neurotoxicity of fluoride:neurodegeneration in hippocampus of female mice[J]. Indian Journal of Experimental Biology, 2002, 40(5): 546–554. |
| [11] | Xiang QY, Liang YX, Chen L, et al. Effect of fluoride in drinking water on children's intelligence[J]. Fluoride, 2003, 36(3): 84–94. |
| [12] | Wang YN, Xiao KQ, Liu JL, et al. Effect of long term fluoride exposure on lipid composition in rat liver[J]. Toxicology, 2000, 146: 161–169. DOI:10.1016/S0300-483X(00)00167-0 |
| [13] | Guan ZZ, Xiao KQ, Zheng XY, et al. Changed celluar membrane lipid composition and lipid peroxidation of kidney in rats with chronic fluorosis[J]. Arch Toxicol, 2000, 74: 602–608. DOI:10.1007/s002040000177 |
| [14] | 李艳菊, 丁文, 李琴山, 等. 贵州产天冬总皂苷清除氧自由基能力的研究[J]. 医药导报, 2012, 31(7): 874–876. |
| [15] | 李艳菊, 李琴山, 田硕, 等. 天冬总皂苷对D-半乳糖致衰老大鼠肾脏p53基因表达的影响[J]. 中国老年学杂志, 2012, 32(18): 3961–3963. DOI:10.3969/j.issn.1005-9202.2012.18.044 |
| [16] | 李艳菊, 王季石, 李琴山, 等. 天冬总皂苷对衰老大鼠脾脏Bcl-2基因表达水平的影响[J]. 时珍国医国药, 2012, 23(5): 1192–1193. |
 2017, Vol. 33
2017, Vol. 33